20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
Làm đề thiCâu hỏi 1 :
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hoà tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là:
- A 27,96.
- B 29,52.
- C 36,51.
- D 1,50.
Đáp án: B
Câu hỏi 2 :
Hòa tan hết 4,667 gam hỗn hợp Na, K, Ba và ZnO (trong đó oxi chiếm 5,14% về khối lượng) vào nước, thu được dung dịch X và 0,032 mol khí H2. Cho 88 ml dung dịch HCl 1M vào X đến khi các phản ứng kết thúc, thu được m gam kết tủa. Giá trị của m là
- A 0,495
- B 0,990
- C 0,198
- D 0,297
Đáp án: D
Phương pháp giải:
+ mO=> nO = nZnO
+ Luôn có: nOH- = 2nH2
+ Viết PTHH: ZnO + 2OH- → ZnO22- + H2O
=> Thành phần dung dịch X
+ Viết các PTHH khi cho HCl vào X và tính toán theo PTHH suy ra khối lượng kết tủa.
Lời giải chi tiết:
mO = 4,667.5,14/100 = 0,24 gam => nO = nZnO = 0,015 mol
Luôn có: nOH- = 2nH2 = 0,064 mol
ZnO + 2OH- → ZnO22- + H2O
0,015→0,03→ 0,015
Vậy dung dịch X gồm: 0,034 mol OH- dư; 0,015 mol ZnO2 2-
Khi cho 0,088 mol HCl vào X:
H+ + OH- → H2O
0,034←0,034
ZnO22- + 2H+ → Zn(OH)2
0,015→0,03 → 0,015
2H+ + Zn(OH)2 → Zn2+ + 2H2O
0,088- 0,034-0,03→ 0,012
m↓ = (0,015 - 0,012).99 = 0,297 gam
Đáp án D
Câu hỏi 3 :
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 22,63 gam X vào nước, thu được 2,24 lít khí H2 (đktc) và dung dịch Y. Nếu cho Y tác dụng với CO2 thu được tối đa 25,61 gam kết tủa. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m gần với giá trị
- A 30.
- B 34.
- C 35.
- D 38.
Đáp án: A
Phương pháp giải:
Cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa:
+ Với muối nhôm
Các phản ứng xảy ra:
Al3+ + 3OH- Al(OH)3 (1)
Al(OH)3 + OH- [Al(OH)4]- (2)
Từ (1) và (2) ta rút ra kết luận:
+ Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và
nAl(OH)3= b/3
+ Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần
Al3+ + 3OH- Al(OH)3 (1)
mol a 3a a
Al(OH)3 + OH- [Al(OH)4]- (2)
mol b-3a b-3a
nAl(OH)3= 4a-b
+ Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn
Lời giải chi tiết:
Tổng quát : X + O2 => Z (oxit) thì lượng ion kim loại trong X vẫn không đổi
Bảo toàn e : nKL = 2nH2 = nO = 0,1 mol
=> mZ = 24,23g
Z + H2O => dung dịch Y
Có : nBaCO3 = nBa(OH)2 = 0,13 mol => nNa2O = 0,07 mol
=> nOH = 0,4 mol
Khi phản ứng với 0,05 mol Al2(SO4)3 thì :
nAl(OH)3 = 4nAl3+ - nOH- = 0
Kết tủa chỉ gồm : 0,13 mol BaSO4
=> m = 30,29g
Đáp án A
Câu hỏi 4 :
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
- A 10,4.
- B 23,4.
- C 54,5.
- D 27,3.
Đáp án: B
Phương pháp giải:
Tính được mO => nO => nAl2O3 = nO/3
\({n_{O{H^ - }}} = 2{n_{{H_2}}}\)
Viết PTHH và tính toán theo PTHH.
Lời giải chi tiết:
\(\begin{gathered}
{n_{O{H^ - }}} = 2{n_{{H_2}}} = 2.0,6 = 1,2mol \hfill \\
{m_O} = 86,3.\frac{{19,47}}{{100}} = 16,8gam \to {n_O} = 1,05mol \hfill \\
\to {n_{A{l_2}{O_3}}} = \frac{{{n_O}}}{3} = 0,35mol \hfill \\
A{l_2}{O_3} + 2O{H^ - } \to 2Al{O_2}^ - + {H_2}O \hfill \\
0,35 \to 0,7 \to \,\,\,\,\,\,\,\,0,7 \hfill \\
DD\,Y\left\{ \begin{gathered}
O{H^ - }du:1,2 - 0,7 = 0,5 \hfill \\
Al{O_2}^ - :0,7 \hfill \\
\end{gathered} \right.\xrightarrow{{ + HCl:2,4}} \hfill \\
O{H^ - } + H + \to {H_2}O \hfill \\
0,5 \to 0,5 \hfill \\
Al{O_2}^ - + {H^ + } + {H_2}O \to Al{(OH)_3} \hfill \\
0,7 \to 0,7 \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,7 \hfill \\
3{H^ + } + Al{(OH)_3} \to A{l^{3 + }} + 3{H_2}O \hfill \\
1,2 \to 0,4 \hfill \\
\to {n_{Al{{(OH)}_3}sau\,pu}} = 0,7 - 0,4 = 0,3 \hfill \\
\to {m_ \downarrow } = 0,3.78 = 23,4gam \hfill \\
\end{gathered} \)
Đáp án B
Câu hỏi 5 :
Hỗn hợp X gồm Al2O3 , K, Ba (trong đó oxi chiếm 20% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,022 mol khí H2 .Cho từ từ đến hết dung dịch gồm 0,018 mol H2SO4 và 0,038 mol HCl vào Y, thu được dung dịch Z (chỉ chứa các muối clorua và muối sunfat trung hòa) và 2,958 gam hỗn hợp kết tủa. Giá trị m là:
- A 3,912
- B 3,090
- C 4,422
- D 3,600.
Đáp án: D
Phương pháp giải:
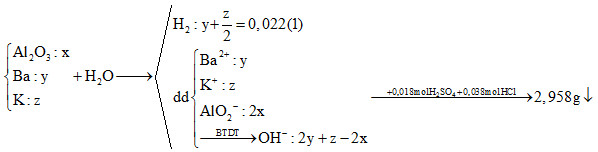
Đặt Al(OH)3 : t (mol) => 233y + 78t = 2,985 (2)
nH+ = nOH- + nAlO2- + 3nAl(OH)3 bị tan => (z + 2y – 2x) + 2x + 3(2x – t) = 0,018.2 + 0,038 (3)
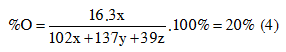
Từ (1), (2), (3), (4) => x = ? ; y = ? ; z = ? ; t = ? (mol)
=> m = ? (g)
Lời giải chi tiết:
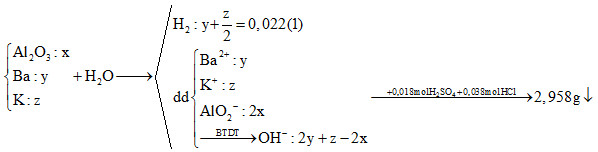
nSO42- = 0,18 (mol) => nBaSO4 (max) = 0,18 (mol) => nBaSO4 > 2,958 (g)
=> nSO42- dư => nBaSO4 = y (mol)
Đặt Al(OH)3 : t (mol) => 233y + 78t = 2,985 (2)
nH+ = nOH- + nAlO2- + 3nAl(OH)3 bị tan => (z + 2y – 2x) + 2x + 3(2x – t) = 0,018.2 + 0,038 (3)
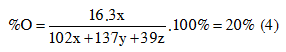
Từ (1), (2), (3), (4) => x = 0,015 ; y = 0,006 ; z = 0,032 ; t = 0,02 (mol)
=> m = 0,015.102 + 0,006.39 + 0,02.39 = 3,6 (g)
Đáp án D
Câu hỏi 6 :
Hỗn hợp X gồm Al, Ba, Na và K. Hòa tan hòa toàn m gam X vào nước dư, thu được dung dịch Y và 0,0405 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,018 mol H2SO4 và 0,03 mol HCl vào Y thu được 1,089 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 3,335 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng của kim loại Ba trong X là
- A 37,78%.
- B 33,12%.
- C 29,87%.
- D 42,33%
Đáp án: C
Phương pháp giải:
Ta coi là hỗn hợp X tác dụng với axit cũng thu được 0,0405 mol H2
=> nH2sinh ra từ H2O = 0,045 – nH2 từ axit = ? (mol)
=> nAl(OH)3 = 1/3 nH2sinh ra từ H2O = ? (mol)
m↓ = 1,089 (g) => nBaSO4 = ? (mol)
Dung dịch Z chứa: nSO42- = nSO4 bđ – nBaSO4 = ? (mol); nCl- = 0,03 (mol)
BTKL: mcationKL = mmuối – mCl- - mSO42- = ? (g)
=> mX = mcationKL + mBa2+ + mAl3+ trong Al(OH)3
Lời giải chi tiết:
\(hh\,X\left\{ \begin{gathered}
Al \hfill \\
Na \hfill \\
Ba \hfill \\
K \hfill \\
\end{gathered} \right.\left\langle \begin{gathered}
\xrightarrow{{ + {H_2}O\,du}}0,0405\,mol\,{H_2} \hfill \\
\xrightarrow{{ + {H_2}S{O_4}:0,018\,mol;HCl:0,03\,mol}}\left\{ \begin{gathered}
1,089\left\{ \begin{gathered}
BaS{O_4} \hfill \\
Al{(OH)_3} \hfill \\
\end{gathered} \right. \hfill \\
Z:3,335\left\{ \begin{gathered}
A{l^{3 + }},{K^ + },N{a^ + } \hfill \\
C{l^ - },S{O_4}^{2 - } \hfill \\
\end{gathered} \right. \hfill \\
\end{gathered} \right. \hfill \\
\end{gathered} \right.\)
Nếu cho X vào hỗn hợp 2 axit ta cũng thu được 0,0405 mol, trong đó nH2 từ axit = nH+/ 2 = 0,033 (mol)
=> nH2sinh ra từ H2O = 0,045 – 0,033 = 0,0075 (mol)
=> nAl(OH)3 = 0,0075.2/3 = 0,005 (mol)
m↓ = 1,089 (g) => nBaSO4 = ( 1,089- 0,005.78)/233 = 0,003 (mol)
Dung dịch Z chứa: nSO42- = 0,018 – 0,003 = 0,015 (mol); nCl- = 0,03 (mol)
BTKL: mcationKL = mmuối – mCl- - mSO42- = 3,335 – 0,03.35,5 – 0,015.96 = 0,83 (g)
=> mX = mcationKL + mBa2+ + mAl3+ trong Al(OH)3 = 0,83+ 0,003.137 + 0,005.27 = 1,376 (g)
%Ba = [(0,03.137): 1,376].100%= 29,87%
Đáp án C
Câu hỏi 7 :
Hỗn hợp X gồm Al, K, K2O và BaO (trong đó oxi chiếm 10% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,056 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,04 mol H2SO4 và 0,02 mol HCl vào Y, thu được 4,98 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 6,182 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là
- A 5,760.
- B 9,592.
- C 5,004.
- D 9,596.
Đáp án: A
Phương pháp giải:
Quy đổi X thành Ba (a mol), K (b mol), Al (c mol), O(d mol)
=> mO = 16d = 10%(137a + 39b + 27c + 16d) (1)
Bte: 2a + b + 3c = 2d + 0,056.2 (2)
Kết tủa gồm: BaSO4 (a mol) và Al(OH)3 ((4,98-233a)/78 mol)
Dung dịch Z chứa SO42- (0,04 – a), Cl- (0,02), K+ (b) và Al3+ [c-(4,98-233a)/78]
BTĐT:
2(0,04 - a) + 0,02 = b + 3[c - (4,98 – 233a)/78] (3)
m muối = 96(0,04 – a) + 0,02.35,5 + 39b + 27[c – (4,98 – 233a)/78] = 6,182 (4)
Giải (1)(2)(3)(4) => a; b; c; d
=> m = ?
Lời giải chi tiết:
Quy đổi X thành Ba (a mol), K (b mol), Al (c mol), O(d mol)
=> mO = 16d = 10%(137a + 39b + 27c + 16d) (1)
Bte: 2a + b + 3c = 2d + 0,056.2 (2)
Kết tủa gồm: BaSO4 (a mol) và Al(OH)3 ((4,98-233a)/78 mol)
Dung dịch Z chứa SO42- (0,04 – a), Cl- (0,02), K+ (b) và Al3+ [c-(4,98-233a)/78]
BTĐT:
2(0,04 - a) + 0,02 = b + 3[c - (4,98 – 233a)/78] (3)
m muối = 96(0,04 – a) + 0,02.35,5 + 39b + 27[c – (4,98 – 233a)/78] = 6,182 (4)
Giải (1)(2)(3)(4) => a = 0,012; b = 0,07; c = 0,03; d = 0,036
=> m = 5,76 gam
Đáp án A
Câu hỏi 8 :
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào H2O thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gần nhất với giá trị nào sau đây?
- A 15.
- B 14.
- C 13.
- D 12.
Đáp án: C
Phương pháp giải:
Bảo toàn nguyên tố
Bảo toàn electron
Bảo toàn điện tích
Lời giải chi tiết:
*Trộn 200 ml dung dịch Y (chứa y mol OH-) với 200 ml HCl 0,2M và H2SO4 0,15M
nH+ = nHCl + 2nH2SO4 = 0,2.0,2 + 2.0,2.0,15 = 0,1 mol
pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M
OH- + H+ → H2O
Bđ: y 0,1
Pư: 0,1 ← 0,1
Sau: y – 0,1 0
\( \to \left[ {O{H^ - }} \right] = \frac{{y - 0,1}}{{0,4}} = 0,1 \to y = 0,14\)
=> 400 ml dung dịch Y chứa 0,28 mol OH-
*Hòa tan m gam hỗn hợp X{Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: 0,28 mol} + H2: 0,07
BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => nNa + nK + 2nBa = 2x + 2.0,07 (1)
BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => nNa + nK + 2nBa = 0,28 (2)
Từ (1) và (2) => 2x + 2.0,07 = 0,28 => x = 0,07 mol
=> mO = 0,07.16 = 1,12 gam => mX = 1,12.(100/8,75) = 12,8 gam gần nhất với 13 gam
Đáp án C
Câu hỏi 9 :
Hòa tan hoàn toàn 20,7 gam hỗn hợp X gồm Na, Ba, Na2O và BaO vào nước thu được 4 lít dung dịch Y có pH = 13 và 0,05 mol khí H2. Cho 4 lít dung dịch Y tác dụng với 100ml dung dịch chứa H2SO4 0,3M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
- A 28
- B 42
- C 35
- D 26
Đáp án: A
Phương pháp giải:
*Quy đổi hỗn hợp thành: Na (x mol); Ba (y mol) và O (z mol)
+ mX → (1)
+ Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y mol) và OH-
BTĐT → nOH- = nNa+ + 2nBa2+ → (2)
+ BTe: nNa + 2nBa = 2nO + 2nH2 → (3)
Giải hệ thu được x, y, z.
Sau đó tính toán theo PTHH để xác định được khối lượng kết tủa thu được sau khi cho dung dịch Y phản ứng với hỗn hợp H2SO4 và Al2(SO4)3
Lời giải chi tiết:
*Quy đổi hỗn hợp thành: Na (x mol); Ba (y mol) và O (z mol)
+ mX = 23x + 137y + 16z = 20,7 (1)
+ Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y mol) và OH-
pH = 13 → pOH = 14 - 13 = 1 → [OH-] = 10-1 = 0,1M → nOH- = 0,1.4 = 0,4 mol
BTĐT → nOH- = nNa+ + 2nBa2+ → x + 2y = 0,4 (mol) (2)
+ BTe: nNa + 2nBa = 2nO + 2nH2 → x + 2y = 2z + 2.0,05 (3)
Giải hệ (1) (2) (3) thu được x = 0,2; y = 0,1; z = 0,15
*Cho Y {Na+ (0,2); Ba2+ (0,1); OH- (0,4)} tác dụng với hỗn hợp H2SO4 (0,03 mol) và Al2(SO4)3 (0,05 mol):
nH+ = 2nH2SO4 = 0,06 mol;
nAl3+ = 2nAl2(SO4)3 = 0,1 mol;
nSO42- = nH2SO4 + 3nAl2(SO4)3 = 0,18 mol
PTHH:
H+ + OH- → H2O
0,06 → 0,06 dư 0,34
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 dư 0,04 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 còn 0,06 ← 0,04
Ba2+ + SO42- → BaSO4
0,1 → 0,1 → 0,1
Vậy kết tủa gồm Al(OH)3 (0,06 mol) và BaSO4 (0,1 mol)
→ m kết tủa = 0,06.78 + 0,1.233 = 27,98 gam gần nhất với 28 gam
Đáp án A
Câu hỏi 10 :
Hòa tan hết 33,02 gam hỗn hợp gồm Na, Na2O, Ba và BaO vào nước dư thu được dung dịch X và 4,48 lít khí H2 (đktc). Cho dung dịch CuSO4 dư vào dung dịch X, thu được 73,3 gam kết tủa. Nếu sục 0,45 mol khí CO2 vào dung dịch X, sau khi kết thúc các phản ứng, thu được lượng kết tủa là
- A 27,58 gam.
- B 31,52 gam.
- C 29,55 gam.
- D 35,46 gam.
Đáp án: D
Phương pháp giải:
Quy đổi hỗn hợp thành: Na (a mol); Ba (b mol); O (c mol)
+) Từ khối lương hỗn hợp → (1)
+) Áp dụng bảo toàn e → (2)
+) Từ khối lượng kết tủa → (3)
Giải hệ được a, b, c
Sau đó bài toán trở thành bài toán hấp thụ CO2 vào dung dịch kiềm
Lời giải chi tiết:
Quy đổi hỗn hợp thành: Na (a mol); Ba (b mol); O (c mol)
→ mhh = 23a + 137b + 16c = 33,02 (1)
Quá trình trao đổi e:
Na0 → Na+ + 1e O0 + 2e → O-2
Ba0 → Ba+2 + 2e 2H+ + 2e → H2
Áp dụng bảo toàn e: nNa + 2nBa = 2nO + 2nH2
→ a + 2b = 2c + 2.0,2 (2)
\(dd\,X\left\{ \begin{array}{l}N{a^ + }:a\\B{a^{2 + }}:b\\O{H^ - }:a + 2b\end{array} \right. + CuS{O_{4\left( {du} \right)}} \to \left\{ \begin{array}{l}Cu{\left( {OH} \right)_2}:\frac{{a + 2b}}{2} = 0,5{\rm{a}} + b\\BaS{O_4}:b\end{array} \right.\)
→ mkết tủa = 98.(0,5a + b) + 233b = 73,3 (3)
Giải hệ (1) (2) (3) được a = 0,28; b = 0,18; c = 0,12
\(C{O_2}:0,45 + X\left\{ \begin{array}{l}N{a^ + }:0,28\\B{a^{2 + }}:0,18\\O{H^ - }:0,64\end{array} \right. \to {m_ \downarrow } = ?\)
Ta thấy 1 < nOH- / nCO2 = 0,64 / 0,45 = 1,422 < 2 → tạo CO32- (u mol) và HCO3- (v mol)
Giải hệ \(\left\{ \begin{array}{l}{n_{C{O_2}}} = u + v = 0,45\\{n_{O{H^ - }}} = 2u + v = 0,64\end{array} \right. \to \left\{ \begin{array}{l}u = 0,19\\v = 0,26\end{array} \right.\)
Ba2+ + CO32- → BaCO3 ↓
Bđ: 0,18 0,19
Pư: 0,18 → 0,18 → 0,18
→ m ↓ = mBaCO3 = 0,18.197 = 35,46 gam
Đáp án D
Câu hỏi 11 :
Hỗn hợp X gồm Na, K, Ba, trong đó số mol của Ba bằng một nửa số mol của hỗn hợp. Cho m gam hỗn hợp X tan hết trong nước dư thu được dung dịch Y và khí H2. Cho lượng H2 thu được vào bình kín đã chứa sẵn 1,2 mol N2 và một ít bột sắt, nung nóng để phản ứng xảy ra (biết hiệu suất phản ứng là 30%). Sau đó, dẫn toàn bộ hỗn hợp thu được qua ống đựng CuO dư đun nóng, phản ứng hoàn toàn, thấy khối lượng của CuO giảm 4,8 gam. Cho dung dịch Y tác dụng với dung dịch chứa 0,2 mol HCl; 0,04 mol AlCl3; 0,04 mol Al2(SO4)3 thu được a gam kết tủa. Giá trị gần nhất của a là
- A 32
- B 34
- C 36
- D 31
Đáp án: B
Phương pháp giải:
- Phương pháp bảo toàn nguyên tố.
- Phương pháp bảo toàn electron.
- Viết và tính toán theo phương trình ion rút gọn.
Lời giải chi tiết:
- Xét phản ứng của CuO và hỗn hợp {N2, H2, NH3}:
mCuO giảm = mO pư = 4,8 gam → nO pư = 4,8/16 = 0,3 mol
Bảo toàn nguyên tố O → \({n_{{H_2}O}} = {n_{Opu}} = 0,3(mol)\)
Ta thấy H của khí H2 cuối cùng chuyển hết thành H trong H2O nên:
Bảo toàn nguyên tố H → \({n_{{H_2}}} = {n_{{H_2}O}} = 0,3(mol)\)
- Xét phản ứng của hỗn hợp kim loại với H2O:
Ta luôn có: \({n_{O{H^ - }}} = 2{n_{{H_2}}} = 0,6(mol)\)
Đặt nNa + nK = nBa = x mol
Áp dụng bảo toàn e: \({n_{Na}} + {n_K} + 2{n_{Ba}} = 2{n_{{H_2}}} \Leftrightarrow x + 2{\rm{x}} = 2.0,3 \Leftrightarrow x = 0,2(mol)\)
- Xét phản ứng của Y {0,6 mol OH- và 0,2 mol Ba2+} với {0,2 mol H+; 0,12 mol Al3+; 0,12 mol SO42-}
H+ + OH- → H2O
0,2 → 0,2dư 0,4
Al3+ + 3OH- → Al(OH)3
0,12 → 0,36dư 0,04 → 0,12
Al(OH)3 + OH- → AlO2- + 2H2O
0,04dư 0,08 ← 0,04
Ba2+ + SO42- → BaSO4
0,12 ← 0,12 → 0,12
Vậy kết tủa chứa 0,08 mol Al(OH)3 và 0,12 mol BaSO4
→ m kết tủa = 0,08.78 + 0,12.233 = 34,2 gam gần nhất với 34 gam.
Đáp án B
Câu hỏi 12 :
Hỗn hợp X gồm Ba, BaO, Na, Na2O và K. Cho m gam hỗn hợp X vào nước dư thu được 3,136 lít H2 (đktc), dung dịch Y chứa 7,2 gam NaOH; 0,93m gam Ba(OH)2 và 0,044m gam KOH. Hấp thụ 7,7952 lít CO2 (đktc) vào dung dịch Y thu được a gam kết tủa. Giá trị a gần nhất với giá trị nào sau đây?
- A 25,5
- B 24,5
- C 26,5
- D 27,5
Đáp án: A
Phương pháp giải:
Ta có: nNaOH = 0,18 mol; nBa(OH)2 = \(\frac{{0,93m}}{{171}}\) mol; nKOH = \(\frac{{0,044m}}{{56}}\) mol
Đặt nH2O pư = a mol
BTKL → PT (1) ẩn m, a
BTNT "H" → PT (2) ẩn m, a
Giải hệ → m → nOH-
Khi cho CO2 hấp thụ vào dung dịch Y ta tính được số mol của CO32-
Ba2++ CO32- → BaCO3 ↓
→ mBaCO3
Lời giải chi tiết:
Ta có: nNaOH = 0,18 mol; nBa(OH)2 = \(\frac{{0,93m}}{{171}}\) mol; nKOH = \(\frac{{0,044m}}{{56}}\) mol
Đặt nH2O pư = a mol
BTKL: m + 18a = 7,2 + 0,93m + 0,044m + 0,14.2 (1)
BTNT "H": 2a = 0,18 + 2. \(\frac{{0,93m}}{{171}}\) + \(\frac{{0,044m}}{{56}}\) + 0,14.2 (2)
Giải hệ trên được m = 25,5 (g)
Vậy nNaOH = 0,18 mol; nBa(OH)2 = 0,1387 mol; nKOH = 0,02 mol
→ nOH- = 0,4774 mol và nCO2 = 0,348 mol
Tính tỉ lệ (*) = nOH-/ nCO2 = 0,4774 : 0,348 = 1,37 → tạo 2 muối CO32- (x mol) và HCO3- (y mol)
Ta có: nCO2 = x + y = 0,348 và nOH- = 2x + y = 0,4774
→ x = 0,1294 và y = 0,2186
Ba2++ CO32- → BaCO3 ↓
0,1387 0,1294 0,1294 mol
→ mBaCO3 = 0,1294.197 = 25,4918 gam ≈ 25,5 gam
Đáp án A
Câu hỏi 13 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al; Na và BaO vào nước dư, thu được dung dịch Y và 0,085 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,03 mol H2SO4 và 0,1 mol HCl vào Y, thu được 3,11 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng của Al trong hỗn hợp X gần nhất với giá trị nào sau đây?
- A 35,9%.
- B 28,8%.
- C 21,6%.
- D 43,1%.
Đáp án: B
Phương pháp giải:
\(m(g)\left\{ \matrix{
Al:a \hfill \cr
Na:b \hfill \cr
BaO:\,c \hfill \cr} \right.\buildrel { + {H_2}O} \over
\longrightarrow \left\{ \matrix{
{H_2}:0,085\,mol \hfill \cr
Y\left. {\left\{ \matrix{
N{a^ + },B{a^{2 + }} \hfill \cr
Al{O_2}^ - ,O{H^ - } \hfill \cr} \right.} \right\} + \left. {\left\{ \matrix{
{H_2}S{O_4}:0,03 \hfill \cr
HCl:0,1 \hfill \cr} \right.} \right\}\buildrel {} \over
\longrightarrow \left\{ \matrix{
3,11\,(g)\left\{ \matrix{
BaS{O_4}:c\,mol \hfill \cr
Al{(OH)_3}:\,d\,(mol) \hfill \cr} \right. \hfill \cr
7,43\,(g)Z\left\{ \matrix{
N{a^ + }:b\,(mol) \hfill \cr
A{l^{3 + }}: \hfill \cr
C{l^ - }:0,1\,(mol) \hfill \cr
S{O_4}^{2 - }:0,03 - c\,(mol) \hfill \cr} \right. \hfill \cr} \right. \hfill \cr} \right.\)
Sử dụng BTNT "Al" tìm ra mol Al3+(trong Z)
Lập phương trình bảo toàn e: 3nAl + nNa = 2nH2 (1)
Lập phương trình khối lượng 3,11 g kết tủa (2)
Lập phương trình bảo toàn điện tích trong Z (3)
Lập phương trình khối lượng các chất trong Z (4)
giải hệ (1), (2), (3), (4) ta tìm ra được a, b, c, d
Lời giải chi tiết:
\(m(g)\left\{ \matrix{
Al:a \hfill \cr
Na:b \hfill \cr
BaO:\,c \hfill \cr} \right.\buildrel { + {H_2}O} \over
\longrightarrow \left\{ \matrix{
{H_2}:0,085\,mol \hfill \cr
Y\left. {\left\{ \matrix{
N{a^ + },B{a^{2 + }} \hfill \cr
Al{O_2}^ - ,O{H^ - } \hfill \cr} \right.} \right\} + \left. {\left\{ \matrix{
{H_2}S{O_4}:0,03 \hfill \cr
HCl:0,1 \hfill \cr} \right.} \right\}\buildrel {} \over
\longrightarrow \left\{ \matrix{
3,11\,(g)\left\{ \matrix{
BaS{O_4}:c\,mol \hfill \cr
Al{(OH)_3}:\,d\,(mol) \hfill \cr} \right. \hfill \cr
7,43\,(g)Z\left\{ \matrix{
N{a^ + }:b\,(mol) \hfill \cr
A{l^{3 + }}: \hfill \cr
C{l^ - }:0,1\,(mol) \hfill \cr
S{O_4}^{2 - }:0,03 - c\,(mol) \hfill \cr} \right. \hfill \cr} \right. \hfill \cr} \right.\)
Bảo toàn e ta có: 3nAl + nNa = 2nH2 → 3a + b = 0,17 (1)
Khối lượng kết tủa: mkết tủa = 233c + 78d = 3,11 (2)
BTNT "Al" có: nAl ban đầu = nAl(OH)3 + nAl3+ → nAl3+ = a - d (mol)
Bảo toàn điện tích với các chất trong dd Z ta có:
nNa+ + 3nAl3+ = nCl- + 2nSO42-
→ b + 3 (a-d) = 0,1 + 2. (0,03 -c) (3)
BTKL mZ = 23b + 27(a - d) + 0,1.35,5 + 96.(0,03 - c) = 7,43
giải hệ (1), (2), (3) và (4) => a = 0,04; b = 0,05 ; c = 0,01 và d = 0,01
\(\% Al = {{{m_{Al}}} \over {{m_X}}}.100\% = {{0,04.27} \over {0,04.27 + 0,05.23 + 0,01.153}}.100\% = 28,72\% \) gần nhất với 28,8%
Đáp án B
Câu hỏi 14 :
Hỗn hợp X gồm: Al2O3, Ba, Na (trong đó số mol Na chiếm 8/14 tổng số mol của X). Hòa tan hoàn toàn X vào nước dư, thu được dung dịch Y và 0,07 mol khí H2. Cho từ từ đến hết dung dịch gồm 0,04 mol H2SO4 và 0,12 mol HCl vào Y thu được dung dịch Z (chỉ chứa m gam các muối clorua và muối sunfat trung hòa) và 10,11 gam hỗn hợp kết tủa. Giá trị của m là
- A 7,60.
- B 8,09.
- C 12,21.
- D 14,35.
Đáp án: A
Câu hỏi 15 :
Hòa tan hoàn toàn 20,7 gam hỗn hợp X gồm Na, Ba, BaO và Na2O vào nước dư thu được 4 lít dung dịch Y có pH = 13 và 0,05 mol khí H2. Cho 4 lít dung dịch Y tác dụng với 100 ml dung dịch chứa H2SO4 0,3M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m gần nhất với
- A 35
- B 30
- C 25
- D 42
Đáp án: B
Phương pháp giải:
*Quy đổi hỗn hợp thành: Na (x mol); Ba (y mol) và O (z mol)
+ mX => (1)
+ Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y mol) và OH-
BTĐT => nOH- = nNa+ + 2nBa2+ => (2)
+ BTe: nNa + 2nBa = 2nO + 2nH2 => (3)
Giải hệ thu được x, y, z.
Sau đó tính toán theo PTHH để xác định được khối lượng kết tủa thu được sau khi cho dung dịch Y phản ứng với hỗn hợp H2SO4 và Al2(SO4)3
Lời giải chi tiết:
*Quy đổi hỗn hợp thành: Na (x mol); Ba (y mol) và O (z mol)
+ mX = 23x + 137y + 16z = 20,7 (1)
+ Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y mol) và OH-
pH = 13 => pOH = 14 - 13 = 1 => [OH-] = 10-1 = 0,1M => nOH- = 0,1.4 = 0,4 mol
BTĐT => nOH- = nNa+ + 2nBa2+ => x + 2y = 0,4 (mol) (2)
+ BTe: nNa + 2nBa = 2nO + 2nH2 => x + 2y = 2z + 2.0,05 (3)
Giải hệ (1) (2) (3) thu được x = 0,2; y = 0,1; z = 0,15
*Cho Y {Na+ (0,2); Ba2+ (0,1); OH- (0,4)} tác dụng với hỗn hợp H2SO4 (0,03 mol) và Al2(SO4)3 (0,05 mol):
nH+ = 2nH2SO4 = 0,06 mol;
nAl3+ = 2nAl2(SO4)3 = 0,1 mol;
nSO42- = nH2SO4 + 3nAl2(SO4)3 = 0,18 mol
PTHH:
H+ + OH- → H2O
0,06 → 0,06 dư 0,34
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 dư 0,04 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 còn 0,06 ← 0,04
Ba2+ + SO42- → BaSO4
0,1 → 0,1 → 0,1
Vậy kết tủa gồm Al(OH)3 (0,06 mol) và BaSO4 (0,1 mol)
=> m kết tủa = 0,06.78 + 0,1.233 = 27,98 gam gần nhất với 30 gam
Đáp án B
Câu hỏi 16 :
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,06 mol khí H2 và dung dịch X. Hấp thụ hết 0,128 mol khí CO2 vào dung dịch X, thu được dung dịch Y (chỉ chứa các muối) và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau:
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,24M thấy thoát ra 0,03 mol khí CO2.
+ Nếu cho từ từ 200 ml dung dịch HCl 0,24M vào phần 2 thấy thoát ra 0,024 mol khí CO2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
- A 8,368.
- B 12,272.
- C 10,352.
- D 11,312.
Đáp án: C
Phương pháp giải:
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+
+ Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư)
CO32- + 2H+ → H2O + CO2
HCO3- + H+ → H2O + CO2
Dựa vào số mol H+ phản ứng và số mol CO2 sinh ra => nCO32- : nHCO3- = 3 : 2
+ Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol)
Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự:
CO32- + H+ → HCO3-
3a → 3a → 3a
HCO3- + H+ → CO2 + H2O
0,024 ← 0,024
Từ số mol H+ đề bài cho tính được a.
=> Thành phần dung dịch Y
BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => nBaCO3 = nBa (hh)
nNa(hh) = nNa+
BT electron: nNa + 2nBa = 2nO + 2nH2 => nO
=> m = mNa + mBa + mO
Lời giải chi tiết:
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+
+ Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư)
CO32- + 2H+ → H2O + CO2
x ← 2x → x
HCO3- + H+ → H2O + CO2
y ← y → y
=> nCO2 = x + y = 0,03 mol; nH+ = 2x + y = 0,24.0,2
Giải hệ thu được x = 0,018 và y = 0,012
=> nCO32- : nHCO3- = 0,018 : 0,012 = 3 : 2
+ Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol)
Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự:
CO32- + H+ → HCO3-
3a → 3a → 3a
HCO3- + H+ → CO2 + H2O
0,024 ← 0,024
=> nH+ = 3a + 0,024 = 0,048 => a = 0,008
Vậy 1/2 dung dịch Y gồm: CO32- (0,024 mol), HCO3- (0,016 mol)
=> dd Y gồm: CO32- (0,048 mol), HCO3- (0,032 mol) và Na+ (0,128 mol) (theo BTĐT)
BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => 0,128 = 0,048 + 0,032 + nBaCO3
=> nBaCO3 = 0,048 mol => nBa (hh) = nBaCO3 = 0,048 mol
nNa(hh) = nNa+ = 0,128 mol
BT electron: nNa + 2nBa = 2nO + 2nH2 => 0,128 + 2.0,048 = 2nO + 2.0,06 => nO = 0,052
=> m = mNa + mBa + mO = 0,128.23 + 0,048.137 + 0,052.16 = 10,352 gam
Đáp án C
Câu hỏi 17 :
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư, thu được dung dịch X và 0,672 lít khí H2 ở đktc. Chia dung dịch X thành 2 phần bằng nhau:
+ Phần 1 cho tác dụng với dung dịch CuSO4 dư thu được 8,09 gam kết tủa.
+ Phần 2 hấp thụ hết 1,344 lít CO2 thu được 1,97 gam kết tủa.
Giá trị của m là
- A 7,50 gam.
- B 7,66 gam.
- C 6,86 gam.
- D 7,45 gam.
Đáp án: A
Phương pháp giải:
Quy đổi hỗn hợp thành Na, Ba, O
Giả sử m/2 (gam) hỗn hợp có: Na (x mol); Ba (y mol) và O (z mol)
+ Hòa tan vào nước:
BT electron: nNa + 2nBa = 2nO + 2nH2 => (1)
+ Phần 1 tác dụng với CuSO4 dư:
Phần 1 của dung dịch X chứa: Na+ (x mol); Ba2+ (y mol) và OH-
BTĐT => nOH- = nNa+ + 2nCa2+ = x + 2y (mol)
Cu2+ + 2OH- → Cu(OH)2
x + 2y → 0,5x + y
Ba2+ + SO42- → BaSO4
y → y
=> m kết tủa = mCu(OH)2 + mBaSO4 => (2)
+ Phần 2 hấp thụ hết 0,06 mol CO2 thu được 0,01 mol BaCO3: nBaCO3 < nCO2 => có tạo muối HCO3-
BTNT "C": nHCO3- = nCO2 - nCO32- = ?
Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y-0,01 mol) và HCO3- (? mol)
BTĐT: nNa+ + 2nBa2+ = nHCO3- => (3)
Giải hệ (1) (2) (3) xác định được x, y, z
Lời giải chi tiết:
Cho m gam hỗn hợp tác dụng với nước dư thu được 0,03 mol H2
=> Cho m/2 gam hỗn hợp tác dụng với nước dư thu được 0,015 mol H2
Quy đổi hỗn hợp thành Na, Ba, O
Giả sử m/2 (gam) hỗn hợp có: Na (x mol); Ba (y mol) và O (z mol)
+ Hòa tan vào nước:
BT electron: nNa + 2nBa = 2nO + 2nH2 => x + 2y = 2z + 2.0,015 (1)
+ Phần 1 tác dụng với CuSO4 dư:
Phần 1 của dung dịch X chứa: Na+ (x mol); Ba2+ (y mol) và OH-
BTĐT => nOH- = nNa+ + 2nCa2+ = x + 2y (mol)
Cu2+ + 2OH- → Cu(OH)2
x + 2y → 0,5x + y
Ba2+ + SO42- → BaSO4
y → y
=> m kết tủa = mCu(OH)2 + mBaSO4 => 98(0,5x + y) + 233y = 8,09 (2)
+ Phần 2 hấp thụ hết 0,06 mol CO2 thu được 0,01 mol BaCO3: nBaCO3 < nCO2 => có tạo muối HCO3-
BTNT "C": nHCO3- = nCO2 - nCO32- = 0,06 - 0,01 = 0,05 mol
Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y-0,01 mol) và HCO3- (0,05 mol)
BTĐT: nNa+ + 2nBa2+ = nHCO3- => x + 2(y-0,01) = 0,05 (3)
Giải hệ (1) (2) (3) được x = 0,03; y = 0,02; z = 0,02
=> m = 2(23x + 137y + 16z) = 7,5 gam
Đáp án A
Câu hỏi 18 :
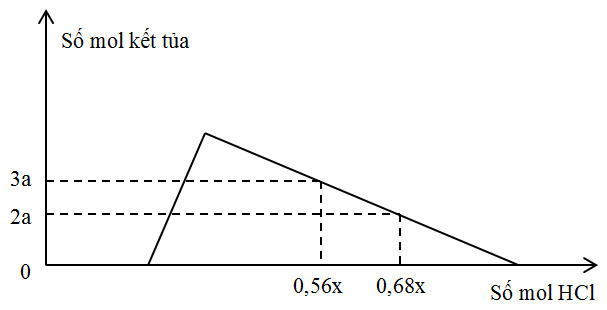
Hỗn hợp X gồm Al, Ca, Al4C3 và CaC2. Cho 40,3 gam X vào H2O dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy Z thu được 20,16 lít khí CO2 (đktc) và 20,7 gam H2O. Nhỏ từ từ V lít dung dịch HCl x M vào Y, được kết quả biểu diễn theo hình vẽ sau. Giá trị của x gần với giá trị nào sau đây?
- A 1,6
- B 2,2
- C 2,4
- D 1,8
Đáp án: C
Lời giải chi tiết:
Quy đổi hỗn hợp X thành: Al, Ca, C; quy đổi khí thành C, H
nCO2 = 0,9 mol => nC = 0,9 mol
nH2O = 1,15 mol => nH = 2,3 mol
\(\left\{ \begin{gathered}
Ca:x \hfill \\
Al:y \hfill \\
C:0,9 \hfill \\
\end{gathered} \right.\xrightarrow{{ + {H_2}O}}\left\{ \begin{gathered}
C:0,9 \hfill \\
H:2,3 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
40x + 27y + 12.0,9 = 40,3 \hfill \\
\xrightarrow{{BTe}}2x + 3y = 2,3 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,4 \hfill \\
y = 0,5 \hfill \\
\end{gathered} \right.\)
nOH- = 2nCa(OH)2 = 0,8 mol
Dung dịch X gồm: AlO2- (0,5 mol), OH- dư (0,3 mol)
Dựa vào đồ thị ta thấy tại 2 điểm nHCl = 0,56x và nHCl = 0,68x:
nHCl = nOH- dư + nAlO2- max + 3n kết tủa bị hòa tan
0,56x = 0,3 + 0,5 + 3(0,5-3a) (1)
0,68x = 0,3 + 0,5 + 3(0,5-2a) (2)
Giải (1) và (2) => x = 2,5; y = 0,1
Vậy x = 2,5 gần nhất với giá trị 2,4
Đáp án C
Câu hỏi 19 :
Hòa tan hoàn toàn hỗn hợp X gồm Na, Ba và Al2O3 vào nước dư, thu được dung dịch Y và 0,065 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,06 mol H2SO4 và 0,1 mol HCl vào Y, được 10,1 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng của Na trong hỗn hợp X gần nhất với giá trị nào sau đây?
- A 22,34%.
- B 23,45%.
- C 13,26%.
- D 27,78%.
Đáp án: C
Lời giải chi tiết:
*Cho X tác dụng với H2O dư:
Giả sử X chứa: Na (x mol); Ba (y mol); Al2O3 (z mol)
nOH- sinh ra = 2nH2 = 0,13 mol
Al2O3 + 2OH- → 2AlO2- + H2O
z → 2z
=> nOH- dư = 0,13 - 2z (mol)
Dung dịch Y chứa \(\left\{ \begin{gathered}
N{a^ + }:x \hfill \\
B{a^{2 + }}:y \hfill \\
Al{O_2}^ - :2z \hfill \\
O{H^ - }du:0,13 - 2z \hfill \\
\end{gathered} \right.\)
BTĐT: x + 2y = 2z + 0,13 - 2z => x + 2y = 0,13 (1)
*Phản ứng của dung dịch Y với hỗn hợp H2SO4 và HCl:
nH+ = 2nH2SO4 + nHCl = 0,22 mol; nSO42- = 0,06 mol; nCl- = 0,1 mol
Nếu SO42- phản ứng hết với Ba2+: mBaSO4 = 0,06.233 = 13,98 gam > 10,1 gam (vô lí)
=> Ba2+ phản ứng hết, SO42- dư
+ Tính Al(OH)3 sử dụng công thức tính nhanh: nH+ = nOH- + 4nAlO2- - 3nAl(OH)3
hay 0,22 = 0,13 - 2z + 4.2z - 3.nAl(OH)3 => nAl(OH)3 = 2z - 0,03 (mol)
+ Tính BaSO4: nBaSO4 = nBa2+ = y (mol)
=> m kết tủa = 233y + 78(2z - 0,03) = 10,1 (2)
*Xét muối trong dung dịch Z:
Na+: x (mol)
Al3+: 2z - (2z - 0,03) = 0,03 (mol)
Cl-: 0,1 (mol)
SO42-: 0,06 - y (mol)
=> m muối = 23x + 27.0,03 + 0,1.35,5 + 96(0,06 - y) = 7,43 (3)
Giải hệ (1) (2) (3) được x = 0,05; y = 0,04; z = 0,02
=> %mNa = 0,05.23/(0,05.23 + 0,04.137 + 0,02.102) = 13,264% gần nhất với 13,26%
Đáp án C
Câu hỏi 20 :
Hòa tan hoàn toàn m gam hỗn hợp Na, K, Ba, Al vào nước được dung dịch X và 8,512 lít H2 (đktc). Cho X phản ứng với 200 ml dung dịch H2SO4 1,25M và HCl 1M thu được 24,86 gam kết tủa và dung dịch Y chỉ chứa các muối clorua và sunfat trung hòa. Cô cạn Y được 30,08 gam chất rắn khan. Phần trăm khối lượng của Ba có trong hỗn hợp ban đầu là:
- A 60,04%.
- B 49,19%.
- C 48,15%.
- D 58,64%.
Đáp án: A
Phương pháp giải:
Ta có: nH2 = 0,38 mol suy ra ne = 0,76 mol
Dồn khối lượng kết tủa và chất rắn lại, ta có: mrắn = 24,86 + 30,08 = 54,94
Chất rắn có chứa 0,2 mol Cl-; 0,25 mol SO42-; a mol OH-; số mol ion dương kim loại = 0,76 mol
Dùng định luật bảo toàn điện tích và bảo toàn khối lượng suy ra a và m kim loại.
24,86 gam kết tủa gồm có Al(OH)3 và BaSO4 →%mBa
Lời giải chi tiết:
Ta có: nH2 = 0,38 mol suy ra ne = 0,76 mol
Dồn khối lượng kết tủa và chất rắn lại, ta có:
mrắn = 24,86 + 30,08 = 54,94 gam
→ Chất rắn có chứa 0,2 mol Cl-; 0,25 mol SO42-; a mol OH-; số mol ion dương kim loại = 0,76 mol
Bảo toàn điện tích có a + 0,25.2 + 0,2 = 0,76 → a = 0,06 mol
Bảo toàn khối lượng ta có mkim loại + mSO4 + mCl + mOH-= mkết tủa + mmuối
→ mkim loại = 54,94 – 0,25.96 – 35,5. 0,2 – 0,06.17 = 22,82 gam
Ta có nAl(OH)3 = nOH- : 3 = 0,06 : 3 = 0,02 mol
→ 24,86 gam kết tủa gồm có 0,02 mol Al(OH)3 và 0,1 mol BaSO4
→ nBa = 0,1 mol → %mBa = 60,04%
Đáp án A
50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có đáp án và lời giải chi tiết
30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có đáp án và lời giải chi tiết
20 bài tập axit tác dụng với muối aluminat có đáp án và lời giải chi tiết
20 bài tập vận dụng cao về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập vận dụng về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập về nhôm và hợp chất của nhôm tác dụng với axit có tính OXH có đáp án và lời giải chi tiết
20 bài tập nhôm và hợp chất của nhôm tác dụng với axit không có tính OXH có đáp án và lời giải chi tiết
20 bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch muối có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết về nhôm và hợp chất của nhôm có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









