15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
Làm đề thiCâu hỏi 1 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5g chất rắn khan gồm 4 muối. giá trị của V là
- A 150.
- B 180.
- C 140.
- D 200.
Đáp án: D
Phương pháp giải:
Bài toán CO2 + dung dịch kiềm; bảo toàn điện tích, bảo toàn nguyên tố
Công thức giải nhanh :
+) TH1 : nOH ≥ 2.nCO2 => OH- dư
=>nCO3 = nCO2
+) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3-
=>nCO3 = nOH – nCO2
+) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-.
=>nHCO3 = nOH
Lời giải chi tiết:
Vì phản ứng tạo 4 muối => có tạo x mol CO32- và y mol HCO3-
=> mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 = 23.2,75v + 2.39v + 60x + 61y
Bảo toàn điện tích : nNa+ + nK+ = nHCO3- + nCO3(2-).2 => 2,75v + 2v = 2x + y
Bảo toàn C : nCO2 + nK2CO3 = x + y = 0,4 + v
Giải hệ phương trình 3 ẩn ta có : v = 0,2 lit = 200 ml
Đáp án D
Câu hỏi 2 :
Hấp thụ hoàn toàn V lit CO2 (đktc) vào bình đựng 200 ml dung dịch NaOH 1M và Na2CO3 0,5M. Cô cạn dung dịch sau phản ứng (bằng cách đun nóng) đến khối lượng không đổi thu được 19,9g chất rắn khan. Giá trị của V là
- A 4,48
- B 1,12
- C 2,24
- D 3,36
Đáp án: B
Phương pháp giải:
Bài toán CO2 + dung dịch kiềm
Công thức giải nhanh :
+) TH1 : nOH ≥ 2.nCO2 => OH- dư
=>nCO3 = nCO2
+) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3-
=>nCO3 = nOH – nCO2
+) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-.
=>nHCO3 = nOH
Lời giải chi tiết:
nNaOH = 0,2 mol ; nNa2CO3 = 0,1 mol
Xét trường hợp 2 muối NaHCO3 và Na2CO3 thì sau khi cô cạn chỉ thu được Na2CO3 (vì NaHCO3 không bền phân huỷ hết thành Na2CO3). Khi đó nNa2CO3 = 0,2 mol
=> mNa2CO3 =21,2 gam ≠ 19,9 gam
=> Chất rắn khan có chứa cả NaOH
Đặt nNaOH pư = x mol
=> Chất rắn gồm (0,2 – x) mol NaOH và (0,1 + 0,5x) mol Na2CO3
=> mrắn = 40.(0,2 – x) + 106.(0,1 + 0,5x) = 19,9g
=> x = 0,1 mol
=> nCO2 = ½ nNaOH pứ = 0,05 mol => V = 1,12 lit
Đáp án B
Câu hỏi 3 :
Dẫn từ từ 5,6 lít CO2 (đktc) vào 400ml dung dịch chứa đồng thời các chất NaOH 0,3M; KOH 0,2M; Na2CO3 0,1875M; K2CO3 0,125M thu được dung dịch X. Thêm dung dịch CaCl2 dư vào dung dịch X, số gam kết tủa thu được là:
- A 7,5gam.
- B 25gam.
- C 12,5gam.
- D 27,5gam.
Đáp án: A
Phương pháp giải:
Bài toán CO2 + dung dịch kiềm
Công thức giải nhanh :
+) TH1 : nOH ≥ 2.nCO2 => OH- dư
=>nCO3 = nCO2
+) TH2 : nCO2< nOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3-
=>nCO3 = nOH – nCO2
+) TH3 : nCO2> nOH => CO2 dư => sinh ra muối HCO3-.
=>nHCO3 = nOH
Lời giải chi tiết:
nCO2 = 0,25 mol
nCO3 = 0,125 mol ; nOH = 0,2 mol
Thứ tự phản ứng:
(1) CO2 + 2OH - → CO3 2- + H2O
0,1 ← 0,2 → 0,1 (mol)
Sau phản ứng (1):
CO2: 0,15 mol
CO32-: 0,1 + 0,125 = 0,225 mol
(2) CO2 + CO32- + H2O → 2HCO3-
0,15→0,15
nCO32- dư = 0,225 – 0,15 = 0,075 mol = nCaCO3
=> mCaCO3 = 0,075.100 = 7,5 gam
Đáp án A
Câu hỏi 4 :
Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 1,82 gam kết tủa. Gía trị của x là
- A 1,4
- B 1,0
- C 1,2
- D 1,6
Đáp án: A
Phương pháp giải:
Bảo toàn nguyên tố
Lời giải chi tiết:
nCO2 = 2,24:22,4 = 0,1 mol; nK2CO3 = 0,02 mol; nKOH = 0,1x mol; nBaCO3 = 11,82: 197 = 0,06 mol
Ta thấy: nCO2 + nCO32- (trong K2CO3) = 0,1 + 0,02 > nBaCO3 = 0,06 mol => Hấp thụ CO2 xảy ra 2 PT:
CO2 + OH- → HCO3- (1)
CO2 + 2OH- → CO3 2- + H2O (2)
Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- + nBaCO3
=> nHCO3- = 0,1 + 0,02 – 0,06 = 0,06 mol
=> ∑nOH- (1) +(2) = nHCO3- + 2 (nBaCO3 - nK2CO3 ) = 0,06 + 2. ( 0,06 – 0,02) = 0,14 mol
=> CM = n: V = 0,14 : 0,1 = 1,4 M
Đáp án A
Câu hỏi 5 :
Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100ml dung dịch chứa K2CO3 0,2M và NaOH x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư, thu được 11,82 gam kết tủa. Giá trị của x là:
- A 1,4
- B 1,2
- C 1,0
- D 1,6
Đáp án: A
Phương pháp giải:
+ BTNT C => nHCO3-=nCO2+nK2CO3-nCO32-
+ nOH-=2nCO32-+nHCO3-
Lời giải chi tiết:
nCO2=0,1 mol; nK2CO3=0,02 mol
nCO32-=nBaCO3=0,06 mol
BTNT C => nHCO3-=nCO2+nK2CO3-nCO32-=0,1+0,02-0,06=0,06 mol
=> CO2 tác dụng với NaOH:
CO32-: 0,06-0,02=0,04 mol
HCO3-: 0,06 mol
=> nOH-=2nCO32-+nHCO3-=2.0,04+0,06=0,14 mol
=> x=1,4M
Đáp án A
Câu hỏi 6 :
Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào dung dịch chứa a mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau. Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc). Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa. Tỉ lệ a: b tương ứng là
- A 1:2.
- B 2: 3.
- C 2: 5.
- D 2: 1.
Đáp án: B
Phương pháp giải:
Bảo toàn nguyên tố C, Na
Bảo toàn điện tích
Lời giải chi tiết:
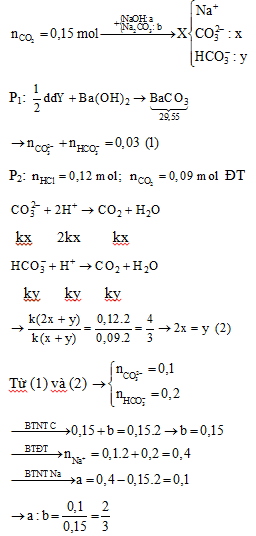
Đáp án B
Câu hỏi 7 :
Hấp thụ hoàn toàn 0,56 lít CO2 (đktc) vào 50 mL dung dịch gồm K2CO3 1,0M và KOH xM, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư, thu được 9,85 gam kết tủa. Giá trị của x là
- A 1,0.
- B 0,5.
- C 1,2.
- D 1,5.
Đáp án: B
Phương pháp giải:
CO2 + OH- → HCO3 –
CO2 + 2OH- → CO3 2- + H2O
Dd Y chứa: HCO3- ; CO32- ; K+
Ba2+ + CO32- → BaCO3↓
=> nCO3 2- (trong Y) = nBaCO3 = ? (mol)
Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- (trong Y) + nCO32- (trong Y)
=> nHCO3- (trong Y) =? (mol)
Bảo toàn điện tích các chất trong dd Y: nK+ = nHCO3- + 2. nCO32- = ? (mol)
BTNT K: nKOH = ∑ nK+ - 2nK2CO3 = ? (mol)
=> x = ? (M)
Lời giải chi tiết:
nCO2 = 0,025 (mol) ; nK2CO3 = 0,05 (mol) ; nKOH = 0,05x (mol)
nBaCO3 = 9,85 : 197 = 0,05 (mol)
CO2 + OH- → HCO3 –
CO2 + 2OH- → CO3 2- + H2O
Dd Y chứa: HCO3- ; CO32- ; K+
Ba2+ + CO32- → BaCO3↓
=> nCO3 2- (trong Y) = nBaCO3 = 0,05 (mol)
Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- (trong Y) + nCO32- (trong Y)
=> 0,025 + 0,05 = nHCO3- (trong Y) + 0,05
=> nHCO3- (trong Y) =0,025 (mol)
Bảo toàn điện tích các chất trong dd Y: nK+ = nHCO3- + 2. nCO32- = 0,025 + 2. 0,05 = 0,125 (mol)
BTNT K: nKOH = ∑ nK+ - 2nK2CO3 = 0,125 – 2. 0,05 = 0,025 (mol)
=> 0,05x = 0,025
=> x = 0,5 (M)
Đáp án B
Câu hỏi 8 :
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 1 mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau :
- Phần 1: Cho từ từ vào 120ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc).
- Phần 2: Cho tác dụng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa.
Tỉ lệ a : b tương ứng là :
- A 2 : 3.
- B 2 : 1.
- C 1 : 2.
- D 2 : 5.
Đáp án: A
Phương pháp giải:
+ Xét phần 2 có:\(\frac{1}{2}({n_{C{O_2}(bd)}} + {n_{C{O_3}^{2 - }(bd)}}) = {n_{BaC{O_3}}} \to b = ?\)
+ Xét phần 1: giả sử dd X có x mol NaHCO3 và y mol Na2CO3 phản ứng với 0,12 mol HCl
ta có hệ:
\(\left\{ \begin{gathered}
{n_{{H^ + }}} = x + 2y = 0,12 \hfill \\
{n_{C{O_2}}} = x + y = 0,09 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = ? \hfill \\
y = ? \hfill \\
\end{gathered} \right.\)
→ Tỉ lệ NaHCO3 và Na2CO3 có trong phần 1
BTNT "C" ta có: \({n_{NaHC{O_3}}} + {n_{N{a_2}C{O_3}}} = \frac{1}{2}({n_{C{O_2}(bd)}} + {n_{C{O_3}^{2 - }(bd)}})\)
→ Số mol của NaHCO3 và Na2CO3 có trong phần 1
BTNT "Na" tính được a
Có a, b ta suy ra được tỉ lệ
Lời giải chi tiết:
nCO2(đktc) = 3,36 :22,4 = 0,15 (mol)
Phần 1: nHCl = 0,12.1 = 0,12 (mol); nCO2(đktc) = 2,016:22,4 = 0,09 (mol)
Phần 2: nBaCO3 = 29,55 : 197 = 0,15 (mol)
Xét phần 2 có:
\({1 \over 2}({n_{C{O_2}(bd)}} + {n_{C{O_3}^{2 - }(bd)}}) = {n_{BaC{O_3}}} \to {1 \over 2}(0,15 + b) = 0,15 \to b = 0,15\)
Xét phần 1: giả sử dd X có x mol NaHCO3 và y mol Na2CO3 phản ứng với 0,12 mol HCl
ta có hệ:
\(\left\{ \matrix{
{n_{{H^ + }}} = x + 2y = 0,12 \hfill \cr
{n_{C{O_2}}} = x + y = 0,09 \hfill \cr} \right. \to \left\{ \matrix{
x = 0,06 \hfill \cr
y = 0,03 \hfill \cr} \right.\)
→ Trong phần 1 có \({{{n_{NaHC{O_3}}}} \over {{n_{N{a_2}C{O_3}}}}} = {{0,06} \over {0,03}} = {2 \over 1}\)
BTNT "C" ta có: \({n_{NaHC{O_3}}} + {n_{N{a_2}C{O_3}}} = {1 \over 2}({n_{C{O_2}(bd)}} + {n_{C{O_3}^{2 - }(bd)}}) = 0,15\)
→ Phần 1 có 0,1 mol NaHCO3 và 0,05 mol Na2CO3
BTNT "Na" ta có: a + 2.0,15 = 2.(0,1+ 0,05.2)
→ a = 0,1
→ a : b = 0,1 : 0,15 = 2:3
Đáp án A
Câu hỏi 9 :
Hấp thụ hoàn toàn 7,84 lít khí CO2 bằng 500 ml dung dịch hỗn hợp Na2CO3 0,5M và KOH aM thu được dung dịch X. Nhỏ từ từ đến hết 200 ml dung dịch HCl 1M vào dung dịch X thì thấy có 2,24 lít khí thoát ra. Giá trị của a là:
- A 0,4
- B 1,5
- C 1,4
- D 1,2
Đáp án: A
Câu hỏi 10 :
Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được khí X và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện m gam kết tủa. Biểu thức liên hệ giữa m với a và b là
- A
m = 100(2b - a).
- B
m = 56(2a - b).
- C m = 100(a - b).
- D m = 197(a + b).
Đáp án: A
Phương pháp giải:
- Tính số mol HCO3-
- Tính số mol kết tủa
Lời giải chi tiết:
Khi cho từ từ HCl vào dd Na2CO3 ban đầu xảy ra phản ứng:
H+ + CO32- → HCO3- (1)
Do thu được khí nên ở (1) thì H+ dư, CO32- hết, ta có thêm phản ứng:
H+ + HCO3- → CO2 + H2O (2)
Vì dung dịch Y tác dụng với nước vôi trong có kết tủa nên có chứa HCO3-, suy ra ở (2) H+ hết, HCO3- dư.
Cho Y tác dụng với nước vôi trong dư thì:
Ca2+ + OH- + HCO3- → CaCO3 + H2O (3)
Đặt mol vào các PTHH:
H+ + CO32- → HCO3- (1)
Bđ: a b
Pư: b ← b → b
Sau: a-b 0 b
H+ + HCO3- → CO2 + H2O (2)
Bđ: a-b b
Pư: a-b → a-b
Sau: 0 2b-a
Ca2+ + OH- + HCO3- → CaCO3 + H2O (3)
2b-a → 2b-a
→ mkết tủa = \({m_{CaC{O_3}}}\) = 100(2b-a) (g)
Đáp án A
Câu hỏi 11 :
Hấp thụ hết 0,3 mol khí CO2 vào 500 ml dung dịch chứa Na2CO3 0,2M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, số mol Na2CO3 thu được là
- A 0,30.
- B 0,10.
- C 0,20.
- D 0,25.
Đáp án: A
Phương pháp giải:
Cách 1: Viết PTHH
Thứ tự các phản ứng xảy ra là:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
Cách 2: Dùng tỉ lệ nNa : nC
Bảo toàn Na → nNa = 2nNa2CO3 bđ + nNaOH
Ta thấy \(\frac{{{n_{Na}}}}{{{n_C}}} = 2,33 > 2\) ⟹ tạo muối Na2CO3 và NaOH còn dư
Bảo toàn C → nNa2CO3 thu được = nCO2
Lời giải chi tiết:
nNa2CO3 bđ = 0,1 mol; nNaOH = 0,5 mol
Cách 1: Viết PTHH
CO2 + 2NaOH → Na2CO3 + H2O (1)
0,25/0,05 ← 0,5 → 0,25
CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
0,05 → 0,05
⟹ nNa2CO3 thu được = nNa2CO3 bđ + nNa2CO3 (1) - nNa2CO3 (2) = 0,1 + 0,25 - 0,05 = 0,3 mol
Cách 2: Dùng tỉ lệ nNa : nC
Bảo toàn Na → nNa = 2nNa2CO3 bđ + nNaOH = 0,7 mol
Ta thấy \(\frac{{{n_{Na}}}}{{{n_C}}} = \frac{{0,7}}{{0,3}} = 2,33 > 2\) ⟹ tạo muối Na2CO3 và NaOH còn dư
Bảo toàn C → nNa2CO3 thu được = nCO2 = 0,3 mol
Đáp án A
Câu hỏi 12 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
- A 140.
- B 200.
- C 180.
- D 150.
Đáp án: B
Phương pháp giải:
\(C{O_2}:0,4\,mol + \left\{ \begin{gathered}
NaOH:2,75V(mol) \hfill \\
{K_2}C{O_3}:V(mol) \hfill \\
\end{gathered} \right. \to {\text{dd}}\,X\xrightarrow{{co\,can}}64,5(g)\,chat\,ran\left\{ \begin{gathered}
N{a^ + }:2,75V(mol) \hfill \\
{K^ + }:2V(mol) \hfill \\
C{O_3}^{2 - }:x(mol) \hfill \\
HC{O_3}^ - :y(mol) \hfill \\
\end{gathered} \right.\)
BTNT “C”: nCO32- + nHCO3- = nCO2 + nK2CO3 hay x + y = 0,4 + V (1)
BTĐT cho dd sau phản ứng có: 2nCO32- + nHCO3- = nNa+ + nK+ => 2x + y = 4,75V (2)
Từ (1) và (2) => x và y theo V
=> Thành phần dung dịch sau phản ứng (với ẩn số mol là V)
Dựa vào khối lượng chất tan trong dung dịch sau phản ứng tính được giá trị của V.
Lời giải chi tiết:
\(C{O_2}:0,4\,mol + \left\{ \begin{gathered}
NaOH:2,75V(mol) \hfill \\
{K_2}C{O_3}:V(mol) \hfill \\
\end{gathered} \right. \to {\text{dd}}\,X\xrightarrow{{co\,can}}64,5(g)\,chat\,ran\left\{ \begin{gathered}
N{a^ + }:2,75V(mol) \hfill \\
{K^ + }:2V(mol) \hfill \\
C{O_3}^{2 - }:x(mol) \hfill \\
HC{O_3}^ - :y(mol) \hfill \\
\end{gathered} \right.\)
BTNT “C”: nCO32- + nHCO3- = nCO2 + nK2CO3 hay x + y = 0,4 + V (1)
BTĐT cho dd sau phản ứng có: 2nCO32- + nHCO3- = nNa+ + nK+ => 2x + y = 4,75V (2)
Từ (1) và (2) => x = 3,75V – 0,4 và y = 0,8 – 2,75V
Dung dịch sau phản ứng gồm: Na+ (2,75V); K+ (2V), CO32- (3,75V-0,4); HCO3- (0,8-2,75V) (mol)
Khối lượng chất tan: 2,75V.23 + 2V.39 + (3,75V - 0,4).60 + (0,8-2,75V).61 = 64,5
=> V = 0,2 (lít) = 200 ml
Đáp án B
Câu hỏi 13 :
Hấp thụ hết một lượng khí CO2 vào dung dịch chứa a mol NaOH thu được dung dịch X. Nhỏ từ từ từng giọt đến hết lượng X vào 140 ml dung dịch HCl 1M và khuấy đều thu được 2,24 lít khí CO2 (đktc). Mặt khác, nếu cho toàn bộ X tác dụng với lượng dư dung dịch Ba(OH)2 thu được 24,625 gam kết tủa. Giá trị của a là
- A 0,300.
- B 0,350.
- C 0,175.
- D 0,150.
Đáp án: C
Phương pháp giải:
TH1: X chứa NaOH và Na2CO3
BTNT “C”: nNa2CO3 = nBaCO3 = ?
H+ + OH- → H2O
2H+ + CO32- → CO2 + H2O
TH2: X chứa Na2CO3 (a mol) và NaHCO3 (b mol)
BTNT “C”: nNa2CO3 + nNaHCO3 = nBaCO3 => a + b = 0,125 (1)
2H+ + CO32- → CO2 + H2O
2ka ← ka → ka
H+ + HCO3- → CO2 + H2O
kb ← kb
nH+ = 2ka + kb = 0,14 hay k(2a + b) = 0,14(2)
nCO2 = ka + kb = 0,1 hay k(a + b) = 0,1 (3)
Từ (1) (2) (3) => a, b
BTNT “Na”: nNaOH = 2nNa2CO3 + nNaHCO3 = ?
Lời giải chi tiết:
nBaCO3 = 24,625 : 197 = 0,125 mol
TH1: X chứa NaOH và Na2CO3
BTNT “C”: nNa2CO3 = nBaCO3 = 0,125 mol
H+ + OH- → H2O
x x
2H+ + CO32- → CO2 + H2O
0,2 ← 0,2
=> nH+ = x + 0,2 = 0,14 => x < 0 (loại)
TH2: X chứa Na2CO3 (a mol) và NaHCO3 (b mol)
BTNT “C”: nNa2CO3 + nNaHCO3 = nBaCO3 => a + b = 0,125 (1)
2H+ + CO32- → CO2 + H2O
2ka ← ka → ka
H+ + HCO3- → CO2 + H2O
kb ← kb
nH+ = 2ka + kb = 0,14 hay k(2a + b) = 0,14(2)
nCO2 = ka + kb = 0,1 hay k(a + b) = 0,1 (3)
Từ (1) (2) (3) => a = 0,05 và b = 0,075
BTNT “Na”: nNaOH = 2nNa2CO3 + nNaHCO3 = 2.0,05 + 0,075 = 0,175 mol
Đáp án C
Câu hỏi 14 :
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác cho 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4g kết tủa. Giá trị của x là:
- A 0,05
- B 0,10
- C 0,30
- D 0,20
Đáp án: B
Phương pháp giải:
Bài toán muối cacbonat, hidrocacbonat + H+
- TH1: Nếu Cho từ từ Muối (CO32-: x mol và HCO3-: y mol) vào dung dịch Axit
=> Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời theo đúng tỉ lệ về số mol.
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ → CO2 + H2O
=> nCO3 pứ : nHCO3 pứ = x : y
- TH2: Nếu cho từ từ H+ vào dung dịch muối (CO32-: x mol và HCO3-: y mol)
=> Do ban đầu H+ thiếu nên phản ứng với CO32- trước:
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
- TH3: Trộn nhanh 2 dung dịch axit và muối
=> Không biết chất nào phản ứng với chất nào trước
=> Xét cả 2 trường hợp TH1 và TH2 => Sau đó lấy giá trị trong khoảng
Lời giải chi tiết:
nCO2 = 4,48 : 22,4 = 0,2 mol; nBaCO3 = 39,4 : 197 = 0,2 mol
*Cho 100 ml dung dịch X tác dụng với Ba(OH)2 dư thu được 0,2 mol BaCO3
=> 200 ml 0,4 mol
BTNT "C": nCO2 + nK2CO3 bđ = nBaCO3 => 0,2 + y = 0,4 => y = 0,2 mol
*CO2 tác dụng với hỗn hợp {KOH và K2CO3} nên có thể có 2 trường hợp xảy ra:
- TH1: Tạo thành K2CO3 và KOH dư
+ Xét 200 ml dung dịch X:
BTNT "C": nK2CO3 (dd X) = nCO2 + nK2CO3 bđ = 0,2 + 0,2 = 0,4 mol
BTNT "K": nKOH + 2nK2CO3 bđ = nKOH dư + 2nK2CO3 => x + 2.0,2 = nKOH dư + 2.0,4
=> nKOH dư = x - 0,4 (mol)
Vậy 1/2 dd X gồm: KOH dư (0,5x - 0,2 mol) và K2CO3 (0,2 mol)
+ Khi cho từ từ 1/2 dung dịch X phản ứng với 0,15 mol HCl thu được 0,12 mol CO2:
PTHH:
H+ + OH- → H2O
0,5x-0,2 ← 0,5x-0,2
2H+ + CO32- → H2O + CO2
0,24 ← 0,12 (vô lí vì ở đây số mol H+ phản ứng lớn hơn số mol H+ đề bài cho)
=> Loại
- TH2: Tạo KHCO3 và K2CO3
Giả sử dd X chứa a mol KHCO3 và b mol K2CO3
BTNT "C": a + b = (0,2 + 0,2)/2 (1)
Phản ứng đồng thời theo đúng tỉ lệ mol:
KHCO3 + HCl → H2O + CO2 + KCl
ka ka ka
K2CO3 + 2HCl → H2O + CO2 + 2KCl
kb 2kb → kb
nHCl = ka + 2kb = 0,15 (2) và nCO2 = ka + kb = 0,12 (3)
Giải (1) (2) (3) được a = 0,15; b = 0,05
=> 200 ml X chứa 0,3 mol KHCO3 và 0,1 mol K2CO3
BTNT "K": nKOH bđ + 2nK2CO3 bđ = nKHCO3 + 2nK2CO3 => x + 2.0,2 = 0,3 + 0,1.2 => x = 0,1
Đáp án B
Câu hỏi 15 :
Sục 6,16 lít CO2 (dktc) vào 1 lít dung dịch chứa NaOH x M và Na2CO3 y M thu được dung dịch X. Cho từ từ 200 ml dung dịch chứa HCl 1M và H2SO4 0,3M vào dung dịch X thu được 2,688 lít khí CO2 (dktc) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 59,29g kết tủa. Tỷ lệ x: y gần nhất với giá trị nào sau đây?
- A 5,4
- B 5,3
- C 5,2
- D 5,5
Đáp án: B
Phương pháp giải:
- Dựa vào thí nghiệm Ba(OH)2 + Y => số mol BaCO3 trong kết tủa
=> số mol HCO3- trong Y
(Vì Cho axit từ từ vào X nên thứ tự phản ứng là:
OH- + H+ → H2O
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O)
Bảo toàn C: nCO2 bđ + nNa2CO3 = nBaCO3 + nCO2 sản phẩm => nNa2CO3 = y
Bảo toàn điện tích: nNa = nCl + 2nSO4 + nHCO3 (Y) => nNa
Bảo toàn Na: nNa+ = nNaOH + 2nNa2CO3 => nNaOH = x
=> x: y
Lời giải chi tiết:
nCO2 = 6,16 : 22,4 = 0,275 mol
nHCl = 0,2.1 = 0,2 mol ; nH2SO4 = 0,2.0,3 = 0,06 mol ; nCO2 sản phẩm = 2,688 : 22,4 = 0,12 mol
- Khi Y + Ba(OH)2 thì kết tủa gồm 0,06 mol BaSO4 và BaCO3
=> nBaCO3 = 0,23 mol = nHCO3 trong Y
(Vì Cho axit từ từ vào X nên thứ tự phản ứng là:
OH- + H+ → H2O
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O)
Bảo toàn C: nCO2 bđ + nNa2CO3 = nBaCO3 + nCO2 sản phẩm
=> nNa2CO3 = 0,075 mol => y = 0,075 M
- Khi X + axit thì sau phản ứng dung dịch chỉ còn: NaCl ; Na2SO4 và NaHCO3
Bảo toàn điện tích: nNa = nCl + 2nSO4 + nHCO3 (Y)
=> nNa = 0,55 mol
Bảo toàn Na: nNa+ = nNaOH + 2nNa2CO3
=> nNaOH = 0,55 – 0,075.2 = 0,4 mol = x
=>x : y = 0,4 : 0,075 = 5,3
Đáp án B
15 bài toán cho từ từ axit vào muối cacbonat có đáp án và lời giải chi tiết
15 bài toán cho từ từ muối cacbonat vào axit có đáp án và lời giải chi tiết
50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có đáp án và lời giải chi tiết
20 bài toán kim loại kiềm tác dụng với nước có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ thông hiểu và vận dụng về kim loại kiềm có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ nhận biết về kim loại kiềm có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









