20 bài toán kim loại kiềm tác dụng với nước có lời giải
Làm đề thiCâu hỏi 1 :
Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được 2,24 lít H2 (đktc). Hai kim loại đó là
- A Li và Na
- B Na và K
- C K và Rb
- D Rb và Cs
Đáp án: B
Phương pháp giải:
Bảo toàn electron
n Kim loại kiềm = 2 nH2
Lời giải chi tiết:
nH2 = 0,1 mol
Gọi công thức chung của 2 kim loại kiềm là M
2M + 2H2O → 2MOH + H2
0,2 ← 0,1 (mol)
=> M trung bình = 6,2 : 0,2 = 31g/mol
Do 2 kim loại kiềm ở 2 chu kì liên tiếp nên là Na (M = 23) và K (M = 39)
Đáp án B
Câu hỏi 2 :
Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư), thu được 0,336 lít khí hidro (đktc). Kim loại kiềm là:
- A K
- B Li
- C Rb
- D Na
Đáp án: D
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nH2 = 0,336 : 22,4 = 0,015 (mol) => nM = 0,015.2/1 = 0,03 ( mol)
=> MM = 0,69 : 0,03 = 23 => Na
Đáp án D
Câu hỏi 3 :
Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng độ x%. Giá trị của x là
- A 14.
- B 18.
- C 22.
- D 16.
Đáp án: A
Lời giải chi tiết:
\(\begin{gathered}
{n_{{K_2}O}}{\text{ }} = {\text{ }}\frac{{9,4}}{{94}}{\text{ }} = {\text{ }}0,1{\text{ }}mol{\text{ }} = > {\text{ }}{n_{KOH}}{\text{ }} = {\text{ }}2{n_{{K_2}O}}{\text{ }} = {\text{ }}0,2{\text{ }}mol \hfill \\
\to C\% {{\text{ }}_{dd{\text{ }}KOH{\text{ }}}} = {\text{ }}\frac{{0,2.56}}{{9,4 + 70,6}}{\text{.100\% }} = 14\% \hfill \\
\end{gathered} \)
Đáp án A
Câu hỏi 4 :
Cho 7,8g K vào 192,4g nước thu được m gam dung dịch và 1 lượng khí thoát ra. Giá trị của m là :
- A 198g
- B 200g
- C 200,2g
- D 203,6g
Đáp án: B
Lời giải chi tiết:
nK = 7,8/39 = 0,2 mol
nH2 = 0,5nK = 0,1 mol
BTKL => m dung dịch = mK + mH2O – mH2 = 7,8 + 192,4 – 0,1.2 = 200 gam
Đáp án B
Câu hỏi 5 :
Cho 4,6g kim loại kiềm M tác dụng với lượng nước dư sinh ra 2,24 lit H2 (dktc). Kim loại M là :
- A K
- B Na
- C Li
- D Cs
Đáp án: B
Lời giải chi tiết:
M + H2O → MOH + 0,5H2
0,2 ← 0,1 (mol)
=> MM = 4,6/0,2 = 23g => Na
Đáp án B
Câu hỏi 6 :
Cho hỗn hợp các kim loại kiềm Na, K hoà tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hoà hết một phần ba dung dịch A là:
- A 100ml.
- B 200ml.
- C 300ml.
- D 600ml.
Đáp án: B
Lời giải chi tiết:
nOH- = 2nH2 = 0,06 mol
Số mol H+ cần để trung hòa 1/3 dung dịch A là: nH+ = 0,06/3 = 0,02 mol
=> V = 0,02/0,1 = 0,2 (lít) = 200 ml
Đáp án B
Câu hỏi 7 :
Hòa tan hoàn toàn m gam hỗn hợp Na, K vào nước dư thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch chứa HCl 1M và H2SO4 1M cần dùng để trung hòa hết dung dịch X là
- A 150 ml.
- B 200 ml.
- C 300 ml.
- D 100 ml.
Đáp án: D
Phương pháp giải:
=> nOH- = 2nH2 = ? (mol)
H+ + OH- → H2O
nH + = nOH - = ? (mol)
Mặt khác: nH+ = nHCl + 2nH2SO4 = ? (mol)
=> V = ?
Lời giải chi tiết:
nH2 = 3,36 : 22,4 = 0,15 (mol)
=> nOH- = 2nH2 = 0,3 (mol)
H+ + OH- → H2O
nH + = nOH - = 0,3 (mol)
Mặt khác: nH+ = nHCl + 2nH2SO4 = V + 2V = 3V (mol)
=> 3V = 0,3 => V =0,1 (lít) = 100 (ml)
Đáp án D
Câu hỏi 8 :
Cho 0,78 gam một kim loại kiềm tác dụng với nước dư sau phản ứng thu được 0,224 lít khí ở đktc. Kim loại kiềm là
- A Na.
- B K.
- C Rb.
- D Li.
Đáp án: B
Lời giải chi tiết:
Đáp án B
Câu hỏi 9 :
Hòa tan hoàn toàn hỗn hợp gồm K và Na vào nước thu được dung dịch X và V lít khí H2 (đktc). Trung hòa X cần 200 ml dung dịch H2SO4 0,1M. Giá trị của V là
- A 0,112.
- B 0,896.
- C 0,224.
- D 0,448.
Đáp án: D
Phương pháp giải:
Phản ứng trung hòa: nH+ = nOH-
BTNT H: nH2 = ½ nOH-
Lời giải chi tiết:
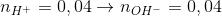
 lít
lít
Đáp án D
Câu hỏi 10 :
Cho 1,365 g một kim loại kiềm X tan hoàn toàn vào nước thu được một dung dịch có khối lượng lớn hơn so với khối lượng nước đã dùng là 1,33 gam. X là:
- A Na
- B K
- C Rb
- D Cs
Đáp án: B
Phương pháp giải:
2X + 2H2O → 2XOH + H2
1,365/X → 0,6825/X
Khối lượng dung dịch sau phản ứng lớn hơn khối lượng nước đã dùng là 1,33 gam => Khối lượng dung dịch tăng
m dd tăng = mKL – mH2 => X
Lời giải chi tiết:
2X + 2H2O → 2XOH + H2
1,365/X → 0,6825/X
Khối lượng dung dịch sau phản ứng lớn hơn khối lượng nước đã dùng là 1,33 gam => Khối lượng dung dịch tăng
m dd tăng = mKL – mH2 => 1,365 - (0,6825/X).2 = 1,33 => X = 39
Vậy X là Kali (K).
Đáp án B
Câu hỏi 11 :
Nồng độ phần trăm của dung dịch thu được khi cho 5,85 gam kali tác dụng với 162,3 gam H2O là:
- A 5,00%
- B 6,00%
- C 4,99%
- D 4,00%
Đáp án: A
Phương pháp giải:
Tính theo PTHH: K + H2O → KOH + 0,5 H2
Chú ý: mdd sau phản ứng = mK + mH2O - mH2
=> C% KOH
Lời giải chi tiết:
PTHH: K + H2O → KOH + 0,5 H2
0,15→ 0,15 →0,075 (mol)
mKOH = 0,15.56 = 8,4 gam
mdd sau phản ứng = mK + mH2O- mH2 = 5,85 + 162,3 – 0,075.2 = 168 (gam)
=> C% = 8,5/168.100% = 5%
Đáp án A
Câu hỏi 12 :
Cho hỗn hợp các kim loại kiềm Na, K tan hết vào nước được dung dịch A và 6,72 lít khí H2 (đktc). Thể tích dung dịch HCl 2 M cần để trung hòa hết một phần ba dung dịch A là
- A 100ml
- B 200ml
- C 300ml
- D 600ml
Đáp án: A
Phương pháp giải:
R + H2O → ROH + 0,5 H2
HS chú ý trung hòa 1/3 dung dịch A.
ROH + HCl → RCl + H2O
Lời giải chi tiết:
R +H2O → ROH + 0,5 H2
0,6 ← 0,3
Trung hòa 1/3 dung dịch A (nROH = 0,6 : 3 = 0,2 mol)
ROH + HCl → RCl +H2O
0,2 → 0,2
V dd HCl = n : CM = 0,2 : 2 = 0,1 lít = 100 ml
Đáp án A
Câu hỏi 13 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K và Ba vào nước thu được dung dịch Y và 8,96 lít khí H2 (đktc). Trung hòa Y cần dùng V ml dung dịch HCl 2 M. Giá trị của V là
- A 400ml
- B 500ml
- C 200ml
- D 250ml
Đáp án: A
Phương pháp giải:
Khi kim loại tác dụng với nước ta luôn có: nOH- = 2nH2
Phản ứng trung hòa luôn có: nH+ = nOH-
Lời giải chi tiết:
Khi kim loại tác dụng với nước ta luôn có: nOH- = 2nH2 = 2.0,4 = 0,8 mol
Phản ứng trung hòa luôn có: nH+ = nOH- = 0,8 mol
=> nHCl = nH+ = 0,8 mol
=> V dd HCl = n : CM = 0,8 : 2 = 0,4 lít = 400 ml
Đáp án A
Câu hỏi 14 :
Hòa tan 4,6 gam một kim loại kiềm vào 200 ml nước thu được 204,4 g một dung dịch kiềm. Kim loại đó là :
- A Li
- B Na
- C Rb
- D K
Đáp án: B
Phương pháp giải:
Bảo toàn khối lượng: mKL + mH2O = mdd kiềm + mH2 => mH2 = ?
Viết PTHH tìm số mol → M
Lời giải chi tiết:
Đặt kim loại kiềm là X thì 2X + 2H2O → 2XOH + H2
Bảo toàn khối lượng có mH2 = 4,6 + 200 - 4.4 =0,2 g → nH2 = 0,1 mol →nX =0,2
→ M = 46 / 0,2 =23 (Na)
Đáp án B
Câu hỏi 15 :
Cho 1,17g một kim loại kiềm tác dụng với nước (dư). Sau phản ứng thu được 0,336 lit khí hiđro (đktc). Kim loại kiềm là (Cho Li = 7, Na = 23, Rb = 85) :
- A Na
- B Li
- C Rb
- D K
Đáp án: D
Phương pháp giải:
Gọi kim loại kiềm là M, tính toán theo phương trình
M + H2O → MOH + 0,5H2
Lời giải chi tiết:
nH2 = 0,336 : 22,4 = 0,015 mol
M + H2O → MOH + 0,5H2
Mol 0,03 ← 0,015
=> MM = 1,17 : 0,03 = 39 (g/mol) => M là Kali
Đáp án D
Câu hỏi 16 :
Cho 4,6 gam Na tác dụng hoàn toàn với nước. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là
- A 6,72 lít.
- B 3,36 lít.
- C 4,48 lít.
- D 2,24 lít.
Đáp án: D
Phương pháp giải:
Tính chất hóa học của kim loại kiềm. Tính toán theo phương trình phản ứng
Lời giải chi tiết:
nNa = 4,6: 23 = 0,2 mol
Na + H2O → NaOH + 0,5H2
Mol 0,2 → 0,1
=> VH2 = 0,1.22,4 = 2,24 lit
Đáp án D
Câu hỏi 17 :
Hòa tan hoàn toàn 4,6 gam Na vào 24 gam nước thu được dung dịch NaOH có nồng độ
- A 12,3%
- B 28,17%
- C 19,78%
- D 13,45%
Đáp án: B
Phương pháp giải:
Bảo toàn khối lượng
Lời giải chi tiết:
nNa = 4,6: 23 = 0,2 mol
- Phản ứng: Na + H2O → NaOH + 0,5H2
Mol 0,2 → 0,2 → 0,1
Bảo toàn khối lượng: mNa + mH2O = mdd + mH2
=> mdd = 4,6 + 24 – 0,1.2 = 28,4g
=> C%NaOH = 0,2.40: 28,4 = 28,17%
Đáp án B
Câu hỏi 18 :
Hòa tan m gam kim loại Na vào trong H2O thu được dung dịch X. Trung hòa dung dịch X cần 100 ml dung dịch H2SO4 1M. Giá trị của m là:
- A 2,3
- B 9,2
- C 4,6
- D 6,9
Đáp án: C
Phương pháp giải:
Tính toán theo phương trình phản ứng
Lời giải chi tiết:
Các phản ứng : Na + H2O → NaOH + ½ H2
2NaOH + H2SO4 → Na2SO4 + 2H2O
nH2SO4 = 0,1.1 = 0,1 mol
Theo các phản ứng : nNa = nNaOH = 2nH2SO4 = 0,2 mol
=> mNa = m = 23.0,2 = 4,6g
Đáp án C
Câu hỏi 19 :
Cho m gam kim loại kiềm vào nước thu được 500 ml dung dịch A và 1,12 lít khí H2(đktc). Nồng độ mol/lít của dung dịch A là
- A 0,20M.
- B 0,40M.
- C 0,10M.
- D 0,05M
Đáp án: A
Phương pháp giải:
Đặt kim loại kiềm là M
PTHH: 2M + 2H2O → 2MOH + H2↑
→ nMOH = 2nH2 =? → CM = nMOH : V =?
Lời giải chi tiết:
nH2(đktc) = 1,12 :22,4 = 0,05 (mol)
Đặt kim loại kiềm là M
2M + 2H2O → 2MOH + H2↑
0,1 ← 0,05 (mol)
→ nMOH = 2nH2 = 2.0,05 = 0,1 (mol) → CM MOH = n:V = 0,1 : 0,5 = 0,2 (M)
Đáp án A
Câu hỏi 20 :
Hòa tan hoàn toàn 1,95 gam kim loại K vào H2O thu được 500 ml dung dịch có pH là
- A 13,0.
- B 14,0.
- C 13,5.
- D
12,0.
Đáp án: A
Phương pháp giải:
Đổi số mol K; nKOH = nK = ? => pOH = -log[KOH] = ? => pH = 14 - pOH =?
Lời giải chi tiết:
nK = 1,95 : 39 = 0,05 (mol)
K + H2O → KOH + 1/2H2
0,05 → 0,05 (mol)
nKOH = 0,05 (mol) → [KOH] = n : V = 0,05 : 0,5 = 0,1 → pOH = -lg[OH-] = 1
→ pH = 14 - pOH = 13
Đáp án A
15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có đáp án và lời giải chi tiết
15 bài toán cho từ từ axit vào muối cacbonat có đáp án và lời giải chi tiết
15 bài toán cho từ từ muối cacbonat vào axit có đáp án và lời giải chi tiết
50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ thông hiểu và vận dụng về kim loại kiềm có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ nhận biết về kim loại kiềm có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









