50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
Làm đề thiCâu hỏi 1 :
Có các phát biểu sau :
(a) Tất cả các kim loại kiềm thổ đều tan trong nước.
(b) Các kim loại kiềm có thể đẩy các kim loại yếu hơn ra khỏi dung dịch muối của chúng.
(c) Các ion Na+,Mg2+, Al3+ có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu.
(d) Các kim loại kiềm K, Rb, Cs có thể tự bốc cháy khi tiếp xúc với nước.
(e) Cho dung dịch NaOH dư vào dung dich AlCl3, sau phản ứng thu được dung dịch trong suốt.
Trong các phát biểu trên số phát biểu đúng là :
- A 2
- B 3
- C 5
- D 4
Đáp án: B
Lời giải chi tiết:
(a) Sai .Mg , Be không tan trong nước
(b) Sai. Các kim loại kiềm không thể đẩy kim loại khác ra khỏi muối
Đáp án B
Câu hỏi 2 :
Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 dư vào dung dịch Ca(OH)2.
(2) Sục khí NH3 dư vào dung dịch AlCl3.
(3) Sục khí CO2 dư vào dung dịch NaAlO2.
(4) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(5) Cho dung dịch HCl vào dung dịch K2SiO3.
(6) Cho ure vào dung dịch Ca(OH)2.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
- A 4
- B 5
- C 3
- D 6
Đáp án: B
Lời giải chi tiết:
(1) Sục khí CO2 dư vào dung dịch Ca(OH)2:
2CO2 + Ca(OH)2 → Ca(HCO3)2
=> không thu được kết tủa
(2) Sục khí NH3 dư vào dung dịch AlCl3:
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Do NH3 là bazo yếu không hòa tan được Al(OH)3
=> thu được kết tủa Al(OH)3
(3) Sục khí CO2 dư vào dung dịch NaAlO2:
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
CO2 + H2O có tính axit yếu nên không hòa tan được Al(OH)3
=> thu được kết tủa Al(OH)3
(4) Cho dung dịch AgNO3 vào dung dịch FeCl3:
3AgNO3 + FeCl3 → Fe(NO3)3 + 3AgCl↓
=> thu được kết tủa AgCl
(5) Cho dung dịch HCl vào dung dịch K2SiO3:
2HCl + K2SiO3 → 2KCl + H2SiO3↓
=> thu được kết tủa H2SiO3
(6) Cho ure vào dung dịch Ca(OH)2:
(NH2)2CO + 2H2O → (NH4)2CO3
(NH4)2CO3 + Ca(OH)2 → CaCO3↓ + 2NH3 + 2H2O
=> thu được kết tủa CaCO3
Vậy có 5 thí nghiệm thu được kết tủa.
Đáp án B
Câu hỏi 3 :
Cho sơ đồ phản ứng sau:
(a) X1 + H2O 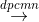 X2 + X3 ↑ + H2 (đpcmn: điện phân có màng ngăn)
X2 + X3 ↑ + H2 (đpcmn: điện phân có màng ngăn)
(b) X2 + X4 → BaCO3 ↓ + Na2CO3 + H2O
(c) X2 + X3 → X1 + X5 + H2O
(d) X4 + X6 → BaSO4 ↓ + K2SO4 + CO2↑ + H2O
Các chất X2, X5, X6 theo thứ tự là
- A NaOH, NaClO, KHSO4.
- B KOH, KClO3, H2SO4.
- C NaHCO3, NaClO, KHSO4.
- D NaOH, NaClO, H2SO4.
Đáp án: A
Lời giải chi tiết:
Ta có 2NaCl (X1) + 2H2O → 2NaOH (X2) + H2 + Cl2(X3)
NaOH + Ba(HCO3)2 (X4) → BaCO3 + Na2CO3 + H2O
2NaOH + Cl2 → NaCl + NaClO(X5) + H2O
Ba(HCO3)2 +2 KHSO4(X6) → BaSO4 + K2SO4 + 2H2O + 2CO2
Đáp án A
Câu hỏi 4 :
Hòa tan hết m gam chất rắn X gồm CaCO3 và KHCO3 vào dung dịch HCl dư thu được 4,48 lít khí CO2 ở đktC. Giá trị của m bằng
- A 15,00
- B 20,00
- C 25,00
- D 10,00
Đáp án: B
Phương pháp giải:
Phương pháp:
2 chất CaCO3 và KHCO3 có cùng phân tử khối => quy về cùng 1 chất có M = 100
Bảo toàn nguyên tố
Lời giải chi tiết:
Hướng dẫn giải:
nCO2 = 4,48 : 22,4 = 0,2 (mol)
=> nX = nCO2 = 0,2 (mol) => m = 0,2.100 = 20 (gam)
Đáp án B
Câu hỏi 5 :
Cho dãy các chất sau: KHCO3; Ba(NO3)2; SO3; KHSO4; K2SO3 ; K2SO4; K3PO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là:
- A 2
- B 4
- C 5
- D 3
Đáp án: C
Lời giải chi tiết:
Số chất phản ứng với dung dịch BaCl2 là: SO3, KHSO4, K2SO3, K2SO4, K3PO4. => Có 5 chất
Đáp án C
Câu hỏi 6 :
Thực hiện các thí nghiệm sau:
(1) Nung NaHCO3 rắn. (2). Cho CaOCl2 vào dung dịch HCl đặc
(3) Sục khí CO2 vào dung dịch Ba(OH)2 dư (4) Sục khí SO2 vào dung dịch KMnO4
(5). Cho dung dịch KHSO4 vào dung dịch NaHCO3. (6). Sục khí Cl2 vào dung dịch KI.
Số thí nghiệm sinh ra chất khí là:
- A 5
- B 4
- C 2
- D 3
Đáp án: D
Lời giải chi tiết:
Các thí nghiệm cho ra chất khí là: (1), (2), (5)
Đáp án D
Câu hỏi 7 :
Cho các phản ứng sau:
(1) NaOH + HCl;
(2) NaOH + CH3COOH;
(3) Mg(OH)2 + HNO3;
(4) Ba(OH)2 + HNO3;
(5) NaOH + H2SO4;
Hãy cho biết có bao nhiêu phản ứng có phương trình ion rút gọn là: H+ + OH- → H2O
- A 5
- B 2
- C 4
- D 3
Đáp án: D
Lời giải chi tiết:
Các phương trình 1 , 4 ,5 : muốn rút gọn được thì các chất đều phải là chất điện ly mạnh ( axit mạnh , bazo manh, muối tan )
(2 ) sai vì CH3COOH là axit yếu
(3 ) sai vì Mg(OH)2 là bazo yếu
Đáp án D
Câu hỏi 8 :
Nghiên cứu một dung dịch chứa chất tan X trong lọ không dán nhãn và thu được kết quả sau:
- X đều có phản ứng với cả 3 dung dịch: NaHSO4, Na2CO3 và AgNO3.
- X không phản ứng với cả 3 dung dịch: NaOH, Ba(NO3)2, HNO3.
Vậy dung dịch X là dung dịch nào sau đây?
- A Dung dịch Mg(NO3)2.
- B Dung dịch FeCl2.
- C Dung dịch BaCl2.
- D Dung dịch CuSO4.
Đáp án: C
Lời giải chi tiết:
X không phản ứng với NaOH => chỉ có BaCl2 thỏa mãn
Đáp án C
Câu hỏi 9 :
Cho các phát biểu sau:
(1) Điều chế kim loại Al bằng cách điện phân nóng chảy Al2O3.
(2) Tất cả kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường.
(3) Quặng boxit có thành phần chính là Na3AlF6.
(4) Bột nhôm tự bốc cháy khi tiếp xúc với khí clo.
(5) Thạch cao sống có công thức là CaSO4. H2O.
(6) Đun nóng có thể làm mềm nước có tính cứng vĩnh cửu.
Số phát biểu đúng là
- A 2.
- B 1.
- C 3.
- D 4.
Đáp án: B
Lời giải chi tiết:
(1) Đúng
(2) sai vì Be, Mg không tan trong nước.
(3) sai quặng boxit có thành phần chính là Al2O3.
(4) sai cần có nhiệt độ.
(5) Thạch cao sống có công thức CaSO4. 2H2O
(6) Sai đun nóng chỉ làm mềm được nước có tính cứng tạm thời
Đáp án B
Câu hỏi 10 :
Thực hiện các thí nghiệm sau:
(1) cho dung dịch NaOH dư vào dung dịch Ca(HCO3)2
(2) Cho Ca vào dung dịch Ba(HCO3)2
(3 Cho Ba vào dung dịch H2SO4 loãng
(4) cho H2S vào dung dịch Fe2(SO4)3
(5) Cho SO2 dư vào dung dịch H2S
(6) Cho NaHCO3 vào dung dịch BaCl2
(7) Cho dung dịch NaAlO2 dư vào dung dịch HCl
Số trường hợp xuất hiện kết tủa khi kết thúc thí nghiệm là
- A 5
- B 4
- C 6
- D 8
Đáp án: A
Lời giải chi tiết:
Hai muối thu được sau phản ứng là CuCl2 và FeCl2
Các trường hợp xuất hiện kết tủa: (1), (2), (3), (4), (7)
(1) 2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3 ↓ + 2H2O
(2) Ca + 2H2O → Ca(OH)2 + H2↑
Ca(OH)2 + Ba(HCO3)2 → CaCO3 ↓+ BaCO3 ↓ + 2H2O
(3) Ba + H2SO4 → BaSO4↓ + H2↑
(4) H2S + Fe2(SO4)3 → 2FeSO4 + S↓ + H2SO4
(7) NaAlO2 + HCl + H2O → Al(OH)3 ↓ + NaCl
Đáp án A
Câu hỏi 11 :
Cho các thí nghiệm sau:
(1) Cho dung dịch Al2(SO4)3 tác dụng với dung dịch NaOH (tỉ lệ mol 1:7).
(2) Cho MgCl2 vào dung dịch NaOH dư.
(3) Cho 0,5 mol Ca và 1 mol Al vào nước dư.
(4) Cho dung dịch AlCl3 tác dụng với lượng dư dung dịch NH3.
(5) Sục khí CO2 dư vào dung dịch NaAlO2.
Các thí nghiệm sau phản ứng thu được kết tủa là:
- A (1), (2), (4), (5)
- B (2), (4), (5)
- C (2), (3), (5)
- D (1), (3), (4)
Đáp án: A
Lời giải chi tiết:
(1) Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
1 → 6 dư 1 → 2
Al(OH)3 + NaOH → NaAlO2 + 2H2O
1 dư 1 ← 1
=> Thu được 1 mol Al(OH)3
(2) MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
=> Thu được kết tủa Mg(OH)2
(3) Ca + 2H2O → Ca(OH)2 + H2
0,5 → 0,5
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2
1 0,5
=> Không thu được kết tủa
(4) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
=> Thu được kết tủa Al(OH)3 (Vì NH3 có tính bazo rất yếu, không hòa tan được Al(OH)3)
(5) CO2 + H2O + NaAlO2 → Al(OH)3 + NaHCO3
=> Thu được kết tủa Al(OH)3 (Vì H2CO3 có tính axit rất yếu nên không hòa tan được Al(OH)3)
Vậy các thí nghiệm thu được kết tủa sau phản ứng là: (1), (2), (4), (5)
Đáp án A
Câu hỏi 12 :
Câu 72: Trong các thí nghiệm sau
(1) Cho dung dịch H2SO4 phản ứng với dung dịch Ba(HCO3)2
(2) Cho dung dịch Na2CO3 vào dung dịch AlCl3
(3) Cho Ba vào dung dịch NaHSO3
(4) Cho Mg vào dung dịch NaHSO4
(5) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2
(6) Cho Na vào dung dịch CuSO4
Số thí nghiệm vừa có khí bay ra vừa có kết tủa là:
- A 5
- B 4.
- C 2.
- D 3.
Đáp án: B
Lời giải chi tiết:
(1) H2SO4 + Ba(HCO3)2 → 2H2O + 2CO2 + BaSO4
(2) 2AlCl3 + 3H2O + 3Na2CO3 → 2Al(OH)3↓ + 6NaCl + 3CO2↑
(3) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + 2NaHSO3 → 2H2O + Na2SO3 + BaSO3
(4) Mg + 2NaHSO4 → Na2SO4 + MgSO4 + H2
(5) Ca(OH)2 + 2NaHCO3 → CaCO3 + 2H2O + Na2CO3
(6) Na + H2O → NaOH+ 1/2H2
NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Các thí nghiệm thỏa mãn (1), (2), (3), (6)
Đáp án B
Câu hỏi 13 :
Cho dung dịch chứa a mol Ca(HCO3)2 tác dụng với dun dịch chứa a mol chất tan X. Để thu được lượng kết tủa lớn nhất thì X là
- A Na2CO3
- B NaOH
- C Ca(OH)2
- D Ba(OH)2
Đáp án: D
Lời giải chi tiết:
Giả sử cho 1 mol Ca(HCO3)2 tác dụng với 1 mol của mỗi chất.
A. Na2CO3+Ca(HCO3)2→CaCO3+2NaHCO3 => m kết tủa = 100 g
B. NaOH+Ca(HCO3)2→CaCO3+NaHCO3+H2O => m kết tủa = 100 g
C. Ca(OH)2+Ca(HCO3)2→2CaCO3+2H2O => m kết tủa = 200 g
D. Ba(OH)2+Ca(HCO3)2→CaCO3+BaCO3+2H2O => m kết tủa = 297 g
Đáp án D
Câu hỏi 14 :
Hoàn tan hoàn toàn hỗn hợp gồm K2O, Al2O3; và MgO vào nước dư sau phản ứng hoàn toàn thu được dung dịch X và chất rắn Y. Sục khí CO2 tới dư vào dung dịch X sau phản ứng thu được kết tủa là:
- A BaCO3
- B Al(OH)3
- C MgCO3
- D Mg(OH)2
Đáp án: B
Lời giải chi tiết:
Đáp án B
\(\left\{ \begin{gathered}
{K_2}O \hfill \\
A{l_2}{O_3} \hfill \\
MgO \hfill \\
\end{gathered} \right.\xrightarrow{{ + {H_2}O}}\left\{ \begin{gathered}
KOH \hfill \\
KAl{O_2} \hfill \\
\end{gathered} \right. \to Al{(OH)_3}\)
sục khí CO2 tới dư thu được:
$C{O_2} + {H_2}O + KAl{O_2} \to KHC{O_3} + Al{(OH)_3} \downarrow $
Câu hỏi 15 :
Tiến hành các thí nghiệm sau:
a) Cho Al vào dung dịch Fe2(SO4)3 dư.
b) Cho dung dịch NaOH (loãng dư) vào dung dịch hỗn hợp Al2(SO4)3 và FeCl3.
c) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2.
d) Cho nước cứng tạm thời vào dung dịch NaOH
Số thí nghiệm thu được kết tủa là:
- A 1
- B 4
- C 2
- D 3
Đáp án: D
Lời giải chi tiết:
a) 2Al+3Fe2(SO4)3→Al2(SO4)3+6FeSO4
b) Thu được Fe(OH)3
c) 2KHSO4+Ba(HCO3)2→BaSO4↓+K2SO4+2H2O+2CO2
d) Thu được MgCO3 và CaCO3
Đáp án D
Câu hỏi 16 :
Thực hiện các thí nghiệm sau :
(I) Cho dung dịch NaCl vào dung dịch KOH
(II) Cho dung dịch K2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCL với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí CO2 vào dung dịch Na2CO3.
Số thí nghiệm không xảy ra phản ứng hóa học là:
- A 3.
- B 4.
- C 2.
- D 1.
Đáp án: D
Lời giải chi tiết:
Các thí nghiệm không xảy ra PUHH: (I); (IV) => có 2 thí nghiệm
Đáp án D
Câu hỏi 17 :
Trong các thí nghiệm sau :
(1) Cho dung dịch H2SO4 phản ứng với dung dịch Ba(HCO3)2
(2) Cho dung dịch Na2CO3 vào dung dịch AlCl3
(3) Cho Mg vào dung dịch NaHSO4
(4) Cho Na vào dung dịch CuSO4
Số thí nghiệm vừa có khí bay ra và kết tủa là :
- A 3
- B 2
- C 1
- D 4
Đáp án: A
Lời giải chi tiết:
(1) CO2 ; BaSO4
(2) CO2 ; Al(OH)3
(4) H2 ; Cu(OH)2
Đáp án A
Câu hỏi 18 :
Hòa tan m gam hỗn hợp KHCO3 và CaCO3 trong lượng dư dung dịch HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 11,2 lít khí CO2 (đktc). Giá trị của m là:
- A 40.
- B 100.
- C 60
- D 50.
Đáp án: D
Phương pháp giải:
+ Nhận thấy KHCO3 và CaCO3 có cùng PTK M= 100 (g/mol) => quy về 1 chất có PTK = 100 (g/mol)
+ Bảo toàn nguyên tố C
Lời giải chi tiết:
nCO2 = 11,2 :22, 4= 0,5 (mol)
BTNT C: => nCO3 = 0,5 (mol)
Vì KHCO3 và CaCO3 có cùng PTK M= 100 (g/mol) => ∑ nHH = ∑ nCO2 = 0,5 (mol)
=> m = 0,5.100= 50 (g)
Đáp án D
Câu hỏi 19 :
Cho các chất rắn: MgO, CaCO3, Al2O3 và các dung dịch: HCl, NaOH, NaHCO3. Khi cho các chất trên tác dụng với nhau từng đôi một, tổng số cặp chất phản ứng được với nhau là:
- A 6.
- B 7.
- C 5.
- D 8.
Đáp án: B
Lời giải chi tiết:
Các cặp chất phản ứng được với nhau là: MgO và HCl; CaCO3 và HCl; Al2O3 và HCl; Al2O3 và NaOH; HCl và NaOH; HCl và NaHCO3; NaOH và NaHCO3 => có 7 cặp chất tất cả
(1) MgO + 2HCl → MgCl2 + H2O
(2) CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
(3) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(4) Al2O3 + 2NaOH → 2NaAlO2 + H2O
(5) HCl + NaOH → NaCl + H2O
(6) HCl + NaHCO3 → NaCl + CO2 ↑+ H2O
(7) NaOH + NaHCO3 → Na2CO3 + H2O
Đáp án B
Câu hỏi 20 :
Cho ba dung dịch X, Y, Z thỏa mãn:
- X tác dụng với Y thì có kết tủa xuất hiện.
- Y tác dụng với Z thì có kết tủa xuất hiện.
- X tác dụng với Z có khí bay ra.
Các dung dịch X, Y, Z lần lượt là:
- A KHCO3, Ba(OH)2, K2SO4.
- B NaHCO3, Ba(OH)2, KHSO4.
- C NaHCO3, Ca(OH)2, Mg(HCO3)2.
- D AlCl3, AgNO3, KHSO4.
Đáp án: B
Lời giải chi tiết:
2NaHCO3 (X) + Ba(OH)2 ( Y) → BaCO3↓ + Na2CO3 + H2O
Ba(OH)2 (Y) + 2KHSO4 (Z)→ BaSO4↓ + K2SO4 + H2O
2NaHCO3 (X) + 2KHSO4 (Z)→ Na2SO4 + K2SO4 + 2CO2 ↑+ 2H2O
Đáp án B
Câu hỏi 21 :
Cho dãy các chất: Al, Al(OH)3, Al2O3, AlCl3. Số chất lưỡng tính trong dãy là
- A 3.
- B 2.
- C 1.
- D 4.
Đáp án: B
Lời giải chi tiết:
Các chất lưỡng tính trong dãy là: Al(OH)3, Al2O3 => có 2 chất
Đáp án B
Câu hỏi 22 :
Ba dung dịch X, Y, Z thỏa mãn
+ X tác dụng với Y thì có kết tủa xuất hiện.
+ Y tác dụng với Z thì có kết tủa xuất hiện.
+ X tác dụng với Z thì có khí bay ra.
Các dung dịch X, Y, Z lần lượt chứa
- A AlCl3, AgNO3, KHSO4.
- B KHCO3, Ba(OH)2, K2SO4.
- C NaHCO3, Ba(OH)2, KHSO4.
- D NaHCO3, Ca(OH)2, Mg(HCO3)2.
Đáp án: C
Lời giải chi tiết:
Xét X + Z thì có khí bay ra => chỉ có đáp án C thỏa mãn
2NaHCO3 + 2KHSO4 → Na2SO4 + K2SO4 + CO2↑ + H2O
Đáp án C
Câu hỏi 23 :
Cho các chất sau: Al; Al2O3; NH2C2H4COOH; NaHCO3; AlCl3; SO2; Al(OH)3. Số chất lưỡng tính trong dãy trên là:
- A 7
- B 5
- C 6
- D 4
Đáp án: D
Phương pháp giải:
+ Chất lưỡng tính là những chất vừa tác dụng với dd axit, vừa tác dụng với dd bazo
Lời giải chi tiết:
Số chất lưỡng tính trong dãy trên là: Al2O3; NH2C2H4COOH; NaHCO3; Al(OH)3.
Đáp án D
Câu hỏi 24 :
Hoà tan hoàn toàn một lượng Ba vào dung dịch chứa a mol HCl thu được dung dịch X và a mol H2. Trong các chất sau: Na2SO4, Na2CO3,Al, Al2O3, AlCl3, Mg, NaOH và NaHCO3. Số chất tác dụng được với dung dịch X là
- A 7.
- B 6.
- C 5.
- D 4.
Đáp án: B
Lời giải chi tiết:
- Nếu Ba không tác dụng với H2O thì Ba + a mol HCl chỉ sinh ra được a/2 mol H2
Nhưng đề bài cho thu được a mol H2 => Ba phải có tác dụng với H2O
Ba + 2HCl → BaCl2 + H2↑
Ba + H2O → Ba(OH)2 + H2↑
- Dung dịch X gồm BaCl2 (0,5a mol) và Ba(OH)2 (0,5a mol)
Các chất tác dụng được với dd X là: Na2SO4; Na2CO3, Al, Al2O3, AlCl3, NaHCO3 => có 6 chất.
Đáp án B
Câu hỏi 25 :
Cho các phản ứng theo sơ đồ:
X1 + H2O \(\xrightarrow{{dienphancomangngan}}\) X2 + X3 + H2 .
X2 + X4 → BaCO3 + K2CO3 + H2O.
Hai chất X2, X4 lần lượt:
- A KOH, Ba(HCO3)2 .
- B NaHCO3, Ba(OH)2.
- C KHCO3, Ba(OH)2 .
- D NaOH, Ba(HCO3)2.
Đáp án: A
Lời giải chi tiết:
2KCl + 2H2O \(\xrightarrow{{dp{\text{d}}d}}\) 2KOH + Cl2 + H2
KOH + Ba(HCO3)2 → BaCO3 + K2CO3 + H2O
Đáp án A
Câu hỏi 26 :
Có các chất sau: Na2O, NaCl, Na2CO3, NaHCO3, Na2SO4. Có bao nhiêu chất mà bằng một phản ứng có thể tạo ra NaOH ?
- A 5
- B 2
- C 4
- D 3
Đáp án: A
Lời giải chi tiết:
Các chất đó là: Na2O; NaCl; Na2CO3, NaHCO3, Na2SO4,
Na2O + H2O → NaOH
2NaCl + 2H2O \(\xrightarrow{{dpmn}}\) 2NaOH + H2 + Cl2
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
NaHCO3 + Ba(OH)2 → BaCO3↓ + NaOH + H2O
=> cả 5 chất đều có thể điều chế trực tiếp ra NaOH bằng một phản ứng.
Đáp án A
Câu hỏi 27 :
Criolit (còn gọi là băng thạch) có công thức phân tử Na3AlF6, được thêm vào Al2O3 trong quá trình điện phân Al2O3 nóng chảy để sản xuất nhôm. Criolit không có tác dụng nào sau đây?
- A Làm tăng độ dẫn điện của Al2O3 nóng chảy.
- B Làm giảm nhiệt độ nóng chảy của Al2O3.
- C Tạo lớp ngăn cách để bảo vệ Al nóng chảy.
- D Bảo vệ điện cực khỏi bị ăn mòn.
Đáp án: D
Lời giải chi tiết:
Đáp án D
Câu hỏi 28 :
Cho hỗn hợp rắn gồm Mg, MgCO3 vào dung dịch HNO3 loãng, dư thu được một chất khí duy nhất và dung dịch X. Nhỏ dung dịch NaOH dư vào dung dịch X thu được kết tủa và khí thoát ra . Sản phẩm khử HNO3 là
- A NO
- B N2
- C NH4NO3
- D NO2
Đáp án: C
Lời giải chi tiết:
Khí thoát ra duy nhất là khí CO2 => sản phẩm khử còn lại phải là NH4NO3
Đáp án C
Câu hỏi 29 :
Cho các phát biểu sau:
(a) Muối NaHCO3 được dùng làm thuốc chữa đau dạ dày do thừa axit.
(b) Ở nhiệt độ thường, tất cả các kim loại kiềm thổ đều tác dụng được với nước.
(c) Công thức hóa học của thạch cao khan là CaSO4.
(d) Các chất Al(OH)3, NaHCO3, Al2O3 đều lưỡng tính.
(e) Có thể dùng dung dịch NaOH để làm mềm nước cứng tạm thời.
Số phát biểu đúng là
- A 3.
- B 5.
- C 2.
- D 4.
Đáp án: A
Lời giải chi tiết:
a) sai, NaHCO3 dùng làm thuốc chữa đau dạ dày vì nó làm giảm nồng độ axit trong dạ dày chứ không phải do thừa axit
HCO3- + H+ → CO2 + H2O
b) sai, Be và Mg là kim loại kiềm thổ nhưng không tác dụng với nước
c) đúng
d) đúng
e) đúng: NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + H2O
=> Có 3 phát biểu đúng
Đáp án A
Câu hỏi 30 :
Tiến hành các thí nghiệm sau:
(a) Cho Na kim loại vào dung dịch CuSO4 dư.
(b) Cho dung dichj NaOH đến dư vào dung dịch AlCl3.
(c) Cho dung dịch HCl đến dư vào dung dịch NaAlO2.
(d) Sục khí CO2 đến dư vào dung dịch NaAlO2.
(e) Sục khí NH3 đến dư vào dung dịch Al2 (SO4)3.
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
- A 2.
- B 5.
- C 3.
- D 4.
Đáp án: C
Phương pháp giải:
Ghi nhớ: Al(OH)3 không tan trong dd NH3 dư
Lời giải chi tiết:
a) thu được Cu(OH)2↓
b) không thu được
c) thu được Al(OH)3↓
d) thu được Al(OH)3↓
=> có 3 phản ứng thu được kết tủa
Đáp án C
Câu hỏi 31 :
Cho các phát biểu sau:
(1) Tất cả kim loại kiềm và kiềm thổ tan trong nước thu được dung dịch kiềm và khí hiđro.
(2) Cho hỗn hợp Na và Al (tỉ lệ mol 1:2) tan hết trong nước dư.
(3) Cho Na vào dung dịch HCl thì Na phản ứng với nước trước sau đó phản ứng với HCl.
(4) Al vừa tác dụng được với NaOH và HCl nên Al là kim loại lưỡng tính.
Số phát biểu không đúng là
- A 1.
- B 2.
- C 3.
- D 4.
Đáp án: D
Lời giải chi tiết:
(1) S. Một số kim loại kiềm thổ không tan như Mg, Be, …
(2) S. Na phản ứng vừa đủ với Al theo tỉ lệ 1 : 1, theo đề bài tỉ lệ Na và Al là 1 : 2 nên Al còn dư.
(3) S. Na phản ứng với HCl sau đó là H2O.
(4) S. Không có khái niệm kim loại lưỡng tính.
Đáp án D
Câu hỏi 32 :
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch NaOH dư vào dung dịch Ca(HCO3)2
(2) Cho Ca vào dung dịch Ba(HCO3)2
(3) Cho Ba vào dung dịch H2SO4 loãng
(4) Cho H2S vào dung dịch Fe2(SO4)3
(5) Cho SO2 dư vào dung dịch H2S
(6) Cho NaHCO3 vào dung dịch BaCl2
(7) Cho dung dịch NaAlO2 dư vào dung dịch HCl
Số trường hợp xuất hiện kết tủa khi kết thúc thí nghiệm là
- A 5.
- B 4.
- C 6.
- D 8.
Đáp án: C
Lời giải chi tiết:
Gồm có (1) (2) (3) (4) (5) (7)
Đáp án C
Câu hỏi 33 :
Thực hiện các thí nghiệm sau:
(1) Cho kim loại K vào dung dịch HCl.
(2) Đốt bột Al trong khí Cl2.
(3) Cho Na2CO3 vào dung dịch BaCl2.
(4) Cho NaOH vào dung dịch Mg(NO3)2.
(5) Điện phân Al2O3 nóng chảy, có mặt Na3AlF6.
Số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
- A 3.
- B 4.
- C 2.
- D 1.
Đáp án: A
Phương pháp giải:
Phản ứng oxi hóa - khử là phản ứng trong đó có sự thay đổi số oxi hóa.
Lời giải chi tiết:
Phản ứng oxi hóa - khử là phản ứng trong đó có sự thay đổi số oxi hóa.
Gồm có (1), (2), (5)
Đáp án A
Câu hỏi 34 :
Trong các thí nghiệm sau:
(a) Cho dung dịch H2SO4 phản ứng với dung dịch Ba(HCO3)2.
(b) Cho dung dịch Na2CO3 vào dung dịch AlCl3.
(c) Cho Ba vào dung dịch NaHSO3.
(d) Cho Mg vào dung dịch NaHSO4.
(e) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2.
(g) Cho Na vào dung dịch CuSO4.
Số thí nghiệm vừa có khí bay ra vừa có kết tủa là:
- A 5.
- B 4.
- C 2.
- D 3.
Đáp án: B
Lời giải chi tiết:
(a) H2SO4 + Ba(HCO3)2 → BaSO4↓ + 2H2O + 2CO2↑
=> ↓, ↑
(b) 3Na2CO3 + 2AlCl3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 6NaCl
=> ↓, ↑
(c) Ba + H2O → Ba(OH)2 + H2↑
Ba(OH)2 + 2NaHSO3 → BaSO3↓ + Na2SO3 + 2H2O
=> ↓, ↑
(d) Mg + 2NaHSO4 → MgSO4 + Na2SO4 + H2↑
=> ↑
(e) 2NaHCO3 + Ca(OH)2 → CaCO3↓ + Na2CO3 + 2H2O
=> ↓
(g) 2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
=> ↓, ↑
Đáp án B
Câu hỏi 35 :
Cho từ từ dung dịch Na2CO3 lần lượt vào các dung dịch sau: Ba(HCO3)2; NaHSO4; Ba(OH)2; AlCl3; HCl; FeCl3. Số phản ứng tạo ra chất khí là
- A 5
- B 3
- C 4
- D 6
Đáp án: C
Lời giải chi tiết:
Na2CO3 + Ba(HCO3)2 → BaCO3 + 2NaHCO3
Na2CO3 + 2NaHSO4 → 2Na2SO4 + CO2↑ + H2O
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
3Na2CO3 + 2AlCl3 + 3H2O → 6NaCl + 2Al(OH)3 + 3CO2↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
3 Na2CO3 + 2FeCl3 + 3H2O → 6NaCl + 2Fe(OH)3 + 3CO2↑
Vậy có 4 phản ứng tạo ra khí
Đáp án C
Câu hỏi 36 :
Cho a mol K tan hết vào dung dịch chứa b mol HCl. Sau đó nhỏ dung dịch CuCl2 vào dung dịch thu được thấy xuất hiện kết tủa xanh lam. Mối quan hệ giữa a và b là
- A a > b
- B a < b
- C b < a < 2b
- D a = b
Đáp án: A
Lời giải chi tiết:
K + HCl → KCl + 1/2H2
K + H2O → KOH+ 1/2H2
KOH + Cu(OH)2 → Cu(OH)2 + KCl
Để có KOH thì K phải dư
=> nK > nHCl => a > b
Đáp án A
Câu hỏi 37 :
X, Y, Z là các dung dịch muối ứng với 3 gốc axit khác nhau. Thỏa mãn các điều kiện sau: X tác dụng với Y có khí thoát ra; Y tác dụng với Z có kết tủa; X tác dụng với Z vừa có khí, vừa có kết tủa. X, Y, Z lần lượt là
- A NaHSO4, Na2CO3, Ba(HSO3)2.
- B NaHSO4, CaCO3, Ba(HSO3)2.
- C Na2CO3, NaHSO3, Ba(HSO3)2.
- D CaCO3, NaHSO4, Ba(HSO3)2.
Đáp án: A
Lời giải chi tiết:
Vì Na2CO3 không phản ứng với NaHSO3 để sinh ra khí nên không thỏa mãn tính chất X, Y => Loại C
Vì CaCO3 không phản ứng được với Ba(HSO3)2 nên không thỏa mãn tính chất của Y, Z => Loại B
Vì CaCO3 không phản ứng được với Ba(HSO3)2 nên không thỏa mãn tính chất của X, Z => Loại D
Vậy đáp án đúng là A
2NaHSO4 (X) + Na2CO3 → 2Na2SO4 + H2O + CO2 ↑
Na2CO3 + Ba(HSO3)2 → BaCO3↓ + 2NaHSO3
2NaHSO4 + Ba(HSO3)2 → BaSO4↓ + Na2SO4 + 2SO2↑ + 2H2O
Đáp án A
Câu hỏi 38 :
Tiến hành các thí nghiệm sau :
(a) Cho dd AgNO3 vào dd HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi phản ứng kết thúc, số thí nghiệm thu được chất rắn là
- A 4
- B 2
- C 5
- D 3
Đáp án: D
Phương pháp giải:
Viết PTHH
Lời giải chi tiết:
(a) đúng tạo AgCl
(b) sai vì Al2O3 tan hết trong HCl
(c) đúng vì Cu không tác dụng với HCl còn nguyên sau phản ứng
(d) đúng do tạo kết tủa BaCO3 : Ba(OH)2 + KHCO3 → BaCO3 + KOH + H2O
Vậy có 3 thí nghiệm thu được chất rắn sau phản ứng
Đáp án D
Câu hỏi 39 :
Cho các phát biểu sau
(a) Công thức hóa học của phèn chua là K2SO4. Al2(SO4)3.24H2O.
(b) Các kim loại Na, K, Ba đều phản ứng mạnh với nước ở nhiệt độ thường.
(c) Quặng boxit có thành phần chính là Al2O3.2H2O.
(d) Nhôm là kim loại có màu trắng bạc, nhẹ, có nhiều ứng dụng quan trọng.
(e) Nước cứng là nước chứa nhiều ion Mg2+, Ca2+.
(g) Có thể điều chế kim loại Na bằng cách điện phân dung dịch NaCl.
Số phát biểu đúng là
- A 4.
- B 3.
- C 5.
- D 2.
Đáp án: C
Phương pháp giải:
Dựa vào kiến thức lí thuyết tổng hợp các chất vô cơ
Lời giải chi tiết:
Chỉ có (g) sai vì \(2NaCl + 2{H_2}O\buildrel {dpdd} \over\longrightarrow \,2NaOH + {H_2} \uparrow + \,C{l_2} \uparrow \)
=> có 5 phát biểu đúng
Đáp án C
Câu hỏi 40 :
Cho các hỗn hợp rắn sau:
(1) FeO, BaO, Al2O3 (tỉ lệ mol 1:1:1)
(2) Al, K, Al2O3 (tỉ lệ mol 1:2:1)
(3) Na2O, Al (tỉ lệ mol 1:1)
(4) K2O, Zn (tỉ lệ mol 1:1 )
Số hỗn hợp tan hết trong nước dư là:
- A 1
- B 3
- C 4
- D 2
Đáp án: D
Phương pháp giải:
Đặt số mol các chất theo tỉ lệ mol đề bài cho.
Viết lần lượt các phương trình hóa học xảy ra, tính toán theo phương trình để xác định chất hết, chất dư.
Lời giải chi tiết:
(1) BaO + H2O → Ba(OH)2
1 1 mol
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
1 1 1 mol
FeO không tan trong dung dịch kiềm
(2) Đặt số mol Al là 1 mol; K là 2 mol; Al2O3 là 1 mol
K + H2O → KOH + ½ H2
2 → 2 mol
Al + KOH + H2O → KAlO2 + 3/2 H2
1 1 mol
Al2O3 + 2KOH → 2 KAlO2+ H2O
1 1 mol
Vậy sau phản ứng còn chất rắn là Al dư hoặc Al2O3 dư.
(3) Đặt số mol của Na2O, Al lần lượt là 1 mol và 1 mol
Na2O + H2O → 2NaOH
1 → 2 mol
Al + NaOH + H2O → NaAlO2 + 3/2 H2
1 2 mol
Vậy sau phản ứng cả Na2O và Al đều tan hết.
(4) Đặt số mol K2O và Zn đều là 1 mol
K2O + H2O → 2KOH
1 2 mol
2KOH + Zn → K2ZnO2 + H2
2 1
Vậy cả K2O và Zn đều tan hết.
Vậy các hỗn hợp tan hết trong nước là (3), (4) (có 2 hỗn hợp)
Đáp án D
Câu hỏi 41 :
Thực hiện các thí nghiệm sau ở nhiệt độ thường
(1) Cho bột Al vào dung dịch NaOH. (2) Cho bột Fe vào dung dịch AgNO3.
(3) Cho CaO vào dung dịch CH3COOH. (4) Cho dung dịch Na2CO3 vào dung dịch AlCl3.
Số thí nghiệm có phản ứng xảy ra là:
- A 4.
- B 2.
- C 3.
- D 1.
Đáp án: A
Phương pháp giải:
Dựa vào kĩ năng viết phương trình vô cơ
Lời giải chi tiết:
Tất cả 4 thí nghiệm đều xảy ra phản ứng
(1) Al + NaOH + H2O → NaAlO2 + 3/2H2↑
(2) Fe + 2AgNO3 → Fe(NO3)2 + Ag↓
(3) CaO + 2CH3COOH → (CH3COO)2Ca + H2O
(4) 3Na2CO3 + 2AlCl3 + 3H2O → 6NaCl + 2Al(OH)3↓ + 3CO2
Đáp án A
Câu hỏi 42 :
Hỗn hợp chất rắn X gồm: BaCO3, Fe(OH)2, Al(OH)3, CuO và MgCO3. Nung X trong không khí đến khối lượng không đổi, thu được hỗn hợp rắn Y. Cho Y vào nước dư, thu dược dung dịch Z chứa 2 chất tan và phần không tan E. Các chất trong E gồm
- A Fe2O3, CuO, MgO.
- B Fe2O3, Cu, MgO.
- C FeO, CuO, MgO.
- D Fe2O3, CuO, MgO, Al2O3.
Đáp án: A
Phương pháp giải:
Tóm tắt sơ đồ phản ứng xảy ra từ đó chọn được rắn E
Lời giải chi tiết:
\(X\left\{ \matrix{
BaC{O_3} \hfill \cr
Fe{(OH)_2} \hfill \cr
Al{(OH)_3} \hfill \cr
CuO \hfill \cr
MgC{O_3} \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow Y\left\{ \matrix{
BaO \hfill \cr
F{e_2}{O_3} \hfill \cr
A{l_2}{O_3} \hfill \cr
CuO \hfill \cr
MgO \hfill \cr} \right.\buildrel { + {H_2}O} \over
\longrightarrow \left\langle \matrix{
dd\,Z\left\{ \matrix{
Ba{(Al{O_2})_2} \hfill \cr
Ba{(OH)_2} \hfill \cr} \right. \hfill \cr
E\left\{ \matrix{
F{e_2}{O_3} \hfill \cr
CuO \hfill \cr
MgO \hfill \cr} \right. \hfill \cr} \right.\)
PTHH xảy ra:
BaCO3 \(\buildrel {{t^0}} \over\longrightarrow \)BaO + CO2↑
4Fe(OH)2 + O2 \(\buildrel {{t^0}} \over\longrightarrow \)2Fe2O3 + 4H2O
2Al(OH)3 \(\buildrel {{t^0}} \over\longrightarrow \)Al2O3 + 3H2O
MgCO3 \(\buildrel {{t^0}} \over\longrightarrow \) MgO + CO2↑
Rắn Y phản ứng với nước có PTHH
BaO + H2O → Ba(OH)2
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O
Vì dd Z thu được 2 chất tan => 2 chất tan là Ba(AlO2)2 và Ba(OH)2 dư. Do vậy Al2O3 tan hết hoàn toàn trong Ba(OH)2
=> Rắn E gồm: Fe2O3, CuO, MgO.
Đáp án A
Câu hỏi 43 :
Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch FeCl2
(b) Dẫn khí CO dư qua bột CuO nóng
(c) Cho K vào dung dịch CuSO4
(d) Cho Mg vào dung dịch HCl
Số phản ứng có tạo thành kim loại là :
- A 3
- B 4
- C 1
- D 2
Đáp án: D
Phương pháp giải:
Tính chất hóa học kim loại sgk hóa 12 – trang 83
Lời giải chi tiết:
a) Mg + FeCl2 → MgCl2 + Fe↓
b) CO + CuO \(\buildrel {{t^0}} \over\longrightarrow\) Cu↓ + CO2
c) K + H2O → KOH + 1/2 H2
2KOH + CuSO4 → Cu(OH)2↓ + K2SO4
d) Mg + 2HCl → MgCl2 + H2↑
=> có 2 pư a,b tạo ra kim loại
Đáp án D
Câu hỏi 44 :
Hỗn hợp X gồm Na và Al:
Thí nghiệm 1: Nếu cho m gam X tác dụng với H2O dư thì thu được V1 lít H2
Thí nghiệm 2: Nếu cho m gam X tác dụng với dung dịch NaOH dư thì thu được V2 lít H2
Các khí đo ở cùng điều kiện. Quan hệ giữa V1 và V2 là:
- A V1 ≤ V2
- B V1 < V2
- C V1 = V2
- D V1 > V2
Đáp án: A
Phương pháp giải:
Ở cả hai thí nghiệm đều xảy ra phản ứng:
Na + H2O → NaOH + ½ H2
NaOH + Al + H2O → NaAlO2+ 3/2 H2
Thí nghiệm 1: Al có thể dư hoặc phản ứng hết
Thí nghiệm 2: Cả Na và Al đều phản ứng hết
Lời giải chi tiết:
Thí nghiệm 2 dùng NaOH dư nên Al phản ứng hết.
Đặt nNa = x và nAl = y (mol)
Xét 2 trường hợp sau:
Trường hợp 1: Ở thí nghiệm 1, Al hết (x ≥ y)
Thí nghiệm 1:
Na + H2O → NaOH + 0,5 H2
x → 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5 H2
y → 1,5y
⟹ V1 = 22,4(0,5x + 1,5y)
Thí nghiệm 2:
Na + H2O → NaOH + 0,5 H2
x → 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5 H2
y → 1,5y
⟹ V2 = 22,4(0,5x + 1,5y)
Vậy V1 = V2 (*)
Trường hợp 2: Ở thí nghiệm 1, Al còn dư (x < y)
Thí nghiệm 1:
Na + H2O → NaOH + 0,5 H2
x → x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5 H2
x ← x → 1,5x
⟹ V1 = 22,4.2x
Thí nghiệm 2:
Na + H2O → NaOH + 0,5 H2
x → 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5 H2
y → 1,5y
⟹ V2 = 22,4(0,5x + 1,5y)
Vì x < y nên V1 < V2 (**)
Kết hợp (*) và (**) ta có: V1 ≤ V2
Đáp án A
Câu hỏi 45 :
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch NaAlO2 dư.
(b) Cho Al2S3 vào dung dịch HCl dư.
(c) Cho Al vào dung dịch NaOH.
(d) Cho dung dịch NH3 vào dung dịch AlCl3.
(e) Cho khí CO2 vào dung dịch NaAlO2.
(g) Cho kim loại Al vào dung dịch FeCl3 dư.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
- A 5.
- B 4.
- C 2.
- D 3.
Đáp án: D
Phương pháp giải:
Viết các phản ứng hóa học xảy ra, chọn các thí nghiệm có xuất hiện kết tủa
Chý ý đến các chất tham gia phản ứng, chất cho hết dư
Lời giải chi tiết:
(a) HCl + NaAlO2 dư + H2O → NaCl + Al(OH)3↓
(b) Al2S3 + 6HCl dư → 2AlCl3 + 3H2S↑
(c) Al + NaOH + H2O → NaAlO2 + 3/2H2
(d) 3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
(e) CO2 + H2O + NaAlO2 → Al(OH)3↓ + NaHCO3
(g) Al + 3FeCl3 dư → AlCl3 + 3FeCl2
=> có 3 thí nghiệm (d) và (g) thu được kết tủa
Đáp án D
Câu hỏi 46 :
Có các thí nghiệm:
(1) Nhỏ dung dịch NaOH dư vào dung dịch hỗn hợp KHCO3 và CaCl2.
(2) Đun nóng dung dịch chứa hỗn hợp Ca(HCO3)2 và MgCl2.
(3) Cho "nước đá khô" vào dung dịch axit HCl.
(4) Nhỏ dung dịch HCl vào "thủy tinh lỏng".
(5) Thêm sođa khan vào dung dịch nước vôi trong.
Số thí nghiệm thu được kết tủa là
- A 3.
- B 5.
- C 4.
- D 2.
Đáp án: C
Phương pháp giải:
Viết các PTHH xảy ra, chọn các thí nghiệm có xuất hiện kết tủa
Lời giải chi tiết:
(1) Thu được kết tủa CaCO3
2NaOH + 2KHCO3 → Na2CO3 + K2CO3 + 2H2O
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
(2) Thu được kết tủa MgCO3
Ca(HCO3)2 + MgCl2 \(\buildrel {{t^0}} \over\longrightarrow \) CaCl2 + MgCO3↓ + CO2↑ + H2O
(3) Không thu được kết tủa
(4) Thu được kết tủa H2SiO3
HCl + Na2SiO3 → NaCl + H2SiO3↓
(5) Thu được kết tủa CaCO3
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
=> có 4 thí nghiệm thu được kết tủa.
Đáp án C
Câu hỏi 47 :
Cho hỗn hợp rắn gồm Na2O, BaO, NaHCO3, Al2O3 và NH4Cl có cùng số mol vào nước dư. Kết thúc các phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan là
- A Na2CO3, NaCl và NaAlO2.
- B BaCl2, NaAlO2, NaOH.
- C NaCl và NaAlO2.
- D AlCl3, NaCl, BaCl2.
Đáp án: C
Phương pháp giải:
Giả sử đặt số mol của mỗi chất là 1 (mol)
Viết các phản ứng hóa học xảy ra (dạng ion rút gọn) từ đó sẽ xác định được các chất tan trong dd X
Lời giải chi tiết:
Giả sử đặt số mol của mỗi chất là 1 (mol)
Các PTHH xảy ra là:
Na2O + H2O → 2NaOH
1 → 2 (mol)
BaO + H2O → Ba(OH)2
1 → 1 (mol)
=> sinh ra tổng 4 mol OH- đủ để thực hiện các phản ứng
HCO3- + OH- → CO32- + H2O
Al2O3 + 2OH- → 2AlO2- + H2O
NH4+ + OH- → NH3 + H2O
Sau đó CO32- sinh ra phản ứng với Ba2+ theo phản ứng:
CO32- + Ba2+ → BaCO3↓
Vậy dung dịch sau phản ứng có chứa các ion: Na+, AlO2- , Cl-
=> Dung dịch chứa: NaCl và NaAlO2
Đáp án C
Câu hỏi 48 :
Cho các chất: NaOH, Na2CO3, CaCO3, Al(OH)3 được đánh dấu bằng bất kỳ chữ cái (X), (Y), (Z), (T). Tiến hành thí nghiệm của 4 chất trên với nước và dung dịch HCl được kết quả như bảng dưới đây:
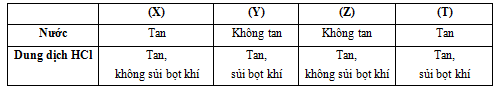
Chất (Y) là:
- A NaOH
- B Na2CO3
- C Al(OH)3
- D CaCO3
Đáp án: D
Phương pháp giải:
CaCO3
Lời giải chi tiết:
X, T tan trong nước: NaOH ; Na2CO3
Y, Z không tan trong nước: CaCO3, Al(OH)3.
Y + HCl → khí => T là CaCO3 (CaCO3 + 2HCl → CaCl2 + CO2 + H2O)
Đáp án D
Câu hỏi 49 :
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: Ba(HCO3)2, NaOH, AlCl3, KHSO4. Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau: (dấu - là không có hiện tượng).

Nhận xét nào sau đây đúng?
- A X là KHSO4.
- B Y là AlCl3.
- C Z là NaOH.
- D T là Ba(HCO3)2.
Đáp án: C
Lời giải chi tiết:
- Chỉ có X có phản ứng với HCl tạo khí => X là Ba(HCO3)2
Ba(HCO3)2 + 2HCl → BaCl2 + 2CO2 + 2H2O
=> Loại A và D
- Z làm quì tím hóa xanh nhưng không phản ứng được với HCl tạo khí => Z là NaOH
NaOH + HCl → NaCl + H2O
Đáp án C
Câu hỏi 50 :
Cho các phương trình phản ứng sau đây
X + Y + 2H2O → Z + T (1) ; T + NaOH → X + 2H2O (2)
Y + 2NaOH → E + H2O (3) ; Y + E + H2O → 2Z (4)
2AlCl3 + 3E + 3H2O → 2T + 3Y + 6NaCl(5)
Các chất Z, T, E là
- A NaAlO2. CO2, Na2CO3
- B CO2, Al(OH)3, NaHCO3
- C NaAlO2, Al(OH)3, NaHCO3
- D NaHCO3, Al(OH)3, Na2CO3
Đáp án: D
Phương pháp giải:
Viết PTHH
Lời giải chi tiết:
Các chất Z, T, E là NaHCO3, Al(OH)3, Na2CO3
NaAlO2 (X) + CO2 (Y) + 2H2O → NaHCO3(Z) + Al(OH)3 (T) (1)
Al(OH)3 (T) + NaOH → NaAlO2 (X) + 2H2O (2)
CO2 (Y) + 2NaOH → Na2CO3 (E) + H2O (3) CO2 (Y) + Na2CO3 (E) + H2O → 2NaHCO3 (Z) (4)
2AlCl3 + 3Na2CO3 (E) + 3H2O → 2Al(OH)3 (T) + 3CO2 (Y) + 6NaCl (5)
Đáp án D
50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có đáp án và lời giải chi tiết
30 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có đáp án và lời giải chi tiết
30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có đáp án và lời giải chi tiết
20 bài tập axit tác dụng với muối aluminat có đáp án và lời giải chi tiết
20 bài tập vận dụng cao về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập vận dụng về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập về nhôm và hợp chất của nhôm tác dụng với axit có tính OXH có đáp án và lời giải chi tiết
20 bài tập nhôm và hợp chất của nhôm tác dụng với axit không có tính OXH có đáp án và lời giải chi tiết
20 bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch muối có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết về nhôm và hợp chất của nhôm có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









