20 bài tập nhôm và hợp chất của nhôm tác dụng với axit không có tính OXH có lời giải
Làm đề thiCâu hỏi 1 :
Cho x gam Al tan hoàn toàn vào y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng đô mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- là:
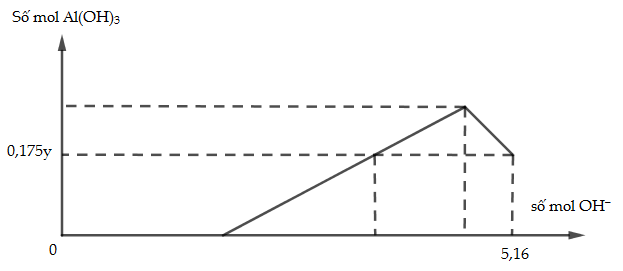
Giá trị của x là:
- A 32,40
- B 26,10
- C 27,00
- D 20,25
Đáp án: A
Phương pháp giải:
Bài toán muối nhôm tác dụng với dd kiềm
Các phản ứng xảy ra:
Al3+ + 3OH-→ Al(OH)3 (1)
Al(OH)3 + OH-→ [Al(OH)4]- (2)
Từ (1) và (2) ta rút ra kết luận:
+ Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và
nAl(OH)3= b/3
+ Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần
Al3+ + 3OH-→ Al(OH)3 (1)
mol a →3a →a
Al(OH)3 + OH- → [Al(OH)4]- (2)
Mol b-3a b-3a
nAl(OH)3= 4a-b
+ Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn
Lời giải chi tiết:
Vì Z có 2 chất tan cùng nồng độ mol => đó là AlCl3 và HCl
=> nAlCl3 = nHCl => n = y – 3n => y = 4n (1)
Tại nOH = 5,16 mol thì kết tủa tan 1 phần
=> nAl(OH)3 = 4nAl3+ - (nOH – nHCl (Z) )
=> 0,175y = 4n – ( 5,16 – n) (2)
Từ (1,2) => n = 1,2 mol
=> x = 32,4g
Đáp án A
Câu hỏi 2 :
Cho m g Al vào dung dịch HCl dư dến khi ngừng thoát khí thì thấy khối lượng dung dịch tăng 14,4 g so với dd HCl ban đầu. Tính khối lượng muối tạo thành :
- A 71,2g
- B 80,1g
- C 16,2g
- D 14,4g
Đáp án: B
Lời giải chi tiết:
2Al + 6HCl → 2AlCl3 + 3H2
Hướng dẫn giải :
mdd tắng= m – mH2 = 27nAl – 3nAl → nAl=0,6 mol → mAlCl3 =0,6.133,5=80,1 g
Đáp án B
Câu hỏi 3 :
Cho 16,6 gam hỗn hợp kim loại gồm Fe và Al vao dung dịch HCl dư thu được 11,2 lít khí ở đktc và m gam muối. Giá trị của m là
- A 73,4g
- B 45g
- C 52,1g
- D 67,8g
Đáp án: C
Phương pháp giải:
mmuối = mKl + mCl-
Lời giải chi tiết:
nH2= 11,2:22,4= 0,5 mol
2HCl => H2
1 0,5
mmuối = mKl + mCl- = 16,6 + 1.35,5=52,1 gam
Đáp án C
Câu hỏi 4 :
Hoà tan 5,1 gam oxit của kim loại ( có hóa trị không đổi)cần dùng 54,75 gam dung dịch HCl 20%. Công thức của oxit kim loại đó là:
- A Al2O3.
- B Fe2O3.
- C Cr2O3.
- D Pb2O3
Đáp án: A
Phương pháp giải:
nHCl = \(\frac{{{m_{{\text{dd}}}}.C\% }}{{100.M}} = \frac{{54,75.20}}{{100.36,5}} = 0,3mol\)
M2On + 2nHCl → 2MCln +n H2O
0,15/n 0,3
=> Moxit = 2M + 16n= 5,1:(0,15/n)=34n
=> n,M
Lời giải chi tiết:
nHCl = \(\frac{{{m_{{\text{dd}}}}.C\% }}{{100.M}} = \frac{{54,75.20}}{{100.36,5}} = 0,3mol\)
M2On + 2nHCl → 2MCln +n H2O
0,15/n 0,3
=> Moxit = 2M + 16n= 5,1:(0,15/n)=34n
=> M= 9n
=> n=3, M=27(Al)
=> oxit: Al2O3
Đáp án A
Câu hỏi 5 :
Hòa tan hết 0,54 gam Al trong 70 ml dung dịch HCl 1M, thu được dung dịch X. Cho 75 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
- A 0,78.
- B 1,17.
- C 1,56.
- D 0,29.
Đáp án: B
Lời giải chi tiết:
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam
Đáp án B
Câu hỏi 6 :
Hòa tan hoàn toàn hỗn hợp Al và Al2O3 trong 200 ml dung dịch HCl nồng độ a mol/l, thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch NaOH (V ml) được biểu diễn bằng đồ thị:

Giá trị lớn nhất của m là
- A 8,58.
- B 7,02.
- C 11,70.
- D 7,80.
Đáp án: D
Phương pháp giải:
Ta chia đồ thị làm 3 giai đoạn
Giai đoạn 1: bắt đầu xuất hiện kết tủa => hết VNaOH = 100 ml => đây là lượng thể tích cần dùng để trung hòa lượng HCl còn dư sau phản ứng => nHCl dư = 0,1 (mol)
Giai đoạn 2: đồ thi bắt đầu đi lên đến điểm cực đại
Tại giai đoạn này xảy ra phản ứng:
Al3+ + 3OH- → Al(OH)3↓
=> nAl(OH)3 = 1/3nOH-
Giai đoạn 3: đồ thị đi xuống, tại giai đoạn này lượng kết tủa bị hòa tan theo phản ứng
Al(OH)3 + OH- → AlO2− + 2H2O
Từ đồ thị ta thấy tại giá trị VNaOH = 250 ml và VNaOH = 450 ml cùng thu được một lượng kết tủa như nhau
=> áp dụng công thức nhanh ta có: nNaOH = 4nAl3+ - nAl(OH)3 + nH+ dư => nAl3+ = ?
Vậy để lượng kết tủa cực đại thì tất cả lượng Al3+ sẽ chuyển hết thành Al(OH)3
=> nAl(OH)3 = nAl3+ = ? (mol) => mAl(OH)3 = ?
Lời giải chi tiết:
Ta chia đồ thị làm 3 giai đoạn
Giai đoạn 1: bắt đầu xuất hiện kết tủa => hết VNaOH = 100 ml => đây là lượng thể tích cần dùng để trung hòa lượng HCl còn dư sau phản ứng
=> nHCl dư = 0,1 (mol)
Giai đoạn 2: đồ thi bắt đầu đi lên đến điểm cực đại
Tại giai đoạn này xảy ra phản ứng:
Al3+ + 3OH- → Al(OH)3↓
(0,25 – 0, 1) → 0,05 (mol)
Giai đoạn 3: đồ thị đi xuống, tại giai đoạn này lượng kết tủa bị hòa tan theo phản ứng
Al(OH)3 + OH- → AlO2− + 2H2O
Từ đồ thị ta thấy tại giá trị VNaOH = 250 ml và VNaOH = 450 ml cùng thu được một lượng kết tủa như nhau
=> áp dụng công thức nhanh ta có:
nNaOH = 4nAl3+ - nAl(OH)3 + nH+ dư
=> 0,45 = 4a – 0,05 + 0,1
=> a = 0,1 (mol)
Vậy để lượng kết tủa cực đại thì tất cả lượng Al3+ sẽ chuyển hết thành Al(OH)3
=> nAl(OH)3 = nAl3+ = 0,1 (mol) => mAl(OH)3 = 0,1.78 = 7,8(g)
Đáp án D
Câu hỏi 7 :
Cho x gam Al2O3 tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
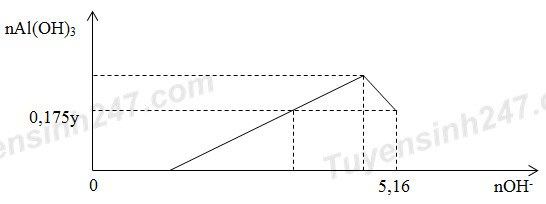
Giá trị của x là
- A 20,25.
- B 56,10.
- C 61,20.
- D 32,40.
Đáp án: C
Phương pháp giải:
Dung dịch Z gồm: AlCl3 (a mol) và HCl dư (a mol)
BTNT Cl: 3nAlCl3 + nHCl dư = nHCl ban đầu => (1)
Khi nOH- = 5,16 mol: nOH- = nH+ dư + 4nAl3+ max – nAl(OH)3 => (2)
Giải (1) và (2) => a; y
=> x = 102.0,5a
Lời giải chi tiết:
Dung dịch Z gồm: AlCl3 (a mol) và HCl dư (a mol)
BTNT Cl: 3nAlCl3 + nHCl dư = nHCl ban đầu => 3a + a = y (1)
Khi nOH- = 5,16 mol: nOH- = nH+ dư + 4nAl3+ max – nAl(OH)3 => 5,16 = a + 4.a - 0,175y (2)
Giải (1) và (2) => a = 1,2; y = 4,8
=> x = 102.0,5a = 61,2 gam
Đáp án C
Câu hỏi 8 :
Hòa tan hoàn toàn 0,54g Al vào trong 200ml dung dịch X chứa HCl 0,2M và H2SO4 0,1M thu được dung dịch Y. Thể tích dung dịch NaOH 2M cần thêm vào dung dịch Y để lượng kết tủa thu được lớn nhất là?
- A 40ml
- B 60ml
- C 80ml
- D 30ml
Đáp án: A
Lời giải chi tiết:
nAl = 0,02, nH+ = 0,08
=> sau phản ứng: nAl = 0,02, nH+ = 0,08
=> kết tủa max khi
nAl(OH)3 = nAl3+ = 0,02 mol
=> nNaOH = 3nAl + nH+ = 0,08 mol
=> V = 40ml
Đáp án A
Câu hỏi 9 :
Hòa tan 0,54 gam Al trong 0,5 lít dung dịch H2SO4 0,1M được dung dịch A. Thêm V lít dung dịch NaOH 0,1M cho đến khi kết tủa tan trở lại 1 phần. Nung kết tủa thu được đến khối lượng không đổi ta được chất rắn nặng 0,51 gam. Giá trị của V là:
- A 0,8 lít
- B 1,1 lít
- C 1,2 lít
- D 1,5 lít
Đáp án: B
Phương pháp giải:
Al + 3H+ → Al3++ 3/2 H2
H+ + OH- → H2O (1)
Al3++ 3OH- → Al(OH)3 (2)
Al(OH)3+ OH- → AlO2-+ 2H2O (3)
2Al(OH)3 \(\xrightarrow{{{t}^{o}}}\) Al2O3 + 3H2O
Do nAl3+ > nkết tủa Al(OH)3 và kết tủa tan 1 phần nên n↓ = 4.nAl3+ - nOH-
Vậy nOH- = nOH- PT 1+ nOH- PT 2,3 → V = n/CM
Lời giải chi tiết:
Ta có: nAl = 0,02 mol; nH2SO4 = 0,5. 0,1 = 0,05 mol; nH+ = 2.0,05 = 0,1 mol
Al + 3H+ → Al3++ 3/2 H2
0,02 → 0,06 0,02 mol
H+ + OH- → H2O (1)
0,04→ 0,04 mol
Al3++ 3OH- → Al(OH)3 (2)
Al(OH)3+ OH- → AlO2-+ 2H2O (3)
2Al(OH)3 \(\xrightarrow{{{t}^{o}}}\)Al2O3 + 3H2O
0,01 ← 0,005 mol
Do nAl3+ > nkết tủa Al(OH)3 và kết tủa tan 1 phần nên n↓ = 4.nAl3+ - nOH- → nOH- PT 2,3 = 4. 0,02-0,01 = 0,07 mol
Vậy nOH- = nOH- PT 1+ nOH- PT 2,3 = 0,04 + 0,07 = 0,11 mol → V = n/CM = 0,11: 0,1 = 1,1 lít
Đáp án B
Câu hỏi 10 :
Hòa tan 7,8 gam hỗn hợp bột Al và Mg trong dd HCl dư . Sau phản ứng khối lượng dung dịch tăng thêm 7g so với ban đầu. Khối lượng Al và Mg lần lượt là
- A 4,86 g và 2,94 g
- B 2,4g và 5,4 g
- C 5,4 g và 2,4 g
- D 2,94 g và 4,86 g
Đáp án: C
Phương pháp giải:
Đặt nAl = x mol và nMg = y mol
Có Al → Al +3 + 3e
Mg → Mg+2+ 2e
2H+1 + 2e → H2
Bảo toàn KL có mdd tăng = mKL – mH2 = 7 → mH2 ? → nH2 = ? mol
Ta có hệ phương trình sau
\(\left\{ \begin{gathered}\xrightarrow{{Bt\,e}}3x + 2y = 0,4.2 \hfill \\\sum {mhh = } 27x + 24y = 7,8 \hfill \\\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}x = ? \hfill \\y = ? \hfill \\\end{gathered} \right.\)
Lời giải chi tiết:
Đặt nAl = x mol và nMg = y mol
Có Al → Al +3 + 3e
Mg → Mg+2+ 2e
2H+1 + 2e → H2
Theo bảo toàn e có : 3x + 2y = 2nH2
Bảo toàn KL có mdd tăng = mKL – mH2 = 7 → mH2 = 7,8 – 7 = 0,8 → nH2 = 0,4 mol
Ta có hệ phương trình sau
\(\left\{ \begin{gathered}3x + 2y = 0,4.2 \hfill \\27x + 24y = 7,8 \hfill \\\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}x = 0,2 \hfill \\y = 0,1 \hfill \\\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}{m_{Al}} = 5,4 \hfill \\{m_{Mg}} = 2,4 \hfill \\\end{gathered} \right.\)
Đáp án C
Câu hỏi 11 :
Cho x gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
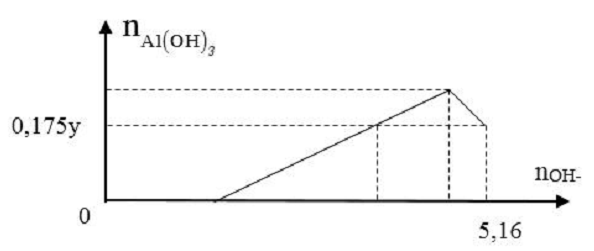
Giá trị của x là:
- A 32,4
- B 27,0
- C 20,2
- D 26,1
Đáp án: A
Phương pháp giải:
Dung dịch Z chứa nAlCl3 = nHCl dư = z mol
Bảo toàn nguyên tố Cl ta có: nHCl ban đầu = y = 3z + z = 4z mol
Khi nOH- = 5,16 mol thì kết tủa bị hòa tan 1 phần và còn lại 0,175y = 0,7z mol Al(OH)3
Khi đó sử dụng công thức: nOH- - nH+ = 4.nAl3+ - nAl(OH)3. Từ đó ta tính được giá trị z, suy ra giá trị x.
Lời giải chi tiết:
Dung dịch Z chứa nAlCl3 = nHCl dư = z mol
Bảo toàn nguyên tố Cl ta có: nHCl ban đầu = y = 3z + z = 4z mol
Khi nOH- = 5,16 mol thì kết tủa bị hòa tan 1 phần và còn lại 0,175y = 0,7z mol Al(OH)3
Khi đó sử dụng công thức: nOH- - nH+ = 4.nAl3+ - nAl(OH)3 → 5,16-z = 4z-0,7z → z = 1,2 mol
→ x = 27z = 32,4 gam
Đáp án A
Câu hỏi 12 :
Cho m gam bột Al kim loại vào V lít dung dịch HCl 1M được dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, số mol kết tủa và thể tích (lít) của dung dịch NaOH được biểu diễn bằng đồ thị sau:
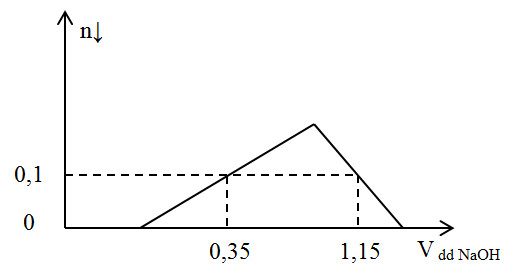
Giá trị của m và V là:
- A 8,1 và 0,95
- B 8,1 và 0,90
- C 6,75 và 0,95
- D 6,75 và 0,90
Đáp án: A
Phương pháp giải:
Tại điểm A: kết tủa chưa đạt cực đại: nOH- = nH+ + 3.nkết tủa. Từ đó ta tính được nH+
Tại điểm B: kết tủa tan 1 phần: nkết tủa = 4.nAl3+ - (nOH- - nH+)
Từ đó ta tính được nAl3+
Khi đó ta tính được nAl và nH+ suy ra m và V.
Lời giải chi tiết:
X gồm Al3+ a mol và H+ dư b mol
Tại điểm A: kết tủa chưa đạt cực đại: nOH- = b + 3.nkết tủa = 0,35 mol → b = 0,35- 3. 0,1 = 0,05 mol
Tại điểm B: kết tủa tan 1 phần: nkết tủa = 4.nAl3+ - (nOH- - nH+)
→ 0,1 = 4.a- (1,15- 0,05) → a = 0,3 mol
Suy ra m = 0,3.27 = 8,1 gam
Ta có: nHCl = nCl- = 3a + b = 0,95 mol → V = 0,95 lít
Đáp án A
Câu hỏi 13 :
Cho x gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm tử từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau
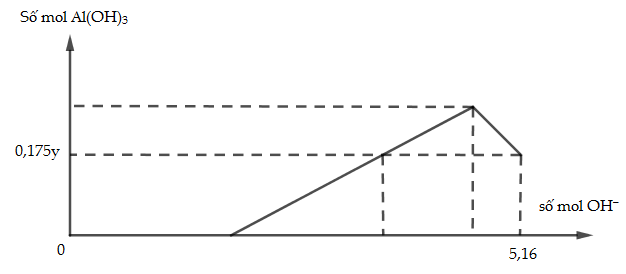
Giá trị của x là
- A 26,1.
- B 27,0.
- C 32,4.
- D 20,25.
Đáp án: C
Phương pháp giải:
Dung dịch Z chứa AlCl3: x (mol) và HCl dư: (y - 3x) mol
Dung dịch Z chứa 2 chất tan có cùng nồng độ mol => phương trình (1)
Khi thêm NaOH vào dung dịch Z thì NaOH tham gia phản ứng với HCl trước, sau đó NaOH tham gia phản ứng với AlCl3
Tại thời điểm nNaOH = 5,16 (mol) xảy ra quá trình hòa tan kết tủa
=> nOH-= nHCl + (4nAl3+ - nAl(OH)3) (2)
giải hệ (1) và (2) => x = ? và y = ? => mAl = ?
Lời giải chi tiết:
Dung dịch Z chứa AlCl3: x (mol) và HCl dư: (y - 3x) mol
Dung dịch Z chứa 2 chất tan có cùng nồng độ mol nên x = y -3x => y = 4x (1)
Khi thêm NaOH vào dung dịch Z thì NaOH tham gia phản ứng với HCl trước, sau đó NaOH tham gia phản ứng với AlCl3
Tại thời điểm nNaOH = 5,16 (mol) xảy ra quá trình hòa tan kết tủa
=> nOH-= nHCl + (4nAl3+ - nAl(OH)3)
=> 5,16 = y -3x + 4x - 0,175y
=> x + 0,825y = 5,16 (2)
giải hệ (1) và (2) => x = 1,2 và y = 4,8
=> mAl = 1,2.27 = 32,4 (g)
Đáp án C
Câu hỏi 14 :
Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y và dung dịch Z. Dẫn từ từ đến dư CO2 vào dung dịch Z thu được kết tủa T. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn R.Các chất trong T và R gồm
- A BaSO4, FeO và Al(OH)3.
- B BaSO4, FeO và Al(OH)3.
- C BaSO4, FeO và Al(OH)3.
- D BaSO4, Fe2O3 và Al(OH)3.
Đáp án: D
Phương pháp giải:
Viết các phương trình hóa học xảy ra sẽ xác định được các chất
Lời giải chi tiết:
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
Fe + H2SO4 loãng → FeSO4 + H2↑
Dung dịch X chứa: Al2(SO4)3; FeSO4 và H2SO4 loãng dư. Dd X tác dụng với Ba(OH)2 dư có PTHH sau:
Ba(OH)2 + H2SO4 loãng → BaSO4↓ + 2H2O
Ba(OH)2 + FeSO4 → BaSO4↓ + Fe(OH)2↓
4Ba(OH)2 + Al2(SO4)3 → Ba(AlO2)2 + 3BaSO4↓ + 4H2O
Kết tủa Y là: BaSO4 và Fe(OH)2
Dung dịch Z: Ba(AlO2)2 và Ba(OH)2 dư. Sục CO2 từ từ đến dư xảy ra phản ứng
2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3↓ + Ba(HCO3)2
2CO2 + Ba(OH)2 → Ba(HCO3)2
Kết tủa T là Al(OH)3.
Nung Y trong không khí đến khối lượng không đổi xảy ra pư
4Fe(OH)2 + O2 \(\xrightarrow{{{t^0}}}\) 2Fe2O3 + 4H2O
Rắn R gồm: Fe2O3 và BaSO4
Đáp án D
Câu hỏi 15 :
Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
- A 24,5
- B 25,0
- C 27,5
- D 26,0
Đáp án: D
Phương pháp giải:
X + 0,17 mol HCl thì 2 Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
→ Dung dịch Y thu được có AlCl3 : ? mol ; FeCl2 : ? mol; HCl : ? mol
Y + 0,2 mol AgNO3 thì : 3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO
Fe2+ + Ag+ → Fe3+ + Ag
Ag+ + Cl- → AgCl
Lời giải chi tiết:
Đặt số mol Al và Fe trong X là x mol thì mX = 27x + 56x = 2,49 → x = 0,03 mol
X + 0,17 mol HCl thì 2 Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
→ Dung dịch Y thu được có AlCl3 : 0,03 mol ; FeCl2 : 0,03 mol; HCl : 0,02 mol
Y + 0,2 mol AgNO3 thì : 3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO
0,015 mol ← 0,02 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,015 mol 0,015 mol
Ag+ + Cl- → AgCl
0,17 mol 0,17 mol
→ mrắn = mAgCl + mAg = 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g → gần nhất với 26,0 g
Đáp án D
Câu hỏi 16 :
Cho 7,8 gam hỗn hợp X gồm Al và Al2O3 tác dụng với 700 ml dung dịch HCl 1M, thu được dung dịch Y và 3,36 lít khí H2. Cho Y tác dụng với V lít dung dịch NaOH 1M, thu được 11,7 gam kết tủa. Giá trị lớn nhất của V là :
- A 0,75
- B 0,85
- C 0,45
- D 0,65
Đáp án: A
Phương pháp giải:
2Al + 6HCl → 2AlCl3 + 3H2
Al2O3 + 6HCl → 2AlCl3 + 3H2O
→ nAl2O3 → nHCl phản ứng → sau phản ứng dung dịch thu được có ? mol AlCl3 và ? mol HCl
Y + NaOH → kết tủa Al(OH)3 < nAlCl3 = 0,2 mol
→ nên để kết tủa thu được là lớn nhất thì kết tủa Al(OH)3 tạo tối đa rồi tan một phần
NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Lời giải chi tiết:
2Al + 6HCl → 2AlCl3 + 3H2
0,1 0,15 mol
Al2O3 + 6HCl → 2AlCl3 + 3H2O
→ mAl2O3 = 7,8 – 0,1.27 = 5,1 g → nAl2O3 = 0,05 mol
→ nHCl phản ứng = 0,05.6 + 0,1.3 = 0,6 < nHCl = 0,7 mol
Nên sau phản ứng dung dịch thu được có 0,2 mol AlCl3 và 0,1 mol HCl
Y + NaOH → kết tủa Al(OH)3 : 0,15 mol < nAlCl3 = 0,2 mol
→ nên để kết tủa thu được là lớn nhất thì kết tủa Al(OH)3 tạo tối đa rồi tan một phần
NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
nNaOH = nHCl + 3nAlCl3 + nAl(OH)3 hòa tan = 0,1 + 3.0,2 + (0,2 – 0,15) = 0,75 mol → V = 0,75 : 1 = 0,75 lít
Đáp án A
Câu hỏi 17 :
Hòa tan hết 0,54 gam Al trong 70 ml dung dịch HCl 1M thu được dung dịch X. Cho 75 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
- A 1,56
- B 1,17
- C 0,78
- D 0,39
Đáp án: B
Phương pháp giải:
Viết và tính theo PTHH:
2Al + 6HCl → 2AlCl3 + 3H2
HCl + NaOH → NaCl + H2O
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Lời giải chi tiết:
nAl = 0,54 : 27 = 0,02 mol; nHCl = 0,07 mol; nNaOH = 0,075 mol
2Al + 6HCl → 2AlCl3 + 3H2
0,02 → 0,06 dư 0,01 → 0,02 (mol)
Vậy X chứa: HCl dư (0,01 mol) và AlCl3 (0,02 mol)
Khi cho NaOH vào dung dịch X:
HCl + NaOH → NaCl + H2O
0,01 → 0,01dư 0,065
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
0,02 → 0,06dư 0,005 → 0,02
NaOH + Al(OH)3 → NaAlO2 + 2H2O
0,005 → 0,005còn 0,02-0,005 = 0,015
Vậy m = mAl(OH)3 = 0,015.78 = 1,17 gam
Đáp án B
Câu hỏi 18 :
Hòa tan hoàn toàn 22,5 gam hỗn hợp X gồm Al, Al2O3, Al(NO3)3 trong dung dịch H2SO4 loãng sau phản ứng thu được dung dịch Y chỉ chứa một chất tan duy nhất và 6,72 lít hỗn hợp khí Z ở đktc (gồm hai khí không màu trong đó có một khí tự hóa nâu trong không khí) có tỉ khối so với H2 là 8. Số mol H2SO4 đã tham gia phản ứng bằng
- A 0,45 mol.
- B 0,30 mol.
- C 0,75 mol.
- D 0,60 mol.
Đáp án: D
Phương pháp giải:
Dựa vào dữ kiện Z chứa khí không màu hóa nâu và MZ ta suy ra Z chứa H2 và NO
Từ số mol và tỉ khối ta tính được số mol mỗi khí.
Áp dụng BTe có: 3nAl = 2nH2 + 3nNO => nAl = ?
Mặt khác dung dịch sau phản ứng chỉ chứa chất tan duy nhất là Al2(SO4)3 nên NO3- chuyển hết vào NO
BTNT "N" => nAl(NO3)3 = nNO/3 = ?
=> mAl2O3 = mX - mAl - mAl(NO3)3 = ? => nAl2O3 = ?
BTNT "Al": nAl2(SO4)3 = (nAl + 2nAl2O3 + nAl(NO3)3)/2 = ?
BTNT "S": nH2SO4 = 3nAl2(SO4)3 = ?
Lời giải chi tiết:
Z chứa khí không màu hóa nâu và MZ = 8.2 = 16 => Z chứa H2 (a mol) và NO (b mol)
Giải nhanh hệ nZ = a + b = 0,3 và mZ = 2a + 30b = 0,3.16 được a = b = 0,15 mol
Áp dụng BTe có: 3nAl = 2nH2 + 3nNO => nAl = (2.0,15 + 3.0,15)/3 = 0,25 mol
Mặt khác dung dịch sau phản ứng chỉ chứa chất tan duy nhất là Al2(SO4)3 nên NO3- chuyển hết vào NO
BTNT "N" => nAl(NO3)3 = nNO/3 = 0,05 mol
=> mAl2O3 = mX - mAl - mAl(NO3)3 = 22,5 - 0,25.27 - 0,05.213 = 5,1 gam => nAl2O3 = 0,05 mol
BTNT "Al": nAl2(SO4)3 = (nAl + 2nAl2O3 + nAl(NO3)3)/2 = 0,2 mol
BTNT "S": nH2SO4 = 3nAl2(SO4)3 = 0,6 mol
Đáp án D
Câu hỏi 19 :
Cho x gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ 5,16 lít dung dịch NaOH 1M vào dung dịch Z ta thu được lượng kết tủa là 0,175y mol. Giá trị của x là:
- A 20,25.
- B 26,10.
- C 27,00.
- D 32,40.
Đáp án: D
Câu hỏi 20 :
Hòa tan một lượng hỗn hợp gồm Al và Al2O3 trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch X trong đó số nguyên tử hiđro bằng 1,76 lần số nguyên tử oxi. Nồng độ phần trăm của chất tan trong dung dịch X là:
- A 17,76%.
- B 16,06%.
- C 15,28%.
- D 14,54%.
Đáp án: A
20 bài tập về nhôm và hợp chất của nhôm tác dụng với axit có tính OXH có đáp án và lời giải chi tiết
20 bài tập vận dụng về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập vận dụng cao về phản ứng nhiệt nhôm có đáp án và lời giải chi tiết
20 bài tập axit tác dụng với muối aluminat có đáp án và lời giải chi tiết
30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có đáp án và lời giải chi tiết
30 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có đáp án và lời giải chi tiết
20 bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch muối có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết về nhôm và hợp chất của nhôm có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









