Lý thuyết Axit nitric và muối nitrat.
Trong hợp chất
A. AXIT NITRIC
I. CẤU TẠO
- Trong hợp chất HNO3, nguyên tố nitơ có số oxi hóa cao nhất là +5
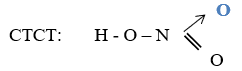
II. TÍNH CHẤT VẬT LÍ
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
- Axit HNO3 tan vô hạn trong nước.
- Axit nitric kém bền. Trong điều kiện thường, có ánh sáng, dung dịch axit đặc bị phân hủy 1 phần giải phóng khí nito dioxit, khí này lại tan trong dung dịch axit làm cho dung dịch có màu vàng
4HNO3 → 4NO2 + O2 + 2H2O
III. TÍNH CHẤT HÓA HỌC
1. Axit HNO3 là một trong các axit mạnh
- Làm quỳ tím hóa đỏ, tác dụng với bazơ và oxit bazơ, tác dụng với muối của axit yếu.
VD:
CuO + 2HNO3 → Cu(NO3)2 + H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
2. Axit HNO3 là chất oxi hóa mạnh
* Phản ứng với hầu hết các kim loại trừ Pt và Au,
VD:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H 2O
* Một số phi kim, nhiều hợp chất vô cơ và hữu cơ.
(Một số hợp chất hữu cơ bốc cháy khi gặp HNO3 đặc)
VD:
C + 4HNO3 (đ) \(\xrightarrow{{{t}^{o}}}\) CO2 + 4NO2 + 2H2O
3FeO + 10HNO3 (đ) → 3Fe(NO3)3 + NO + 5H2O
- Sản phẩm khử sinh ra tùy thuộc nồng độ axit, tính khử của kim loại và nhiệt độ phản ứng.
* Lưu ý: Al, Fe, Cr bị thụ động trong HNO3 đặc nguội.
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Axit HNO3 được điều chế bằng cách cho NaNO3 hoặc KNO3 tác dụng với axit H2SO4 đăc, nóng:
2NaNO3(tt) + H2SO4(đ) \(\overset{t^{0}}{\rightarrow}\) Na2SO4 + 2HNO3
2. Trong công nghiệp
Được sản xuất theo sơ đồ sau:
N2 \(\xrightarrow[xt, t^{0},p]{+H_{2}}\) NH3 \(\xrightarrow[xt, t^{0}]{+O_{2}}\) NO \(\overset{O_{2}}{\rightarrow}\) NO2 \(\overset{+O_{2}+H_{2}O}{\rightarrow}\) HNO3
B. MUỐI NITRAT
I. TÍNH CHẤT VẬT LÍ
Tất cả các muối nitrat đều tan nhiều trong nước và là chất điện li mạnh.
II. TÍNH CHẤT HÓA HỌC
Các muối nitrat kém bền với nhiệt, chúng bị phân hủy khi đun nóng
- Muối nitrat của các kim loại hoạt động mạnh đứng trước Mg (kali, natri,…) bị phân hủy thành muối nitrit và oxit
VD: 2KNO3 \(\xrightarrow{{{t}^{o}}}\) 2KNO2 + O2
- Muối nitrat của kim loại từ Mg đến Cu bị phân hủy thành oxit kim loại tương ứng, NO2 và O2
VD: 2Cu(NO3)2 \(\xrightarrow{{{t}^{o}}}\) 2CuO + 4NO2 + O2
- Muối nitrat của kim loại kém hoạt động (Sau Cu) bị phân hủy thành kim loại tương ứng, khí NO2 và O2.
VD: 2AgNO3 \(\xrightarrow{{{t}^{o}}}\) 2Ag + 2NO2 + O2
III. NHẬN BIẾT ION NITRAT
- Trong môi trường axit, ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
- Hiện tượng: dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ (dd màu xanh) + 2NO↑ + 4H2O
2NO + O2 (không khí) → 2NO2 (màu nâu đỏ)
IV. ỨNG DỤNG
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm) trong nông nghiệp như NH4NO3, NaNO3, KNO3.
- KNO3 còn được sử dụng để chế thuốc nổ đen.
Sơ đồ tư duy: Axit nitric và muối nitrat.

Loigiaihay.com













Danh sách bình luận