Lý thuyết Amoniac và muối amoni
Phân tử NH3 có cấu tạo hình chop, với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên tử hiđro.
I. CẤU TẠO
- Phân tử NH3 có cấu tạo hình chóp, với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên từ hiđro.
- Ba liên kết N-H đều là liên kết cộng hóa trị có cực, các cặp electron chung đều lệch về phía nguyên tử nitơ
=> NH3 là phân tử có cực.
II. TÍNH CHẤT VẬT LÍ
Amoniac là chất khí không màu, mùi khai và sốc, nhẹ hơn không khí; tan tốt trong nước
III. TÍNH CHẤT HÓA HỌC
1. Tính bazo yếu
- Do có cặp electron tự do nên NH3 dễ nhận H+, thể hiện tính bazơ yếu(tác dụng với nước tạo dung dịch làm quỳ tím hóa xanh, tác dụng với axit, tác dụng với dung dịch muối).
a) Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
b) Tác dụng với dung dịch muối:
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Lưu ý: Al(OH)3 không tan được trong dung dịCh NH3
c) Tác dụng với axit tạo muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2. Tính khử
- Nitơ trong NH3 có mức oxi hóa thấp nhất (-3) nên NH3 thể hiện tính khử mạnh như tác dụng với oxi, clo và một số oxit kim loại.
a) Tác dụng với oxi:
4NH3 + 3O2 .\(\xrightarrow{{{t}^{o}}}\) 2N2 + 6H2O
- Nếu có Pt là xúc tác, ta thu được khí NO.
4NH3 + 5O2 \(\xrightarrow{{{t}^{o}},\,\,xt}\) 4NO + 6H2O
b) Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
=> NH3 kết hợp ngay với HCl vừa sinh ra tạo “ khói trắng” NH4Cl
c) Tác dụng với oxit kim loại:
2NH3 + 3CuO \(\xrightarrow{{{t}^{o}}}\) 3Cu + N2 + 3H2O
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
NH3 được điều chế bằng cách cho muối amniac tác dụng với chất kiềm khi đun nóng nhẹ. Để điều chế nhanh một lượng nhỏ khí ammoniac người ta thường đun nóng dung dịch ammoniac đặc.
2. Trong công nghiệp
Amoniac được tổng hợp từ khí N2 và khí H2 theo phản ứng:
N2 (k) + 3H2(k) ⇔ 2NH3 (k); ∆H = -92 kJ
V. MUỐI AMONI là những chất tinh thể ion, phân tử gồm cation amoni NH4+ và anion gốc axit.
1. Tính chất vật lí
Tất cả các muối amoni đều dễ tan trong nước và khi tan điện li hoàn toàn thành các ion.
2. Tính chất hóa học
a) Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
b) Tác dụng với dung dịch kiềm: (nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
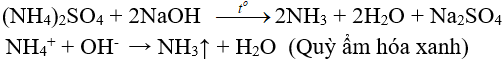
c) Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
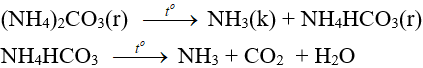
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
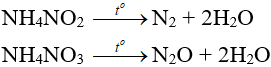
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
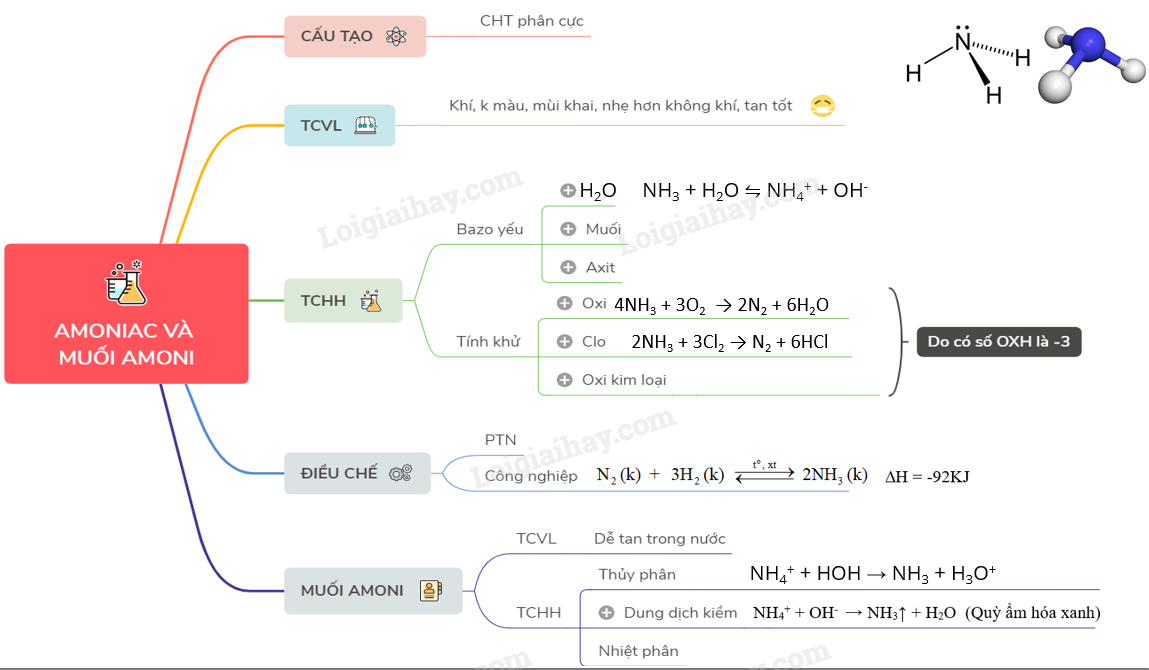
Sơ đồ tư duy: Amoniac và muối amoni
Loigiaihay.com













Danh sách bình luận