Giải đề thi học kì II Hóa 11 sở giáo dục tỉnh Bình Thuận
Giải chi tiết đề thi kì 2 môn hoá lớp 11 năm 2019 - 2020 Sở GD Bình Thuận với cách giải nhanh và chú ý quan trọng
Đề bài
Câu 1 :
Viết phương trình phản ứng hóa học sau (ghi rõ điều kiện xảy ra phản ứng, nếu có)
a, Propan (CH3CH2CH3) tác dụng với Cl2 (ánh sáng) theo tỉ lệ mol 1:1
b, Etilen (CH2 = CH2) tác dụng với dung dịch Brom (Br2)
c, Axetilen (CH≡CH) tác dụng với AgNO3/NH3 dư
d, Oxi hóa metanol (CH3OH) bằng CuO dư
e, Đun nóng ancol etylic (CH3CH2OH) với H2SO4 đặc ở 1700C
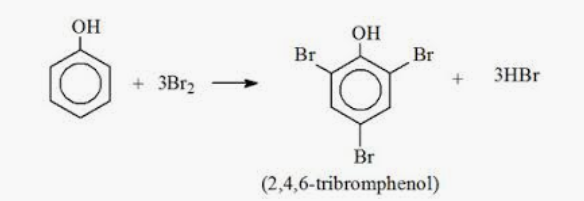
f, Cho phenol tác dụng với dung dịch nước brom
g, Cho andehit fomic (HCHO) tác dụng với lượng dư dung dịch AgNO3/NH3
Câu 2.
Nhận biết các dung dịch mất nhãn sau bằng phương pháp hóa học: Glixerol (C3H5(OH)3); metanol (CH3OH); pentan (CH3CH2CH2CH2CH3); andehit axetic (CH3CHO). Viết phương trình phản ứng xảy ra nếu có.
Câu 3
Cho 25,7 gam hỗn hợp X gồm ancol etylic (C2H5OH) và phenol (C6H5OH) tác dụng vừa đủ với K thu được 3,92 lít khí H2 (đktc)
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp X
b, Tính thể tích dung dịch NaOH 0,15 M cần để trung hòa vừa hết 25,7 gam hỗn hợp X
Câu 4
Đốt cháy hoàn toàn m gam hỗn hợp X gồm (một ancol no, đa chức, mạch hở Y và một andehit no, đơn chức mạch hở Z) cần dùng vừa đủ 11,648 lít khí O2 (đktc) sau phản ứng thu được 9,408 lít khí CO2 (đktc) và 9,36 gam H2O. Mặt khác, m gam hỗn hợp X trên tác dụng vừa đủ với 2,688 lít khí H2 thu được hỗn hợp ancol. Xác định công thức cấu tạo có thể có của Y,Z (biết Y tác dụng với Cu(OH)2 tạo dung dịch xanh lam.
(Biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; K = 39; Ag =108)
Lời giải chi tiết
Câu 1:
Phương pháp giải:
Xem lại phần điều chế hidro cacbon và dẫn xuất hidro cacbon
Hướng dẫn giải
a, CH3CH2CH3 + Cl2 \(\xrightarrow{\text{as}}\)CH3CHClCH3 + HCl
b, CH2=CH2 + Br2 → CH2Br-CH2Br
c, CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg + 2NH4NO3
d, CH3OH + CuO \(\xrightarrow{{{t}^{o}}}\)HCHO + Cu + H2O
e, CH3CH2OH \(\xrightarrow[{{170}^{o}}C]{{{H}_{2}}S{{O}_{4}}d}\)CH2=CH2 + H2O
f,
g, HCHO + 4AgNO3 + 2NH3 → (NH4)2CO3 + 4Ag + 2NH4NO3
Câu 2:
Phương pháp
Xem lại phần tính chất hóa học của dẫn xuất hidro cacbon có trong chương trình hóa học lớp 11
Hướng dẫn giải
B1: Hòa tan lần lượt các chất trên vào trong nước. Chất nào không tan và nổi lên trên mặt nước thì chất đó là pentan
B2: Cho các chất còn lại vào Cu(OH)2 ở nhiệt độ thường, sau đó đun nóng. Ta sẽ có bảng sau:
|
|
C3H5(OH)3 |
CH3OH |
CH3CHO |
|
Cu(OH)2 ở nhiệt độ thường |
Tạo phức xanh lam |
Không hiện tượng |
|
|
Cu(OH)2/(OH-) ở nhiệt độ cao
|
|
|
Xuất hiện kết tủa đỏ gạch (Cu2O) |
Vậy sau 2 bước trên ta đã có thể nhận biết được cả 4 dung dịch mất nhãn đã cho.
PTHH:
2 C3H8O3 + Cu(OH)2 → (C3H7O3)2Cu + 2H2O
CH3CHO + 2Cu(OH)2 + NaOH → CH3CHOONa + Cu2O + 2H2O
Câu 3:
Phương pháp giải:
a, gọi số mol của C2H5OH, C6H5OH lần lượt là a,b mol
Dựa vào dữ kiện đề bài lập hệ phương trình 2 ẩn => x, y
ð % khối lượng mối chất có trong X
b, Dựa vào câu a, và phương trình phản ứng để suy ra nNaOH phản ứng => V NaOH
Hướng dẫn giải:
a, Ta có:
C2H5OH + K → C2H5OK +1/2 H2 (1)
C6H5OH + K → C6H5OK +1/2 H2 (2)
nH2 = 3,92 : 22,4 = 0,175 mol
Gọi nC2H5OH, nC6H5OH lần lượt là x, y mol
Từ (1) nH2 = ½ nC2H5OH = x/2 (mol)
Từ (2) nH2 = ½ nC6H5OH = y/2 (mol)
ð x/2 + y/2 = 0,175 (I)
Mặt khác, tổng khối lượng của 2 chất trong X nặng 25,7 gam
ð 46x + 94y = 25,7 (II)
Từ (I) và (II) => x= 0,15; y= 0,2
%mC2H5OH = 0,15 * 46 : 25,2 * 100% = 27,38%
%mC6H5OH = 72,72%
b, Ta có:
C6H5OH + NaOH → C6H5ONa + H2O
nNaOH = nC6H5OH = 0,2 (mol)
V NaOH = n : CM = 0,2 : 0,15 = 4/3 (lít)
Câu 4
Phương pháp giải:
X chứa ancol no, đa chức mạch hở và andehit no, đơn chức mạch hở
ð Khi đốt X thì nancol = nH2O –nCO2
X tác dụng với H2 cần dùng 2,688 lít
ð Số mol andehit no, đơn chức mạch hở.
Từ số mol khí CO2 và số mol andehit, ancol biện luận để => số nguyên tử C có trong mỗi Y và Z
Bảo toàn nguyên tố O để tìm ra số nguyên tử Oxi có trong ancol
ð Y và Z
Hướng dẫn giải
nCO2 = 9,408 : 22,4 = 0,42 mol
nH2O = 9,36 : 18 = 0,52 mol
Xét khi đốt X
Y là ancol no, mạch hở=> Y có dạng CnH2n+2Ox khi đốt sẽ được nY = nH2O – nCO2
Z là andehit no, đơn chức, mạch hở => Z có dạng CmH2mO khi đốt sẽ được nH2O = nCO2
Vậy khi ta đốt X nY = nH2O –nCO2 = 0,52 – 0,42 = 0,1 (mol)
Mặt khác, khi hidro hóa X cần 2,688 lít H2
nH2 = 2,688 :22,4 = 0,12 (mol)
PTHH:
CmH2mO + H2→ CnH2n+2O
=> nCnH2nO = nH2 = 0,12 (mol)
Áp dụng định luật bảo toàn nguyên tố C ta có:
m * 0,1 + n * 0,12 = nCO2 = 0,42
=> m = 3, n =1 (vì m, n phải nguyên)
Z là HCHO
nO2 = 11,648 : 22,4 = 0,52 (mol)
Áp dụng định luật bảo toàn nguyên tố Oxi ta lại có:
x*nO(Y) +nO(Z) +2 * nO2 = 2 * nCO2 + nH2O
=> x * 0,1 + 0,12 + 2 * 0,52 = 2 * 0,42 + 0,52
=> x = 2
CTPT Y là C3H5(OH)2
Mặt khác, Y tác dụng với dung dịch Cu(OH)2 tạo dung dịch phức màu xanh lam nên Y phải có 2 nhóm OH liền kề
=> CTCT của Y là: CH2(OH)-CH(OH)-CH3












Danh sách bình luận