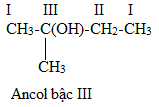Giải đề thi hết học kì II năm học 2019 - 2020 trường THPT Nguyễn Viết Xuân
Đề thi hết học kì II năm học 2019 - 2020 trường THPT Nguyễn Viết Xuân có đáp án và lời giải chi tiết
Đề bài
Câu 1 : Vật liệu nào không có nguồn gốc từ silic?
A. Vôi sống.
B. Xi măng.
C. Thủy tinh.
D. Đồ gốm.
Câu 2 : Đâu không phải là một dạng thù hình của cacbon?
A. Kim cương.
B. Than chì.
C. Fuleren.
D. Đolomit.
Câu 3 : Ankađien là hiđrocacbon mạch hở mà trong phân tử có chứa
A. 2 hay nhiều liên kết đôi C=C.
B. 1 liên kết đôi C=C.
C. 2 liên kết đôi C=C.
D. 1 liên kết ba.
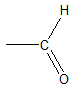
Câu 4 : Phản ứng oxi hóa ancol bậc 1 bởi CuO thu được sản phẩm là
A. xeton.
B. phenol.
C. axit cacboxylic.
D. anđehit.
Câu 5 : Nguyên tử Nitơ (Z = 7) có số electron độc thân là
A. 5.
B. 3.
C. 2.
D. 1.
Câu 6 : Chất nào sau đây là chất điện li yếu?
A. Na2CO3.
B. KOH.
C. HCl.
D. H2S.
Câu 7 : Chất CH2=CH2 có tên gọi là
A. butilen.
B. axetilen.
C. etilen.
D. propen.
Câu 8 : Chất nào sau đây không phải là ankyl benzen?
A. C6H5CH2CH3.
B. C6H4-CH=CH2.
C. C6H5CH3.
D. CH3-C6H4-CH3.
Câu 9 : Ancol no, đơn chức, mạch hở có công thức tổng quát là
A. CnH2n+1OH (n ≥ 1).
B. CnH2n(OH)2 (n ≥ 2).
C. CnH2n-1OH (n ≥ 3).
D. CnH2n+1OH (n ≥ 2).
Câu 10 : Số liên kết π trong nhóm chức anđehit là
A. 2.
B. 0.
C. 3.
D. 1.
Câu 11 : Phản ứng sau: C2H6 + Cl2 \(\xrightarrow{as}\) C2H5Cl + HCl thuộc loại phản ứng gì?
A. Phản ứng phân hủy.
B. Phản ứng thế.
C. Phản ứng crackinh.
D. Phản ứng oxi hóa.
Câu 12 : Chất nào sau đây không thuộc cùng dãy đồng đẳng với các chất còn lại?
A. C3H8.
B. C2H4.
C. C4H10.
D. CH4.
Câu 13 : Cacbon monooxit (CO) không khử được oxit kim loại nào sau đây?
A. PbO.
B. MgO.
C. CuO.
D. Fe2O3.
Câu 14 : Mệnh đề nào sau đây sai?
A. Hai khoáng vật chính của photpho là apatit và photphorit.
B. Phân đạm cung cấp nitơ dưới dạng N2.
C. Axit silixic có công thức là H2SiO3.
D. Nước đá khô là CO2 rắn.
Câu 15 : Anđehit không tác dụng với chất nào sau đây?
A. NaOH.
B. H2 (Ni, to).
C. Dung dịch Br2.
D. O2 (to).
Câu 16 : Phát biểu nào sau đây về anđehit là đúng?
A. Fomanđehit và axetanđehit là những chất lỏng không màu, mùi xốc ở điều kiện thường.
B. Axetanđehit có công thức phân tử là C2H4O2.
C. Dung dịch 37-40% fomanđehit trong nước được gọi là fomalin (còn gọi là fomon).
D. 1 mol anđehit bất kỳ khi tham gia phản ứng tráng bạc đều tạo ra 2 mol Ag.
Câu 17 : Để phân biệt C2H5OH và C3H5(OH)3 dùng chất nào sau đây?
A. Cu(OH)2.
B. Na.
C. H2SO4.
D. NaOH.
Câu 18 : Sản phẩm chính của phản ứng CH2=CH-CH2-CH3 + HCl là
A. CH3-CHCl-CH2-CH3.
B. CH2Cl-CH2-CH2-CH3.
C. CH2Cl-CH2-CH=CH2.
D. CH3-CHCl-CH=CH2.
Câu 19 : Phản ứng nào sau đây sinh ra kết tủa?
A. MgSO4 + NaNO3.
B. Ca(HCO3)2 + HCl.
C. Na2CO3 + H2SO4.
D. NaHSO4 + BaCl2.
Câu 20 : Khi nhiệt phân hoàn toàn muối Fe(NO3)2 trong không khí thu được sản phẩm gồm:
A. Fe2O3, NO2, O2.
B. Fe, NO2, O2.
C. Fe2O3, N2O, O2.
D. FeO, NO2, O2.
Câu 21 : Phát biểu nào sau đây đúng?
A. C2H4 được điều chế bằng phản ứng cộng nước C2H5OH (xúc tác H2SO4 đặc, 170oC).
B. Naphtalen có công thức là C6H5CH=CH2.
C. Tất cả các ankin đều tạo kết tủa vàng với dung dịch AgNO3/NH3.
D. C6H5CH2OH là một ancol thơm.
Câu 22 : Bậc của ancol (CH3)2C(OH)CH2CH3 là
A. 3.
B. 4.
C. 2.
D. 1.
Câu 23 : Benzen (C6H6) tác dụng với chất nào sau đây?
A. Dung dịch KMnO4.
B. Dung dịch AgNO3/NH3.
C. Dung dịch Br2.
D. Br2 khan (Fe bột).
Câu 24 : Đốt cháy 1,6 gam CH4 thu được thể tích CO2 (đktc) là
A. 1,12 lít.
B. 4,48 lít.
C. 3,36 lít.
D. 2,24 lít.
Câu 25 : Crackinh 8,8 gam propan thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propan chưa bị crackinh. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là
A. 39,6.
B. 2,315.
C. 23,16.
D. 3,96.
Câu 26 : Đốt cháy hoàn toàn a gam chất hữu cơ A cần dùng 6,72 lít O2 (đktc). Sản phẩm cháy lần lượt qua bình đựng P2O5 thấy bình tăng 3,6 gam, rồi qua bình nước vôi trong dư thấy xuất hiện 20 gam kết tủa trắng. Giá trị của a là
A. 2,6.
B. 7,6.
C. 2,8.
D. 12,4.
Câu 27 : Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. Tăng 20 gam.
B. Tăng 13,2 gam.
C. Giảm 6,8 gam.
D. Giảm 16,8 gam.
Câu 28 : Để điều chế ra 4 lít NH3 từ N2 và H2 với hiệu suất 25% thì cần thể tích N2 ở cùng điều kiện là
A. 2 lít.
B. 8 lít.
C. 1 lít.
D. 4 lít.
Câu 29 : Hỗn hợp X gồm C2H4 và C2H2. Dẫn 1,12 lít X đi qua bình đựng dung dịch AgNO3/NH3 thu được 2,4 gam kết tủa vàng. Phần trăm thể tích của C2H2 trong hỗn hợp X là
A. 25%.
B. 50%.
C. 20%.
D. 40%.
Câu 30 : Cho Na tác dụng vừa đủ với 1,24 gam hỗn hợp 3 ancol đơn chức thấy thoát ra 0,336 lít khí H2 (đktc). Khối lượng muối natri ancolat thu được là
A. 1,585 gam.
B. 1,93 gam.
C. 1,9 gam.
D. 1,555 gam.
Câu 31 : Hòa tan hoàn toàn hỗn hợp gồm 0,1 mol Fe và 0,2 mol Al vào dung dịch HNO3 dư thu được hỗn hợp khí X gồm NO và NO2 có tỉ lệ mol tương ứng là 2:1 và 68,8 gam muối. Thể tích của hỗn hợp khí X (đktc) là
A. 6,72 lít.
B. 9,41 lít.
C. 8,64 lít.
D. 4,48 lít.
Câu 32 : Để trung hòa 9 gam axit cacboxylic cần dùng 200 ml dung dịch NaOH 1M. Axit cacboxylic đó là
A. axit etanoic.
B. axit propionic.
C. axit oxalic.
D. axit metanoic.
Câu 33 : Cho 4,35 gam một anđehit tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng thu được 32,4 gam Ag. Công thức cấu tạo của anđehit là
A. C2H5OH.
B. OHC-CHO.
C. CH3CHO.
D. HCHO.
Câu 34 : Cho các chất sau: vinyl axetilen, butan, toluen, etanol, phenol, propilen, axit axetic, buta-1,3-đien. Số chất làm mất màu dung dịch brom là
A. 3.
B. 4.
C. 5.
D. 6.
Câu 35 : Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH là
A. 13,0.
B. 1,0.
C. 1,2.
D. 12,8.
Câu 36 : 0,05 mol hiđrocacbon X mạch hở làm mất màu vừa đủ dung dịch chứa m gam brom cho ra sản phẩm có hàm lượng brom đạt 69,56%. Công thức phân tử của X và giá trị m lần lượt là
A. C5H10 và 4 gam.
B. C5H8 và 16 gam.
C. C5H8 và 8 gam.
D. C5H10 và 8 gam.
Câu 37 : Hỗn hợp X gồm C3H8O3 (glixerol), CH3OH, C2H5OH, C3H7OH và H2O. Cho m gam X tác dụng với Na dư thu được 3,36 lít H2 (đktc). Đốt cháy hoàn toàn m gam X thu được 11,34 gam H2O. Biết trong X glixerol chiếm 25% về số mol. Giá trị của m gần nhất với
A. 13.
B. 11.
C. 10.
D. 12.
Câu 38 : Đốt cháy 12,7 gam hỗn hợp X gồm C4H4, C2H2, C3H6 và H2 cần dùng 1,335 mol O2. Mặt khác, nung nóng 12,7 gam X có mặt Ni làm xúc tác, sau một thời gian thu được hỗn hợp khí Y chỉ gồm các hiđrocacbon có tỉ khối so với He bằng 127/12. Dẫn toàn bộ Y qua bình đựng lượng dư dung dịch AgNO3 trong NH3 thu được 23,98 gam kết tủa; khí thoát ra khỏi bình được làm no hoàn toàn cần dùng 0,11 mol H2 (xúc tác Ni, to) thu được hỗn hợp khí Z có thể tích là 4,032 lít (đktc). Phần trăm khối lượng của C2H2 có trong Y là
A. 12,28%.
B. 10,24%.
C. 8,19%.
D. 16,38%.
Câu 39 : Cho 7,68 gam kim loại X phản ứng hết với 1 lít dung dịch HNO3 thu được dung dịch Y và 1,792 lít khí NO (đktc) là sản phẩm khử duy nhất. Để trung hòa lượng HNO3 dư cần thêm vào Y đúng 150 ml dung dịch KOH 1,2M. Sau phản ứng thu được dung dịch Z. Cô cạn cẩn thận Z rồi đem chất rắn khan thu được nung đến khối lượng không đổi thu được hỗn hợp khí T. Tỉ khối của hỗn hợp khí T so với N2 là
A. 1,41.
B. 1,39.
C. 1,37.
D. 1,45.
Câu 40 : Cho 11,2 lít (đktc) hỗn hợp khí X gồm N2, CO và CO2 qua dung dịch Ca(OH)2 dư thu được 15,0 gam kết tủa, sau đó đi qua ống sứ chứa CuO dư nung nóng thấy khối lượng chất rắn trong ống sứ giảm đi 1,60 gam. Nếu cho 5,6 lít hỗn hợp khí trên đi qua ống sứ chứa CuO dư nung nóng rồi dẫn sản phẩm khí đi qua dung dịch Ca(OH)2 dư thì lượng kết tủa thu được là
A. 5 gam.
B. 15 gam.
C. 12,5 gam.
D. 25 gam.
Lời giải chi tiết
Câu 1 :
Phương pháp:
Lý thuyết tổng hợp về cacbon - silic.
Cách giải:
Vôi: CaO.
Xi măng có thành phần 3CaO.SiO2.
Thủy tinh là hỗn hợp Na2SiO3, CaSiO3, SiO2.
Đồ gốm chế tạo từ đất sét và cao lanh.
Chọn A.
Câu 2
Phương pháp:
Thù hình là các dạng đơn chất khác nhau của cùng một nguyên tố.
Cách giải:
Nguyên tố C có các dạng thù hình: kim cương, than chì, fuleren, cacbon vô định hình.
Đolomit có thành phần CaCO3, MgCO3 ⟹ không phải là thù hình của C.
Chọn D.
Câu 3
Phương pháp:
Dựa vào khái niệm của ankađien.
Cách giải:
Ankađien là hiđrocacbon mạch hở mà trong phân tử có chứa 2 liên kết đôi C=C.
Chọn C.
Câu 4
Phương pháp:
Dựa vào tính chất hóa học của ancol.
Cách giải:
Phản ứng oxi hóa ancol bậc 1 bởi CuO thu được sản phẩm là anđehit.
Chọn D.
Câu 5
Phương pháp:
Dựa vào cấu hình e nguyên tử nitơ.
Cách giải:
Cấu hình e nguyên tử N (Z = 7): 1s22s22p3
Sự phân bố electron vào các AO:
⟹ N có 3 e độc thân.
Chọn B.
Câu 6
Phương pháp:
Các chất phân li không hoàn toàn được gọi là chất điện li yếu.
Cách giải:
A. Na2CO3 → 2Na+ + CO32-.
B. KOH → K+ + OH-.
C. HCl → H+ + Cl-.
D. H2S ⇄ H+ + HS-.
Chọn D.
Câu 7
Phương pháp:
Dựa vào quy tắc gọi tên của anken.
Cách giải:
Chất CH2=CH2 có tên gọi là etilen.
Chọn C.
Câu 8
Phương pháp:
Dãy đồng đẳng ankyl benzen gồm các hiđrocacbon chứa vòng benzen liên kết với gốc hiđrocacbon no.
Cách giải:
A. C6H5CH2CH3: etyl benzen.
B. C6H4-CH=CH2: vinyl benzen.
C. C6H5CH3: metyl benzen.
D. CH3-C6H4-CH3: đimetyl benzen.
⟹ Vinyl benzen không phải ankyl benzen.
Chọn B.
Câu 9
Phương pháp:
Lý thuyết về ancol.
Cách giải:
Ancol no, đơn chức, mạch hở có công thức tổng quát là CnH2n+1OH (n ≥ 1).
Chọn A.
Câu 10
Phương pháp:
Dựa vào cấu tạo nhóm CHO.
Cách giải:
Cấu tạo nhóm CHO:
⟹ Nhóm CHO có chứa 1 liên kết π.
Chọn D.
Câu 11
Phương pháp:
Dựa vào phản ứng hóa học để xác định loại phản ứng.
Cách giải:
Phản ứng: C2H6 + Cl2 \(\xrightarrow{as}\) C2H5Cl + HCl thuộc loại phản ứng thế.
Chọn B.
Câu 12
Phương pháp:
Đồng đẳng là những chất hữu cơ có tính chất tương tự nhau và trong phân tử hơn kém nhau 1 hay nhiều nhóm CH2.
Cách giải:
Các chất CH4, C3H8, C4H10 thuộc dãy đồng đẳng ankan.
C2H4 thuộc dãy đồng đẳng anken.
Chọn B.
Câu 13
Phương pháp:
CO khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
Cách giải:
CO khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học ⟹ CO không khử được MgO.
PTHH:
CO + PbO \(\overset{{{t}^{o}}}{\mathop{\to }}\,\) Pb + CO2.
CO + CuO \(\overset{{{t}^{o}}}{\mathop{\to }}\,\) Cu + CO2.
3CO + Fe2O3 \(\overset{{{t}^{o}}}{\mathop{\to }}\,\) 2Fe + 3CO2.
Chọn B.
Câu 14
Phương pháp:
Dựa vào tính chất hóa học và ứng dụng của Nitơ, photpho, cacbon và hợp chất.
Cách giải:
A đúng.
B sai, vì phân đạm cung cấp nitơ dưới dạng NO3- hoặc NH4+.
C đúng.
D đúng.
Chọn B.
Câu 15
Phương pháp:
Dựa vào tính chất hóa học của anđehit.
Cách giải:
- Anđehit tác dụng với H2 (Ni,to); dung dịch Br2; O2(to).
R-CHO + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) RCH2OH.
R-CHO + Br2 + H2O → RCOOH + 2HBr.
R-CHO + ½ O2 \(\xrightarrow{xt,{{t}^{o}}}\) RCOOH (hoặc phản ứng cháy).
- Anđehit không tác dụng với NaOH.
Chọn A.
Câu 16
Phương pháp:
Dựa vào tính chất của anđehit.
Cách giải:
A sai, fomanđehit và axetanđehit là những chất khí ở điều kiện thường.
B sai, axetanđehit có công thức phân tử là C2H4O.
C đúng.
D sai, ví dụ 1 mol HCHO hoặc anđehit 2 chức tham gia phản ứng trạng bạc tạo 4 mol Ag.
Chọn C.
Câu 17
Phương pháp:
Chọn thuốc thử cho hiện tượng khác nhau giữa các chất.
Cách giải:
Dùng Cu(OH)2:
+ Hòa tan Cu(OH)2 tạo dung dịch phức màu xanh lam ⟹ C3H5(OH)3.
PTHH: 2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O.
+ Không hiện tượng ⟹ C2H5OH.
Chọn A.
Câu 18
Phương pháp:
Quy tắc cộng Mac-cop-nhi-cop:
Trong phản ứng cộng axit hoặc nước (kí hiệu chung là HA) vào liên kết C=C của anken, H (phần tử mang điện tích dương) ưu tiên cộng vào C mang nhiều H hơn (cacbon bậc thấp hơn), còn A (phần tử mang điện tích âm) ưu tiên cộng vào C mang ít H hơn (cacbon bậc cao hơn).
Cách giải:
CH2=CH-CH2-CH3 + HCl → CH3-CHCl-CH2-CH3 (spc).
Chọn A.
Câu 19
Phương pháp:
Dựa vào điều kiện phản ứng trao đổi trong dung dịch.
Cách giải:
A. MgSO4 + NaNO3 → không phản ứng.
B. Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O.
C. Na2CO3 + H2SO4 → Na2SO4 + CO2 ↑ + H2O.
D. NaHSO4 + BaCl2 → BaSO4 ↓ + NaCl + HCl.
Chọn D.
Câu 20
Phương pháp:
Dựa vào tính chất hóa học của muối nitrat để xác định sản phẩm.
Cách giải:
2Fe(NO3)2 \(\xrightarrow{{{O}_{2}},{{t}^{o}}}\) Fe2O3 + 2NO2 + 0,5O2.
Lưu ý: Nhiệt phân ban đầu sinh ra FeO nhưng FeO phản ứng với O2 tạo thành Fe2O3.
Chọn A.
Câu 21:
Phương pháp:
Dựa vào tính chất của ancol, hiđrocacbon.
Cách giải:
A sai, C2H4 được điều chế bằng phản ứng tách nước C2H5OH (xúc tác H2SO4 đặc, 170oC).
PTHH: C2H5OH \(\xrightarrow{{{H}_{2}}S{{O}_{4}},{{170}^{o}}C}\) C2H4 + H2O
B sai.
C sai, chỉ có các ankin có liên kết ba đầu mạch phản ứng được với dung dịch AgNO3/NH3.
D đúng, C6H5CH2OH là một ancol thơm.
Chọn D.
Câu 22 (NB):
Phương pháp:
Bậc ancol bằng bậc nguyên tử C liên kết với nhóm OH đó.
Cách giải:
⟹ Ancol bậc 3.
Chọn A.
Câu 23 (NB):
Phương pháp:
Dựa vào tính chất hóa học của hiđrocacbon thơm.
Cách giải:
C6H6 không tác dụng với dung dịch KMnO4, AgNO3/NH3, dung dịch Br2.
C6H6 tác dụng với Br2 (bột Fe, to).
PTHH: C6H6 + Br2 \(\xrightarrow{Fe,{{t}^{o}}}\) C6H5Br + HBr.
Chọn D.
Câu 24 (TH):
Phương pháp:
Cách 1: Tính theo PTHH:
CH4 + 2O2 → CO2 + 2H2O.
Cách 2: Sử dụng bảo toàn nguyên tố C.
Cách giải:
Cách 1:
nCH4 = 1,6/16 = 0,1 mol
CH4 + 2O2 → CO2 + 2H2O
0,1 → 0,1 (mol)
⟹ VCO2 = 0,1.22,4 = 2,24 lít.
Cách 2:
BTNT.C ⟹ nCO2 = nCH4 = 1,6/16 = 0,1 mol
⟹ VCO2 = 2,24 lít.
Chọn D.
Câu 25
Phương pháp:
nC3H8 bđ = m/M; nC3H8 pư = nC3H8 bđ.H%
C3H8 → C3H6 + H2
C3H8 → C2H4 + CH4
Từ các PTHH ta thấy: nC3H8 pư = nanken; nC3H8 bđ = nankan sau.
Dùng BTKL ⟹ Khối lượng phân tử trung bình của A.
Cách giải:
nC3H8 bđ = 0,2 mol; nC3H8 pư = 0,2.90% = 0,18 mol.
C3H8 → C3H6 + H2
C3H8 → C2H4 + CH4
Từ các PTHH ta thấy:
nanken = nC3H8 pư = 0,18 mol
nankan sau = nC3H8 bđ = 0,2 mol
⟹ nhh A = nanken + nankan sau = 0,18 + 0,2 = 0,38 mol.
BTKL: mC3H8 = mhh A
⇔ 8,8 = 0,38.MA
⟹ MA ≈ 23,16.
Chọn C.
Câu 26
Phương pháp:
Bình P2O5 hấp thụ H2O ⟹ mH2O.
Do Ca(OH)2 dư nên ta có nCO2 = nCaCO3 ⟹ mCO2.
BTKL: mA + mO2 = mCO2 + mH2O
Cách giải:
nO2 = 6,72/22,4 = 0,3 mol; nCaCO3 = 20/100 = 0,2 mol.
Bình P2O5 hấp thụ H2O ⟹ mH2O = 3,6 gam.
Do Ca(OH)2 dư nên ta có nCO2 = nCaCO3 = 0,2 mol ⟹ mCO2 = 0,2.44 = 8,8 gam.
BTKL: mA + mO2 = mCO2 + mH2O
⟹ a + 0,3.32 = 3,6 + 8,8
⟹ a = 2,8.
Chọn C.
Câu 27
Phương pháp:
*Tính tỉ lệ nOH-/nCO2 xác định sản phẩm của phản ứng.
*Khối lượng dung dịch tăng - giảm:
- Những chất hấp thụ vào dung dịch làm cho khối lượng dung dịch tăng
- Những chất đi ra khỏi dung dịch (chất khí, chất kết tủa) làm cho khối lượng dung dịch giảm
⟹ Δm dung dịch = m vào - m khí - m kết tủa
+ Nếu Δm dung dịch > 0 ⟹ Khối lượng dung dịch tăng
+ Nếu Δm dung dịch < 0 ⟹ Khối lượng dung dịch giảm
Cách giải:
nOH- = 2nCa(OH)2 = 0,5 mol
⟹ 1 < nOH-/nCO2 = 0,5/0,3 = 1,67 < 2 ⟹ Sản phẩm tạo CaCO3 (a mol) và Ca(HCO3)2 (b mol)
Giải hệ: \(\left\{ {\begin{array}{*{20}{l}}{{n_{C{O_2}}} = a + 2b = 0,3\left( {BTNT.C} \right)}\\{{n_{Ca{{(OH)}_2}}} = a + b = 0,25\left( {BTNT.Ca} \right)}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{a = 0,2}\\{b = 0,05}\end{array}} \right.\)
∆m = mCO2 - mCaCO3 = 0,3.44 - 0,2.100 = -6,8 gam < 0.
Vậy khối lượng dung dịch sau phản ứng giảm 6,8 gam.
Chọn C.
Câu 28
Phương pháp:
PTHH: N2 + 3H2 ⇄ 2NH3
Từ lượng NH3 suy ra lượng N2 lý thuyết.
Suy ra lượng N2 thực tế cần dùng.
Cách giải:
PTHH: N2 + 3H2 ⇄ 2NH3
2 ← 4 (lít)
⟹ VN2 (lý thuyết) = 2 lít
⟹ VN2 (thực tế) = 2 : 25% = 8 (lít).
Chọn B.
Câu 29
Phương pháp: Từ nkết tủa ⟹ nC2H2, %VC2H2.
Cách giải:
nhh X = 1,12/22,4 = 0,05 mol
nAg2C2 = 2,4/240 = 0,01 mol
PTHH: C2H2 + 2AgNO3 + 2NH3 → Ag2C2 ↓ + 2NH4NO3
(mol) 0,01 ← 0,01
⟹ %VC2H2 = \(\frac{{0,01}}{{0,05}}.100\% \) = 20%.
Chọn C.
Câu 30
Phương pháp:
Gọi CT chung của ancol là ROH.
PTHH: ROH + Na → RONa + 0,5H2; từ số mol H2 suy ra số mol Na.
BTKL: mancol + mNa = mmuối + mH2 ⟹ mmuối.
Cách giải:
nH2 = 0,336/22,4 = 0,015 mol ⟹ mH2 = 0,03 gam.
Gọi CT chung của ancol là ROH.
PTHH: ROH + Na → RONa + 0,5H2
(mol) 0,03 ← 0,015
BTKL: mancol + mNa = mmuối + mH2
⟹ 1,24 + 0,03.23 = mmuối + 0,015.2
⟹ mmuối = 1,9 gam.
Chọn C.
Câu 31
Phương pháp:
So sánh thấy (mFe(NO3)3 + mAl(NO3)3) < 68,8 gam ⟹ Muối còn chứa NH4NO3.
Dùng phương pháp bảo toàn e để xác định số mol mỗi khí.
Cách giải:
Ta có nFe(NO3)3 = nFe = 0,1 mol; nAl(NO3)3 = nAl = 0,2 mol
⟹ mFe(NO3)3 + mAl(NO3)3 = 66,8 gam < 68,8 gam ⟹ Muối còn chứa NH4NO3.
⟹ mNH4NO3 = 68,8 - 66,8 = 2 gam ⟹ nNH4NO3 = 2/80 = 0,025 mol.
Đặt nNO = 2x; nNO2 = x (mol).
Quá trình nhường e:
Fe → Fe3+ + 3e
0,1→ 0,3 (mol)
Al → Al3+ + 3e
0,2 → 0,6 (mol)
⟹ ne nhường = 0,3 + 0,6 = 0,9 mol.
Quá trình nhận e:
N+5 + 3e → N+2
6x ← 2x (mol)
N+5 + 1e → N+4
x ← x (mol)
N+5 + 8e → N-3
0,2 ← 0,025 (mol)
⟹ ne nhận = 6x + x + 0,2 = 7x + 0,2 (mol).
Áp dụng bảo toàn e ⟹ 7x + 0,2 = 0,9 ⟹ x = 0,1.
⟹ VX = (0,2 + 0,1).22,4 = 6,72 lít.
Chọn A.
Câu 32
Phương pháp:
Gọi công thức axit là R(COOH)t.
PTHH: R(COOH)t + tNaOH → R(COONa)t + tH2O.
Từ số mol NaOH suy ra số mol axit.
Lập phương trình mối liên hệ giữa R, t ⟹ công thức của axit.
Cách giải:
nNaOH = 0,2 mol.
Gọi công thức axit là R(COOH)t.
PTHH: R(COOH)t + tNaOH → R(COONa)t + tH2O.
(mol) 0,2/t ← 0,2
Mặt khác, maxit = naxit.Maxit
⟹ \(\frac{{0,2}}{t}\).(R + 45t) = 9 ⟹ R = 0.
⟹ Axit là HOOC-COOH (axit oxalic).
Chọn C.
Câu 33
Phương pháp:
Từ nAg ⟹ nanđehit ⟹ Manđehit ⟹ R ⟹ công thức anđehit.
Cách giải:
nAg = 32,4/108 = 0,3 mol
R(CHO)t → 2tAg
0,15/t ← 0,3 (mol)
⟹ Manđehit = manđehit : nanđehit = 4,35 : (0,15/t) = 29t.
⟹ R + 29t = 29t ⟹ R = 0
⟹ Anđehit là OHC-CHO.
Chọn B.
Câu 34
Phương pháp:
Tính chất hóa học của: hiđrocacbon, ancol, phenol, axit cacboxylic.
Cách giải:
Các chất làm mất màu dung dịch brom là: vinyl axetilen, phenol, propilen, buta-1,3-đien (4 chất).
Vinyl axetilen:
CH≡C-CH=CH2 + 3Br2 → CHBr2-CBr2-CHBr-CH2Br.
Phenol:
C6H5OH + 3Br2 → C6H2Br3OH ↓ + 3HBr.
Propilen:
C3H6 + Br2 → C3H6Br2.
Buta-1,3-đien:
CH2=CH-CH=CH2 + 2Br2 → CH2Br-CHBr-CHBr-CH2Br.
Chọn B.
Câu 35
Phương pháp:
nH2SO4, nHCl ⟹ nH+.
nNaOH, nBa(OH)2 ⟹ nOH-.
Từ nH+; nOH- ⟹ pH của dung dịch sau phản ứng.
Cách giải:
nH2SO4 = 0,005 mol; nHCl = 0,01 mol
⟹ nH+ = 2nH2SO4 + nHCl = 0,02 mol.
nNaOH = 0,02 mol; nBa(OH)2 = 0,01 mol
⟹ nOH- = nNaOH + 2nBa(OH)2 = 0,04 mol.
PT ion rút gọn: H+ + OH- → H2O
⟹ nOH dư = 0,04 - 0,02 = 0,02 mol.
⟹ [OH-] = 0,02/(0,1 + 0,1) = 0,1 mol/l
⟹ [H+] = 10-14 : 0,1 = 10-13 ⟹ pH = 13.
Chọn A.
Câu 36
Phương pháp:
CTTQ hiđrocacbon là CnH2n+2-2k.
CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k.
⟹ nBr2 và %mbr ⟹ CTPT của X.
Cách giải:
CTTQ hiđrocacbon là CnH2n+2-2k (với k là số liên kết π).
PTHH: CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k
(mol) 0,05 → 0,05k → 0,05
Theo đề bài %mBr = 69,56%
⟹ \(\frac{{80.2k}}{{14n + 2 + 158k}}.100 = 69,56\)
⟹ 160k = 9,7384n + 1,3912 + 109,9048k
⟹ 50,0952k = 9,7384n + 1,3912
⟹ 36k = 7n + 1
⟹ k = 1; n = 5 thỏa mãn
⟹ CTPT của X là C5H10 và mBr2 = 0,05.160 = 8 gam.
Chọn D.
Câu 37
Phương pháp:
Coi hỗn hợp ban đầu gồm: C3H5(OH)3 và CnH2n+1OH
(lưu ý: H2O có dạng C0H2.0+1OH).
Giả sử nhỗn hợp = x mol
⟹ nC3H5(OH)3 = 25%.x = 0,25x (mol)
⟹ nCnH2n+1OH = x - 0,25x = 0,75x (mol)
*Khi cho hỗn hợp tác dụng với Na:
C3H5(OH)3 + 3Na → C3H5(ONa)3 + 1,5H2
CnH2n+1OH + Na → CnH2n+1ONa + 0,5H2
Từ nH2 ⟹ giá trị của x ⟹ số mol của C3H5(OH)3 và CnH2n+1OH.
*Khi đốt cháy hỗn hợp:
C3H5(OH)3 → 4H2O
CnH2n+1OH → (n+1)H2O
Từ nH2O ⟹ giá trị của n ⟹ khối lượng hỗn hợp.
Cách giải:
Coi hỗn hợp ban đầu gồm: C3H5(OH)3 và CnH2n+1OH
(lưu ý: H2O có dạng C0H2.0+1OH).
Giả sử nhỗn hợp = x mol
⟹ nC3H5(OH)3 = 25%.x = 0,25x (mol)
⟹ nCnH2n+1OH = x - 0,25x = 0,75x (mol)
*Khi cho hỗn hợp tác dụng với Na:
C3H5(OH)3 + 3Na → C3H5(ONa)3 + 1,5H2
0,25x → 0,375x (mol)
CnH2n+1OH + Na → CnH2n+1ONa + 0,5H2
0,75x → 0,375x (mol)
Theo đề bài nH2 = 3,36/22,4 = 0,15 mol
⟹ 0,375x + 0,375x = 0,15
⟹ x = 0,2
⟹ nC3H5(OH)3 = 0,25x = 0,05 mol;
nCnH2n+1OH = 0,75x = 0,15 mol.
*Khi đốt cháy hỗn hợp:
C3H5(OH)3 → 4H2O
0,05 → 0,2
CnH2n+1OH → (n+1)H2O
0,15 → (n+1).0,15
⟹ 0,2 + 0,15(n+1) = 11,34/18 ⟹ n = 28/15.
⟹ mhỗn hợp = 0,05.92 + 0,15.\(\left( {14.\frac{{28}}{{15}} + 18} \right)\) = 11,22 gam.
Chọn B.
Câu 38
Cách giải:
Quy đổi X thành C (x mol) và H (y mol).
+) mC + mH = 12,7 ⟹ 12x + y = 12,7
+) nO2 = x + y/4 = 1,335
⟹ x = 0,92 và y = 1,66
BTKL pư nung X: mY = mX = 12,7 gam
⟹ nY = 12,7 : (127/3) = 0,3 mol.
*Giả sử trong Y chứa:
CH≡C-CH=CH2: a mol
CH≡C-CH2-CH3: b mol
CH≡CH: c mol
+) m kết tủa = mC4H3Ag + mC4H5Ag + mC2Ag2 = 23,98 gam
⟹ m kết tủa = 159a + 161b + 240c = 23,98 (1)
+) nY = n hiđrocacbon bị AgNO3 hấp thụ + nZ
⟹ a + b + c + 0,18 = 0,3 (2)
+) Trong Z chứa:
nC = 0,92 - 4a - 4b - 2c (BTNT.C)
nH = 1,66 - 4a - 6b - 2c + 0,11.2 (BTNT.H)
Z là ankan nên nếu đốt Z thì: nZ = nH2O - nCO2
0,18 = (1,88 - 4a - 6b - 2c)/2 - (0,92 - 4a - 4b - 2c) (3)
Giải hệ (1)(2)(3): a = 0,04; b = 0,02; c = 0,06.
⟹ %mC2H2 (Y) = 12,28%.
Chọn A.
Câu 39
Phương pháp:
Dùng phương pháp bảo toàn e để xác định X.
Xác định thành phần dung dịch Z ⟹ thành phần hỗn hợp khí T ⟹ MT ⟹ dT/N2.
Cách giải:
nNO = 0,08 mol.
Quá trình nhận e:
N+5 + 3e → N+2
0,24 ← 0,08
Quá trình nhường e:
X → Xn+ + ne
0,24/n ← 0,24 (mol)
⟹ MX = 7,68 : (0,24/n) = 32n
⟹ n = 2; M = 64 thỏa mãn ⟹ Kim loại là Cu.
Do HNO3 dư ⟹ Dung dịch Y có HNO3dư; Cu(NO3)2.
Trung hòa HNO3 trong Y cần 0,18 mol KOH
⟹ Dung dịch Z có nKNO3 = 0,18 mol; nCu(NO3)2 = 0,12 mol.
KNO3 → KNO2 + 0,5O2
0,18 → 0,09 (mol)
Cu(NO3)2 → CuO + 2NO2 + 0,5O2
0,12 → 0,24 → 0,06 (mol)
Hỗn hợp khí T có: nNO2 = 0,24 mol; nO2 = 0,15 mol.
⟹ MT = (mNO2 + mO2)/(nNO2 + nO2) ≈ 40,6
⟹ dT/N2 = 40,6/28 = 1,45.
Chọn D.
Câu 40
Phương pháp:
Khi CO2 tác dụng Ca(OH)2 dư thì nCaCO3 = nCO2(X).
Khi CO phản ứng với oxit: mgiảm = mO(oxit) = nCO(pư).
Cách giải:
mkết tủa = 15 gam ⟹ nCaCO3 = nCO2(X) = 0,15 mol.
mgiảm = mO(oxit) = 1,6 gam ⟹ nCO = nO(oxit) = 0,1 mol.
Trong 11,2 lít hỗn hợp khí X có chứa 0,15 mol CO2; 0,1 mol CO.
⟹ Trong 5,6 lít hỗn hợp khí X có chứa 0,075 mol CO2; 0,05 mol CO.
Khi cho 5,6 lít hỗn hợp X tác dụng CuO dư:
⟹ nCO2 tạo thành = nCO = 0,05 mol
⟹ ΣnCO2 = nCO2(X) + nCO2 tạo thành = 0,075 + 0,05 = 0,125 mol
⟹ nkết tủa = nCO2 = 0,125 mol (do Ca(OH)2 dư)
⟹ mCaCO3 = 0,125.100 = 12,5 gam.
Chọn C.
Loigiaihay.com