 Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi học kì 2 của các trường có lời giải – Mới nhất
Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo
Đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo có đáp án và lời giải chi tiết
Đề bài
Câu 1: Kim loại crom tan trong dung dịch
A. HNO3 (đặc, nguội)
B. HCl (loãng, nóng)
C. H2SO4 (đặc, nguội)
D. NaOH (loãng, nóng)
Câu 2: Trong phương pháp thủy luyện, điều chế Cu từ CuSO4 có thể dùng kim loại nào làm chất khử?
A. Zn
B. Ba
C. Ag
D. Na
Câu 3: Nguyên tắc điều chế kim loại là
A. Oxi hóa kim loại thành ion kim loại
B. Khử kim loại thành ion kim loại
C. Khử ion kim loai thành kim loại
D. Oxi hóa kim loại thành kim loại
Câu 4: Phát biểu nào sau đây sai?
A. Hàm lượng cacbon trong thép cao hơn trong gang
B. Sắt là kim loại màu trắng hơi xám, dẫn điện tốt
C. Quặng pirit sắt có thành phần chính là FeS2
D. Sắt (III) hidroxit là chất rắn, màu nâu đỏ, không tan trong nước
Câu 5: Phương trình hóa học nào sau đây giải thích được câu tục ngữ: nước chảy đá mòn
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. Ca(HCO3)2 → CaCO3 + CO2 + H2O
C. CaCO3 → CaO + CO2
D. CaCO3 + 2HCl CaCl2 + CO2 + H2O
Câu 6: Cho các kim loại sau: Na, Ba, Cr, Fe. Số kim loại tác dụng với nước tạo dung dịch bazơ là
A. 1
B. 4
C. 2
D. 3
Câu 7: Trường hợp nào sau đây tạo ra kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Cho dung dịch HCl dư vào dung dịch NaAlO2
B. Sục CO2 dư vào dung dịch Ca(OH)2
C. Cho dung dịch NaOH dư vào dung dịch AlCl3
D. Cho dung dịch AlCl3 dư vào dung dịch NaOH
Câu 8: Dung dịch NaOH có thể phản ứng với tất cả các chất trong dãy nào sau đây?
A. K2CO3, HNO3, SO2, CuO
B. CuSO4, HNO3, SO2, KNO3
C. Na2SO4, HCl, CO2, Al2O3
D. MgCl2, HCl, CO2, Al(OH)3
Câu 9: Cấu hình electron nào sau đây của ion Cr3+?
A. [Ar]3d6
B. [Ar]3d5
C. [Ar]3d4
D. [Ar]3d3
Câu 10: Công thức hóa học của sắt (II) hidroxit là
A. Fe2O3
B. Fe(OH)2
C. Fe(OH)3
D. Fe3O4
Câu 11: Phương trình nào sau đây đúng?
A. FeSO4 + Cu CuSO4 + Fe
B. 2Cr + 3Cl2 2CrCl3
C. Fe + 2S FeS2
D. Cr + 2HNO3 Cr(NO3)2 + H2
Câu 12: Khí X được điều chế và thu vào bình tam giác theo hình vẽ
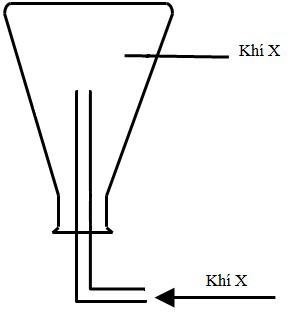
Khí X được tạo ra từ phản ứng hóa học nào dưới đây?
A. Cho dung dịch H2SO4 loãng vào bình đựng hạt kim loại Zn
B. Cho dung dịch HCl đặc vào bình đựng tinh thể K2Cr2O7
C. Cho dung dịch H2SO4 đặc vào bình đựng kim loại Cu
D. Cho dung dịch HCl vào bình đựng bột CaCO3
Câu 13: Dãy gồm các chất chỉ có tính OXH là
A. FeO, FeCl2
B. Fe, Fe2O3
C. Fe2O3, Fe2(SO4)3
D. Fe3O4, Fe(OH)2
Câu 14: Cho 1,17 gam một kim loại kiềm tác dụng với nước (dư). Sau phản ứng thu được 0,336 lít khí H2. Kim loại kiềm là
A. K
B. Na
C. Li
D. Rb
Câu 15: Để phân biệt hai dung dịch KNO3, Mg(NO3)2 đựng trong hai lọ riêng biệt, ta có thể dùng dung dịch
A. MgCl2
B. NaOH
C. HCl
D. NaCl
Câu 16: Quặng nào sau đây có chứa thành phần chính là là Al2O3 ?
A. Hematit đỏ
B. Manhetit
C. Criolit
D. Boxit
Câu 17: Công thức của phèn chua là
A. Al2(SO4)3. 18H2O
B. K2SO4.Al2(SO4)3.24H2O
C. (NH4)2SO4. Al2(SO4)3.24H2O
D. Na3AlF6
Câu 18: Hòa tan hoàn toàn m gam Fe bằng dung dịch HNO3 đặc nóng dư thu được 3,36 lít NO2 (đktc, sản phẩm khử duy nhất). Gía trị của m là
A. 4,2
B. 2,8
C. 8,4
D. 25,2
Câu 19: Hai dung dịch đều phản ứng với kim loại Fe là
A. ZnCl2, FeCl3
B. CuSO4 và HNO3 đặc nguội
C. AgNO3 và H2SO4 loãng
D. HCl và AlCl3
Câu 20: Chất nào sau đây vừa phản ứng với dung dịch NaOH, vừa phản ứng với dung dịch HCl
A. AlCl3
B. Al2(SO4)3
C. NaAlO2
D. Al2O3
Câu 21: Cho các hợp kim sau: Cu – Fe; Zn – Fe; Fe – C; Sn – Fe. Khi tiếp xúc với chất điện li thì số hợp kim mà trong đó Fe bị ăn mòn trước là
A. 2
B. 4
C. 3
D. 1
Câu 22: Kim loại nào sau đây không phải là kim loại kiềm?
A. Cs
B. Li
C. Ba
D. Na
Câu 23: Kim loại Ca được điều chế bằng phương pháp nào sau đây?
A. Cho K tác dụng với dung dịch CaCl2
B. Điện phân dung dịch CaCl2
C. Nhiệt phân CaCO3
D. Điện phân CaCl2 nóng chảy
Câu 24: Dung dịch NaHCO3 không tác dụng với
A. CO2
B. NaOH
C. KOH
D. HCl
Câu 25: Cho luồng khí H2 dư đi qua hỗn hợp rắn X gồm CuO, FeO, MgO đến khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Chất Y tác dụng với dung dịch HCl dư thì thấy
A. Y tan một phần và có hiện tượng sủi bọt khí
B. Y tan hết và không có hiện tượng sủi bọt khí
C. Y tan hết và có hiện tượng sủi bọt khí
D. Y tan một phần và không có hiện tượng sủi bọt khí.
Câu 26: Một mẫu nước cứng có chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng làm mềm mẫu nước cứng trên là
A. NaHCO3
B. Na2CO3
C. H2SO4
D. HCl
Câu 27: Người ta thường dùng hỗn hợp tecmit (kim loại M và Fe2O3) điều chế một lượng nhỏ sắt để hàn đường ray. Kim loại M là
A. Fe
B. Ag
C. Al
D. Cu
Câu 28: Phản ứng không tạo FeCl2 là
A. Fe + Cl2
B. Fe + HCl
C. Fe(OH)2 + HCl
D. Cu + FeCl3
Câu 29: Điện phân dung dịch NaCl có màng ngăn xốp một thời gian, thu được dung dịch A. Cho vài giọt phenol phtalein vào dung dịch A, hiện tượng quan sát được là
A. dung dịch không màu chuyển sang màu xanh
B. dung dịch không màu chuyển sang màu hồng
C. dung dịch chuyển từ màu xanh thành màu hồng
D. dung dịch không đổi màu
Câu 30: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 7,8 gam. Gía trị lớn nhất của V là
A. 1,2
B. 1,8
C. 2,4
D. 2,2
Câu 31: Hòa tan hết a mol Al vào dung dịch chứa 2,5 mol NaOH thu được dung dịch A. Kết luận nào sau đây là đúng?
A. Dung dịch A không làm đổi màu quỳ tím
B. Thêm HCl dư vào dung dịch A thu được 0,5 a mol kết tủa
C. Dung dịch A không phản ứng với dung dịch MgCl2
D. Sục CO2 dư vào dung dịch A thu được a mol kết tủa
Câu 32: Hấp thụ hoàn toàn khí CO2 vào dung dịch Ca(OH)2 thu được 20 gam kết tủa. Lọc bỏ kết tủa rồi nung nóng dung dịch còn lại thu thêm 5 gam kết tủa nữa. Thể tích khí CO2 đã hấp thụ là
A. 3,36 lít
B. 4,48 lít
C. 2,24 lít
D. 6,72 lít
Câu 33: Cho các chất: Ag, Fe3O4, Na2CO3, Fe(OH)3. Số chất trong dãy tác dụng với dung dịch H2SO4 loãng
A. 3
B. 4
C. 2
D. 1
Câu 34: Cho 13,7 Ba gam tan hết vào 300 gam dung dịch Al2(SO4)3. Sau khi các phản ứng hết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Nồng độ mol/ lít của dung dịch Al2(SO4)3 đã dùng là
A. 0,11M
B. 0,12M
C. 0,20M
D. 0,10M
Câu 35: Cho hỗn hợp gồm Fe(NO3)2 và Al2O3 vào dung dịch H2SO4 (loãng, dư) thu được dung dịch X. Cho dung dịch KOH vào dung dịch X thu được kết tủa chứa
A. Fe(OH)2 và Al(OH)3
B. Fe(OH)3 và Al(OH)3
C. Fe(OH)3
D. Fe(OH)2
Câu 36: Cho 3 dung dịch A, B, C là dung dịch các chất khác nhau với kết quả thí nghiệm giữa chúng được ghi ở bảng sau (dấu – là không có hiện tượng)
|
|
A |
B |
C |
|
A |
- |
- |
kết tủa trắng |
|
B |
- |
- |
kết tủa trắng |
|
C |
kết tủa trắng |
kết tủa trắng |
- |
Biết dung dịch B là quì tím hóa xanh
Các dung dịch A,B,C lần lượt là
A. Na2SO4, Na2CO3, Ba(OH)2
B. BaCl2, Al2(SO4)3, Ba(NO3)2
C. NaHCO3, Na2SO4, BaCl2
D. Ca(HCO3)2, NaOH, Na2CO3
Câu 37: Cho các phát biểu sau:
(1) Dùng dung dịch Ba(OH)2 để phân biệt hai dung dịch AlCl3 vàNa2SO4
(2) Cho dung dịch NH3 dư vào dung dịch AlCl3 thu được kết tủa
(3) Nhôm là kim loại nhẹ, màu trắng bạc dẫn điện, dẫn nhiệt tốt
(4) Kim loại Al tan được trong dung dịch H2SO4 đặc nguội
(5) Cho Cr vào dung dịch NaOH đặc, nóng có khí H2 thoát ra
(6) Ở nhiệt độ cao NaOH và Al(OH)3 đều không bị phân hủy
Số phát biểu đúng là
A. 1
B. 4
C. 2
D. 3
Câu 38: Hòa tan hoàn toàn 0,5 mol hỗn hợp X chứa Fe, Mg, Fe3O4 và Fe(NO3)2 trong dung dịch chứa 0,08 mol HNO3 và 0,71 mol H2SO4 thu được dung dịch Y chỉ chứa hỗn hợp muối trung hòa có khối lượng X là 62,6 và 3,136 lít hỗn hợp khí Z gồm hai đơn chất khí với tổng khối lượng là 1,58 gam. Cho tiếp dung dịch Ba(OH)2 dư vào dung dịch Y thu được 211,77 gam kết tủa. Phần trăm khối lượng của Fe có trong X là
A. 19,65%
B. 24,96%
C. 33,77%
D. 38,93%
Câu 39: Cho dung dịch A chứa AlCl3 và HCl. Chia dung dịch A thành phần bằng nhau
- Thí nghiệm: Cho phần 1 tác dụng với dung dịch AgNO3 dư thu được 71,75 gam kết tủa
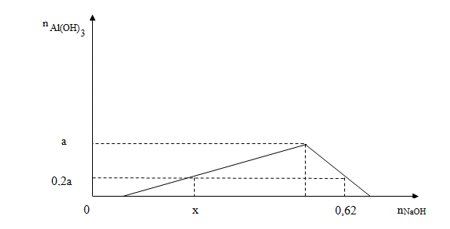
- Thí nghiệm nhỏ từ từ đến dư dung dịch NaOH vào phần 2, kết quả thí nghiệm được biểu diễn trên biểu đồ sau:
Gía trị của x là
A. 0,15
B. 0,09
C. 0,18
D. 0,14
Câu 40: Hòa tan hết 17,4 gam hỗn hợp Fe3O4 và FeCO3 trong dung dịch H2SO4 đặc, nóng dư. Kết thúc phản ứng thu được dung dịch X chứa 36 gam muối và V lít hỗn hợp khí có chứa SO2. Gía trị của V là
A. 2,688
B. 3,36
C. 8,064
D. 2,016
Lời giải chi tiết
Câu 1:
Phương pháp giải
Lý thuyết tính chất hóa học của crom
Hướng dẫn giải chi tiết
Crom tác dụng với HCl loãng, nóng
Đáp án B
Câu 2:
Phương pháp giải
Kim loại mạnh tác dụng với dung dịch muối của kim loại yếu hơn sinh ra muối mói và kim loại mới
Hướng dẫn giải chi tiết
Zn + CuSO4 → ZnSO4 + Cu
Đáp án A
Câu 3:
Phương pháp giải:
Định nghĩa nguyên tắc điều chế kim loại
Hướng dẫn giải chi tiết
Nguyên tắc điều chế kim loại là Khử ion kim loai thành kim loại
Đáp án C
Câu 4:
Hướng dẫn giải chi tiết:
Hàm lượng C có trong gang cao hơn trong thép
Đáp án A
Câu 5:
Hướng dẫn giải chi tiết:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Đáp án A
Câu 6:
Phương pháp giải:
Lý thuyết kim loại kiềm, kiềm thổ
Hướng dẫn giải chi tiết
Các kim loại tác dụng với nước là: Na, Ba
Đáp án C
Câu 7:
(A) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
2Al(OH)3 + 6HCl → 2AlCl3 + 3H2O
(B) 2CO2 + H2O + Ca(OH)2 → Ca(HCO3)2
(D) AlCl3 dư + NaOH → Al(OH)3 + 3NaCl
(C) AlCl3 dư + NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Đáp án D
Câu 8
Đáp án D
Câu 9:
Đáp án B
Câu 10:
Đáp án B
Câu 11:
Đáp án B
Câu 12:
Khí X là khí nhẹ hơn không khí
(A) khí thu được là H2 => thỏa mãn
(B) Khí thu được là Cl2 => loại
(C) khí thu được là SO2 => loại
(D) khí thu được là CO2 => loại
Đáp án A
Câu 13:
Chất chỉ có tính OXH là chất chỉ có khả năng nhận e khi tham gia phản ứng hóa học
Đáp án C
Câu 14:
n H2 = 0,015 mol
=> n X = 2 n H2 = 0,03 mol
MX = 1,17 : 0,03 = 39 (gam/mol)
=> X là K
Đáo án A
Câu 15:
Khi cho 2 chất trên tác dụng với dung dịch NaOH.
Chất tác dụng với NaOH cho xuất hiện kết tủa trắng là Mg(NO3)2
Chất còn lại là KNO3
Đáp án B
Câu 16:
(A) Fe2O3
(B) Fe3O4
(C) Na3AlF6
(D) Al2O3
Đáp án D
Câu 17:
Đáp án B
Câu 18:
n NO2 = 0,15 mol
Áp dụng định luật bảo toàn electron
=> 3n Fe = n NO2
=> n Fe = 0,05 mol
m Fe = 0,05 . 56 = 2,8 gam
Đáp án B
Câu 19:
Đáp án C
Câu 20:
Đáp án D
Câu 21:
Fe bị ăn mòn trước
=> Fe đóng vai trò là cực âm
=> Kim loại Fe phải kết hợp với KL yếu hơn hoặc phi kim
=> Các hợp kim thỏa mãn là: Cu – Fe; Fe – C; Sn – Fe.
Đáp án C
Câu 22:
Đáp án C
Câu 23:
Kim loại Ca được điều chế bằng điện phân nóng chảy CaCl2
Đáp án D
Câu 24:
Đáp án A
Câu 25:
\(\left\{ \begin{array}{l}FeO\\MgO\\CuO\end{array} \right. + {H_2} \to \left\{ \begin{array}{l}Fe\\MgO\\Cu\end{array} \right. + HCl \to \left\{ \begin{array}{l}FeC{l_2}\\MgC{l_2}\\Cu\end{array} \right.\)
=> Y tan một phần và có hiện tượng sủi bọt khí
Đáp án D
Câu 26:
Đáp án B
Câu 27
Đáp án C
Câu 28:
2Fe + 3Cl2 → 2FeCl3
Đáp án A
Câu 29:
2NaCl + H2O → NaOH + Cl2 + H2
=> Dung dịch từ không màu chuyển sang màu hồng
Đáp án C
Câu 30:
n Al(OH)3 = 0,1 mol
n AlCl3 = 0,2 . 1,5 = 0,3 mol
=> Trong trường hợp lượng NaOH phản ứng là lớn nhất
=> Lượng NaAlO2 có trong dung dịch là 0,2 mol
=> n NaOH phản ứng
= 3n Al(OH)3 + 4 n NaAlO2 = 0,1 . 3 + 0,2 . 4 = 1,1 mol
=> V NaOH = 1,1 : 0,5 = 2,2 lít
Đáp án D
Câu 31:
Khi cho a mol Al vào 2,5 mol NaOH
=> n NaAlO2 = a mol; n NaOH = 1,5 a mol
A sai, quì tím sẽ chuyển sang màu xanh
B sai, kết tủa sẽ tan hết
C sai, NaOH vẫn phản ứng được với MgCl2
D đúng, kết tủa thu được là Al(OH)3
Đáp án D
Câu 32:
n CaCO3 = 20 : 100 = 0,2 mol (1)
n Ca(HCO3)2 = n CaCO3 thu được sau khi nung nóng = 5 : 100 = 0,05 mol (2)
=> n CO2 = n CaCO3 (1) + 2 n Ca(HCO3)2
= 0,2 + 0,05 . 2 = 0,3 mol
=> V CO2 = 0,3 . 22,4 = 6,72 lít
Đáp án D
Câu 33:
Các chất tác dụng được với H2SO4 loãng là: Fe3O4, Na2CO3, Fe(OH)3
Đáp án A
Câu 34:
n Ba = 0,1 mol
Khối lượng kết tủa tạo thành sau phản ứng là:
13,7 + 10,59 – 0,2 = 24,09 gam
Giả sử sau phản ứng, kết tủa gồm có BaSO4, Al(OH)3
Gọi n Al2(SO4)3 là x
=> Dung dịch sau phản ứng gồm có:
Ba2+ : 0,1 – 3x
AlO2- : 0,2 – 6x
=> n Al(OH)3 tạo thành là: 2x – (0,2 – 6x) = 8x – 0,2
=> Khối lượng kết tủa thu được sau phản ứng được tính là:
m BaSO4 + m Al(OH)3
= (0,1 – 3x) . 233 + (8x – 0,2 ). 78 = 24,09
=> x = 0,03 mol
CM Al2(SO4)3 = 0,1 M
Đáp án D
Câu 35:
\(\left\{ \begin{array}{l}Fe{(N{O_3})_2}\\A{l_2}{O_3}\end{array} \right. + {H_2}S{O_4}(l) \to \left\{ \begin{array}{l}F{e^{3 + }}\\A{l^{3 + }}\end{array} \right. + KOH(d) \to Fe{(OH)_3}\).
Đáp án C
Câu 36:
Đáp án A
Câu 37:
(1) đúng AlCl3 xuất hiện kết tủa, sau kết tủa tan; Na2SO4 xuất hiện kết tủa trắng
(2) đúng
(3) đúng
(4) sai
(5) sai
(6) sai
Đáp án D
Câu 38:
Theo đề bài, hỗn hợp Z gồm 2 đơn chất
=> 2 khí là H2 và N2
n Z = 0,14
m Z = 1,58
=> Ta có hệ phương trình:
2x + 28y = 1,58
x + y = 0,14
=> x = 0,05 ; y = 0,09
Áp dụng định luật bảo toàn khối lượng ta có:
m X + m HNO3 + m H2SO4 = m Muối + m Z + m H2O
m Muối – m X = 62,6
=> m H2O = 10,44 gam
n H2O = 10,44 : 18 = 0,58 mol
Áp dụng định luật bảo toàn H
=> n NH4+ = (n HNO3 + 2 n H2SO4 – 2n H2O) : 4 = 0,04 mol
Áp dụng định luật bảo toàn N ta có:
n Fe(NO3)2 = (n NH4+ + 2 n N2 – n HNO3) : 2 = 0,03 mol
Mặt khác ta có:
n H+ = 0,08 + 0,71 . 2
= 12 . N2 + 10 NH4+ + 2 n H2 + 2 n O
=> n O = 0,16
=> n Fe3O4 = 0,04 mol
Đặt u,v là số mol của Fe, Mg có trong X
n X = u + v + 0,04 + 0,03 = 0,5
n Ba(OH)2 = n H2SO4 = 0,71
=> n OH- trong kết tủa = 0,71 . 2 – n NH4+ = 1,38
=> Khối lượng kết tủa là:
56 (u + 0,03 + 0,04 . 3) + 24v + 1,38 . 17 + 233 . 0,71 = 211,77
=> u = 0,13 và v = 0,3
%Fe = 24,96%
Đáp án B
Câu 39:
Gọi a, b là số mol của AlCl3 ; HCl trong mỗi phần
Xét phần 1
=> n AgCl = 0,5 mol
=> 3a + b = 0,5 (I)
Xét phần 2
n OH- = x = b + 0,2a . 3 (II)
n OH- = 0,62 = b + 4a – 0,2a (III)
Từ (I), (II) và (III)
=> a = 0,15 ; b = 0,05 ; x = 0,14
Đáp án D
Câu 40:
n Fe2(SO4)3 = 36 : 400 = 0,09 mol
Gọi n Fe3O4, n FeCO3 lần lượt là x,y mol
=> Ta có hệ phương trình:
232x + 116y = 174,
3x + y = 0,09 . 2
=> x = 0,03 ; y = 0,09
=> n CO2 = n FeCO3 = 0,09 mol
n SO2 = ½ (n Fe3O4 + n FeCO3) = (0,09 + 0,03) : 2 = 0,06 mol
=> V = (n CO2 + n SO2) . 22,4 = 0,15 . 22,4 = 3,36 lít
Đáp án B
Loigiaihay.com
- Giải đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có lời giải
- Giải đề thi hết học kì II Hóa 12 năm học 2019 - 2020 trường THPT Nghĩa Dân - Hưng Yên
- Giải đề thi hết học kì II Hóa 12 năm học 2016 - 2017 sở GDĐT Khánh Hòa có lời giải
- Giải đề thi học kì II năm học 2019 - 2020 sở GD - ĐT Hà Nam
- Giải đề thi hết học kì II Hóa 12 năm học 2020 - 2021 THPT Lương Thế Vinh Hải Dương có lời giải
>> Xem thêm
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết












Danh sách bình luận