 Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi hết học kì II năm học 2017 - 2018 sở GDDT Nam Định có lời giải
Đề thi hết học kì II năm học 2017 - 2018 sở GDDT Nam Định có đáp án và lời giải chi tiết
Đề bài
Câu 41 : Nhiệt phân hoàn toàn muối X thu được kim loại và hỗn hợp khí. Muối X là
A. Fe(NO3)2.
B. AgNO3.
C. KNO3
D. Al(NO3)3.
Câu 42 : Hiđrocacbon nào sau đây không làm mất màu dung dịch brom ở nhiệt độ thường?
A. Metan.
B. Etilen.
C. Axetilen.
D. Buta-1,3-đien.
Câu 43 : Thực hiện phản ứng hiđro hóa CH3CHO (xúc tác Ni, to) thu được sản phẩm hữu cơ nào sau đây?
A. CH3COOH.
B. CH3OH.
C. C2H5OH
D. CH3COONH4.
Câu 44 : Thủy phân este X có công thức phân tử C4H8O2 trong dung dịch NaOH đun nóng, sản phẩm thu được có chứa natri fomat. Số công thức cấu tạo thỏa mãn điều kiện của X là
A. 4.
B. 3.
C. 1.
D. 2.
Câu 45 : Cho hình vẽ mô tả thí nghiệm điều chế khí Z từ dung dịch X và chất rắn Y:
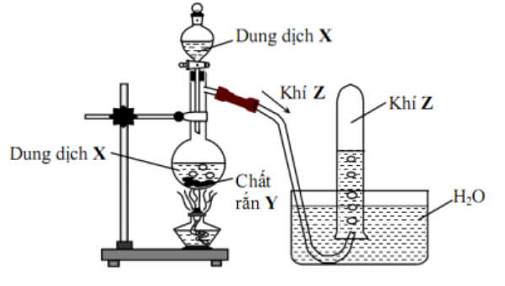
Khí Z được tạo ra từ phản ứng hóa học nào sau đây?
A. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
B. NH4Cl + NaOH → NH3 + NaCl + H2O
C. H2SO4 + Na2SO3 → SO2 + Na2SO4 + H2O
D. CH3COONa + NaOH → Na2CO3 + CH4
Câu 46 : Kim loại có khối lượng riêng nhỏ nhất, là vật liệu quan trọng trong việc sản xuất anot của pin điện là
A. Hg.
B. Cs.
C. Al.
D. Li.
Câu 47 : Phản ứng hóa học xảy ra trong quá trình tạo thạch nhũ trong các hang động đá vôi là
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. Ca(OH)2 + CO2 → CaCO3 + H2O
C. Ca(HCO3)2 → CaCO3 + CO2 + H2O
D. Ca(OH)2 + 2CO2 → Ca(HCO3)2
Câu 48 : Quặng manhetit là loại quặng giàu sắt nhưng hiếm gặp trong tự nhiên. Thành phần chính của quặng manhetit là:
A. Fe2O3
B. Fe3O4
C. FeS2
D. FeCO3
Câu 49 :Thí nghiệm nào sau đây không xảy ra phản ứng hóa học?
A. Cho kim loại Fe vào dung dịch HCl (to).
B. Cho Cr(OH)3 vào dung dịch KOH loãng.
C. Cho Zn vào dung dịch Cr2(SO4)3.
D. Cho Fe vào dung dịch HNO3 đặc, nguội.
Câu 50 : Chất nào sau đây là chất điện li mạnh?
A. C2H5OH (ancol etylic).
B. CH3COOH (axit axetic).
C. Al(OH)3.
D. HNO3.
Câu 51: Amin X chứa vòng benzen có công thức phân tử: C6H7N. Danh pháp nào sau đây không phải của amin X?
A. Anilin.
B. Phenylamin.
C. Benzenamin.
D. Benzylamin
Câu 52 : Trong các dung dịch: HOOC-CH2-CH2-CH(NH2)-COOH (1); H2N-CH2-COOH (2);
C6H5-NH2 (anilin) (3); H2N-CH2-CH(NH2)-COOH (4), CH3-CH2-NH2 (5). Số dung dịch làm xanh quỳ tím là
A. 2
B. 3
C. 1
D. 4
Câu 53 : Pentapeptit X mạch hở, được tạo nên từ một loại amino axit Y (trong Y chỉ chứa một nhóm amino và một nhóm cacboxyl). Phân tử khối của X là 513. Phân tử khối của Y là:
A. 57
B. 89
C. 75
D. 117
Câu 54 : Cho các chất: Si, NH4NO3, Al, CO2, CO, H3PO4. Số chất phản ứng được với dung dịch NaOH loãng khi đun nóng là:
A. 3
B. 4
C. 5
D. 6
Câu 55 : Chất nào không phải là polime:
A. Chất béo
B. Xenlulozơ
C. PVC
D. Polibuta-1,3-đien
Câu 56 : Nhận định nào sau đây đúng?
A. Số nguyên tử C, H, O trong phân tử chất béo đều là số nguyên, chẵn.
B. Nhiệt độ nóng chảy của tristearin cao hơn nhiệt độ nóng chảy của triolein.
C. Phản ứng thủy phân chất béo trong môi trường kiềm là phản ứng thuận nghịch.
D. Dầu ăn và dầu nhớt động cơ có cùng thành phần nguyên tố.
Câu 57 : Thủy phân hoàn toàn m gam metyl fomat bằng 74 ml dung dịch NaOH 1M dư, đun nóng. Cô cạn dung dịch sau phản ứng thu được 4,08 gam rắn khan. Giá trị của m là:
A. 2,4
B. 3,6
C. 3,0
D. 6,0
Câu 58 : Nhúng một lá Zn vào 200 ml dung dịch CuSO4 nồng độ x (mol/l) đến khi dung dịch mất màu hoàn toàn thấy khối lượng lá Zn giảm 0,15 gam so với ban đầu (coi kim loại tạo thành bán hết vào lá kẽm). Giá trị của x là:
A. 0,75
B. 0,25
C. 0,35
D. 0,30
Câu 59 : Glucozơ và xenlulozơ có cùng đặc điểm nào sau đây?
A. Là các chất rắn, dễ tan trong nước
B. Tham gia phản ứng tráng bạc
C. Bị thủy phân trong môi trường axit
D. Trong phân tử có nhiều nhóm hiđroxyl (-OH)
Câu 60 : Hòa tan hoàn toàn m gam hỗn hợp Na và Ba vào nước thu được dung dịch X và 4,48 lít H2 (đktc). Để trung hòa X cần vừa đủ 400ml dung dịch H2SO4 xM. Giá trị của x là
A. 0,5
B. 1,0
C. 0,8
D. 0,4
Câu 61 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Mg trong 500 ml dung dịch HNO3 1M thu được dung dịch Y và khí NO. Cho từ từ dung dịch NaOH vào dung dịch Y, lượng kết tủa tạo thành được biểu diễn theo đồ thị sau:
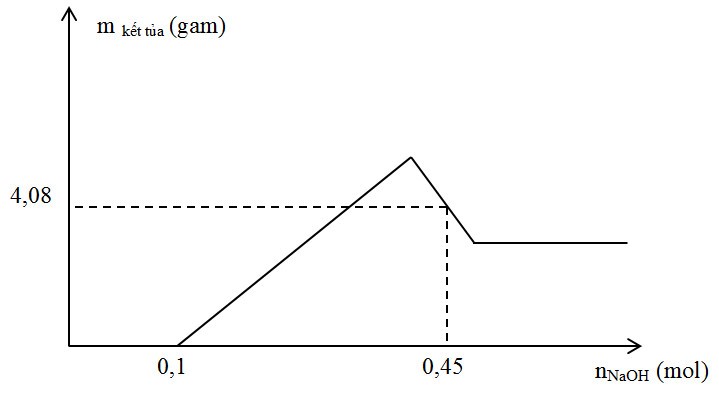
Giá trị của m là
A. 3,06.
B. 3,24.
C. 2,88.
D. 2,79.
Câu 62 : Cho các phát biểu sau:
(a) Các kim loại Na, K, Ba đều phản ứng mạnh với nước.
(b) Kim loại Cu tác dụng được với dung dịch hỗn hợp NaNO3 và H2SO4 (loãng).
(c) Cho lá sắt vào dung dịch CuSO4 xảy ra hiện tượng ăn mòn điện hóa.
(d) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa ba muối.
(e) Hỗn hợp Al2O3 và Na (tỉ lệ mol tương ứng 1:1) tan hoàn toàn trong nước dư.
(f) Lưu huỳnh, photpho, ancol etylic đều bốc cháy khi tiếp xúc với CrO3.
Số phát biểu đúng là
A. 4
B. 5
C. 3
D. 6
Câu 63 : Cho sơ đồ phản ứng sau:
\(2{{C}_{2}}{{H}_{4}}+\text{ }{{O}_{2}}~\xrightarrow{{{t}^{0}},xt}2C{{H}_{3}}CHO\)
Biết Y, Z, T đều là hợp chất của crom. Các chất X, T lần lượt là:
A. Fe2(SO4)3 và CrCl3
B. Fe2(SO4)3 và K2CrO4
C. FeSO4 và K2Cr2O7
D. FeSO4 và K2CrO4
Câu 64 : Cho các phát biểu sau:
(1) Có thể phân biệt axit fomic và anđehit fomic bằng phản ứng với dung dịch AgNO3/NH3.
(2) Tất cả các peptit đều phản ứng với Cu(OH)2 tạo dung dịch màu tím.
(3) Amilozơ và amilopectin là đồng phân của nhau.
(4) Điều chế anđehit axetic trong công nghiệp bằng phản ứng oxi hóa etilen.
(5) Glucozơ và fructozơ đều làm mất màu dung dịch nước Br2.
(6) Tách H2O từ etanol dùng điều chế etilen trong công nghiệp.
Số phát biểu đúng là:
A. 3
B. 2
C. 1
D. 5
Câu 65 : Cho sơ đồ biến hóa: (muối)
Phát biểu nào sau đây không đúng:
A. Từ axetanđehit điều chế trực tiếp ra X và Y.
B. Nhiệt độ sôi của Y lớn hơn nhiệt độ sôi của X.
C. Trong sơ đồ trên có 1 phản ứng sản phẩm có H2O.
D. Muối Z có đồng phân là amino axit.
Câu 66 : Phát biểu nào sau đây không đúng?
A. Các kim loại Al, Cr, Fe đều bị thụ động trong dung dịch HNO3 đặc nguội.
B. Trong công nghiệp, các kim loại Al, Cu, Zn đều được điều chế bằng phương pháp điện phân dung dịch muối của chúng.
C. Các kim loại Al, Fe, Cr khi phản ứng với khí clo đều thu được muối có công thức dạng RCl3.
D. Các kim loại Fe, Cu, Mg đều có thể tan hoàn toàn trong dung dịch FeCl3 dư.
Câu 67 : Cho các dung dịch: CH3COOH, C2H4(OH)2, saccarozơ, C2H5OH; anbumin. Số dung dịch phản ứng được với Cu(OH)2 là
A. 2
B. 6
C. 4
D. 3
Câu 68 : Hòa tan hoàn toàn m gam Cu trong dung dịch HNO3 dư thu được dung dịch X không chứa muối amoni và 4,48 lít hỗn hợp khí Y gồm NO và NO2 (đktc), tỉ khối của Y so với H2 là 17. Giá trị của m là
A. 12,8
B. 9,6
C. 32,0
D. 16,0
Câu 69 : Trạng thái, nhiệt độ nóng chảy, nhiệt độ sôi và độ tan trong nước của ba chất hữu cơ X, Y, Z được trình bày trong bảng sau:
|
|
Trạng thái (ở điều kiện thường) |
Nhiệt độ sôi (oC) |
Nhiệt độ nóng chảy (oC) |
Độ tan trong nước (g/100 ml) |
|
|
20oC |
90oC |
||||
|
X |
Rắn |
181,7 |
43 |
8,3 |
∞ |
|
Y |
Lỏng |
184,1 |
-6,3 |
3,0 |
6,4 |
|
Z |
Lỏng |
78,37 |
-114 |
∞ |
∞ |
X, Y, Z tương ứng là chất nào sau đây:
A. Phenol, ancol etylic, anilin
B. Phenol, anilin, ancol etylic
C. Anilin, phenol, ancol etylic
D. Ancol etylic, anilin, phenol
Câu 70 : Cho các thí nghiệm sau:
(1) Trộn dung dịch NaHCO3 dư với dung dịch Ba(OH)2.
(2) Sục khí CO2 dư vào dung dịch bari aluminat Ba(AlO2)2.
(3) Cho NaOH dư vào dung dịch CrCl3.
(4) Cho Ba(OH)2 dư vào dung dịch Al2(SO4)3.
Số thí nghiệm thu được kết tủa sau khi kết thúc là:
A. 1
B. 2
C. 3
D. 4
Câu 71 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 500ml dung dịch chứa hỗn hợp NaOH 0,3M và Ba(OH)2 0,1M thu được dung dịch Y và 3,36 lít H2 (đktc). Cho dung dịch Y phản ứng với 500 ml dung dịch Z chứa HCl 0,64M và H2SO4 0,08M thu được 21,02 gam kết tủa. Nếu cho dung dịch Y phản ứng với V lít dung dịch Z thì thu được kết tủa lớn nhất có khối lượng a gam. Giá trị của a là:
A. 20,750
B. 21,425
C. 31,150
D. 21,800
Câu 72 : Hỗn hợp gồm hexametylenđiamin, anilin, alanin và lysin (trong đó nguyên tố nitơ chiếm 20,22% khối lượng). Trung hòa m gam X bằng dung dịch H2SO4 vừa đủ, thu được 201,0 gam hỗn hợp muối. Giá trị của m là
A. 127,40
B. 83,22
C. 65,53
D. 117,70
Câu 73 : Hỗn hợp X gồm 4 chất hữu cơ đều có cùng công thức phân tử C2H8O3N2. Cho một lượng X phản ứng vừa đủ với V ml dung dịch NaOH 0,5M và đun nóng, thu được dung dịch Y chỉ gồm các chất vô cơ và 6,72 lít (đktc) hỗn hợp Z gồm 3 amin. Cô cạn toàn bộ dung dịch Y thu được 29,28 gam hỗn hợp muối khan. Giá trị của V là
A. 420
B. 480
C. 960
D. 840
Câu 74 : Chất hữu cơ Xcó công thức phân tử C4H6O4 không có khả năng tham gia phản ứng tráng bạc. Cho a mol X phản ứng với dung dịch KOH dư, thu được ancol Y và m gam một muối. Đốt cháy hoàn toàn một lượng ancol Y thu được 0,2 mol CO2 và 0,3 mol H2O. Giá trị của a và m lần lượt là
A. 0,1 và 16,6
B. 0,12 và 24,4
C. 0,2 và 16,8
D. 0,05 và 6,7
Câu 75 : Tiến hành điện phân (điện cực trơ, màng ngăn) một dung dịch hỗn hợp RSO4 0,3M và KCl 0,2M với cường độ dòng điện I = 0,5A sau thời gian t giây thu được kim loại ở catot và 1,344 lít (đktc) hỗn hợp khí ở anot. Sau thời gian 3t giây thu được hỗn hợp khí có thể tích là 4,256 lít (đktc) hỗn hợp khí. Biết hiệu suất phản ứng 100%, R có hóa trị không đổi. Giá trị của t là
A. 23160
B. 27020
C. 19300
D. 28950
Câu 76 : Thủy phân hoàn toàn một este E trong 500ml dung dịch NaOH 3M, cô cạn dung dịch sau phản ứng thu được 135,6 gam chất rắn và m gam hơi một ancol no, đơn chức, mạch hở X. Oxi hóa m gam ancol X thu được hỗn hợp Y gồm anđehit, axit, ancol dư và nước. Chia hỗn hợp thành 3 phần bằng nhau:
Phần 1: Cho vào dung dịch AgNO3/NH3 dư thu được 54 gam Ag.
Phần 2: Cho phản ứng vừa đủ với dung dịch nước brom thu được 3,36 lít khí Z (đktc) duy nhất.
Phần 3: Cho tác dụng với Na dư thu được 5,6 lít khí H2 (đktc)
Công thức cấu tạo của E là
A. CH3CH2COOCH3
B. CH2 =CHCOOCH3
C. CH3COOCH2CH3
D. C2H3COOC2H5
Câu 77 : E là hỗn hợp 3 peptit X, Y, Z. Thủy phân hoàn toàn 37 gam E cần dùng 450 ml dung dịch KOH 1M, sau phản ứng hoàn toàn cô cạn thu được hỗn hợp M gồm 3 muối kali của Gly, Ala và Lys với số mol tương ứng là x, y, z. Nếu đốt cháy hoàn toàn một lượng hỗn hợp peptit E thu được số mol CO2 và H2O bằng nhau. Nếu đốt cháy hỗn hợp gồm a mol muối kali của Gly và b mol muối kali của Ala (a.y = b.x) được 99 gam CO2 và 49,5 gam H2O. Phần trăm khối lượng muối của kali của Ala trong hỗn hợp muối M gần nhất với giá trị nào sau đây?
A. 65%
B. 75%
C. 45%
D. 25%
Câu 78 : Hỗn hợp P gồm 2 axit đa chức X, Y có số mol bằng nhau và axit đơn chức Z (X, Y, Z đều mạch hở, không phân nhánh và có số nguyên tử C không lớn hơn 4; MX < MY). Trung hòa m gam hỗn hợp P cần vừa đủ 510 ml dung dịch NaOH 1M. Đốt cháy hoàn toàn m gam P thu được CO2 và 7,02 gam H2O. Còn nếu cho m gam P tác dụng với AgNO3/NH3 dư thì thu được 52,38 gam kết tủa. Nhận định nào sau đây đúng?
A. Phần trăm khối lượng X trong P bằng 17,34%.
B. X, Y, Z đều là các axit no.
C. Số nguyên tử C trong phân tử Z, X, Y tương ứng tăng dần.
D. Thực hiện phản ứng este hóa 2m gam hỗn hợp P với metanol dư (xúc tác H2SO4 đặc, đun nóng) thu được 56,76 gam hỗn hợp các este (Giả sử các phản ứng este hóa đều đạt hiệu suất 100%).
Câu 79 : Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3 và Cu (trong đó FeO chiếm 1/5 tổng số mol hỗn hợp X) trong dung dịch HCl thu được dung dịch Z chỉ chứa 20,71 gam hỗn hợp 3 muối clorua. Mặt khác, hòa tan hoàn toàn m gam hỗn hợp X trên trong dung dịch chứa KNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,448 lít khí NO (đktc, sản phẩm khử duy nhất của N+5). Trộn dung dịch Y với dung dịch Z thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào T thu được 119,86 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
A. 11,4
B. 14,9
C. 13,6
D. 12,8
Câu 80 : Cho 19,55 gam hỗn hợp X gồm Zn, ZnO, Mg, MgCO3 vào dung dịch chứa 108,8 gam KHSO4 và 9,45 gam HNO3 đến phản ứng hoàn toàn thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 125,75 gam và 2,24 lít (đktc) hỗn hợp khí Z gồm hai khí, tỉ khối của Z so với H2 bằng 22. Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 10 gam chất rắn khan. Phần trăm khối lượng của Zn có trong hỗn hợp X là
A. 26,60%
B. 33,25%
C. 19,95%
D. 16,62%
\(2{{C}_{2}}{{H}_{4}}+\text{ }{{O}_{2}}~\xrightarrow{{{t}^{0}},xt}2C{{H}_{3}}CHO\)
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
|
41.B |
45.A |
49.D |
53.D |
57.A |
61.C |
65.D |
69.B |
73.C |
77.A |
|
42.A |
46.D |
50.D |
54.C |
58.A |
62.B |
66.B |
70.C |
74.A |
78.A |
|
43.C |
47.C |
51.D |
55.A |
59.D |
63.D |
67.C |
71.B |
75.B |
79.A |
|
44.D |
48.B |
52.A |
56.B |
60.A |
64.C |
68.D |
72.D |
76.A |
80.B |
Câu 41:
Muối X là AgNO3. Phản ứng nhiệt phân:
AgNO3 \(\xrightarrow{{{t}^{0}}}\) Ag + NO2 + ½ O2
Đáp án B
Câu 42:
Hiđrocacbon no không tác dụng với dung dịch brom nên metan không làm mất màu dung dịch brom ở nhiệt độ thường.
Đáp án A
Câu 43:
CH3-CH =O + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) CH3-CH2-OH
Đáp án C
Câu 44:
Thủy phân este X có công thức phân tử C4H8O2 trong dung dịch NaOH đun nóng, sản phẩm thu được có chứa natri fomat nên X phải có dạng HCOOR.
Vậy các công thức este X là HCOOCH2CH2CH3, HCOOCH(CH3)2 (có 2 công thức cấu tạo thỏa mãn).
Đáp án D
Câu 45:
Khí Z thu được bằng phương pháp đẩy nước nên khí Z không tan hoặc ít tan trong nước.
Vậy khí Z là CO2 hoặc CH4.
Do điều chế khí Z từ dung dịch X và chất rắn Y nên dung dịch X là HCl và chất rắn Y là CaCO3.
Khí Z là CO2.
Đáp án A
Câu 46:
Kim loại có khối lượng riêng nhỏ nhất, là vật liệu quan trọng trong việc sản xuất anot của pin điện là Li.
Đáp án D
Câu 47:
Phản ứng hóa học xảy ra trong quá trình tạo thạch nhũ trong các hang động đá vôi là
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Đáp án C
Câu 48:
Fe2O3: thành phần chính của quặng hematit đỏ và hematit nâu
FeS2: thành phần chính của quặng pirit
Fe3O4: thành phần chính của quặng manhetit
FeCO3: thành phần chính của quặng xiderit
Vậy thành phần chính của quặng manhetit là Fe3O4.
Đáp án B
Câu 49:
A. Fe + 2HCl → FeCl2 + H2
B. Cr(OH)3+ KOH → KCrO2 + 2H2O
C. Zn + Cr2(SO4)3 → ZnSO4 + 2CrSO4
Fe không tác dụng với dung dịch HNO3 đặc nguội do bị thụ động hóa trong axit này.
Đáp án D
Câu 50:
Chất không phải là chất điện li: ancol etylic.
Chất điện li yếu: axit axetic, Al(OH)3.
Chất điện li mạnh là HNO3.
Đáp án D
Câu 51:
Amin X chứa vòng benzen có công thức phân tử: C6H7N có công thức cấu tạo là C6H5NH2 có tên là anilin hoặc phenylamin hoặc benzenamin. Amin X không có tên benzylamin.
Đáp án D
Câu 52:
(1) làm quỳ chuyển hồng
(2) không làm quỳ chuyển màu
(3) không làm quỳ chuyển màu
(4) làm quỳ chuyển xanh
(5) làm quỳ chuyển xanh
Vậy có 2 chất làm quỳ tím chuyển xanh
Đáp án A
Câu 53:
Phương trình tạo thành pentapeptit X từ amino axit Y là:
5Y → X + 4H2O
Đặt npentapeptit X = 1 mol suy ra nH2O = 4 mol; nY = 5 mol
Áp dụng định luật bảo toàn khối lượng ta có: mY = mX + mH2O
=> MY. 5 = 513. 1 + 18.4 → MY = 117
Đáp án D
Câu 54:
Các chất phản ứng được với dung dịch NaOH loãng khi đun nóng là: Si, NH4NO3, Al, CO2, H3PO4 (có 5 chất)
Đáp án C
Câu 55:
Chất béo không phải là polime.
Đáp án A
Câu 56:
Nhận định A là sai vì số nguyên tử C trong phân tử chất béo là số lẻ.
Nhận định B đúng.
Nhận định C là sai vì phản ứng thủy phân chất béo trong môi trường kiềm là phản ứng một chiều.
Nhận định D là sai vì dầu ăn là chất béo (chứa C, H, O) còn dầu nhớt động cơ là hidrocacbon (chứa C, H).
Đáp án B
Câu 57:
Ta có: nNaOH = 0,074 mol; nHCOOCH3 = m/60 mol
HCOOCH3+ NaOH→ HCOONa + CH3OH
Áp dụng bảo toàn khối lượng ta có: m + mNaOH = m chất rắn + mCH3OH
=> m + 0,074.40 = 4,08 + 32.m/60 suy ra m = 2,4 gam
Đáp án A
Câu 58:
Zn + CuSO4 → ZnSO4 + Cu
Đặt nZn pứ = a mol → nCu = a mol
Sau khi dung dịch CuSO4 mất màu hoàn toàn thì CuSO4 phản ứng hết.
→ Khối lượng lá Zn giảm là mchất rắn giảm = mZn pứ - mCu sinh ra = 65a - 64a = a = 0,15
→ x = CM CuSO4 = n/Vdd = 0,15: 0,2 = 0,75M
Đáp án A
Glucozơ và xenlulozơ có cùng đặc điểm trong phân tử có nhiều nhóm hiđroxyl (-OH)
Đáp án D
Câu 60:
Ta có: nOH- = 2.nH2 = 2.0,2 = 0,4 mol
OH- + H+ → H2O
Do phản ứng trung hòa nên nOH- = nH+ => 0,4 = 2.0,4.x => x = 0,5M
Đáp án A
Câu 61:
Phương pháp:
Khi nOH- = 0,1 mol thì kết tủa mới xuất hiện nên nH+ dư = 0,1 mol → nH+ pứ = 0,4 mol → nNO
Khi nOH- = 0,45 mol thì 4,08 gam kết tủa thu được gồm Mg(OH)2 và Al(OH)3
Lập hệ phương trình theo định luật bảo toàn electron và khối lượng kết tủa để tìm số mol Mg và Al. Từ đó tính được m.
Hướng dẫn giải:
Khi nOH- = 0,1 mol thì kết tủa mới xuất hiện nên nH+ dư = 0,1 mol → nH+ pứ = 0,4 mol
→ nNO = 0,1 mol
Đặt a, b là số mol Al và Mg
Áp dụng bảo toàn electron ta có: 3.nAl + 2.nMg = 3.nNO suy ra 3a + 2b = 3.0,1 (1)
Khi nOH- = 0,45 mol thì kết tủa thu được gồm Mg(OH)2 b mol; Al(OH)3 (4,08-58b)/78 mol
Suy ra 0,45 = 0,1 + 2b + 4a - (4,08-58b)/78 (2)
Giải hệ (1) và (2) ta có a = 0,08 và b = 0,03
Suy ra m = 2,88 gam
Đáp án C
Câu 62:
Các phát biểu đúng là (a), (b), (c), (d) và (f) (5 phát biểu đúng).
Phát biểu (e) sai vì: Đặt nNa = nAl2O3 = 1 mol
Na + H2O → NaOH + ½ H2
1 1 mol
Al2O3 + 2NaOH → 2NaAlO2+ H2O
1 1 mol
Ta có: Al2O3 dư nên hỗn hợp Al2O3 và Na không tan hoàn toàn trong nước dư.
Đáp án B
Câu 63:
Fe + H2SO4 → FeSO4 (X) + H2
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 (Y) + K2SO4 + 7H2O
Cr2(SO4)3 + 8KOH dư → 3K2SO4 + 2 KCrO2 (Z) + 4H2O
2KCrO2 + 3Cl2 + 8KOH → 2 K2CrO4 (T) + 6KCl + 4H2O
Vậy X là FeSO4 và T là K2CrO4.
Đáp án D
Câu 64:
Phát biểu (1) sai vì cả axit fomic và anđehit fomic đều có phản ứng với dung dịch AgNO3/NH3 tạo thành kết tủa Ag.
Phát biểu (2) sai vì chỉ có tripeptit trở lên mới phản ứng với Cu(OH)2 tạo dung dịch màu tím.
Phát biểu (3) sai vì amilozơ và amilopectin không là đồng phân của nhau (số lượng mắt xích khác nhau).
Phát biểu (4) đúng vì 2C2H4 + O2 2CH3CHO
Phát biểu (5) sai vì chỉ có glucozơ làm mất màu dung dịch nước Br2.
Phát biểu (6) sai vì tách H2O từ etanol dùng điều chế etilen trong phòng thí nghiệm.
Vậy chỉ có 1 phát biểu đúng.
Đáp án C
Câu 65:
C2H4 + H2O \(\xrightarrow{{{t}^{0}},xt}\) C2H5OH (X)
C2H5OH + O2\(\xrightarrow{{{t}^{0}},xt}\) CH3COOH (Y) + H2O
CH3COOH + CH3NH2 → CH3COONH3CH3 (Z)
Phát biểu a, b, c đúng
Phát biểu d sai
Đáp án D
Câu 66:
Phương pháp:
Dựa vào tính chất của các kim loại để tìm phát biểu không đúng.
Hướng dẫn giải:
Phát biểu B sai vì Al không được điều chế bằng phương pháp điện phân dung dịch muối của nó được. Al chỉ được điều chế bằng điện phân nóng chảy Al2O3.
Đáp án B
Câu 67:
Phương pháp:
Dựa vào tính chất hóa học của các chất để kết luận.
Hướng dẫn giải:
Các dung dịch phản ứng được với Cu(OH)2 là CH3COOH, C2H4(OH)2, saccarozơ, anbumin. Vậy có 4 chất.
Đáp án C
Câu 68:
Phương pháp:
Bảo toàn electron
Hướng dẫn giải:
Đặt số mol NO là a mol; số mol NO2 là b mol
Suy ra a + b = 0,2 mol; 30a + 46b = 0,2.17.2 = 6,8 gam
Giải hệ trên ta có a = 0,15 và b = 0,05
Quá trình cho e:
Cu → Cu2++ 2e
Quá trình nhận e:
N+5 + 3e → N+2
N+5 + 1e → N+4
Áp dụng định luật bảo toàn e: 2.nCu = 3.nNO + 1.nNO2 → nCu = (3.nNO+ nNO2): 2 = 0,25 mol
Suy ra m = 0,25.64 = 16 gam
Đáp án D
Câu 69:
Phương pháp:
Dựa vào trạng thái, nhiệt độ sôi, nhiệt độ nóng chảy và độ tan trong nước của các chất để kết luận các chất X, Y, Z.
Hướng dẫn giải:
Z là chất lỏng ở điều kiện thường, tan vô hạn trong nước nên Z là ancol etylic.
X là chất rắn ở điều kiện thường, tan ít trong nước lạnh, tan nhiều trong nước nóng nên X là phenol.
Còn lại Y là anilin.
Đáp án B
Câu 70:
(1) 2NaHCO3 + Ba(OH)2→ BaCO3↓ + Na2CO3+ 2H2O
(2) CO2 + Ba(AlO2)2+ H2O → Al(OH)3↓+ Ba(HCO3)2
(3) 4NaOH dư+ CrCl3 → NaCrO2+ 3NaCl + 2H2O
(4) Al3+ + 3OH- → Al(OH)3
Al(OH)3+ OH- → AlO2-+ 2H2O
Ba2++ SO42- → BaSO4↓
Vậy các thí nghiệm thu được kết tủa sau phản ứng là (1), (2), (4) . Có 3 thí nghiệm.
Đáp án C
Câu 71:
Phương pháp:
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Xét 2 trường hợp:
Nếu Al(OH)3 chưa bị hòa tan
Nếu Al(OH)3 đã bị hòa tan
Lập hệ phương trình tìm u và v.
Xét 2 trường hợp:
Khi Al(OH)3 max
Khi BaSO4 max
Tìm khối lượng kết tủa trong mỗi trường hợp để tìm khối lượng kết tủa max.
Hướng dẫn giải:
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam
Đáp án B
Câu 72:
Phương pháp:
Dùng định luật bảo toàn khối lượng để tìm giá trị m.
Hướng dẫn giải:
Ta có: mX = m. Vì nguyên tố nitơ chiếm 20,22% khối lượng → mN = 0,2022.m (gam)
→ nN = 0,2022m/14
Ta có: nH2SO4 = nN/2 = 0,2022m/28 mol
Áp dụng bảo toàn khối lượng ta có: mX + mH2SO4 = mmuối
=> m + 98. 0,2022m/28 = 201,0 suy ra m =117,70 gam
Đáp án D
Câu 73:
Phương pháp:
Hỗn hợp X gồm
C2H5NH3NO3
(CH3)2NH2NO3
CH2(NH3)2CO3
NH2-CH2-NH3HCO3
Hỗn hợp Z gồm 3 amin là C2H5NH2, (CH3)2NH, CH2(NH2)2
Cô cạn dung dịch Y thu được các muối NaNO3 mol và Na2CO3 mol
Lập hệ phương trình về khí Z và khối lượng muối khan ta tìm được tổng số mol của 2 chất đầu và tổng số mol của 2 chất sau trong hỗn hợp X. Từ đó tính được số mol NaOH tham gia phản ứng.
Hướng dẫn giải:
Hỗn hợp X gồm
C2H5NH3NO3
(CH3)2NH2NO3
CH2(NH3)2CO3
NH2-CH2-NH3HCO3
Đặt tổng số mol 2 chất đầu là a mol, tổng số mol 2 chất cuối là b mol
Hỗn hợp Z gồm 3 amin là C2H5NH2, (CH3)2NH, CH2(NH2)2
Vậy nZ = a + b = 0,3 mol
Cô cạn dung dịch Y thu được các muối NaNO3 a mol và Na2CO3 b mol
→ 85a+ 106b = 29,28 gam
Giải hệ trên ta có a = 0,12 và b = 0,18
Vậy nNaOH = a + 2b = 0,48 mol
→ Vdung dịch = nNaOH/ CM = 0,48/ 0,5 = 0,96 lít = 960 ml
Đáp án C
Câu 74:
Hướng dẫn giải:
Ta có: nY = nH2O - nCO2 = 0,3 - 0,2 = 0,1 mol
Suy ra số C của Y bằng nCO2/ nY = 0,2: 0,1 = 2
Vậy Y là C2H5OH hoặc C2H4(OH)2
Do X (C4H6O4) không có khả năng tham gia phản ứng tráng bạc, phản ứng với KOH sinh ra Y nên X là C2H5OOC-COOH → nX = a = nY = 0,1 mol
Muối thu được là (COOK)2 0,1 mol → m = 16,6 gam
Đáp án A
Câu 75:
Đặt nRSO4 = 3x mol và nKCl = 2x mol
Trong t giây: nCl2 = x mol và nO2 = y mol
→ x + y = 0,06 mol (1)
Khi đó ne = 2x + 4y mol
Sau 3t giây ta có: nCl2 = x mol
→ nO2 = (3.ne- 2x)/4 = x+ 3y mol
Suy ra nH2 = 0,19- nCl2- nO2 = 0,19- 2x-3y mol
Bảo toàn electron trong 3t giây:
3x.2 + 2. (0,19-2x-3y) = 3. (2x+ 4y) (2)
Giải hệ (1) và (2) ta có x = 0,05 và y = 0,01
Suy ra ne = It/F = 2x+4y = 0,14 mol → t = 27020 giây
Đáp án B
Câu 76:
Y tác dụng với Br2 tạo ra khí nên Y chứa HCHO, HCOOH
Suy ra ancol X là CH3OH.
Trong mỗi phần Y chứa a mol HCHO, b mol HCOOH, c mol CH3OH dư, (a+b) mol H2O
Phần 1: nAg = 4a + 2b = 0,5 mol
Phần 2: nCO2 = a + b = 0,15 mol
Phần 3: nH2 = 0,5.nHCOOH + 0,5. nCH3OH + 0,5.nH2O = 0,5b + 0,5c + 0,5(a+b) = 0,25 mol
Giải hệ trên ta có a = 0,1; b = 0,05 và c = 0,3
Ta có: nCH3OH ban đầu = 3(a+b+c) = 1,35 mol ; nNaOH = 1,5 mol
Chất rắn gồm RCOONa 1,35 mol và NaOH dư 0,15 mol
Mà mchất rắn = 135,6 gam suy ra 1,35(R+67)+ 0,15.40 = 135,6 suy ra R =29 → R là C2H5
Vậy E là C2H5COOCH3.
Đáp án A
Câu 77:
Phương pháp:
Dùng phương pháp quy đổi: Quy đổi E thành C2H3ON, CH2, H2O, NH
Kết hợp với bảo toàn nguyên tố N, C để tìm ra a, b, x, y, z từ đó tính được %m của muối kali của Ala.
Hướng dẫn giải:
Quy đổi E thành:
C2H3ON: 0,45 mol (tính từ mol KOH)
CH2: u mol
H2O: v mol
NH: p mol
Ta có: mE = 0,45.57 + 14u + 18v + 15p = 37 (1)
Đốt E tạo thành số mol CO2 bằng số mol H2O nên:
0,45.2 + u = 0,45.1,5 + u + v + 0,5p (2)
Khi đốt C2H4NO2K (a mol) và C3H6NO2K (b mol)
Ta có: nCO2 = 2a + 3b - (a+b)/2 = 2,25 mol
Và nH2O = 2a + 3b = 2,75 mol
Giải hệ trên ta có: a = 0,25 và b = 0,75
Suy ra x/y = a/b = 1/3
Đặt nGlyK = k ; nAlaK = 3k và nLysK = p mol
Bảo toàn nguyên tố N ta có: nN = k + 3k + 2p = 0,45 + p
Suy ra k = (0,45-p)/4
Bảo toàn nguyên tố C ta có: nC = 2k + 3.3k + 6p = 0,45.2 + u
Suy ra k = (u-6p+0,9)/11
Do đó: (0,45-p)/4 = (u-6p+0,9)/11 (3)
Giải hệ (1), (2), (3) ta có: u = 0,5; v = 0,2 và p = 0,05
Vậy nKOH = x+ y+z = 0,45 mol ; nCH2 = y+4z = 0,5 mol ; nNH = z = 0,05 mol
Giải ra x = 0,1 ; y = 0,3 và z = 0,05
Suy ra %mAlaK = 65,02% gần nhất với giá trị 65%.
Đáp án A
Câu 78:
Phương pháp:
X, Y không nhánh nên đều 2 chức.
Ta có: nX = nY = x mol và nZ = z mol
Ta có: nNaOH = 2x + 2x + z = 0,51 mol (1)
P tạo kết tủa với AgNO3/NH3 nên Z là HCOOH hoặc Z có liên kết ba đầu mạch.
Nếu Z là CH≡C-COOH thì kết tủa là CAg≡C-COONH4 0,27 mol
Từ (1) suy ra x = 0,06 mol
Đặt n là số H trung bình của X và Y.
Suy ra nH = 0,06.2n + 0,27.2 = 0,39.2 → n = 2
Do các axit không có quá 4C nên tìm được các công thức X, Y, Z.
Từ đó tìm phát biểu đúng .
Hướng dẫn giải:
X, Y không nhánh nên đều 2 chức.
Ta có: nX = nY = x mol và nZ = z mol
Ta có: nNaOH = 2x + 2x + z = 0,51 mol (1)
P tạo kết tủa với AgNO3/NH3 nên Z là HCOOH hoặc Z có liên kết ba đầu mạch.
Nếu Z là CH≡C-COOH thì kết tủa là CAg≡C-COONH4 0,27 mol
Từ (1) suy ra x = 0,06 mol
Đặt n là số H trung bình của X và Y.
Suy ra nH = 0,06.2n + 0,27.2 = 0,39.2 → n = 2
Do các axit không có quá 4C nên
X là HOOC-COOH (0,06 mol)
Y là HOOC-C≡C-COOH (0,06 mol)
Z là CH≡C-COOH (0,27 mol)
Phát biểu A tính được %mX = 17,34% nên phát biểu A đúng
Phát biểu B sai vì chỉ có X là axit no
Phát biểu C sai
Phát biểu D sai vì:
Este gồm (COOCH3)2 0,12 mol, C2(COOCH3)2 0,12 mol; và CH≡C-COOCH3 0,54mol
Suy ra meste = 76,56 gam
Các trường hợp khác như Z là HCOOH hoặc Z là CH≡C-CH2-COOH giải tương tự.
Đáp án A
Câu 79:
Phương pháp:
-Thí nghiệm 1: Hòa tan hỗn hợp X trong dung dịch HCl:
Ta có: nH2O = nO (X) Suy ra nCl- → mmuối clorua = mFe+ mCu+ mCl
-Thí nghiệm 2:
Ta có: nH+ = 4.nNO+ 2.nO = nCl-
Áp dụng định luật bảo toàn e và chú ý 119,86 gam kết tủa gồm AgCl và Ag
Lập hệ phương trình tìm số mol FeO, Fe2O3 và Cu. Từ đó tính được giá trị m.
Hướng dẫn giải:
Bảo toàn nguyên tố N ta có: nKNO3 = nNO = 0,02 mol
Đặt a, b, c là số mol FeO, Fe2O3 và Cu
Ta có: nX = a + b + c = 5a (1)
-Thí nghiệm 1: Hòa tan hỗn hợp X trong dung dịch HCl:
Ta có: nH2O = nO (X) = a + 3b mol
Suy ra nCl- = nH+ = 2a + 6b mol
Khối lượng muối clorua thu được là:
mmuối clorua = mFe + mCu + mCl = 56. (a + 2b) + 64c + 35,5.(2a + 6b) = 20,71 (2)
-Thí nghiệm 2:
Ta có: nH+ = 4.nNO + 2.nO = 0,02.4 + 2(a + 3b)
→ nCl- = nH+ = 0,08 + 2a + 6b mol
Vậy nAgCl = nCl- tổng = 2a + 6b + 0,08 + 2a + 6b = 4a + 12b + 0,08 mol
Bảo toàn electron ta có: nAg = nFe + 2nCu - 3.nNO = (2a+4c) - 0,06 mol
119,86 gam kết tủa gồm AgCl và Ag
Suy ra 143,5. (4a + 12b + 0,08) + 108. (2a + 4c - 0,06) = 119,86 (3)
Giải hệ gồm (1), (2), (3) ta có: a = 0,02; b = 0,05 và c = 0,03
Suy ra m = 11,36 gam gần nhất với giá trị 11,4 gam
Đáp án A
Câu 80:
Phương pháp:
Ta có: MZ = 44 g/mol suy ra Z gồm 2 khí là CO2 và N2O
Dùng bảo toàn khối lượng để tìm nH2O
Dùng bảo toàn nguyên tố H để tìm số mol NH4+
Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được rắn khan đó là MgO. Suy ra nMgO.
Áp dụng định luật bảo toàn điện tích và khối lượng muối trong Y để xác định số mol các ion có trong dung dịch Y.
Bảo toàn nguyên tố N ta tìm được nN2O suy ra nCO2
Từ số mol H+ suy ra số mol O. Từ đó suy ra số mol ZnO, bảo toàn nguyên tố Zn suy ra số mol Zn. Từ đó tính được %mZn.
Hướng dẫn giải:
Ta có: nKHSO4 = 0,8 mol và nHNO3 = 0,15 mol
Ta có: MZ = 44 g/mol suy ra Z gồm 2 khí là CO2 và N2O
Bảo toàn khối lượng ta có: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
→ mH2O = 19,55 + 108,8 + 9,45 - 125,75 - 0,1.44 = 7,65 gam → nH2O = 0,425 mol
Bảo toàn nguyên tố H ta có: nKHSO4+ nHNO3 = 4.nNH4++ 2.nH2O
Suy ra nNH4+ = 0,025 mol
Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 10 gam chất rắn khan. Chất rắn khan đó là MgO suy ra mMgO = 10 gam.
Ta có: nMgO = 0,25 mol
Vậy dung dịch Y gồm
Mg2+ (0,25 mol), K+ (0,8 mol), SO42- (0,8 mol), Zn2+ (a mol), NH4+ (0,025 mol) và NO3- (b mol)
Áp dụng định luật bảo toàn điện tích ta có:
0,25.2 + 0,8 + 2a + 0,025 = b + 0,8.2
Ta có: khối lượng muối trong dung dịch Y là:
mmuối = 0,25.24 + 0,8.39 + 0,8.96 + 65a + 18.0,025 + 62b = 127,75
Giải hệ trên ta có: a = 0,15 và b = 0,025
Bảo toàn nguyên tố N ta tìm được nN2O = 0,05 mol suy ra nCO2 = 0,05 mol
Ta có: nH+ = 0,8 + 0,15 = 10.nN2O + 10.nNH4+ + 2.nO suy ra nO = 0,1 mol
Ta có: nO = nZnO + nMgCO3 suy ra nZnO = 0,05 mol
Bảo toàn nguyên tố Zn suy ra nZn = 0,1 mol Suy ra %mZn = 33,25%
Đáp án B
Loigiaihay.com
- Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo
- Giải đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có lời giải
- Giải đề thi hết học kì II Hóa 12 năm học 2019 - 2020 trường THPT Nghĩa Dân - Hưng Yên
- Giải đề thi hết học kì II Hóa 12 năm học 2016 - 2017 sở GDĐT Khánh Hòa có lời giải
- Giải đề thi học kì II năm học 2019 - 2020 sở GD - ĐT Hà Nam
>> Xem thêm
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết












Danh sách bình luận