 Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi học kì 2 của các trường có lời giải – Mới nhất
Giải đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có lời giải
Đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có đáp án và lời giải chi tiết
Đề bài
Câu 1 : Dung dịch FeCl2 tác dụng với chất nào sau đây tạo ra kết tủa Fe(OH)2?
A. HNO3.
B. KNO3.
C. K2SO4.
D. KOH.
Câu 2 : Sắt có số oxi hóa +2 trong hợp chất nào sau đây?
A. Fe(OH)3.
B. FeCl3.
C. FeSO4.
D. Fe2O3.
Câu 3 : Chất X có công thức phân tử H2N-CH(CH3)-COOH, tên gọi của X là
A. valin.
B. anilin.
C. alanin.
D. glyxin.
Câu 4 : Chất nào sau đây là chất điện li yếu?
A. NH4Cl.
B. K2SO4.
C. HCOOH.
D. NaNO3.
Câu 5 : Thủy phân tripanmitin có công thức (C15H31COO)3C3H5 trong dung dịch NaOH, thu được glixerol và muối X. Công thức của muối X là
A. CH3COONa.
B. C17H35COONa.
C. C15H31COONa.
D. C17H33COONa.
Câu 6 : Chất nào sau đây có hai liên kết đôi trong phân tử?
A. Buta-1,3-đien.
B. Etilen.
C. Axetilen.
D. Benzen.
Câu 7 : Thạch cao sống có công thức là
A. CaSO4.2H2O.
B. CaSO4.
C. CaSO4.H2O.
D. CaCO3.
Câu 8 : Kim loại nào sau đây không phản ứng được với dung dịch FeCl2?
A. Zn.
B. Al.
C. Cu.
D. Na.
Câu 9 : Thủy phân este HCOOCH2CH3, thu được ancol có công thức là
A. C3H7OH.
B. C2H5OH.
C. CH3OH.
D. C3H5OH.
Câu 10 : Phản ứng nào sau đây thuộc loại phản ứng nhiệt nhôm?
A. Fe2O3 + 2Al \(\xrightarrow{{{t}^{0}}}\) 2Fe + Al2O3.
B. Al + 3AgNO3 → Al(NO3)3 + 3Ag.
C. 2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2.
D. 2Al + 6HCl → 2AlCl3 + 3H2.
Câu 11 : Ở nhiệt độ thường, kim loại nào sau đây không tan được trong nước?
A. K.
B. Na.
C. Ca.
D. Mg.
Câu 12 : Kim loại nào sau đây là kim loại kiềm?
A. Ca.
B. Li.
C. Ba.
D. Mg.
Câu 13 : Khí X là nguyên nhân gây nên hiệu ứng nhà kính khiến cho nhiệt độ trái đất tăng lên, khí X là
A. CO.
B. O2.
C. CO2.
D. N2.
Câu 14 : Dung dịch chất nào sau đây làm xanh giấy quỳ tím?
A. Etylamin.
B. Axit axetic.
C. Metanol.
D. Etanol.
Câu 15 : Ở nhiệt độ thường, kim loại Fe không phản ứng với dung dịch nào sau đây?
A. CuSO4.
B. NaNO3.
C. H2SO4 loãng.
D. AgNO3.
Câu 16 : Trong y học, người ta sử dụng natri hiđrocacbonat để làm thuốc chữa đau dạ dày, công thức của natri hiđrocacbonat là
A. NaHCO3.
B. Na2CO3.
C. NaHSO4.
D. Na2SO4.
Câu 17 : Số nguyên tử hiđro trong phân tử saccarozơ là
A. 6.
B. 12.
C. 11.
D. 22.
Câu 18 : Chất nào sau đây có tính lưỡng tính?
A. Cr(OH)3.
B. Na2CO3.
C. NaOH.
D. Fe(OH)2.
Câu 19 : Chất nào sau đây có thể làm mềm tính cứng của nước cứng vĩnh cửu?
A. CaCO3.
B. K2CO3.
C. MgCl2.
D. CaSO4.
Câu 20 : Chất nào sau đây có phản ứng trùng ngưng?
A. Axit axetic.
B. Glyxin.
C. Etilen.
D. Etanol.
Câu 21 : Cho các tơ sau: visco, capron, xenlulozơ axetat, olon. Số tơ nhân tạo là
A. 1.
B. 3.
C. 4.
D. 2.
Câu 22 : Cho 9 gam glucozơ lên men rượu với hiệu suất 80% thu được V lít khí CO2. Giá trị của V là
A. 0,896.
B. 1,792.
C. 2,240.
D. 1,120.
Câu 23 : Cho 0,15 mol Ala-Gly tác dụng với dung dịch KOH dư, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, số mol KOH đã phản ứng là
A. 0,3.
B. 0,4.
C. 0,1.
D. 0,2.
Câu 24 : X là chất rắn vô định hình, màu trắng, không tan trong nước nguội; trong nước nóng (từ 65oC trở lên) chuyển thành dung dịch keo nhớt. Nhỏ vài giọt dung dịch chứa chất Y vào dung dịch keo nhớt trên thấy xuất hiện màu xanh tím. Chất X và Y lần lượt là
A. glucozơ và I2.
B. tinh bột và Br2.
C. tinh bột và I2.
D. glucozơ và Br2.
Câu 25 : Cho m gam bột Fe tác dụng với dung dịch CuSO4 dư, sau khi kết thúc phản ứng thấy thu được 6,4 gam kim loại Cu. Giá trị của m là
A. 8,4.
B. 2,8.
C. 11,2.
D. 5,6.
Câu 26 : Phát biểu nào sau đây sai?
A. Nhúng dây thép vào dung dịch NaCl có xảy ra ăn mòn điện hóa học.
B. Kim loại Na được bảo quản bằng cách ngâm trong cồn 96o.
C. Nhôm bền trong không khí ở nhiệt độ thường do có lớp màng oxit bảo vệ.
D. Thạch cao sống có công thức CaSO4.2H2O.
Câu 27 : Nghiền nhỏ 1 gam CH3COONa cùng 2 gam vôi tôi xút (CaO và NaOH) rồi cho vào đáy ống nghiệm. Đun nóng đều ống nghiệm, sau đó đun tập trung phần có chứa hỗn hợp phản ứng. Hiđrocacbon sinh ra trong thí nghiệm trên là
A. etilen.
B. axetilen.
C. etan.
D. metan.
Câu 28 : Cho Fe tác dụng với lượng dư các chất: khí Cl2; dung dịch HNO3 đặc nóng; dung dịch HCl; dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp sinh ra muối sắt(II) là
A. 2. B. 1.
C. 3. D. 4.
Câu 29 : Hòa tan hoàn toàn 0,12 mol Al bằng dung dịch Ca(OH)2 dư, thu được V lít khí H2. Giá trị của V là
A. 2,688.
B. 4,032.
C. 1,344.
D. 2,240.
Câu 30 : Phát biểu nào sau đây không đúng?
A. Etylamin là chất khí tan nhiều trong nước.
B. Dung dịch lysin làm quỳ tím chuyển sang màu xanh.
C. Anilin không làm đổi màu quỳ tím.
D. Dung dịch glyxin làm quỳ tím chuyển sang màu xanh.
Câu 31 : Cho m gam hỗn hợp X gồm ba este đều đơn chức tác dụng tối đa với 400 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm hai ancol cùng dãy đồng đẳng và 34,4 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y, thu được 3,584 lít khí CO2 và 4,68 gam H2O. Giá trị của m là
A. 25,14.
B. 24,24.
C. 21,10.
D. 22,44.
Câu 32 : Dẫn a mol hỗn hợp X gồm hơi nước và CO2 đi qua cacbon nung đỏ, sau khi kết thúc phản ứng thu được 1,73a mol hỗn hợp Y gồm CO, H2 và CO2. Dẫn toàn bộ Y qua ống sứ đựng 13,6 gam hỗn hợp gồm CuO và Fe2O3 dư, nung nóng. Sau phản ứng thu được 11,264 gam chất rắn. Giá trị của a là
A. 0,20.
B. 0,15.
C. 0,10.
D. 0,25.
Câu 33 : Cho các phát biểu sau:
(a) Sục khí NH3 vào dung dịch AlCl3 thấy xuất hiện kết tủa.
(b) Thạch cao khan có thành phần chính là CaCO3.
(c) Hỗn hợp gồm Na và Al (tỉ lệ mol 2:1) tan hết trong nước dư.
(d) Trong công nghiệp, Na2CO3 là nguyên liệu dùng để sản xuất thủy tinh.
(e) Kim loại Mg tác dụng hết với dung dịch FeCl3 dư thu được Fe.
Số phát biểu đúng là
A. 5.
B. 3.
C. 4.
D. 2.
Câu 34 : Đốt cháy hoàn toàn m gam triglixerit X cần vừa đủ 3,26 mol O2, thu được 2,28 mol CO2 và 39,6 gam H2O. Cho m gam X tác dụng với dung dịch NaOH vừa đủ, đun nóng, thu được dung dịch chứa x gam muối. Giá trị của x là
A. 36,72.
B. 31,92.
C. 35,60.
D. 40,40.
Câu 35 : Cho từ từ từng giọt đến hết 100 ml dung dịch HCl aM vào 100 ml dung dịch Na2CO3 1M, thấy thoát ra 1,344 lít khí CO2. Giá trị của a là
A. 1,2.
B. 0,6.
C. 1,6.
D. 0,8.
Câu 36 : Cho các phát biểu sau:
(a) Các chất béo thường không tan trong nước và nhẹ hơn nước.
(b) Nước ép quả nho chín có khả năng tham gia phản ứng tráng gương.
(c) Tơ nilon-6 kém bền trong môi trường axit và trong môi trường kiềm.
(d) Dùng giấm ăn hoặc chanh khử được mùi tanh trong cá do amin gây ra.
(e) Cao su buna-S, cao su buna-N đều thuộc loại cao su thiên nhiên.
Số phát biểu đúng là
A. 5.
B. 4.
C. 2.
D. 3.
Câu 37 : Chất X (CnH2n+4O4N2) là muối amoni của axit cacboxylic đa chức; chất Y (CmH2m-4O7N6) là hexapeptit tạo bởi một α-amino axit. Biết 0,1 mol E gồm X và Y tác dụng tối đa với 0,32 mol NaOH trong dung dịch, đun nóng, thu được metylamin và dung dịch chỉ chứa 31,32 gam hỗn hợp muối. Phần trăm khối lượng của X trong E có giá trị gần nhất với giá trị nào sau đây?
A. 49.
B. 22.
C. 77.
D. 52.
Câu 38 : Cho 7,34 gam hỗn hợp E gồm hai este X và Y (đều tạo bởi axit cacboxylic và ancol; MX < MY < 150) tác dụng vừa đủ với dung dịch NaOH, thu được ancol Z và 6,74 gam hỗn hợp muối T. Cho toàn bộ lượng Z tác dụng với Na dư, thu được 1,12 lít khí H2. Đốt cháy hoàn toàn T, thu được H2O, Na2CO3 và 0,05 mol CO2. Phần trăm khối lượng của X trong E là
A. 35,97%.
B. 81,74%.
C. 30,25%.
D. 40,33%.
Câu 39 : Tiến hành thí nghiệm điều chế etyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml C2H5OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở 65 - 70oC.
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Phát biểu nào sau đây không đúng?
A. H2SO4 đặc có vai trò vừa làm chất xúc tác vừa làm tăng hiệu suất tạo sản phẩm.
B. Sau bước 3, chất lỏng trong ống nghiệm tách thành hai lớp.
C. Mục đích chính của việc thêm dung dịch NaCl bão hòa là để tránh phân hủy sản phẩm.
D. Sau bước 2, trong ống nghiệm vẫn còn C2H5OH và CH3COOH.
Câu 40 : Thủy phân hoàn toàn chất hữu cơ X (C8H12O4, chứa hai chức este) bằng dung dịch NaOH, thu được sản phẩm gồm ancol Z và hỗn hợp Y gồm hai muối. Axit hóa Y, thu được hai axit cacboxylic Q và Tcó cùng số nguyên tử hiđro (MQ > MT). Cho các phát biểu sau:
(a) Phân tử khối của Z là 62 g/mol.
(b) Có ba công thức cấu tạo thỏa mãn tính chất của X.
(c) Nung nóng T với hỗn hợp rắn gồm NaOH, CaO, thu được CH4.
(d) Chất Q bị oxi hóa bởi dung dịch Br2.
Số phát biểu đúng là
A. 1.
B. 4.
C. 2.
D. 3.
----- HẾT -----
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
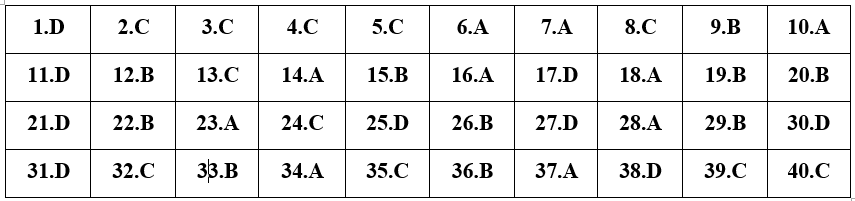
Câu 1
Phương pháp: Dựa vào tính chất hóa học của muối Fe2+
Cách giải: FeCl2 + KOH → Fe(OH)2↓ + 2KCl
Chọn D.
Câu 2
Cách giải:
Trong Fe(OH)3; FeCl3; Fe2O3 sắt đều có số oxi hóa +3.
Trong FeSO4 sắt có số oxi hóa +2.
Chọn C.
Câu 3
Phương pháp: Dựa vào kiến thức về tên gọi của một số amino axit.
Cách giải: H2N-CH(CH3)-COOH có tên gọi là alanin.
Chọn C.
Câu 4
Phương pháp:
Các axit mạnh, bazơ mạnh và hầu hết các muối là các chất điện li mạnh.
Các axit yếu, bazơ yếu và một số muối là các chất điện li yếu.
Cách giải:
HCOOH là axit yếu, trong nước chỉ phân li một phần nên là chất điện li yếu.
HCOOH ⇄ HCOO- + H+
Chọn C.
Câu 5
Phương pháp:
Thủy phân chất béo trong môi trường kiềm:
(RCOO)3C3H5 + 3NaOH \(\xrightarrow{{{t}^{o}}}\) 3RCOONa + C3H5(OH)3
Cách giải:
PTHH: (C15H31COO)3C3H5 + 3NaOH \(\xrightarrow{{{t}^{o}}}\) 3C15H31COONa (X) + C3H5(OH)3 (glixerol)
Chọn C.
Câu 6
Phương pháp:
Từ tên gọi dịch ra công thức cấu tạo. Từ đó xác định được số liên kết đôi có trong phân tử.
Cách giải:
A: Buta-1,3-đien có CTCT: CH2=CH-CH=CH2 ⟹ có chứa 2 liên kết đôi.
B: Etilen có CTCT CH2=CH2 ⟹ chứa 1 liên kết đôi.
C: Axetile có CTCT CH≡CH ⟹ chứa 1 liên kết ba.
D: Benzen có CTCT C6H6 ⟹ chứa 1 vòng và 3 liên kết đôi.
Chọn A.
Câu 7
Phương pháp:
Dựa vào kiến thức một số hợp chất quan trọng của canxi.
Cách giải:
Thạch cao sống: CaSO4.2H2O.
Thạch cao nung: CaSO4.H2O.
Thạch cao khan: CaSO4.
Chọn A.
Câu 8
Phương pháp:
Điều kiện KL tác dụng với dd FeCl2 là phải đứng trước Fe trong dãy hoạt động hóa học của kim loại.
Cách giải:
Cu đứng sau Fe trong dãy hoạt động hóa học của kim loại nên không có phản ứng với FeCl2.
Chọn C.
Câu 9
Phương pháp: RCOOR' + NaOH → RCOONa + R'OH
Cách giải: HCOOCH2CH3 + NaOH → HCOONa + CH3CH2OH
Chọn B.
Câu 10
Phương pháp:
Phản ứng nhiệt nhôm là phản ứng xảy ra giữa Al và oxit của kim loại có tính khử yếu hơn Al.
Cách giải:
Phản ứng thuộc loại phản ứng nhiệt nhôm là:
Fe2O3 + 2Al \(\xrightarrow{{{t}^{0}}}\) 2Fe + Al2O3.
Chọn A.
Câu 11
Phương pháp: Kim loại nhóm IA và IIA (trừ Be, Mg) tan được trong nước ở điều kiện thường.
Cách giải: Mg không tan trong nước ở điều kiện thường.
Chọn D.
Câu 12
Phương pháp:
Các kim loại thuộc nhóm IA được gọi là kim loại kiềm.
Cách giải:
Các kim loại thuộc nhóm IA được gọi là kim loại kiềm.
⟹ Các KL kiềm là: Li, Na, K, Rb, Cs, Fr.
Chọn B.
Câu 13
Cách giải: CO2 là khí gây nên hiệu ứng nhà kính.
Chọn C.
Câu 14
Phương pháp:
Dung dịch bazơ; các dung dịch amin (trừ amin có nhóm NH2 gắn trực tiếp với vòng benzen); muối có tính bazơ; R(NH2)x(COOH)y (x > y); … làm quỳ tím chuyển sang màu xanh.
Cách giải:
Etylamin (C2H5NH2) làm quỳ tím chuyển sang màu xanh.
Axit axetic (CH3COOH) làm quỳ tím chuyển sang màu đỏ.
Metanol (CH3OH) và etanol (C2H5OH) không làm quỳ tím chuyển màu.
Chọn A.
Câu 15
Phương pháp: Dựa vào tính chất hóa học của Fe.
Cách giải:
A: CuSO4 + Fe → FeSO4 + Cu.
B: không xảy ra pư.
C: H2SO4 loãng + Fe → FeSO4 + H2.
D: 2AgNO3 + Fe → Fe(NO3)2 + 2Ag.
Chọn B.
Câu 16
Cách giải: CTHH của natri hiđrocacbonat là NaHCO3.
Chọn A.
Câu 17
Phương pháp: Dựa vào lý thuyết chương 2.
Cách giải: CTHH của saccarozơ là C12H22O11 ⟹ có 22 nguyên tử H trong phân tử
Chọn D.
Câu 18
Phương pháp:
Chất lưỡng tính vừa có khả năng phản ứng với dd axit và dd bazơ.
Cách giải:
Cr(OH)3 là hiđroxit có tính chất lưỡng tính, Cr(OH)3 vừa phản ứng được với dd axit và dd bazơ:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Chọn A.
Câu 19
Phương pháp:
Nước cứng vĩnh cửu chứa nhiều ion Ca2+, Mg2+, SO42-, Cl-.
Chọn chất có thể kết tủa hết ion Ca2+, Mg2+ ra khỏi dd thì sẽ làm mềm được nước cứng.
Cách giải:
K2CO3 có thể làm mềm nước cứng vĩnh cửu vì:
Ca2+ + CO32- → CaCO3↓
Mg2+ + CO32- → MgCO3↓
Chọn B.
Câu 20
Phương pháp:
Điều kiện cần của cấu tạo monome tham gia phản ứng trùng ngưng: trong phân tử phải có ít nhất hai nhóm chức có khả năng tham gia phản ứng.
Cách giải:
Glyxin có thể tham gia phản ứng trùng ngưng.
PTHH: nH2N-CH2-COOH \(\xrightarrow{{{t}^{0}},p,xt}\) -(NH-CH2-CO-)n + (n-1)H2O
Chọn B.
Câu 21
Phương pháp:
Phân loại các loại tơ:
- Tơ thiên nhiên là tơ sẵn có trong thiên nhiên
- Tơ hóa học:
+ Tơ nhân tạo (hay tơ bán tổng hợp) là tơ có nguồn gốc thiên nhiên và được con người chế biến thêm bằng phương pháp hóa học
+ Tơ tổng hợp là tơ do con người tạo ra
Cách giải:
Các tơ nhân tạo trong các tơ trên là: tơ visco, tơ xenlulozơ tơ axetat (2 tơ).
Chọn D.
Câu 22
Phương pháp:
PTHH: C6H12O6 \(\xrightarrow{menruou}\) 2C2H5OH + 2CO2
Từ lượng glucozơ và PTHH suy ra lượng CO2 theo lý thuyết
Tính lượng CO2 thực tế thu được: VCO2 thực tế = VCO2 lý thuyết × H%
Cách giải:
nC6H12O6 = 9/180 = 0,05 (mol)
PTHH: C6H12O6 → 2C2H5OH + 2CO2
(mol) 0,05 → 0,1
⟹ VCO2 lý thuyết = 0,1.22,4 = 2,24 (l)
Vì H% = 80% ⟹ VCO2 thực tế = VCO2 lý thuyết × H% = 2,24 × 0,8 = 1,792 (l).
Chọn B.
Câu 23
Phương pháp:
Khi thủy phân peptit trong MT kiềm:
Số phân tử KOH/NaOH = Tổng nhóm COOH (sau khi thủy phân bởi nước).
Cách giải:
Ala-Gly + 2KOH → AlaK + GlyK
⟹ nKOH = 2.nAla-Gly = 2.0,15 = 0,3 (mol).
Chọn A.
Câu 24
Phương pháp:
Lý thuyết về cacbohiđrat.
Cách giải:
Chỉ có hồ tinh bột tạo được với I2 dung dịch màu xanh tím
⟹ X là tinh bột, Y là I2.
Chọn C.
Câu 25
Phương pháp:
Tính theo PTHH: Fe + CuSO4 → FeSO4 + Cu.
Cách giải:
nCu = 6,4/64 = 0,1 (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu
(mol) 0,1 ← 0,1
⟹ m = mFe = 0,1.56 = 5,6 (g).
Chọn D.
Câu 26
Phương pháp:
Dựa vào kiến thức tổng hợp chương đại cương kim loại; kim loại kiềm - kiềm thổ - nhôm.
Cách giải:
A đúng, vì có cặp điện cực Fe-C cùng nhúng trong dd chất điện li là NaCl.
B sai, vì Na có phản ứng với cồn 960; người ta bảo quản Na trong dầu hỏa.
C đúng.
D đúng.
Chọn B.
Câu 27
Phương pháp:
Phản ứng vôi tôi - xút điều chế ankan:
RCOONa + NaOH \(\xrightarrow{CaO,{{t}^{0}}}\) RH↑ + Na2CO3
Cách giải:
PTHH: CH3COONa + NaOH \(\xrightarrow{CaO,{{t}^{0}}}\) CH4↑ + Na2CO3
Khí sinh ra là CH4 (metan).
Chọn D.
Câu 28
Phương pháp:
Dựa vào tính chất hóa học của Fe.
Cách giải:
Các trường hợp Fe tác dụng sinh ra muối Fe(II) là: dd HCl, dd CuSO4 (2 trường hợp).
PTHH:
2Fe + 3Cl2 \(\xrightarrow{{{t}^{o}}}\) 2FeCl3
Fe + 6HNO3 đặc nóng → Fe(NO3)3 + 3NO2 + 3H2O
Fe + 2HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + H2O
Chọn A.
Câu 29
Phương pháp:
Cách 1: Tính theo PTHH
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2↑
Cách 2: Sử dụng bảo toàn e
Cách giải:
Cách 1: Tính theo PTHH
PTHH: 2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2↑
(mol) 0,12 → 0,18
⟹ VH2(đktc) = 0,18.22,4 = 4,032 (lít)
Cách 2: Sử dụng bảo toàn e
Áp dụng bảo toàn e: 3nAl = 2nH2
⟹ 3.0,12 = 2.nH2 ⟹ nH2 = 0,18 mol ⟹ VH2 = 4,032 lít.
Chọn B.
Câu 30
Phương pháp:
Dựa vào kiến thức chương 3: Amin - Amino axit - Protein.
Cách giải:
D sai, vì glyxin (NH2CH2COOH) không làm quỳ tím chuyển màu.
Chọn D.
Câu 31
Phương pháp:
- Thủy phân hỗn hợp X trong NaOH chỉ thu được ancol và muối ⟹ hh X chỉ chứa các este đơn chức thông thường (tức là không có este đặc biệt).
- Đốt hh Y thu được nH2O > nCO2 mà 2 ancol là đồng đẳng kế tiếp ⟹ 2 ancol no, đơn chức.
+ Đốt ancol no luôn có: nancol = nH2O - nCO2 = nO(trong Y)
+ Từ đó tính được: mY = mC + mH + mO(trong Y)
- Xét phản ứng X + NaOH → hh Z + hh Y
BTKL ta có: mX = mZ + mY - mNaOH
Cách giải:
Ta có: nNaOH = 0,4.1 = 0,4 (mol); nCO2(đktc) = 3,584/22,4 = 0,16 (mol); nH2O = 4,68/18 = 0,26 (mol)
- Xét phản ứng đốt dd Y:
+ Ta thấy nH2O > nCO2 mà 2 ancol là đồng đẳng kế tiếp ⟹ 2 ancol no, đơn chức.
+ Đốt ancol no luôn có: nhh Y = nH2O - nCO2 = 0,26 - 0,16 = 0,1 (mol)
Do các ancol đều có 1 nguyên tử O ⟹ nO(trong Y) = nhh Y = 0,1 (mol)
+ BTKL ta có: mY = mC + mH + mO(trong Y) = 0,16.12 + 0,26.2 + 0,1.16 = 4,04 (g)
- Xét phản ứng X + 0,4 mol NaOH → 34,4 gam hh Z + 4,04 gam hh Y
BTKL ta có: m + 0,4.40 = 34,4 + 4,04 ⟹ m = 22,44 (g).
Chọn D.
Câu 32
Phương pháp:
Sơ đồ:
Quá trình 1 (QT1): \({a^{mol}}X\left\{ {\begin{array}{*{20}{l}}{{H_2}O}\\{C{O_2}}\end{array}} \right. + C \to 1,73{{\rm{a}}^{mol}}Y\left\{ {\begin{array}{*{20}{l}}{CO}\\{{H_2}}\\{C{O_2}}\end{array}} \right.\)
Quá trình 2 (QT2):
\(Y\left\{ {\begin{array}{*{20}{l}}{CO}\\{{H_2}}\\{C{O_2}}\end{array}} \right. + 13,6\left( g \right)\left\{ {\begin{array}{*{20}{l}}{CuO}\\{F{{\rm{e}}_2}{O_3}}\end{array}} \right. \to 11,264\left( g \right)ran + \left\{ {\begin{array}{*{20}{l}}{C{O_2}}\\{{H_2}O}\end{array}} \right.\)
- Trong QT2: mchất rắn giảm = mO(pư) ⟹ nO(pư).
- Áp dụng bảo toàn e cho toàn bộ các quá trình: 4nC(pư) = 2nO(pư) ⟹ 4.nC(pư).
- Trong QT1: Lượng C phản ứng làm cho số mol khí tăng ⟹ nY - nX = nC(pư) ⟹ giá trị của a.
Cách giải:
Sơ đồ:
Quá trình 1 (QT1):
\({a^{mol}}X\left\{ {\begin{array}{*{20}{l}}{{H_2}O}\\{C{O_2}}\end{array}} \right. + C \to 1,73{{\rm{a}}^{mol}}Y\left\{ {\begin{array}{*{20}{l}}{CO}\\{{H_2}}\\{C{O_2}}\end{array}} \right.\)
Quá trình 2 (QT2):
\(Y\left\{ {\begin{array}{*{20}{l}}{CO}\\{{H_2}}\\{C{O_2}}\end{array}} \right. + 13,6\left( g \right)\left\{ {\begin{array}{*{20}{l}}{CuO}\\{F{{\rm{e}}_2}{O_3}}\end{array}} \right. \to 11,264\left( g \right)ran + \left\{ {\begin{array}{*{20}{l}}{C{O_2}}\\{{H_2}O}\end{array}} \right.\)
- Trong QT2: mchất rắn giảm = mO(pư) = 13,6 - 11,264 = 2,336 gam ⟹ nO(pư) = 0,146 mol.
- Áp dụng bảo toàn e cho toàn bộ các quá trình: 4nC(pư) = 2nO(pư)
⟹ 4.nC(pư) = 2.0,146 ⟹ nC(pư) = 0,073 mol.
- Trong QT1: Lượng C phản ứng làm cho số mol khí tăng
⟹ nY - nX = nC(pư)
⟹ 1,73a - a = 0,073
⟹ a = 0,1.
Chọn C.
Câu 33
Phương pháp:
Dựa vào kiến thức học trong chương 6: Kim loại kiềm - Kiềm thổ - Nhôm.
Cách giải:
(a) đúng. PTHH: 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl.
(b) sai, thành phần chính của thạch cao khan là CaSO4.
(c) đúng. PTHH:
2Na + 2H2O → 2NaOH + H2↑
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(d) đúng.
(e) sai. PTHH: Mg + 2FeCl3 dư → MgCl2 + 2FeCl2.
⟹ có 3 phát biểu đúng.
Chọn B.
Câu 34
Phương pháp:
- BTNT "O": 6nX + 2nO2 = 2nCO2 + nH2O ⟹ nX
- BTKL: mX = mCO2 + mH2O - mO2
- Xét X + NaOH: (RCOO)3C3H5 + 3NaOH → 3RCOONa + C3H5(OH)3
+ Từ số mol X suy ra số mol NaOH và C3H5(OH)3
+ BTKL: mX + mNaOH = mRCOONa + mC3H5(OH)3 ⟹ mmuối.
Cách giải:
nH2O = 39,6/18 = 2,2 (mol)
Đặt CT chung của X: (RCOO)3C3H5
BTNT "O": 6nX + 2nO2 = 2nCO2 + nH2O ⟹ nX = (2.2,28 + 2,2 - 2.3,26)/6 = 0,04 (mol)
BTKL ta có: mX = mCO2 + mH2O - mO2 = 2,28.44 + 39,6 - 3,26.32 = 35,6 (g)
- Xét X + NaOH có pư:
(RCOO)3C3H5 + 3NaOH → 3RCOONa + C3H5(OH)3
0,04 → 0,12 → 0,04 (mol)
BTKL: mX + mNaOH = mRCOONa + mC3H5(OH)3
⟹ 35,6 + 0,12.40 = mmuối + 0,04.92
⟹ mmuối = 36,72 (g).
Chọn A.
Câu 35
Phương pháp:
Cho từ từ dd HCl vào dd Na2CO3 phản ứng xảy ra theo thứ tự:
HCl + Na2CO3 → NaCl + NaHCO3 (1)
HCl + NaHCO3 → NaCl + CO2 + H2O (2)
Tính toán nHCl theo mol Na2CO3 và mol CO2.
Cách giải:
nCO2(đktc) = 1,344/22,4 = 0,06 (mol)
nNa2CO3 = 0,1.1 = 0,1 (mol)
Cho từ từ dd HCl vào dd Na2CO3 phản ứng xảy ra theo thứ tự:
HCl + Na2CO3 → NaCl + NaHCO3 (1)
0,1 ← 0,1 → 0,1 (mol)
HCl + NaHCO3 → NaCl + CO2 + H2O (2)
0,06 ← 0,06dư 0,04 ← 0,06 (mol)
⟹ ∑nHCl = 0,1 + 0,06 = 0,16 (mol)
⟹ a = nHCl : VHCl = 0,16 : 0,1 = 1,6 (M).
Chọn C.
Câu 36
Cách giải:
(a) đúng.
(b) đúng, vì trong nho chín có chứa nhiều glucozơ, mà glucozơ có khả năng tham gia phản ứng tráng gương.
(c) đúng, vì nilon-6 có nhóm -CO-NH- kém bền trong môi trường H+ và OH-.
(d) đúng, vì giấm ăn và chanh có chứa axit, mà amin có phản ứng với axit nên sẽ làm giảm được mùi tanh.
(e) sai, cao su buna-S và buna-N đều là cao su tổng hợp.
⟹ có 4 phát biểu đúng.
Chọn B.
Câu 37
Phương pháp:
- Từ số mol hỗn hợp E và số mol NaOH tính được số mol của X và Y.
- Khi Y phản ứng với NaOH:
X + 2NaOH → Muối + 2CH3NH2 + 2H2O
Y + 7NaOH → Muối + H2O
Bảo toàn khối lượng: mE + mNaOH = mmuối + mH2O + mCH3NH2 ⟹ khối lượng của E.
Từ đó lập được mối quan hệ giữa m, n. Biện luận tìm m, n thỏa mãn.
Cách giải:
Trong E đặt số mol của X và Y lần lượt là x và y mol.
Ta có hệ: \(\left\{ {\begin{array}{*{20}{l}}{x + y = {n_E} = 0,1}\\{2{\rm{x}} + 6y = {n_{NaOH}} = 0,32}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{x = 0,07}\\{y = 0,03}\end{array}} \right.\)
X + 2NaOH → Muối + 2CH3NH2 + 2H2O
0,07 → 0,14 → 0,14
Y + 7NaOH → Muối + H2O
0,03 → 0,03
Bảo toàn khối lượng: mE + mNaOH = mmuối + mH2O + mCH3NH2
⟹ mE = 31,32 + (0,14 + 0,03).18 + 0,14.31 - 0,32.40 = 25,92 gam
Mặt khác: mE = 0,07.(14n + 96) + 0,03.(14m + 192) = 25,92
⟹ 98n + 42m = 1344
Vì m là số C của hexapeptit nên m chia hết cho 6 và m ≥ 12 và n ≥ 4
⟹ m = 18 và n = 6 thỏa mãn.
⟹ X: C6H16O4N2
⟹ mX = 0,07.180 = 12,6 gam
⟹ %mX = (12,6/25,92).100% = 48,61% gần nhất với 49%.
Chọn A.
Câu 38
Cách giải:
Sơ đồ bài toán:
\(7,34{\mkern 1mu} \left( g \right){\mkern 1mu} E\left\{ {\begin{array}{*{20}{l}}X\\Y\end{array}} \right. + NaOH \to \left\{ {\begin{array}{*{20}{l}}{ancol{\mkern 1mu} Z\mathop \to \limits^{Na} {H_2}:0,05}\\{6,74{\mkern 1mu} \left( g \right){\mkern 1mu} hh{\mkern 1mu} T\mathop \to \limits^{ + {O_2}} \left\{ {\begin{array}{*{20}{l}}{{H_2}O}\\{N{a_2}C{O_3}}\\{C{O_2}:0,05}\end{array}} \right.}\end{array}} \right.\)
nH2 = 0,05 mol ⟹ nOH(ancol) = 2nH2 = 0,1 mol = nNaOH(pư).
BTKL: mZ = 7,34 + 0,1.40 - 6,74 = 4,6 gam.
Đặt ancol Z: R(OH)x ( mol) ⟹ .(R + 17x) = 4,6
⟹ R = 29x ⟹ x = 1; R = 29 (C2H5-) thỏa mãn.
Vậy Z là C2H5OH.
BTNT "Na" ⟹ nNa2CO3 = ½ nNaOH = 0,05 mol
⟹ nC(muối) = nNa2CO3 + nCO2 = 0,05 + 0,05 = 0,1 mol
Nhận thấy nC = nNa ⟹ Muối gồm HCOONa (a mol) và (COONa)2 (b mol) (vì MX,Y < 150).
Ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{l}}{a + 2b = 0,1\left( {BT:Na} \right)}\\{68{\rm{a}} + 134b = {m_{muoi}} = 6,74}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{a = 0,04}\\{b = 0,03}\end{array}} \right.\)
⟹ \(E\left\{ {\begin{array}{*{20}{l}}{X:HCOO{C_2}{H_5}\left( {0,04} \right)}\\{Y:{{\left( {COO{C_2}{H_5}} \right)}_2}\left( {0,03} \right)}\end{array}} \right.\)
⟹ %mX = 40,33%.
Chọn D.
Câu 39
Phương pháp:
Dựa vào kiến thức điều chế este.
Cách giải:
A đúng, axit H2SO4 đặc vừa làm chất xúc tác, vừa có tác dụng hút nước, do đó góp phần làm tăng hiệu suất tạo este.
B đúng.
C sai, mục đích chính của việc thêm NaCl bão hòa để làm tăng khối lượng riêng của lớp chất lỏng phía dưới khiến este dễ dàng nổi lên trên và tách lớp, thu hồi sẽ dễ dàng hơn.
D đúng, vì phản ứng điều chế este là phản ứng thuận nghịch, nên C2H5OH và CH3COOH vẫn còn sau phản ứng.
Chọn C.
Câu 40
Phương pháp:
+ C8H12O4 có độ bất bão hòa: k = (2C + 2 - H)/2 = 3 ⟹ X chứa 2 nhóm -COO- và 1 liên kết đôi C=C trong phân tử.
+ Q và T có cùng số nguyên tử H trong phân tử ⟹ T là: CH3COOH và Q : CH2=CH-COOH.
⟹ CTCT thỏa mãn X.
+ Từ đó xét tính đúng/sai của các phát biểu.
Cách giải:
+ C8H12O4 có độ bất bão hòa: k = (8.2+2-12)/2 = 3 ⟹ X chứa 2 nhóm -COO- và 1 liên kết đôi C=C trong phân tử.
+ Nếu liên kết đôi C=C nằm trong gốc ancol thì không có este nào thỏa mãn ⟹ liên kết C=C nằm trong gốc axit.
+ Q và T có cùng số nguyên tử H trong phân tử ⟹ T là: CH3COOH và Q: CH2=CH-COOH
⟹ X có 3 CTCT thỏa mãn là:
CH3COO-CH2-CH2-CH2-OOC-CH=CH2
CH3COO-CH(CH3)-CH2-OOC-CH=CH2
CH3COO-CH2-CH(CH3)-OOC-CH=CH2
⟹ CTPT của Z là: C3H8O2
Xét các phát biểu:
(a) sai, vì phân tử khối của Z là 76 đvC.
(b) đúng.
(c) sai, vì T là CH3COOH không có phản ứng vôi tôi-xút; muối CH3COONa mới có phản ứng này.
PTHH: CH3COONa + NaOH \(\xrightarrow{CaO,{{t}^{0}}}\) CH4 + Na2CO3
(d) đúng, CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
Vậy có 2 phát biểu đúng.
Chọn C.
Loigiaihay.com
- Giải đề thi hết học kì II Hóa 12 năm học 2019 - 2020 trường THPT Nghĩa Dân - Hưng Yên
- Giải đề thi hết học kì II Hóa 12 năm học 2016 - 2017 sở GDĐT Khánh Hòa có lời giải
- Giải đề thi học kì II năm học 2019 - 2020 sở GD - ĐT Hà Nam
- Giải đề thi hết học kì II Hóa 12 năm học 2020 - 2021 THPT Lương Thế Vinh Hải Dương có lời giải
- Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo
>> Xem thêm
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết












Danh sách bình luận