Đề thi thử THPT môn Hóa lần 1 năm 2025 Sở GD Thái Bình
Cho dung dịch glucose vào ống ng̣hiệm chứa copper
Đề bài
Cho dung dịch glucose vào ống ng̣hiệm chứa copper (II) hydroxide và NaOH rồi đun nóng nhẹ thấy xuất hiện .....(1)..... Cho dung dịch lòng trắng trứng vào ống nghiệm chứa copper (II) hydroxide và NaOH rồi khuấy đệ̀u thấy xuất hiện .....(2)..... Nội dung phù hợp trong các ô trống (1) và (2) lần lượt là
-
A.
(1) dung dịch màu xanh lam, (2) dung dịch màu xanh lam.
-
B.
(1) kết tủa màu đỏ gạch, (2) dung dịch màu xanh lam.
-
C.
(1) dung dịch màu xanh lam, (2) dung dịch màu tím.
-
D.
(1) kết tủa màu đỏ gạch, (2) dung dịch màu tím.
Khi dẫn CO2 vào dung dịch sodium chloride bão hòa và ammonia bão hòa (phương pháp Solvay), thu được dung dịch chứa \({\rm{NaCl}},{\rm{N}}{{\rm{H}}_4}{\rm{Cl}},{\rm{NaHC}}{{\rm{O}}_3}\). Để tách \({\rm{NaHC}}{{\rm{O}}_3}\) khỏi dung dịch hỗn hợp cần dùng phương pháp nào sau đây?
-
A.
Lọc.
-
B.
Kết tinh.
-
C.
Chiết.
-
D.
Nung nóng.
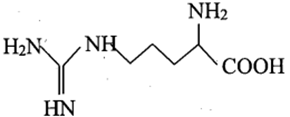
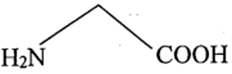
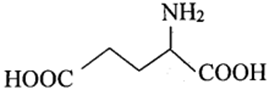
Thực hiện thí nghiệm về tính điện di ở của các amino acid gồm arginine, glycine, glutamic acid. Xét các thông tín dưới đây:
|
Cấu trúc |
 |
 |
 |
|
pHI |
Arginine
(10,76) |
Glycine (5,97) |
Glutamic acid (3,22) |
là giá trị pH mà tại đó aminoacid tồn tại ở dạng ion lưỡng cực có tổng điện tích dương bằng tổng điện tích âm.
Cho các phát biểu sau:
(a) Tại thì arginine tồn tại chủ yếu ở dạng anion.
(b) Các vệt (1), (2), (3) lần lượt là glutamic acid, glycine, arginine.
(c) Nếu tại thì glycine và glutamic acid đều di chuyển về cực dương.
(d) Tại có thể dùng tính điện di để tách ba amino acid trên.
Số phát biểu đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Công thức cấu tạo nào sau đây biểu diễn một ester?
-
A.
\({\rm{H}} - {\rm{COO}} - {\rm{C}}{{\rm{H}}_2} - {\rm{C}}{{\rm{H}}_3}\).
-
B.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{COOH}}\).
-
C.
\({\rm{C}}{{\rm{H}}_3} - {\rm{CO}} - {\rm{C}}{{\rm{H}}_3}\).
-
D.
\({\rm{C}}{{\rm{H}}_3} - {\rm{COON}}{{\rm{H}}_4}\).
Hai nguyên tố \({\rm{Na}}({\rm{Z}} = 11)\) và \({\rm{Al}}({\rm{Z}} = 13)\) cùng đứng trong một chu kì trong bảng tuần hoàn do chúng có cùng đặc điểm nào sau đây?
-
A.
Số electron ở lớp ngoài cùng.
-
B.
Số electron ở phân lớp ngoài cùng.
-
C.
Số electron độc thân.
-
D.
Số lớp electron.
Đạm \({\left( {{\rm{N}}{{\rm{H}}_4}} \right)_2}{\rm{S}}{{\rm{O}}_4}\) được khuyến cáo không nên bón cho đất có pH thấp (đất chua). Nguyên nhân chính của khuyến cáo là
-
A.
làm tăng khả năng bị rửa trôi dinh dưỡng.
-
B.
làm đất mất độ tơi xốp.
-
C.
tăng \({\rm{N}}{{\rm{H}}_3}\) gây độc hại cho cây trồng.
-
D.
làm tăng độ chua của đất.
Cho chất X có công thức cấu tạo \({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{NH}} - {\rm{C}}{{\rm{H}}_3}\). Tên của X là
-
A.
isopropylamine.
-
B.
dimethylamine.
-
C.
ethylmethylamine.
-
D.
propan-2-amine
Vôi sống (một hợp chất chứa calcium) dùng làm chất khử chua cho đất. Tên hóa học của hợp chất này là
-
A.
Calcium carbonate.
-
B.
Calcium hydrogen carbonate.
-
C.
Calcium oxide.
-
D.
Calcium hydroxide.
Chất X có công thức cấu tạo là \({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{C}}{{\rm{H}}_2} - {\rm{OH}}\). Chất Y là một đồng phân của X . Chất Y có thể có công thức cấu tạo là
-
A.
\({\rm{C}}{{\rm{H}}_3} - {\rm{CH}}({\rm{OH}}) - {\rm{C}}{{\rm{H}}_2}{\rm{OH}}\).
-
B.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{O}} - {\rm{C}}{{\rm{H}}_3}\).
-
C.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{CHO}}\)
-
D.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{OH}}\).
Kim loại có thể bị uốn cong, dễ rèn, dễ dát mỏng và dễ kéo sợi. Tính chất vật lý nào giúp kim loại có những đặc điểm trên?
-
A.
Tính dẫn nhiệt.
-
B.
Khối lượng riêng lớn.
-
C.
Tính dẻo.
-
D.
Tính dẫn điện.
Điện phân là một quá trình .....(1)..... xảy ra tại các điện cực khi có dòng điện .....(2)..... với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Nội dung phù hợp trong các ô trống (1) và (2) lần lượt là
-
A.
khử, một chiều.
-
B.
oxi hóa-khử, một chiều.
-
C.
oxi hóa, một chiều.
-
D.
oxi hóa-khử, xoay chiều.
Chất X có công thức cấu tạo là \({\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{COOC}}{{\rm{H}}_3}\). Tên gọi của X là
-
A.
ethyl acetate.
-
B.
propyl acetate.
-
C.
methyl butyrate.
-
D.
methyl propionate.
Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trọng đời sống: kích thích quả mau chín, điều chế nhựa làm sản phẩm gia dụng,... Phản ứng hóa học của ethylene với dung dịch như sơ đồ 1: Cơ chế của phản ứng trên xảy ra như sơ đồ 2 :
Nhận định nào sau đây không đúng?
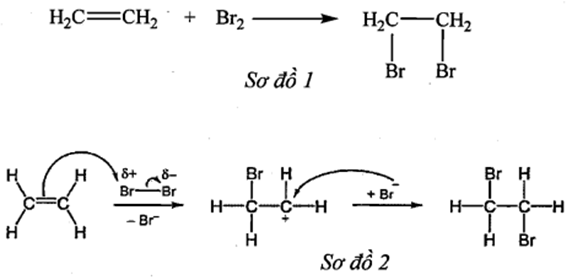
-
A.
Phản ứng trên thuộc loại phản ứng cộng.
-
B.
Hiện tượng của phản ưng là dung dịch bromine bị mất màu.
-
C.
Giai đoạn 1, liên kết đôi phản ứng với tác nhân nucleophile \(\mathop {{B^ - }}\limits^\delta \)r tạo thành phần tử mang điện dương.
-
D.
Giai đoạn 2, phần tử mang điện dương kết hợp với anion \({\rm{B}}{{\rm{r}}^ - }\)tạo thành sản phẩm.
Thí nghiệm về phản ứng của protein.
Buớc 1: Ông nghiệm 1: cho khoảng 1 mL dung dịch \({\rm{HN}}{{\rm{O}}_3}\) đặc vào ống nghiệm.
Bước 2: Ông nghiệm 2: cho khoảng 1 mL dung dịch \({\rm{NaOH}}30\% \) vào ống nghiệm, nhỏ thêm 3-4 giọt dung dịch \({\rm{CuS}}{{\rm{O}}_4}2\% \), lắc đều.
Buớc 3: Cho khoảng 1 mL lòng trắng trứng vào ống nghiệm 1 ; cho khoảng 1 mL dung dịch lòng trắng trứng vào ống nghiệm 2, khuấy đều.
Cho các phát biểu sau:
(a) Thí nghiệm ở ống nghiệm 1 chứng tỏ trong protein có chứa vòng benzene.
(b) Sau bước 2 thu được kết tủa có màu trắng.
(c) Thí nghiệm ở ống nghiệm 1 thể giải thích khi da tay tiếp xúc với \({\rm{HN}}{{\rm{O}}_3}\) đặc thấy màu da chuyển sang vàng.
(d) Thí nghiệm ở ống nghiệm 2 có thể dùng để phân biệt dung dịch lòng trắng trứng với dung dịch đường saccharose.
Số phát biểu đúng là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Carbohydrate nào sau đây không phản ứng với thuốc thử tollens khi đun nóng?
-
A.
Maltose.
-
B.
Fructose.
-
C.
Glucose.
-
D.
Saccharose.
Hình dưới đây là ký hiệu của 6 polymer nhiệt dẻo phổ biến có thể tái chế:
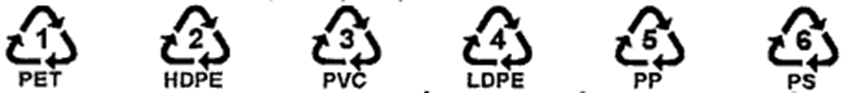
Các ký hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng... để giúp nhận biết vật liệu polymer cũng như thuận lợi cho việc thu gom, tái chế. Polymer có ký hiệu số 5 được điểu chế bẳng phản ứng trùng hợp monomer nào dưới đây?
-
A.
\({\rm{C}}{{\rm{H}}_2} = {\rm{C}}{{\rm{H}}_2}\).
-
B.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {{\rm{C}}_6}{{\rm{H}}_5}\).
-
C.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {\rm{C}}{{\rm{H}}_3}\).
-
D.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {\rm{Cl}}\).
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17-18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
|
Cặp oxi hóa - khử |
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) |
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) |
\({\rm{F}}{{\rm{e}}^{2 + }}/{\rm{Fe}}\) |
\({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\) |
\({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\) |
|
\({E^o}V\) |
\( - 1,676\) |
\( - 0,763\) |
\( - 0,440\) |
0,340 |
0,799 |
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây không xảy ra?
-
A.
\({\rm{Al}} + 3{\rm{A}}{{\rm{g}}^ + } \to {\rm{A}}{{\rm{l}}^{3 + }} + 3{\rm{Ag}}\).
-
B.
\({\rm{Cu}} + {\rm{F}}{{\rm{e}}^{2 + }} \to {\rm{Fe}} + {\rm{C}}{{\rm{u}}^{2 + }}\).
-
C.
\({\rm{Zn}} + {\rm{F}}{{\rm{e}}^{2 + }} \to {\rm{Z}}{{\rm{n}}^{2 + }} + {\rm{Fe}}\).
-
D.
\({\rm{Cu}} + 2{\rm{A}}{{\rm{g}}^ + } \to {\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{Ag}}\).
Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là \(2,475\;{\rm{V}}\). Hai cặp oxi hoá - khử hình thành pin lần lượt là
-
A.
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) và \({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\).
-
B.
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) và \({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\).
-
C.
\({\rm{F}}{{\rm{e}}^{2 + }}/{\rm{Fe}}\) và \({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\).
-
D.
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) và \({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\).
Cao su thiên nhiên không dẫn điện, không thấm nước và khí, có tính đàn hồi tốt. Tuy nhiên, cao su thiên nhiên dễ bị lão hoá dưới tác động của không khí, ánh sáng, nhiệt. Ngoài ra, tính đàn hồi của cao su chỉ tồn tại trong một khoảng nhiệt độ hẹp. Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với sulfur) có chứa khoảng 2,0% sulfur về khối lượng.
a) Bản chất của quá trình lưu hoá cao su là phản ứng tăng mạch polymer, tạo ra cầu disulfide (-S-S-) giữa các phân tử polyisoprene tạo thành polymer có cấu tạo mạng lưới không gian.
b) Trong loại cao su lưu hóa trên, cứ trung bình khoảng 46 mắt xích isoprene có một cầu disulfide (-S-S-).
c) Cao su đã̉ được lưu hoá có các ưu điểm tốt hơn về độ đàn hồi, chống thấm khí, chịu ma sát, bền với nhiệt và các tác nhân khác hơn với cao su thiện nhiên và cao su buna.
d) Cao su lưu hóa không tham gia phản ứng cộng.
Thành phần dịch vị dạ dày gồm là nước, enzyme và hydrochloric acid. Sự có mặt của hydrochloric acid làm cho pH của dịch vị trong khoảng từ . Khi độ acid trong dịch vị dạ dày tăng thì dễ bị ợ chua, ợ hơi, ói mửa, buồn nôn, loét dạ dày, tá tràng. Để làm giảm bớt lượng acid dư trong dịch vị dạ dày người ta thường uống thuốc muối dạ dày "Nabica" từng lượng nhỏ và cách quãng.
a) Công thức hoá học của thuốc muối dạ dày "Nabica" là \({\rm{NaHC}}{{\rm{O}}_3}\).
b) Khi uống thuốc muối dạ dày "Nabica" thì sẽ sinh ra khí carbonmonooxide.
c) Khi uống thuốc muối dạ dày "Nabica" từng lượng nhỏ và cách quãng thì pH của dịch vị dạ dày sẽ tăng từ từ.
d) Nếu có 10 mL dịch vị dạ dày và coi pH của dạ dày hoàn toàn do hydrochloric acid gây ra, để nâng pH của dạ dày từ \({\rm{pH}} = 1\) lên \({\rm{pH}} = 2\) cần dùng hết 0,756 gam thuốc muối dạ dày Nabica (với giả thiét Nabica là nguyên chất và thể tich dung dịch vẫn giũu nguyên sau khi dùng thuốc).
Điều chế ethyl acetate trong phòng thí nghiệm được tiển hành như sau:
Bước 1: Cho khoảng 5 mL ethanol và 5 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
Bước 2: Thêm khoảng 2 mL dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) đặc, lắc nhẹ để các chất trộn đều với nhau.
Bước 3: Đặt ống nghiệm vào cốc nước nóng (khoảng \({60^o}{\rm{C}} - {70^o}{\rm{C}}\)) trong khoảng 5 phút, thỉnh thoảng lắc đều hỗn hợp.
Buớc 4: Lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 10 mL dung dịch muối ăn bão hòa thì thấy chất lỏng trong ống nghiệm tách thành hai lớp, lớp trên có mùi thơm đặc trưng.
Bước 5: Đem đo phổ hồng ngoại (IR) của chất lỏng có mùi thơm đặc trưng.
Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:

a) Dung dịch NaCl bão hoà làm giảm độ tan của ester trong nước để ester dễ dàng tách lớp nổi lên trên tốt hơn.
b) Phản ứng xảy ra trong bước 3 có sự tách nhóm OH của phân tử alcohol.
c) Sulfuric acid đặc vừa là chất xúc tác, vừa có tác dụng hút nước, làm tăng hiệu suất tạo ester.
d) Ở bước 5, phổ hồng ngoại xuất hiện peak với số sóng \(1780 - 1650\;{\rm{c}}{{\rm{m}}^{ - 1}}\).
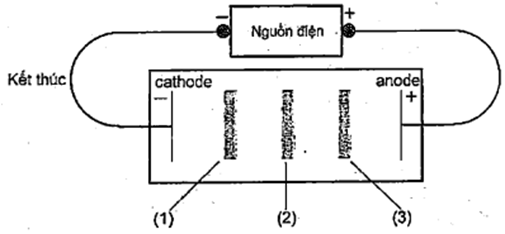
Nghiên cứu ảnh hưởng của hiệu điện thế đến phản ứng điện phân, một nhóm học sinh cho rằng, dòng điện có hiệu điện thế càng lớn thì tổng khối lượng chất rắn và chất khí sau điện phân càng lớn. Để thực hiện điểu đó, nhóm học sinh tiển hành như sau:
Bước 1: Lấy cốc thể tích 100 mL, thêm vào đó 2,5 gam \({\rm{CuS}}{{\rm{O}}_4} \cdot 5{{\rm{H}}_2}{\rm{O}}\) và thêm nước vào cho đến khi thể tích dung dịch là 25 mL.
Bược 2: Thêm tiếp dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}1{\rm{M}}\) vào dung dịch cho đến khi thể tích dung dịch đạt 40 mL. Đem cân toàn bộ cốc thì thấy khối lượng là \({{\rm{m}}_1}\) gam.
Bước 3: Lấy hai điện cực than chì, nhúng vào dung dịch trong cốc (hai điện cực không tiếp xúc với nhau) và nối một điện cực với cực dương và nối một điện cực với cực âm của pin điện 2 V.
Bước 4: Thực hiện điện phân trong khoảng thời gian 10 phút, sau đó lấy hai điện cực ra và đem cân lại cốc đựng dung dịch sau điện phân thì khối lượng cốc là \({{\rm{m}}_2}\) gam.
Lặp lại thí nghiệm khi thay dò̀ng điện 2 V bằng các dòng điện \(4\;{\rm{V}},6\;{\rm{V}},8\;{\rm{V}},10\;{\rm{V}}\). Kết quả thí nghiệm:
|
Hiệu điện thế (V) |
2 |
4 |
6 |
8 |
|
\(\Delta m = {m_1} - {m_2}\) |
1,5 |
1,2 |
1,0 |
0,8 |
a) Các quá trình khử ion Cu2+ thành Cu và khử ion H+ thành H2 xảy ra tại điện cực than chì nối với cực âm.
b) Quá trình oxi hóa \({{\rm{H}}_2}{\rm{O}}\) tạo thành khí \({{\rm{O}}_2}\) và ion \({{\rm{H}}^ + }\)xảy ra tại điện cực than chì nối với cực dương.
c) Sự chênh lệch khối lượng trước và sau điện phân đúng bằng khối lượng chất trong dung dịch đã điện phân.
d) Kết quả thí nghiệm chứng tỏ nhận định ban đầu của nhóm học sinh là sai.
Soda \(\left( {{\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}} \right)\) được dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt....
Làm lạnh 100 gam dung dịch \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) bão hòa ở \({20^o}{\rm{C}}\) đến khi thu được dung dịch bão hòa ở \({10^o}{\rm{C}}\) thì tách ra m gam tinh thể \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} \cdot 10{{\rm{H}}_2}{\rm{O}}\). Biết 100 gam nước hòa tan được tối đa lượng \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) ở \({20^o}{\rm{C}}\) và \({10^o}{\rm{C}}\) lần lượt là 21,5 gam và 12,5 gam. Tính giá trị của m. (Làm tròn kết quả đến 1 chữ số sau dấu phảy).
Theo QCVN 01-1-2018/BYT, hàm lượng ion sắt tối đa cho phép trong nước sinh hoạt là \(0,30{\rm{mg}}/{\rm{L}}\). Một mẫu nước có hàm lượng ion sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng \({\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3}\) và \({\rm{FeS}}{{\rm{O}}_4}\) với tỉ lệ mol tương ứng là 1: 6. Quá trình loại bỏ hoàn toàn ion sắt trong \(10\;{{\rm{m}}^3}\) mẫu nước trên được thực hiện bằng cách sử dụng \(m\) gam vôi tôi (vừa đủ), sau đó sục không khí. Các quá trình diễn ra theo sơ đồ sau:
\(\begin{array}{l}{\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + {\rm{Ca}}{({\rm{OH}})_2} \to {\rm{Fe}}{({\rm{OH}})_3} + {\rm{CaS}}{{\rm{O}}_4}\\{\rm{FeS}}{{\rm{O}}_4} + {\rm{Ca}}{({\rm{OH}})_2} + {{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}} \to {\rm{Fe}}{({\rm{OH}})_3} + {\rm{CaS}}{{\rm{O}}_4}\end{array}\)
Giả thiết vôi tôi chỉ chứa \({\rm{Ca}}{({\rm{OH}})_2}\). Giá trị của m là bao nhiêu? (Kết quả làm tròn đến hàng đơn vị).
Cho các thông tin sau đây về tinh bột:
(1) Là một polysaccharide.
(2) Chứa liên kết \(\alpha - 1,4\)-glycoside.
(3) Thủy phân đến cùng trong môi trường acid, thu được glucose.
(4) Phản ứng được với thuốc thử tollens.
(5) Hồ tinh bột phản ứng với dung dịch iodine tạo hợp chất màu xanh tím.
(6) Trong cơ thể, enzyme \(\alpha \)-amilase thúc đẩy quá trình thủy phân tinh bột.
Tổng số phát biểu đúng là bao nhiêu?
Cho các nhận định sau:
(1) Aniline phản ứng với dung dịch \({\rm{B}}{{\rm{r}}_2}\) thu được chất kết tủa trắng.
(2) \({\rm{C}}{{\rm{H}}_3} - {\rm{CH}}\left( {{\rm{N}}{{\rm{H}}_2}} \right) - {\rm{C}}{{\rm{H}}_3}\) là amine bậc hai.
(3) \({\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{N}}{{\rm{H}}_2}\) phản ứng với \({\rm{HN}}{{\rm{O}}_2}\) ở nhiệt độ thường thu được chất khí không màu.
(4) Để khử mùi tanh của cá (thường do trimethylamine gây ra) có thể dùng giấm ăn.
Sắp xếp các nhận định đúng theo số thứ tự tăng dần (ví dụ \(123,1234, \ldots \). ).
Xét quá trình đốt cháy ethanol \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}(l):{{\rm{C}}_2}{{\rm{H}}_5}{\rm{O}}{{\rm{H}}_{(l)}} + 3{{\rm{O}}_{2(g)}} \to 2{\rm{C}}{{\rm{O}}_{2(g)}} + 3{{\rm{H}}_2}{{\rm{O}}_{(l)}}\) Cho biết enthalpy tạo thành \(\left( {{\Delta _{\rm{f}}}{\rm{H}}_{298}^0} \right)\) của các chất như sau:
|
Chất |
\({\bf{C}}{{\bf{O}}_2}(g)\) |
\({{\bf{H}}_2}{\bf{O}}(l)\) |
\({{\bf{C}}_2}{{\bf{H}}_5}{\bf{OH}}(l)\) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{298}^0(\;{\rm{kJ}}/{\rm{mol}})\) |
\( - 393,5\) |
\( - 285,8\) |
-267 |
Cần x gam \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\) đốt cháy để cung cấp nhiệt dùng để đun 1,5 lít nước từ 25oC đến 100oC biết rằng có \(40\% \) lượng nhiệt đốt cháy bị thất thoát ra ngoài môi trường; biết rằng để tăng nhiệt độ của 1 gam nước thêm 1oC cần \(4,2\;{\rm{J}}\) nhiệt; khối lượng riêng của nước là \(1\;{\rm{g}}/{\rm{mL}}\).
Xét quá trình đốt cháy propane \({{\rm{C}}_3}{{\rm{H}}_8}(g)\) và butane \({{\rm{C}}_4}{{\rm{H}}_{10}}(g)\) :
\(\begin{array}{*{20}{l}}{{{\rm{C}}_3}{{\rm{H}}_8}(g) + 5{{\rm{O}}_2}(g) \to 3{\rm{C}}{{\rm{O}}_2}(g) + 4{{\rm{H}}_2}{\rm{O}}(l)}&{{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 2220\;{\rm{kJ}}}\\{{{\rm{C}}_4}{{\rm{H}}_{10}}(g) + 13/2{{\rm{O}}_2}(g) \to 4{\rm{C}}{{\rm{O}}_2}(g) + 5{{\rm{H}}_2}{\rm{O}}(l)}&{{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 2874\;{\rm{kJ}}.}\end{array}\)
Nếu thay lượng nhiệt do \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\) đốt chạ́y ở trên bằng lượng nhiệt lấy từ quá trình đốt cháy y gam khí hóa lỏng LPG chứa hỗn hợp propane và butane theo tỉ lệ mol tương ứng 2: 3. Tính tổng \({\rm{x}} + {\rm{y}}\)? (Kết quả làm tròn đến hàng đơn vị).
Cho công thức cấu tạo của phân tử chất giặt rửa sodium laurylsulfate sau đây:
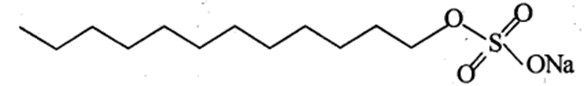
Phần kị nước của phân tử trên có tổng số nguyên tử là bao nhiêu ?
Lời giải và đáp án
Cho dung dịch glucose vào ống ng̣hiệm chứa copper (II) hydroxide và NaOH rồi đun nóng nhẹ thấy xuất hiện .....(1)..... Cho dung dịch lòng trắng trứng vào ống nghiệm chứa copper (II) hydroxide và NaOH rồi khuấy đệ̀u thấy xuất hiện .....(2)..... Nội dung phù hợp trong các ô trống (1) và (2) lần lượt là
-
A.
(1) dung dịch màu xanh lam, (2) dung dịch màu xanh lam.
-
B.
(1) kết tủa màu đỏ gạch, (2) dung dịch màu xanh lam.
-
C.
(1) dung dịch màu xanh lam, (2) dung dịch màu tím.
-
D.
(1) kết tủa màu đỏ gạch, (2) dung dịch màu tím.
Đáp án : D
Dựa vào tính chất hoá học của glucose.
(1) kết tủa đỏ gạch, (2) dung dịch màu tím.
Đáp án D
Khi dẫn CO2 vào dung dịch sodium chloride bão hòa và ammonia bão hòa (phương pháp Solvay), thu được dung dịch chứa \({\rm{NaCl}},{\rm{N}}{{\rm{H}}_4}{\rm{Cl}},{\rm{NaHC}}{{\rm{O}}_3}\). Để tách \({\rm{NaHC}}{{\rm{O}}_3}\) khỏi dung dịch hỗn hợp cần dùng phương pháp nào sau đây?
-
A.
Lọc.
-
B.
Kết tinh.
-
C.
Chiết.
-
D.
Nung nóng.
Đáp án : B
Dựa vào phương pháp Solvay.
Để tách NaHCO3 khỏi dung dịch hỗn hợp cần dùng phương pháp kết tinh.
Đáp án B
Thực hiện thí nghiệm về tính điện di ở của các amino acid gồm arginine, glycine, glutamic acid. Xét các thông tín dưới đây:
|
Cấu trúc |
 |
 |
 |
|
pHI |
Arginine
(10,76) |
Glycine (5,97) |
Glutamic acid (3,22) |
là giá trị pH mà tại đó aminoacid tồn tại ở dạng ion lưỡng cực có tổng điện tích dương bằng tổng điện tích âm.
Cho các phát biểu sau:
(a) Tại thì arginine tồn tại chủ yếu ở dạng anion.
(b) Các vệt (1), (2), (3) lần lượt là glutamic acid, glycine, arginine.
(c) Nếu tại thì glycine và glutamic acid đều di chuyển về cực dương.
(d) Tại có thể dùng tính điện di để tách ba amino acid trên.

Số phát biểu đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Đáp án : C
Dựa vào tính chất điện di của amino acid.
(a) sai, tại pH = 6 thì arginine tồn tại chủ yếu ở dạng cation.
(b) đúng
(c) sai, glutamic acid không di chuyển
(d) đúng
Đáp án C
Công thức cấu tạo nào sau đây biểu diễn một ester?
-
A.
\({\rm{H}} - {\rm{COO}} - {\rm{C}}{{\rm{H}}_2} - {\rm{C}}{{\rm{H}}_3}\).
-
B.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{COOH}}\).
-
C.
\({\rm{C}}{{\rm{H}}_3} - {\rm{CO}} - {\rm{C}}{{\rm{H}}_3}\).
-
D.
\({\rm{C}}{{\rm{H}}_3} - {\rm{COON}}{{\rm{H}}_4}\).
Đáp án : A
Dựa vào cấu tạo của ester.
\({\rm{H}} - {\rm{COO}} - {\rm{C}}{{\rm{H}}_2} - {\rm{C}}{{\rm{H}}_3}\)là ester vì có nhóm chức – COO –
Đáp án A
Hai nguyên tố \({\rm{Na}}({\rm{Z}} = 11)\) và \({\rm{Al}}({\rm{Z}} = 13)\) cùng đứng trong một chu kì trong bảng tuần hoàn do chúng có cùng đặc điểm nào sau đây?
-
A.
Số electron ở lớp ngoài cùng.
-
B.
Số electron ở phân lớp ngoài cùng.
-
C.
Số electron độc thân.
-
D.
Số lớp electron.
Đáp án : D
Dựa vào cấu tạo của nguyên tử kim loại.
Na và Al đứng trong một chu kì trong bảng tuần hoàn do chúng có cùng số lớp electron.
Đáp án D
Đạm \({\left( {{\rm{N}}{{\rm{H}}_4}} \right)_2}{\rm{S}}{{\rm{O}}_4}\) được khuyến cáo không nên bón cho đất có pH thấp (đất chua). Nguyên nhân chính của khuyến cáo là
-
A.
làm tăng khả năng bị rửa trôi dinh dưỡng.
-
B.
làm đất mất độ tơi xốp.
-
C.
tăng \({\rm{N}}{{\rm{H}}_3}\) gây độc hại cho cây trồng.
-
D.
làm tăng độ chua của đất.
Đáp án : D
Dựa vào tính chất của phân đạm.
Vì (NH4)2SO4 có môi trường pH < 7 nên không bón cho đất có pH thấp.
Đáp án D
Cho chất X có công thức cấu tạo \({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{NH}} - {\rm{C}}{{\rm{H}}_3}\). Tên của X là
-
A.
isopropylamine.
-
B.
dimethylamine.
-
C.
ethylmethylamine.
-
D.
propan-2-amine
Đáp án : C
Dựa vào tên gọi của amine.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{NH}} - {\rm{C}}{{\rm{H}}_3}\): ethylmethylamine.
Đáp án C
Vôi sống (một hợp chất chứa calcium) dùng làm chất khử chua cho đất. Tên hóa học của hợp chất này là
-
A.
Calcium carbonate.
-
B.
Calcium hydrogen carbonate.
-
C.
Calcium oxide.
-
D.
Calcium hydroxide.
Đáp án : C
Dựa vào hợp chất nhóm IIA.
Vôi sống có công thức là calcium oxide.
Đáp án C
Chất X có công thức cấu tạo là \({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{C}}{{\rm{H}}_2} - {\rm{OH}}\). Chất Y là một đồng phân của X . Chất Y có thể có công thức cấu tạo là
-
A.
\({\rm{C}}{{\rm{H}}_3} - {\rm{CH}}({\rm{OH}}) - {\rm{C}}{{\rm{H}}_2}{\rm{OH}}\).
-
B.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{O}} - {\rm{C}}{{\rm{H}}_3}\).
-
C.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{CHO}}\)
-
D.
\({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{OH}}\).
Đáp án : B
Dựa vào cách viết đồng phân.
Chất Y có công thức là \({\rm{C}}{{\rm{H}}_3} - {\rm{C}}{{\rm{H}}_2} - {\rm{O}} - {\rm{C}}{{\rm{H}}_3}\)
Đáp án B
Kim loại có thể bị uốn cong, dễ rèn, dễ dát mỏng và dễ kéo sợi. Tính chất vật lý nào giúp kim loại có những đặc điểm trên?
-
A.
Tính dẫn nhiệt.
-
B.
Khối lượng riêng lớn.
-
C.
Tính dẻo.
-
D.
Tính dẫn điện.
Đáp án : C
Dựa vào tính chất vật lí của kim loại.
Kim loại dễ bị uốn cong, dễ rèn và dát mỏng là do kim loại có tính dẻo.
Đáp án C
Điện phân là một quá trình .....(1)..... xảy ra tại các điện cực khi có dòng điện .....(2)..... với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Nội dung phù hợp trong các ô trống (1) và (2) lần lượt là
-
A.
khử, một chiều.
-
B.
oxi hóa-khử, một chiều.
-
C.
oxi hóa, một chiều.
-
D.
oxi hóa-khử, xoay chiều.
Đáp án : B
Dựa vào khái niệm của điện phân.
(1) oxi hoá – khử; (2) một chiều.
Đáp án B
Chất X có công thức cấu tạo là \({\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{COOC}}{{\rm{H}}_3}\). Tên gọi của X là
-
A.
ethyl acetate.
-
B.
propyl acetate.
-
C.
methyl butyrate.
-
D.
methyl propionate.
Đáp án : D
Dựa vào tên gọi của ester.
\({\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{COOC}}{{\rm{H}}_3}\): methyl propionate.
Đáp án D
Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trọng đời sống: kích thích quả mau chín, điều chế nhựa làm sản phẩm gia dụng,... Phản ứng hóa học của ethylene với dung dịch như sơ đồ 1: Cơ chế của phản ứng trên xảy ra như sơ đồ 2 :
Nhận định nào sau đây không đúng?

-
A.
Phản ứng trên thuộc loại phản ứng cộng.
-
B.
Hiện tượng của phản ưng là dung dịch bromine bị mất màu.
-
C.
Giai đoạn 1, liên kết đôi phản ứng với tác nhân nucleophile \(\mathop {{B^ - }}\limits^\delta \)r tạo thành phần tử mang điện dương.
-
D.
Giai đoạn 2, phần tử mang điện dương kết hợp với anion \({\rm{B}}{{\rm{r}}^ - }\)tạo thành sản phẩm.
Đáp án : C
Dựa vào cơ chế phản ứng.
C sai, liên kết đôi phản ứng với tác nhân electrophile \(\mathop B\limits^{\delta + } r\)tạo thành phần tử mang điện dương.
Đáp án C
Thí nghiệm về phản ứng của protein.
Buớc 1: Ông nghiệm 1: cho khoảng 1 mL dung dịch \({\rm{HN}}{{\rm{O}}_3}\) đặc vào ống nghiệm.
Bước 2: Ông nghiệm 2: cho khoảng 1 mL dung dịch \({\rm{NaOH}}30\% \) vào ống nghiệm, nhỏ thêm 3-4 giọt dung dịch \({\rm{CuS}}{{\rm{O}}_4}2\% \), lắc đều.
Buớc 3: Cho khoảng 1 mL lòng trắng trứng vào ống nghiệm 1 ; cho khoảng 1 mL dung dịch lòng trắng trứng vào ống nghiệm 2, khuấy đều.
Cho các phát biểu sau:
(a) Thí nghiệm ở ống nghiệm 1 chứng tỏ trong protein có chứa vòng benzene.
(b) Sau bước 2 thu được kết tủa có màu trắng.
(c) Thí nghiệm ở ống nghiệm 1 thể giải thích khi da tay tiếp xúc với \({\rm{HN}}{{\rm{O}}_3}\) đặc thấy màu da chuyển sang vàng.
(d) Thí nghiệm ở ống nghiệm 2 có thể dùng để phân biệt dung dịch lòng trắng trứng với dung dịch đường saccharose.
Số phát biểu đúng là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Đáp án : B
Dựa vào tính chất hoá học của protein.
(c) sai vì sau bước 2 thu được màu tím vàng ở ống nghiệm 2.
Đáp án B
Carbohydrate nào sau đây không phản ứng với thuốc thử tollens khi đun nóng?
-
A.
Maltose.
-
B.
Fructose.
-
C.
Glucose.
-
D.
Saccharose.
Đáp án : D
Dựa vào tính chất của carbohydrate.
Saccharose không có nhóm -OH khử nên không phản ứng với thuốc thử tollens.
Đáp án D
Hình dưới đây là ký hiệu của 6 polymer nhiệt dẻo phổ biến có thể tái chế:
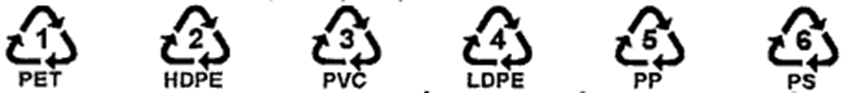
Các ký hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng... để giúp nhận biết vật liệu polymer cũng như thuận lợi cho việc thu gom, tái chế. Polymer có ký hiệu số 5 được điểu chế bẳng phản ứng trùng hợp monomer nào dưới đây?
-
A.
\({\rm{C}}{{\rm{H}}_2} = {\rm{C}}{{\rm{H}}_2}\).
-
B.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {{\rm{C}}_6}{{\rm{H}}_5}\).
-
C.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {\rm{C}}{{\rm{H}}_3}\).
-
D.
\({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {\rm{Cl}}\).
Đáp án : C
Dựa vào kí hiệu của polymer.
PP là kí hiệu của polypropylene được trùng hợp từ monomer \({\rm{C}}{{\rm{H}}_2} = {\rm{CH}} - {\rm{C}}{{\rm{H}}_3}\)
Đáp án C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17-18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
|
Cặp oxi hóa - khử |
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) |
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) |
\({\rm{F}}{{\rm{e}}^{2 + }}/{\rm{Fe}}\) |
\({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\) |
\({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\) |
|
\({E^o}V\) |
\( - 1,676\) |
\( - 0,763\) |
\( - 0,440\) |
0,340 |
0,799 |
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây không xảy ra?
-
A.
\({\rm{Al}} + 3{\rm{A}}{{\rm{g}}^ + } \to {\rm{A}}{{\rm{l}}^{3 + }} + 3{\rm{Ag}}\).
-
B.
\({\rm{Cu}} + {\rm{F}}{{\rm{e}}^{2 + }} \to {\rm{Fe}} + {\rm{C}}{{\rm{u}}^{2 + }}\).
-
C.
\({\rm{Zn}} + {\rm{F}}{{\rm{e}}^{2 + }} \to {\rm{Z}}{{\rm{n}}^{2 + }} + {\rm{Fe}}\).
-
D.
\({\rm{Cu}} + 2{\rm{A}}{{\rm{g}}^ + } \to {\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{Ag}}\).
Đáp án: B
Dựa vào ý nghĩa của thế điện cực của kim loại.
B không xảy ra vì Cu có tính khử yếu hơn Fe.
Đáp án B
Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là \(2,475\;{\rm{V}}\). Hai cặp oxi hoá - khử hình thành pin lần lượt là
-
A.
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) và \({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\).
-
B.
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) và \({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\).
-
C.
\({\rm{F}}{{\rm{e}}^{2 + }}/{\rm{Fe}}\) và \({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\).
-
D.
\({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\) và \({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\).
Đáp án: D
Dựa vào thế điện cực chuẩn của kim loại
Hai cặp oxi hoá – khử hình thành pin lần lượt là \({\rm{A}}{{\rm{l}}^{3 + }}/{\rm{Al}}\)và \({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\)
Đáp án D
Cao su thiên nhiên không dẫn điện, không thấm nước và khí, có tính đàn hồi tốt. Tuy nhiên, cao su thiên nhiên dễ bị lão hoá dưới tác động của không khí, ánh sáng, nhiệt. Ngoài ra, tính đàn hồi của cao su chỉ tồn tại trong một khoảng nhiệt độ hẹp. Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với sulfur) có chứa khoảng 2,0% sulfur về khối lượng.

a) Bản chất của quá trình lưu hoá cao su là phản ứng tăng mạch polymer, tạo ra cầu disulfide (-S-S-) giữa các phân tử polyisoprene tạo thành polymer có cấu tạo mạng lưới không gian.
b) Trong loại cao su lưu hóa trên, cứ trung bình khoảng 46 mắt xích isoprene có một cầu disulfide (-S-S-).
c) Cao su đã̉ được lưu hoá có các ưu điểm tốt hơn về độ đàn hồi, chống thấm khí, chịu ma sát, bền với nhiệt và các tác nhân khác hơn với cao su thiện nhiên và cao su buna.
d) Cao su lưu hóa không tham gia phản ứng cộng.
a) Bản chất của quá trình lưu hoá cao su là phản ứng tăng mạch polymer, tạo ra cầu disulfide (-S-S-) giữa các phân tử polyisoprene tạo thành polymer có cấu tạo mạng lưới không gian.
b) Trong loại cao su lưu hóa trên, cứ trung bình khoảng 46 mắt xích isoprene có một cầu disulfide (-S-S-).
c) Cao su đã̉ được lưu hoá có các ưu điểm tốt hơn về độ đàn hồi, chống thấm khí, chịu ma sát, bền với nhiệt và các tác nhân khác hơn với cao su thiện nhiên và cao su buna.
d) Cao su lưu hóa không tham gia phản ứng cộng.
Dựa vào tính chất hoá học của cao su.
a) đúng
b) đúng
c) đúng
d) sai, cao su lưu hoá có tham gia phản ứng cộng.
Thành phần dịch vị dạ dày gồm là nước, enzyme và hydrochloric acid. Sự có mặt của hydrochloric acid làm cho pH của dịch vị trong khoảng từ . Khi độ acid trong dịch vị dạ dày tăng thì dễ bị ợ chua, ợ hơi, ói mửa, buồn nôn, loét dạ dày, tá tràng. Để làm giảm bớt lượng acid dư trong dịch vị dạ dày người ta thường uống thuốc muối dạ dày "Nabica" từng lượng nhỏ và cách quãng.
a) Công thức hoá học của thuốc muối dạ dày "Nabica" là \({\rm{NaHC}}{{\rm{O}}_3}\).
b) Khi uống thuốc muối dạ dày "Nabica" thì sẽ sinh ra khí carbonmonooxide.
c) Khi uống thuốc muối dạ dày "Nabica" từng lượng nhỏ và cách quãng thì pH của dịch vị dạ dày sẽ tăng từ từ.
d) Nếu có 10 mL dịch vị dạ dày và coi pH của dạ dày hoàn toàn do hydrochloric acid gây ra, để nâng pH của dạ dày từ \({\rm{pH}} = 1\) lên \({\rm{pH}} = 2\) cần dùng hết 0,756 gam thuốc muối dạ dày Nabica (với giả thiét Nabica là nguyên chất và thể tich dung dịch vẫn giũu nguyên sau khi dùng thuốc).
a) Công thức hoá học của thuốc muối dạ dày "Nabica" là \({\rm{NaHC}}{{\rm{O}}_3}\).
b) Khi uống thuốc muối dạ dày "Nabica" thì sẽ sinh ra khí carbonmonooxide.
c) Khi uống thuốc muối dạ dày "Nabica" từng lượng nhỏ và cách quãng thì pH của dịch vị dạ dày sẽ tăng từ từ.
d) Nếu có 10 mL dịch vị dạ dày và coi pH của dạ dày hoàn toàn do hydrochloric acid gây ra, để nâng pH của dạ dày từ \({\rm{pH}} = 1\) lên \({\rm{pH}} = 2\) cần dùng hết 0,756 gam thuốc muối dạ dày Nabica (với giả thiét Nabica là nguyên chất và thể tich dung dịch vẫn giũu nguyên sau khi dùng thuốc).
Dựa vào tính chất hoá học của hợp chất nhóm IA.
a) đúng
b) sai, sinh ra khí CO2.
c) đúng
d) sai vì
n H+ = \(({10^{ - 1}} - {10^{ - 2}}).0,01 = {9.10^{ - 4}}mol\)
H+ + HCO3- → CO2 + H2O
9.10-4 → 9.10-4
m NaHCO3 = 9.10-4.84 = 0,0756g.
Điều chế ethyl acetate trong phòng thí nghiệm được tiển hành như sau:
Bước 1: Cho khoảng 5 mL ethanol và 5 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
Bước 2: Thêm khoảng 2 mL dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) đặc, lắc nhẹ để các chất trộn đều với nhau.
Bước 3: Đặt ống nghiệm vào cốc nước nóng (khoảng \({60^o}{\rm{C}} - {70^o}{\rm{C}}\)) trong khoảng 5 phút, thỉnh thoảng lắc đều hỗn hợp.
Buớc 4: Lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 10 mL dung dịch muối ăn bão hòa thì thấy chất lỏng trong ống nghiệm tách thành hai lớp, lớp trên có mùi thơm đặc trưng.
Bước 5: Đem đo phổ hồng ngoại (IR) của chất lỏng có mùi thơm đặc trưng.
Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:

a) Dung dịch NaCl bão hoà làm giảm độ tan của ester trong nước để ester dễ dàng tách lớp nổi lên trên tốt hơn.
b) Phản ứng xảy ra trong bước 3 có sự tách nhóm OH của phân tử alcohol.
c) Sulfuric acid đặc vừa là chất xúc tác, vừa có tác dụng hút nước, làm tăng hiệu suất tạo ester.
d) Ở bước 5, phổ hồng ngoại xuất hiện peak với số sóng \(1780 - 1650\;{\rm{c}}{{\rm{m}}^{ - 1}}\).
a) Dung dịch NaCl bão hoà làm giảm độ tan của ester trong nước để ester dễ dàng tách lớp nổi lên trên tốt hơn.
b) Phản ứng xảy ra trong bước 3 có sự tách nhóm OH của phân tử alcohol.
c) Sulfuric acid đặc vừa là chất xúc tác, vừa có tác dụng hút nước, làm tăng hiệu suất tạo ester.
d) Ở bước 5, phổ hồng ngoại xuất hiện peak với số sóng \(1780 - 1650\;{\rm{c}}{{\rm{m}}^{ - 1}}\).
Dựa vào tính chất hoá học của ester.
a) đúng
b) sai, phản ứng xảy ra trong bước 3 có sự tách nhóm OH của phân tử carboxylic acid.
c) đúng
d) đúng
Nghiên cứu ảnh hưởng của hiệu điện thế đến phản ứng điện phân, một nhóm học sinh cho rằng, dòng điện có hiệu điện thế càng lớn thì tổng khối lượng chất rắn và chất khí sau điện phân càng lớn. Để thực hiện điểu đó, nhóm học sinh tiển hành như sau:
Bước 1: Lấy cốc thể tích 100 mL, thêm vào đó 2,5 gam \({\rm{CuS}}{{\rm{O}}_4} \cdot 5{{\rm{H}}_2}{\rm{O}}\) và thêm nước vào cho đến khi thể tích dung dịch là 25 mL.
Bược 2: Thêm tiếp dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}1{\rm{M}}\) vào dung dịch cho đến khi thể tích dung dịch đạt 40 mL. Đem cân toàn bộ cốc thì thấy khối lượng là \({{\rm{m}}_1}\) gam.
Bước 3: Lấy hai điện cực than chì, nhúng vào dung dịch trong cốc (hai điện cực không tiếp xúc với nhau) và nối một điện cực với cực dương và nối một điện cực với cực âm của pin điện 2 V.
Bước 4: Thực hiện điện phân trong khoảng thời gian 10 phút, sau đó lấy hai điện cực ra và đem cân lại cốc đựng dung dịch sau điện phân thì khối lượng cốc là \({{\rm{m}}_2}\) gam.
Lặp lại thí nghiệm khi thay dò̀ng điện 2 V bằng các dòng điện \(4\;{\rm{V}},6\;{\rm{V}},8\;{\rm{V}},10\;{\rm{V}}\). Kết quả thí nghiệm:
|
Hiệu điện thế (V) |
2 |
4 |
6 |
8 |
|
\(\Delta m = {m_1} - {m_2}\) |
1,5 |
1,2 |
1,0 |
0,8 |
a) Các quá trình khử ion Cu2+ thành Cu và khử ion H+ thành H2 xảy ra tại điện cực than chì nối với cực âm.
b) Quá trình oxi hóa \({{\rm{H}}_2}{\rm{O}}\) tạo thành khí \({{\rm{O}}_2}\) và ion \({{\rm{H}}^ + }\)xảy ra tại điện cực than chì nối với cực dương.
c) Sự chênh lệch khối lượng trước và sau điện phân đúng bằng khối lượng chất trong dung dịch đã điện phân.
d) Kết quả thí nghiệm chứng tỏ nhận định ban đầu của nhóm học sinh là sai.
a) Các quá trình khử ion Cu2+ thành Cu và khử ion H+ thành H2 xảy ra tại điện cực than chì nối với cực âm.
b) Quá trình oxi hóa \({{\rm{H}}_2}{\rm{O}}\) tạo thành khí \({{\rm{O}}_2}\) và ion \({{\rm{H}}^ + }\)xảy ra tại điện cực than chì nối với cực dương.
c) Sự chênh lệch khối lượng trước và sau điện phân đúng bằng khối lượng chất trong dung dịch đã điện phân.
d) Kết quả thí nghiệm chứng tỏ nhận định ban đầu của nhóm học sinh là sai.
Dựa vào phương pháp điện phân dung dịch.
a) đúng
b) đúng
c) sai vì sự chênh lệch khối lượng trước và sau điện phân không bằng khối lượng chất trong dung dịch đã điện phân.
n CuSO4.5H2O = 2,5 : 250 = 0,01 mol → m Cu điện phân = 0,01.64 = 0,64g
n e trao đổi = \(\frac{{I.t}}{F} = \frac{{2.10.60}}{{96500}} = 0,012mol\)→ n Cu sinh ra = 0,006 mol
d) đúng
Soda \(\left( {{\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}} \right)\) được dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt....
Làm lạnh 100 gam dung dịch \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) bão hòa ở \({20^o}{\rm{C}}\) đến khi thu được dung dịch bão hòa ở \({10^o}{\rm{C}}\) thì tách ra m gam tinh thể \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} \cdot 10{{\rm{H}}_2}{\rm{O}}\). Biết 100 gam nước hòa tan được tối đa lượng \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) ở \({20^o}{\rm{C}}\) và \({10^o}{\rm{C}}\) lần lượt là 21,5 gam và 12,5 gam. Tính giá trị của m. (Làm tròn kết quả đến 1 chữ số sau dấu phảy).
Dựa vào sự kết tinh của hợp chất nhóm IA.
Ở 20oC: 121,5 gam dung dịch Na2CO3 bão hoà chưaá 21,5 gam Na2CO3
→ 100 gam dung dịch Na2CO3 bão hoà chứa:
m Na2CO3 = \(\frac{{100.21,5}}{{121,5}} = 17,7g \to {n_{N{a_2}C{O_3}}} = 0,167mol\)
100 gam dung dịch chứa Na2CO3 (0,167 mol) và H2O (4,572 mol)
ở 10oC
Đặt lượng kết tinh Na2CO3.10H2O là a mol
Khối lượng dung dịch bão hoà: (100 – 286a) gam
Độ tan Na2CO3 ở 10oC
\(\frac{{(0,167 - a).106}}{{100 - 286{\rm{a}}}} = \frac{{12,5}}{{112,5}} \to a = 0,8888\)
→ m = 25,4gam
Đáp án 25,4
Theo QCVN 01-1-2018/BYT, hàm lượng ion sắt tối đa cho phép trong nước sinh hoạt là \(0,30{\rm{mg}}/{\rm{L}}\). Một mẫu nước có hàm lượng ion sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng \({\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3}\) và \({\rm{FeS}}{{\rm{O}}_4}\) với tỉ lệ mol tương ứng là 1: 6. Quá trình loại bỏ hoàn toàn ion sắt trong \(10\;{{\rm{m}}^3}\) mẫu nước trên được thực hiện bằng cách sử dụng \(m\) gam vôi tôi (vừa đủ), sau đó sục không khí. Các quá trình diễn ra theo sơ đồ sau:
\(\begin{array}{l}{\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + {\rm{Ca}}{({\rm{OH}})_2} \to {\rm{Fe}}{({\rm{OH}})_3} + {\rm{CaS}}{{\rm{O}}_4}\\{\rm{FeS}}{{\rm{O}}_4} + {\rm{Ca}}{({\rm{OH}})_2} + {{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}} \to {\rm{Fe}}{({\rm{OH}})_3} + {\rm{CaS}}{{\rm{O}}_4}\end{array}\)
Giả thiết vôi tôi chỉ chứa \({\rm{Ca}}{({\rm{OH}})_2}\). Giá trị của m là bao nhiêu? (Kết quả làm tròn đến hàng đơn vị).
Khối lượng sắt có trong 10 m3 = 0,3.10000 .28 = 84000mg = 84g
n Fe = 84 : 56 = 1,5 mol
Gọi số mol Fe3+ và Fe2+ lần lượt theo tỉ lệ là a và 6a
Bảo toàn nguyên tố Fe có: n Fe = n Fe2+ + 2n Fe3+
→ 1,5 = 2.a + 6a → a = 0,1875 mol
Vậy n Fe2+ = 6.0,1875 = 1,125 mol; n Fe3+ = 0,1875.2 = 0,375 mol
Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaSO4 (1)
a→ 3a
4FeSO4 + 4Ca(OH)2 + O2 + 2H2O → 4Fe(OH)3 + 4CaSO4 (2)
6a → 6a
n Ca(OH)2 = 9a= 9.0,1875 = 1,6875 mol → m Ca(OH)2 = 1,6875.74 = 125g
Đáp án 125
Cho các thông tin sau đây về tinh bột:
(1) Là một polysaccharide.
(2) Chứa liên kết \(\alpha - 1,4\)-glycoside.
(3) Thủy phân đến cùng trong môi trường acid, thu được glucose.
(4) Phản ứng được với thuốc thử tollens.
(5) Hồ tinh bột phản ứng với dung dịch iodine tạo hợp chất màu xanh tím.
(6) Trong cơ thể, enzyme \(\alpha \)-amilase thúc đẩy quá trình thủy phân tinh bột.
Tổng số phát biểu đúng là bao nhiêu?
Dựa vào tính chất của tinh bột
(1) đúng
(2) đúng
(3) đúng
(4) sai, không có phản ứng với thuộc thử tollens.
(5) đúng
(6) đúng
Đáp án 5
Cho các nhận định sau:
(1) Aniline phản ứng với dung dịch \({\rm{B}}{{\rm{r}}_2}\) thu được chất kết tủa trắng.
(2) \({\rm{C}}{{\rm{H}}_3} - {\rm{CH}}\left( {{\rm{N}}{{\rm{H}}_2}} \right) - {\rm{C}}{{\rm{H}}_3}\) là amine bậc hai.
(3) \({\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{N}}{{\rm{H}}_2}\) phản ứng với \({\rm{HN}}{{\rm{O}}_2}\) ở nhiệt độ thường thu được chất khí không màu.
(4) Để khử mùi tanh của cá (thường do trimethylamine gây ra) có thể dùng giấm ăn.
Sắp xếp các nhận định đúng theo số thứ tự tăng dần (ví dụ \(123,1234, \ldots \). ).
Dựa vào tính chất hoá học của amine.
(2) sai, \({\rm{C}}{{\rm{H}}_3} - {\rm{CH}}\left( {{\rm{N}}{{\rm{H}}_2}} \right) - {\rm{C}}{{\rm{H}}_3}\)là amine bậc 1
Đáp án 134
Xét quá trình đốt cháy ethanol \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}(l):{{\rm{C}}_2}{{\rm{H}}_5}{\rm{O}}{{\rm{H}}_{(l)}} + 3{{\rm{O}}_{2(g)}} \to 2{\rm{C}}{{\rm{O}}_{2(g)}} + 3{{\rm{H}}_2}{{\rm{O}}_{(l)}}\) Cho biết enthalpy tạo thành \(\left( {{\Delta _{\rm{f}}}{\rm{H}}_{298}^0} \right)\) của các chất như sau:
|
Chất |
\({\bf{C}}{{\bf{O}}_2}(g)\) |
\({{\bf{H}}_2}{\bf{O}}(l)\) |
\({{\bf{C}}_2}{{\bf{H}}_5}{\bf{OH}}(l)\) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{298}^0(\;{\rm{kJ}}/{\rm{mol}})\) |
\( - 393,5\) |
\( - 285,8\) |
-267 |
Cần x gam \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\) đốt cháy để cung cấp nhiệt dùng để đun 1,5 lít nước từ 25oC đến 100oC biết rằng có \(40\% \) lượng nhiệt đốt cháy bị thất thoát ra ngoài môi trường; biết rằng để tăng nhiệt độ của 1 gam nước thêm 1oC cần \(4,2\;{\rm{J}}\) nhiệt; khối lượng riêng của nước là \(1\;{\rm{g}}/{\rm{mL}}\).
Xét quá trình đốt cháy propane \({{\rm{C}}_3}{{\rm{H}}_8}(g)\) và butane \({{\rm{C}}_4}{{\rm{H}}_{10}}(g)\) :
\(\begin{array}{*{20}{l}}{{{\rm{C}}_3}{{\rm{H}}_8}(g) + 5{{\rm{O}}_2}(g) \to 3{\rm{C}}{{\rm{O}}_2}(g) + 4{{\rm{H}}_2}{\rm{O}}(l)}&{{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 2220\;{\rm{kJ}}}\\{{{\rm{C}}_4}{{\rm{H}}_{10}}(g) + 13/2{{\rm{O}}_2}(g) \to 4{\rm{C}}{{\rm{O}}_2}(g) + 5{{\rm{H}}_2}{\rm{O}}(l)}&{{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 2874\;{\rm{kJ}}.}\end{array}\)
Nếu thay lượng nhiệt do \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\) đốt chạ́y ở trên bằng lượng nhiệt lấy từ quá trình đốt cháy y gam khí hóa lỏng LPG chứa hỗn hợp propane và butane theo tỉ lệ mol tương ứng 2: 3. Tính tổng \({\rm{x}} + {\rm{y}}\)? (Kết quả làm tròn đến hàng đơn vị).
Tính biến thiên enthalpy của 2 phản ứng.
Gọi số mol C3H8 và C4H10 lần lượt là 2a và 3a mol
Lượng nhiệt toả ra khi đốt cháy y gam khí LPG là: 2a.2220 + 3a.2874
C2H5OH + 3O2 → 2CO2 + 3H2O
\(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^oC{O_2} + 3.{\Delta _f}H_{298}^o{H_2}{\rm{O}} - {\Delta _f}H_{298}^o{C_2}{H_5}{\rm{O}}H\\ = 2.( - 393,5) + 3.( - 285,8) - ( - 267) = - 1377,4kJ\end{array}\)
n C2H5OH = x : 46 mol
Lượng nhiệt toả ra khi đốt cháy x gam C2H5OH = \(\frac{x}{{46}}.1377,4kJ\)
Lượng nhiệt cần để đung 1,5 lít nước là: Q = m.C.∆T = 1,5.4,2.(100-25) = 472,5 kJ
Lượng nhiệt thực tế đã cung cấp là: 472,5 : 60% = 787,5 kJ
Ta có: \(\frac{x}{{46}}.1377,4kJ\)= 787,5 → x = 26,3g
2a.2220 + 3a.2874 = 787,5 → a = \(\frac{{75}}{{1244}}mol\)
m LPG =\(\frac{{75}}{{1244}}.2.44 + \frac{{75}}{{1244}}.3.58 = 15,8g\)
tổng x + y = 42
Đáp án 42
Cho công thức cấu tạo của phân tử chất giặt rửa sodium laurylsulfate sau đây:

Phần kị nước của phân tử trên có tổng số nguyên tử là bao nhiêu ?
Dựa vào cấu tạo của sodium laurylsulfate.
Phần kị nước là phần hydrocarbon có công thức – C12H25
Đáp án 37
I. Trắc nghiệm
Vào mùa hè, trong một số khách sạn hay nhà hàng
Để chuyển hóa dầu mỡ động thực vật thành xà phòng người ta thực hiện quá trình
Cho ba dung dịch có cùng nồng độ mol sau:
Thức uống chứa cồn như rượu, bia, nước trái cây lên men
Cho biết số hiệu nguyên tử của sodium là 11. Vị trí của sodium trong bảng tuần hoàn là
Điện phân dung dịch CuSO4 với anode
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau
Chất nào sau đây thuộc loại disaccharide?
Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu
Tro thực vật được sử dụng như một loại phân bón
Cho khối lượng riêng của các chất như bảng sau:
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Fe = 56
Tinh bột chứa hỗn hợp chất nào sau đây?
Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Cấu trúc mạch vòng của carbohydrate nào sau đây không có nhóm -OH hemiacetal hoặc hemiketal?
Trong nước, thế điện cực chuẩn của kim loại Mn+/M
Chất X có công thức cấu tạo là CH3CH2COOCH3. Tên gọi của X là
Các bài khác cùng chuyên mục









Danh sách bình luận