Đề tham khảo thi THPT môn Hóa - Đề số 8 (hay, chi tiết)
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
Đề bài
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
-
A.
1s22s2
-
B.
1s22s22p2
-
C.
1s22s32p63s2.
-
D.
1s22s22p73s1.
Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
-
A.
NH3.
-
B.
\(NH_4^ + \)
-
C.
\(NO_3^ - \).
-
D.
N2.
Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không có hấp thụ ở vùng 1750-1600 cm-1 của nhóm C=O?
-
A.
Alcohol.
-
B.
Ketone.
-
C.
Ester.
-
D.
Aldehyde.
-
A.
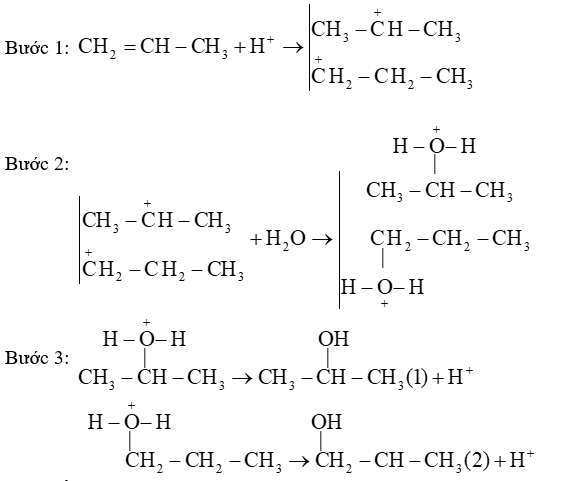
Sản phẩm (1) của phản ứng là sản phẩm chính theo quy tắc Markovnikov.
-
B.
Ở bước 1, quá trình proton hóa liên kết đôi C=C của propene tạo thành carbocation.
-
C.
Ở bước 2, quá trình tách proton để tạo thành alcohol.
-
D.
Nếu thay H2O bằng HBr thì cơ chế phản ứng xảy ra tương tự.
Dầu mỡ (thực phẩm) để lâu bị ôi thiu là do
-
A.
chất béo bị vữa ra.
-
B.
chất béo bị thủy phân với nước trong không khí.
-
C.
bị vi khuẩn tấn công.
-
D.
chất béo bị oxi hóa chậm bởi oxygen không khí.
Hợp chất nào sau đây chứa nhóm chức ester?
-
A.
CH3COOC2H5.
-
B.
СН3СООН.
-
C.
H2N-CH2-COOH.
-
D.
CH3СНО.
Chất nào sau đây thuộc loại amine bậc một?
-
A.
(CH3)3N.
-
B.
CH3NH2.
-
C.
CH3CH2NHCH3.
-
D.
CH3NHCH3.
Vai trò nào sau đây không phải của protein
-
A.
Vận chuyển các chất dinh dưỡng ra, vào tế bào.
-
B.
Lưu trữ một số chất cần thiết cho tế bào.
-
C.
Duy trì pH của máu.
-
D.
Là thành phần tạo nên cao su.
Cho hình vẽ sau của amino acid X trong môi trường pH = 6 dưới tác dụng của điện trường:
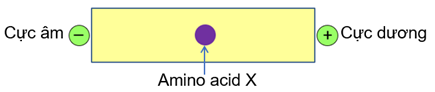
X không thể là
-
A.
Alanine.
-
B.
Valine.
-
C.
Glycine.
-
D.
Lysine.
Polymer Y ký hiệu nhựa số 2 – HDPE (High Density Polyethylene). Đây là loại nhựa nhiệt dẻo mật độ cao được ứng dụng nhiều trong việc chế tạo các bình đựng như bình đựng sữa, dầu ăn, một số túi nhựa, bình đựng chất tẩy rửa, đồ chơi,...Vật liệu làm từ Y thường có thể tái chế được. Đây là loại nhựa được các chuyên gia khuyên nên sử dụng vì chúng có độ an toàn cao hơn so với các loại nhựa khác. Vậy polymer Y là
-
A.
Poly(methyl methacrylate).
-
B.
Nylon-6,6.
-
C.
Polyethylene.
-
D.
Polyisoprene.
Để tạo ra một loại cao su có cấu trúc dạng mạch không gian, làm tăng cao tính bền cơ học, khả năng chịu được sự ma sát, va chạm người ta sử dụng phương pháp kết hợp giữa nguyên tố S (sulfur) với cao su ở điều kiện thích hợp. Loại cao su tạo thành có tên là
-
A.
cao su buna-S.
-
B.
cao su buna-N.
-
C.
cao su buna.
-
D.
cao su lưu hóa.
Sức điện động chuẩn của các pin điện hóa: Zn – Cu là 1,1V; Cu – Ag là 0,46V. Biết thế điện cực chuẩn \({\rm{E}}_{^{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}}^0\)= +0,8V. Thế điện cực chuẩn \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}}\)và \({\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}}\)có giá trị lần lượt là
-
A.
– 0,76V và + 0,34V.
-
B.
– 1,46V và – 0,34V.
-
C.
+ 1,56V và + 0,64V.
-
D.
– 1,56V và + 0,64V.
Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
|
Cặp oxi hóa – khử |
Na+/Na |
Mg2+/Mg |
Al3+/A1 |
Cu2+/Cu |
|
Thế điện cực chuẩn (V) |
-2,713 |
-2,356 |
-1,676 |
+0,340 |
Ion kim loại nào sau đây bị khử tại cathode khi điện phân (với điện graphite) dung dịch muối sulfate tương ứng?
-
A.
Mg2+.
-
B.
Na+.
-
C.
Cu2+.
-
D.
Al3+.
Liên kết trong mạng tinh thể kim loại là loại liên kết nào sau đây?
-
A.
Ion.
-
B.
Cộng hóa trị.
-
C.
Van der Waals.
-
D.
Kim loại.
Hiện tượng nào sau đây không phải là hiện tượng ăn mòn kim loại?
-
A.
Ống thép bị gỉ sắt màu nâu đỏ.
-
B.
Vòng bạc bị xỉn màu.
-
C.
Công trình bằng đá bị ăn mòn bởi mưa acid.
-
D.
Chuông đồng bị gỉ đồng màu xanh.
Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng
-
A.
Nhường 2 electron.
-
B.
Nhận 2 electron.
-
C.
Nhận 1 electron.
-
D.
Nhường 1 electron.
Khi đun nóng nước tự nhiên, muối nào sau đây bị phân huỷ tạo thành cặn đá vôi trong phích nước, ấm đun nước?
-
A.
Ca3(PO4)2.
-
B.
CaCl2.
-
C.
CaSO4.
-
D.
Ca(HCO3)2.
Hiện tượng điện phân có nhiều ứng dụng trong thực tiễn sản xuất và đời sống như luyện kim, tinh chế kim loại, mạ điện. Điện phân dung dịch CuSO4 loãng với điện cực trơ, đến khi cathode bắt đầu xuất hiện bọt khí thì dừng điện phân, thu được dung dịch X
a) Trong quá trình điện phân dung dịch CuSO4, khối lượng điện cực cathode tăng.
b) Thay dung dịch CuSO4 bằng dung dịch CuCl2 thì bản chất quá trình điện phân không thay đổi.
c) Ở cực dương xảy ra quá trình khử.
d) Trong quá trình điện phân pH của dung dịch giảm.
a) Phân tử cellulose được tạo thành từ nhiều đơn vị α -glucose liên kết với nhau bằng liên kết α-1,4-glycoside.
b) Cellulose có công thức phân tử (C6H10O5)n, mỗi mắt xích của cellulose chứa 5 nhóm -OH.
c) Khi cho cellulose tác dụng với hỗn hợp HNO3 đặc và H2SO4 đặc ở điều kiện thích hợp có thể thu được cellulose trinitrate là chất dễ cháy và nổ mạnh, dùng để chế tạo thuốc súng không khói.
d) Cellulose không tan trong nước nóng nhưng tan được trong nước Schweizer.
Trong phòng thí nghiệm, ethyl acetate được điều chế từ acetic acid và ethanol, xúc tác H2SO4 đặc, theo mô hình thí nghiệm sau:
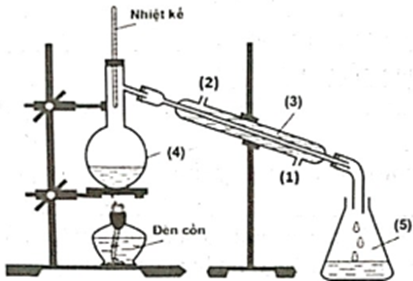
Biết nhiệt độ trong bình cầu (4) giữ ở mức 65-70°C, nhiệt độ trong ống sinh hàn (3) duy trì ở 25°C. Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, ethanol và ethyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
|
Liên kết |
O-H (alcohol) |
O-H (carboxylic acid) |
C=O (ester, carboxylic acid) |
|
Số sóng (cm-1) |
3650 - 3200 |
3300 - 2500 |
1780 - 1650 |
a) Dựa vào phổ hồng ngoại, phân biệt được acetic acid, ethanol và ethyl acetate.
b) Vai trò của ống sinh hàn (3) để ngưng tụ hơi; nước vào từ (1), nước ra ở (2).
c) Nhiệt độ phản ứng ở bình cầu (4) càng cao thì phản ứng điều chế ethyl acetate xảy ra càng nhanh.
d) Chất lỏng trong bình hứng (5) có ethyl acetate.
Muối NiCl2 khan có màu vàng. Hòa tan một lượng muối này vào nước, thu được dung dịch màu xanh lá cây [Ni(H2O)6]2+. Thêm dung dịch NaOH vào dung dịch này, xuất hiện kết tủa màu xanh lá cây (chất Y).
a) NiCl2 là hợp chất của kim loại chuyển tiếp.
b) Phức chất X có chứa phối tử aqua (phối tử H2O).
c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
d) Chất Y là Ni(OH)2.
Để sản xuất m kg xà phòng (có chứa 75% muối sodium của acid béo, còn lại là chất độn), người ta xà phòng hóa hoàn toàn 1 tấn chất béo trung tính bằng dung dịch chứa 150 kg NaOH vừa đủ. Xác định giá trị m. Làm tròn kết quả đến hàng đơn vị.
Đáp án:
Một nhà máy sản xuất túi nylon từ HDPE cần sản xuất túi đựng hình chữ nhật (có kích thước là 20cm x 30cm, bề dày của mỗi lớp nylon là 0,02cm. Biết hiệu suất phản ứng trùng hợp ethylene để điều chế HDPE là 60%, quá trình chuyển nhựa thành túi có hiệu suất là 95% và biết khối lượng riêng của nhựa HDPE là 0,95 g/cm3. Khối lượng nguyên liệu ethylene dùng để sản xuất đơn hàng 100.000 túi trên bằng bao nhiêu tấn? (kết quả làm tròn đến hàng đơn vị)
Đáp án:
Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
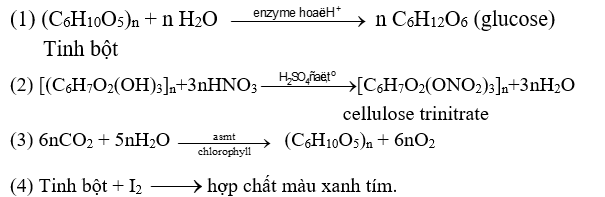
Gán số thứ tự các phương trình theo tên gọi : Phản ứng quang hợp, cellulose phản ứng với nitric acid, tinh bột phản ứng ứng màu với dung dịch iodine và thủy phân tinh bột.
Đáp án
Số đồng phân amine bậc 3 của amine có công thức phân tử C5H13N là
Đáp án:
Ethylene (C2H4) là một trong những nguyên liệu quan trọng trong công nghiệp hóa dầu. Ethylene có thể được sản xuất từ ethane (C2H6) thông qua phản ứng dehydrogen hóa :
(1) C2H6 (g) → C2H4 (g) + H2 (g)
Phản ứng dehydrogen hóa là phản ứng thu nhiệt, năng lượng cần thiết được cung cấp bằng cách đốt cháy một phần ethane:
(2) C2H6 (g) + 7/2O2(g) → 2CO2 (g) + 3H2O(g)
Giả sử hiệu suất của cả hai phản ứng là 100%. Tính khối lượng ethane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 1 tấn C2H4 (g), biết 60% lượng nhiệt tỏa ra từ phản ứng (2) được sử dụng để cung cấp cho phản ứng (1).
Bảng nhiệt tạo thành chuẩn (\({\Delta _{\rm{f}}}H_{298}^o\)) của các chất (kJ/mol):
|
Chất |
C2H6 (g) |
C2H4 (g) |
H2(g) |
O2 (g) |
CO2(g) |
H2O(g) |
|
\({\Delta _{\rm{f}}}H_{298}^o\)(kJ mol⁻¹) |
-84,7 |
52,3 |
0 |
0 |
-393,5 |
-241,8 |
Đáp án:
Cho bảng giá trị sau:
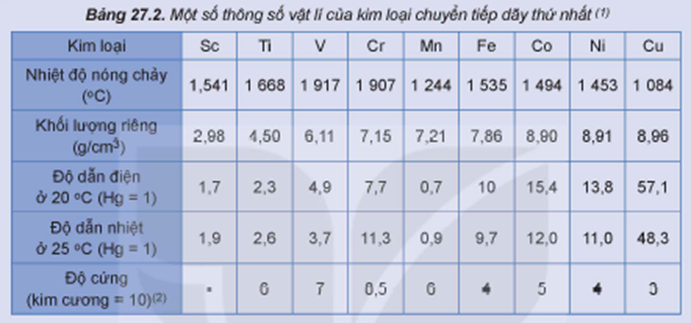
Số kim loại khó nóng chảy hơn Be (biết nhiệt dộ nóng chảy của Be là 12870C) là bao nhiêu?
Đáp án:
Lời giải và đáp án
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
-
A.
1s22s2
-
B.
1s22s22p2
-
C.
1s22s32p63s2.
-
D.
1s22s22p73s1.
Đáp án : A
Dựa vào cách viết cấu hình electron.
Vì Be có Z = 8 nên cấu hình của Be là: 1s2 2s2.
Đáp án A
Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
-
A.
NH3.
-
B.
\(NH_4^ + \)
-
C.
\(NO_3^ - \).
-
D.
N2.
Đáp án : B
Dựa vào khái niệm acid – base theo bronster – lowry.
\(NH_4^ + \) đóng vai trò là acid vì nhường proton H+ tạo thành NH3 và OH-
Đáp án B
Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không có hấp thụ ở vùng 1750-1600 cm-1 của nhóm C=O?
-
A.
Alcohol.
-
B.
Ketone.
-
C.
Ester.
-
D.
Aldehyde.
Đáp án : A
Dựa vào số sóng của từng nhóm chức.
Alcohol có nhóm – OH ở vùng 3500 – 3200 cm-1.
Đáp án A
-
A.
Sản phẩm (1) của phản ứng là sản phẩm chính theo quy tắc Markovnikov.
-
B.
Ở bước 1, quá trình proton hóa liên kết đôi C=C của propene tạo thành carbocation.
-
C.
Ở bước 2, quá trình tách proton để tạo thành alcohol.
-
D.
Nếu thay H2O bằng HBr thì cơ chế phản ứng xảy ra tương tự.
Đáp án : C
Dựa vào cơ chế phản ứng của propene với H2O.
C sai, do ở bước 2 là quá trình cộng.
Đáp án C
Dầu mỡ (thực phẩm) để lâu bị ôi thiu là do
-
A.
chất béo bị vữa ra.
-
B.
chất béo bị thủy phân với nước trong không khí.
-
C.
bị vi khuẩn tấn công.
-
D.
chất béo bị oxi hóa chậm bởi oxygen không khí.
Đáp án : D
Dựa vào tính chất hóa học của dầu mỡ.
Dầu mỡ để lâu bị ôi thiu là do chất béo bị oxi hóa chậm bởi oxygen trong không khí chuyển thành aldehyde có mùi hôi.
Đáp án D
Hợp chất nào sau đây chứa nhóm chức ester?
-
A.
CH3COOC2H5.
-
B.
СН3СООН.
-
C.
H2N-CH2-COOH.
-
D.
CH3СНО.
Đáp án : A
Dựa vào công thức cấu tạo của ester.
CH3COOC2H5. Có chứa nhóm chức – COO – .
Đáp án A
Chất nào sau đây thuộc loại amine bậc một?
-
A.
(CH3)3N.
-
B.
CH3NH2.
-
C.
CH3CH2NHCH3.
-
D.
CH3NHCH3.
Đáp án : B
Amine bậc một có dạng RNH2.
CH3NH2 thuộc amine bậc một.
Đáp án B
Vai trò nào sau đây không phải của protein
-
A.
Vận chuyển các chất dinh dưỡng ra, vào tế bào.
-
B.
Lưu trữ một số chất cần thiết cho tế bào.
-
C.
Duy trì pH của máu.
-
D.
Là thành phần tạo nên cao su.
Đáp án : D
Dựa vào ứng dụng của protein.
Protein không phải là thành phần tạo nên cao su.
Đáp án D
Cho hình vẽ sau của amino acid X trong môi trường pH = 6 dưới tác dụng của điện trường:

X không thể là
-
A.
Alanine.
-
B.
Valine.
-
C.
Glycine.
-
D.
Lysine.
Đáp án : D
Dựa vào tính điện di của amino acid.
X không phải là lysine vì lysine sẽ di chuyển về điện cực âm trong pH = 6.
Đáp án D
Polymer Y ký hiệu nhựa số 2 – HDPE (High Density Polyethylene). Đây là loại nhựa nhiệt dẻo mật độ cao được ứng dụng nhiều trong việc chế tạo các bình đựng như bình đựng sữa, dầu ăn, một số túi nhựa, bình đựng chất tẩy rửa, đồ chơi,...Vật liệu làm từ Y thường có thể tái chế được. Đây là loại nhựa được các chuyên gia khuyên nên sử dụng vì chúng có độ an toàn cao hơn so với các loại nhựa khác. Vậy polymer Y là
-
A.
Poly(methyl methacrylate).
-
B.
Nylon-6,6.
-
C.
Polyethylene.
-
D.
Polyisoprene.
Đáp án : C
Dựa vào kí hiệu của polymer Y.
Polymer Y là polyethylene.
Đáp án C
Để tạo ra một loại cao su có cấu trúc dạng mạch không gian, làm tăng cao tính bền cơ học, khả năng chịu được sự ma sát, va chạm người ta sử dụng phương pháp kết hợp giữa nguyên tố S (sulfur) với cao su ở điều kiện thích hợp. Loại cao su tạo thành có tên là
-
A.
cao su buna-S.
-
B.
cao su buna-N.
-
C.
cao su buna.
-
D.
cao su lưu hóa.
Đáp án : D
Dựa vào tính chất của loại cao su trên.
Cao su kết hợp giữa nguyên tố S được gọi là cao su lưu hóa.
Đáp án D
Sức điện động chuẩn của các pin điện hóa: Zn – Cu là 1,1V; Cu – Ag là 0,46V. Biết thế điện cực chuẩn \({\rm{E}}_{^{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}}^0\)= +0,8V. Thế điện cực chuẩn \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}}\)và \({\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}}\)có giá trị lần lượt là
-
A.
– 0,76V và + 0,34V.
-
B.
– 1,46V và – 0,34V.
-
C.
+ 1,56V và + 0,64V.
-
D.
– 1,56V và + 0,64V.
Đáp án : A
Dựa vào công thức tính sức điện động của pin.
\(E_{pin}^o = E_{Ag + /Ag}^o - E_{Cu2 + /Cu}^o \to E_{Cu2 + /Cu}^o = 0,8 - 0,46 = 0,34V\)
\(E_{Zn - Cu}^o = E_{Cu2 + /Cu}^o - E_{Zn2 + /Zn}^o \to E_{Zn2 + /Zn}^o = 0,34 - 1,1 = - 0,76V\)
Đáp án A
Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
|
Cặp oxi hóa – khử |
Na+/Na |
Mg2+/Mg |
Al3+/A1 |
Cu2+/Cu |
|
Thế điện cực chuẩn (V) |
-2,713 |
-2,356 |
-1,676 |
+0,340 |
Ion kim loại nào sau đây bị khử tại cathode khi điện phân (với điện graphite) dung dịch muối sulfate tương ứng?
-
A.
Mg2+.
-
B.
Na+.
-
C.
Cu2+.
-
D.
Al3+.
Đáp án : C
Dựa vào ý nghĩa của thế điện cực.
Cu2+/Cu bị khử tại cathode.
Đáp án C
Liên kết trong mạng tinh thể kim loại là loại liên kết nào sau đây?
-
A.
Ion.
-
B.
Cộng hóa trị.
-
C.
Van der Waals.
-
D.
Kim loại.
Đáp án : D
Dựa vào khái niệm liên kết kim loại.
Liên kết trong mạng tinh thể kim loại là loại liên kết kim loại.
Đáp án D
Hiện tượng nào sau đây không phải là hiện tượng ăn mòn kim loại?
-
A.
Ống thép bị gỉ sắt màu nâu đỏ.
-
B.
Vòng bạc bị xỉn màu.
-
C.
Công trình bằng đá bị ăn mòn bởi mưa acid.
-
D.
Chuông đồng bị gỉ đồng màu xanh.
Đáp án : C
Dựa vào khái niệm ăn mòn kim loại.
Công trình bằng đá bị ăn mòn bởi mưa acid là phản ứng giữa acid và muối không phải hiện tượng ăn mòn kim loại.
Đáp án C
Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng
-
A.
Nhường 2 electron.
-
B.
Nhận 2 electron.
-
C.
Nhận 1 electron.
-
D.
Nhường 1 electron.
Đáp án : D
Dựa vào tính chất hóa học của kim loại.
Mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng nhường 1 electron.
Đáp án D
Khi đun nóng nước tự nhiên, muối nào sau đây bị phân huỷ tạo thành cặn đá vôi trong phích nước, ấm đun nước?
-
A.
Ca3(PO4)2.
-
B.
CaCl2.
-
C.
CaSO4.
-
D.
Ca(HCO3)2.
Đáp án : D
Dựa vào tính chất của hợp chất nhóm IIA.
Khi đun nóng Ca(HCO3)2 tạo thành CaCO3 (cặn đá vôi)
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Đáp án D
Hiện tượng điện phân có nhiều ứng dụng trong thực tiễn sản xuất và đời sống như luyện kim, tinh chế kim loại, mạ điện. Điện phân dung dịch CuSO4 loãng với điện cực trơ, đến khi cathode bắt đầu xuất hiện bọt khí thì dừng điện phân, thu được dung dịch X
a) Trong quá trình điện phân dung dịch CuSO4, khối lượng điện cực cathode tăng.
b) Thay dung dịch CuSO4 bằng dung dịch CuCl2 thì bản chất quá trình điện phân không thay đổi.
c) Ở cực dương xảy ra quá trình khử.
d) Trong quá trình điện phân pH của dung dịch giảm.
a) Trong quá trình điện phân dung dịch CuSO4, khối lượng điện cực cathode tăng.
b) Thay dung dịch CuSO4 bằng dung dịch CuCl2 thì bản chất quá trình điện phân không thay đổi.
c) Ở cực dương xảy ra quá trình khử.
d) Trong quá trình điện phân pH của dung dịch giảm.
Dựa vào ứng dụng của điện phân dung dịch.
a) đúng
b) sai, bản chất thay đổi do Cl2 bị điện phân ở cực anode.
c) sai, cực dương xảy ra quá trình oxi hóa.
d) đúng
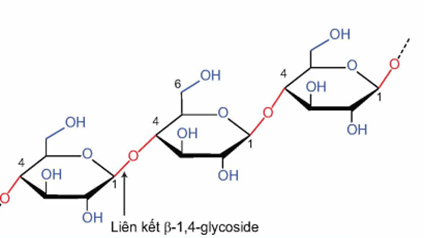
a) Phân tử cellulose được tạo thành từ nhiều đơn vị α -glucose liên kết với nhau bằng liên kết α-1,4-glycoside.
b) Cellulose có công thức phân tử (C6H10O5)n, mỗi mắt xích của cellulose chứa 5 nhóm -OH.
c) Khi cho cellulose tác dụng với hỗn hợp HNO3 đặc và H2SO4 đặc ở điều kiện thích hợp có thể thu được cellulose trinitrate là chất dễ cháy và nổ mạnh, dùng để chế tạo thuốc súng không khói.
d) Cellulose không tan trong nước nóng nhưng tan được trong nước Schweizer.
a) Phân tử cellulose được tạo thành từ nhiều đơn vị α -glucose liên kết với nhau bằng liên kết α-1,4-glycoside.
b) Cellulose có công thức phân tử (C6H10O5)n, mỗi mắt xích của cellulose chứa 5 nhóm -OH.
c) Khi cho cellulose tác dụng với hỗn hợp HNO3 đặc và H2SO4 đặc ở điều kiện thích hợp có thể thu được cellulose trinitrate là chất dễ cháy và nổ mạnh, dùng để chế tạo thuốc súng không khói.
d) Cellulose không tan trong nước nóng nhưng tan được trong nước Schweizer.
Dựa vào cấu trúc phân tử cellulose.
a) sai, phân tử cellulose được tạo thành từ nhiều đơn vị β – glucose liên kết với nhau bằng liên kết β – 1,4 – glycoside.
b) sai, mỗi mắt xích chứa 3 nhóm – OH.
c) đúng
d) đúng
Trong phòng thí nghiệm, ethyl acetate được điều chế từ acetic acid và ethanol, xúc tác H2SO4 đặc, theo mô hình thí nghiệm sau:

Biết nhiệt độ trong bình cầu (4) giữ ở mức 65-70°C, nhiệt độ trong ống sinh hàn (3) duy trì ở 25°C. Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, ethanol và ethyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
|
Liên kết |
O-H (alcohol) |
O-H (carboxylic acid) |
C=O (ester, carboxylic acid) |
|
Số sóng (cm-1) |
3650 - 3200 |
3300 - 2500 |
1780 - 1650 |
a) Dựa vào phổ hồng ngoại, phân biệt được acetic acid, ethanol và ethyl acetate.
b) Vai trò của ống sinh hàn (3) để ngưng tụ hơi; nước vào từ (1), nước ra ở (2).
c) Nhiệt độ phản ứng ở bình cầu (4) càng cao thì phản ứng điều chế ethyl acetate xảy ra càng nhanh.
d) Chất lỏng trong bình hứng (5) có ethyl acetate.
a) Dựa vào phổ hồng ngoại, phân biệt được acetic acid, ethanol và ethyl acetate.
b) Vai trò của ống sinh hàn (3) để ngưng tụ hơi; nước vào từ (1), nước ra ở (2).
c) Nhiệt độ phản ứng ở bình cầu (4) càng cao thì phản ứng điều chế ethyl acetate xảy ra càng nhanh.
d) Chất lỏng trong bình hứng (5) có ethyl acetate.
Dựa vào số sóng của các nhóm chức.
a) đúng
b) đúng
c) sai, nhiệt độ càng cao, ethyl acetate bay hơi.
d) đúng
Muối NiCl2 khan có màu vàng. Hòa tan một lượng muối này vào nước, thu được dung dịch màu xanh lá cây [Ni(H2O)6]2+. Thêm dung dịch NaOH vào dung dịch này, xuất hiện kết tủa màu xanh lá cây (chất Y).
a) NiCl2 là hợp chất của kim loại chuyển tiếp.
b) Phức chất X có chứa phối tử aqua (phối tử H2O).
c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
d) Chất Y là Ni(OH)2.
a) NiCl2 là hợp chất của kim loại chuyển tiếp.
b) Phức chất X có chứa phối tử aqua (phối tử H2O).
c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
d) Chất Y là Ni(OH)2.
Dựa vào tính chất hóa học của phức chất.
a) đúng
b) đúng
c) sai, liên kết giữa nguyên tử trung tâm và phối tử là liên kết cho – nhận.
d) đúng
Để sản xuất m kg xà phòng (có chứa 75% muối sodium của acid béo, còn lại là chất độn), người ta xà phòng hóa hoàn toàn 1 tấn chất béo trung tính bằng dung dịch chứa 150 kg NaOH vừa đủ. Xác định giá trị m. Làm tròn kết quả đến hàng đơn vị.
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của chất béo.
n NaOH = 150 : 40 = 3,75 k.mol
=> n glycerol = 3,75 : 3 = 1,25 k.mol
Bảo toàn khối lượng: m chất béo + m NaOH = m muối + m glycerol
=> m muối = 1000 + 150 – 1,25.92 = 1035kg
m xà phòng thu được là: 1035 : 75% = 1380kg
Một nhà máy sản xuất túi nylon từ HDPE cần sản xuất túi đựng hình chữ nhật (có kích thước là 20cm x 30cm, bề dày của mỗi lớp nylon là 0,02cm. Biết hiệu suất phản ứng trùng hợp ethylene để điều chế HDPE là 60%, quá trình chuyển nhựa thành túi có hiệu suất là 95% và biết khối lượng riêng của nhựa HDPE là 0,95 g/cm3. Khối lượng nguyên liệu ethylene dùng để sản xuất đơn hàng 100.000 túi trên bằng bao nhiêu tấn? (kết quả làm tròn đến hàng đơn vị)
Đáp án:
Đáp án:
Dựa vào quá trình điều chế HDPE.
Thể tích 100.000 túi HDPE là: 20.30.0,02.100000 = 1.200.000 cm3
Khối lượng HDPE tạo thành là: 1.200.000 .0,95 = 1.140.000g
m ethylene = \(\frac{{1140000}}{{28}}:60\% :95\% .28 = 2000000g = 2\)tấn
Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:

Gán số thứ tự các phương trình theo tên gọi : Phản ứng quang hợp, cellulose phản ứng với nitric acid, tinh bột phản ứng ứng màu với dung dịch iodine và thủy phân tinh bột.
Đáp án
Đáp án
Dựa vào tính chất hóa học của tinh bột và cellulose.
(1) phản ứng thủy phân tinh bột
(2) cellulose phản ứng với nitric acid.
(3) phản ứng quang hợp
(4) phản ứng màu với dung dịch iodine.
Sắp xếp: 3241.
Số đồng phân amine bậc 3 của amine có công thức phân tử C5H13N là
Đáp án:
Đáp án:
Dựa vào cách vẽ đồng phần amine.
Có 3 amine bậc 3 ứng với công thức C5H13N là
(CH3)2 – N – CH2 – CH2 – CH3 (1)
(CH3)2 CH2 – N (CH3)2 (2)
(C2H5)2 – N – CH3 (3)
Đáp án 3
Ethylene (C2H4) là một trong những nguyên liệu quan trọng trong công nghiệp hóa dầu. Ethylene có thể được sản xuất từ ethane (C2H6) thông qua phản ứng dehydrogen hóa :
(1) C2H6 (g) → C2H4 (g) + H2 (g)
Phản ứng dehydrogen hóa là phản ứng thu nhiệt, năng lượng cần thiết được cung cấp bằng cách đốt cháy một phần ethane:
(2) C2H6 (g) + 7/2O2(g) → 2CO2 (g) + 3H2O(g)
Giả sử hiệu suất của cả hai phản ứng là 100%. Tính khối lượng ethane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 1 tấn C2H4 (g), biết 60% lượng nhiệt tỏa ra từ phản ứng (2) được sử dụng để cung cấp cho phản ứng (1).
Bảng nhiệt tạo thành chuẩn (\({\Delta _{\rm{f}}}H_{298}^o\)) của các chất (kJ/mol):
|
Chất |
C2H6 (g) |
C2H4 (g) |
H2(g) |
O2 (g) |
CO2(g) |
H2O(g) |
|
\({\Delta _{\rm{f}}}H_{298}^o\)(kJ mol⁻¹) |
-84,7 |
52,3 |
0 |
0 |
-393,5 |
-241,8 |
Đáp án:
Đáp án:
Tính biến thiên năng lượng phản ứng (1), tính biến thiên năng lượng (2).
\({\Delta _r}H_{298}^o = \Delta fH_{298}^o({C_2}{H_4}) - {\Delta _f}H_{298}^o({C_2}{H_6}) = 52,3 - ( - 84,7) = 137kJ\)
Năng lượng cần dùng để tạo ra 1 tấn C2H4 là: \(\frac{{{{1.10}^6}}}{{28}}.137kJ\)
\(\begin{array}{l}{\Delta _r}H_{298}^o(2) = 2.{\Delta _f}H_{298}^o(C{O_2}) + 3.{\Delta _f}H_{298}^o({H_2}{\rm{O}}) - {\Delta _f}H_{298}^o({C_2}{H_6}) = 2.( - 393,5) + 3.( - 241,8) - ( - 84,7)\\ = - 1427,7kJ\end{array}\)
Bảo toàn năng lượng ta có: n ethene.\(1427,7.60\% = \frac{{{{10}^6}}}{{28}}.137 \to {m_{{C_2}{H_6}}} = 1,24\tan \)
Cho bảng giá trị sau:

Số kim loại khó nóng chảy hơn Be (biết nhiệt dộ nóng chảy của Be là 12870C) là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào nhiệt độ nóng chảy của các kim loại chuyển tiếp dãy thứ nhất để so sánh với nhiệt độ nóng chảy của Be.
Có: SC, Ti, V, Cr, Fe, Co, Ni có nhiệt độ nóng chảy cao hơn Be.
Đáp án 7
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
Phần I. Trắc nghiệm nhiều đáp án lựa chọn
Kim loại cứng nhất, thường được pha vào thép để tăng độ cứng và khả năng chống gỉ cho thép là
Trong ăn mòn hóa học, phản ứng hóa học xảy ra là loại phản ứng nào sau đây?
Hợp chất nào sau đây là ester ?
Khi thay thế nhóm …(1) ở nhóm …(2) của carboxylic acid bằng nhóm
Phức chất đơn giản thường có một
Cho phản ứng oxi hóa – khử:
Các bài khác cùng chuyên mục









Danh sách bình luận