Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Đề bài
Cho biết: .\(E_{A{l^{3 + }}/Al}^o = - 1,676\;{\rm{V}};E_{F{e^2}/Fe}^o = - 0,440\;{\rm{V}};E_{{\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}}^o = + 0,340\;{\rm{V}}\)..Sự sắp xếp nào đúng với tính oxi hóa của các cation Al3+, Fe2+ và Cu2+?
-
A.
Cu2+ > Fe2+ > Al3+.
-
B.
Fe2+ > Cu2+ > Al3+.
-
C.
Cu2+ > Al3+ > Fe2+.
-
D.
Al3+ > Fe2+ > Cu2+.
Năng lượng hóa học của một số phản ứng được ghi ở các sơ đồ dưới đây:
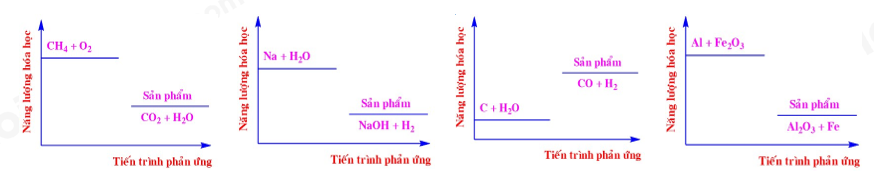
Số phản ứng tỏa nhiệt là
-
A.
2
-
B.
4
-
C.
1
-
D.
3
Khi cho khí chlorine vào dung dịch KI dư thì thu được dung dịch X. Nhỏ vài giọt hồ tinh bột vào dung dịch X thì dung dịch chuyển màu gì?
-
A.
Vàng lục.
-
B.
Xanh tím.
-
C.
Tím đen
-
D.
Đỏ nâu.
-
A.
CH3CH2CH2CH2OH.
-
B.
(CH3)3C-OH và (CH3)2CH-CH2OH.
-
C.
CH3-CH2CH(OH)-CH3 và CH3CH2CH2CH2OH.
-
D.
CH3-CH2-CH(OH)-CH3.
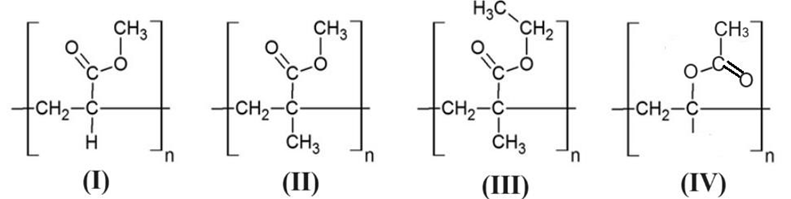
-
A.
(I).
-
B.
(II).
-
C.
(III).
-
D.
(IV).
Chất nào sau đây là thành phần chính của chất giặt rửa tổng hợp ?
-
A.
CH3[CH2]16-COONa.
-
B.
CH3[CH2]11-C6H4-SO3Na.
-
C.
CH3[CH2]14-COOK.
-
D.
(CH3[CH2]16-COO)2Ca.
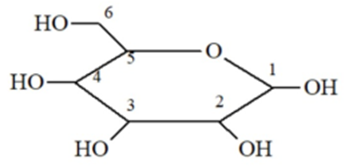
Dạng mạch vòng của glucose có cấu tạo như hình dưới đây. Nhóm -OH hemiacetal ở vị trí của carbon nào?
-
A.
số 4.
-
B.
số 6.
-
C.
số 1.
-
D.
số 2.
Chất nào sau đây có thể điều chế trực tiếp được bằng phản ứng oxi hóa ethylene?
-
A.
CH3-CHO.
-
B.
polyethylene.
-
C.
CH3-CH3.
-
D.
CH3-CH2-OH.
Trên thực tế, khí thải chứa SO2 được dẫn vào dung dịch Ca(OH)2, sản phẩm cuối cùng thu được là CaSO4.2H2O (thạch cao). Hãy cho biết ngoài khí SO2 còn có khí nào sau đây tham gia phản ứng?
-
A.
H2.
-
B.
H2S.
-
C.
HCl.
-
D.
O2.
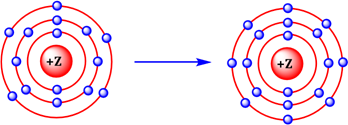
Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
-
A.
Oxygen (8O).
-
B.
Nitrogen (7N).
-
C.
Aluminium (13Al).
-
D.
Phosphorus (15P).
-
A.
Omega-6.
-
B.
Omega-3.
-
C.
Omega-9.
-
D.
Omega-5.
Acetic acid trong giấm ăn có thể được sử dụng để loại bỏ CaCO3 bám vào vật dụng. Sử dụng 200 mL dung dịch giấm ăn (D = 1,05 g/mL) chứa CH3COOH 5% có thể làm sạch tối đa bao nhiêu CaCO3 bám vào vật dụng?
-
A.
8,75 gam.
-
B.
9,25 gam.
-
C.
12,00 gam.
-
D.
6,75 gam.
Cho biết sức điện động chuẩn của các pin sau:
|
Pin điện hóa |
X - Y |
M - Y |
M - Z |
|
Sức điện động chuẩn (V) |
0,20 |
0,60 |
0,30 |
Sự sắp xếp nào đúng với tính khử của các kim loại X, Y, Z, M?
-
A.
M < Z < Y < X.
-
B.
Y < X < Z < M.
-
C.
X < Y < M < Z.
-
D.
X < Y < Z < M.
Cho 9,48 gam phèn chua (K2SO4.Al2(SO4)3.24H2O) vào nước thu được 500 mL dung dịch. Nồng độ ion K+ có trong phèn chua là
-
A.
0,02.
-
B.
0,01.
-
C.
0,04.
-
D.
0,05.
Một amino acid có công thức cấu tạo CH3-CH(NH2)-COOH có tên thay thế là
-
A.
α-amino propionic.
-
B.
2-amino propanoic.
-
C.
2-amino propionic.
-
D.
alanine.
Glutamic acid có các dạng tồn tại và giá trị pH mà dạng tồn tại đó là chủ yếu (≈ 100%) sau:
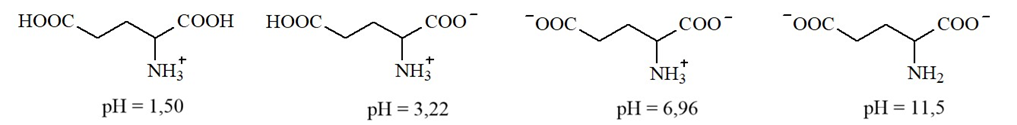
Giá trị pH của dung dịch bằng bao nhiêu thì glutamic acid không bị điện di?
-
A.
11,5.
-
B.
3,22.
-
C.
1,50.
-
D.
6,96.
-
A.
tăng nhiệt độ hệ phản ứng.
-
B.
tăng nhiệt độ hệ phản ứng.
-
C.
giảm áp suất chung của hệ phản ứng.
-
D.
giảm nhiệt độ của hệ phản ứng.
Một phương pháp xử lí nước thải chứa các cation kim loại nặng bằng cách điện phân dung dịch nước thải (pH ≤ 5, mật độ dòng điện khoảng 10mA/cm2) để tạo ra các chất kết tủa tại khu vực điện cực. Hãy cho biết quá trình kết tủa này xảy ra ở khu vực điện cực nào trong điện phân?
-
A.
tại cathode.
-
B.
tại bề mặt dung dịch.
-
C.
cả anode và cathode.
-
D.
tại anode.
Salbutamol là một hợp chất hữu cơ có hoạt tính sinh học cao. Bên cạnh tác dụng chính dùng trong y học, salbutamol còn sử dụng làm doping trong thi đấu thể thao. Trong thi đấu thể thao vận động viên sử dụng salbutamol với liều lượng vượt quá 20 µg/kg trong vòng 24h được coi là sử dụng doping (Tổ chức phòng chống Doping thế giới, WADA). Salbutamol có công thức cấu tạo như hình dưới.
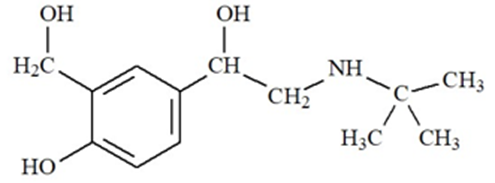
Salbutamol có những tính chất hóa học đặc trưng như sau: 2 nhóm OH liên kết trực tiếp với nguyên tử carbon no (nhóm chức -OH alcohol) và 1 nhóm -OH liên kết trực tiếp với nguyên tử carbon của vòng benzene (nhóm chức -OH phenol). Sự khác biệt của hai loại nhóm chức này đó là nhóm -OH phenol có lực acid mạnh hơn nhóm -OH alcohol, chúng đều phản ứng với Na kim loại và sản phẩm là sodium alcoholate và sodium phenolate, nhưng phenol còn có khả năng phản ứng với dung dịch NaOH còn alcohol không có phản ứng này. Một tính chất khác biệt nữa đó là nhóm -OH alcohol có khả năng bị thay thế với nguyên tử bromine (Br) khi cho tác dụng với acid HBr mà nhóm -OH phenol không có tính chất này. Ngoài ra, cấu tạo của salbutamol còn có một nhóm amine bậc 2 (R-NH-R' trong đó R và R' là các gốc hydrocarbon) mang tính chất hóa học của một base, có khả năng tạo muối R(R')NH2+Br- khi cho tác dụng với acid HBr.
a) Salbutamol tác dụng với NaOH theo tỉ lệ mol 1 : 3.
b) Một vận động viên thể thao có cân nặng 80 kg thì trong vòng 24h chỉ được sử dụng liều tối đa là 1600 µg salbutamol.
c) Khi cho salbutamol tác dụng với HBr dư thu được hợp chất có công thức phân tử là C13H22NO3Br
d) Salbutamol tác dụng với Na theo tỉ lệ mol 1 : 3.
Cho bảng nhiệt độ sôi (oC) đo ở áp suất 1 atm như sau:
|
Công thức chất |
C2H5OH |
CH3COOH |
H2O |
CH3COOC2H5 |
H2SO4 |
|
Nhiệt độ sôi |
78,3 |
118 |
100 |
77 |
337 |
Ethyl acetate được điều chế bằng cách đun nóng hỗn hợp gồm acetic acid, ethanol và dung dịch H2SO4 98%, đựng trong bình cầu có nhánh. Nhiệt độ bếp điện được thiết lập ở 80oC. Mô hình điều chế và tách ethyl acetate được thực hiện như sau:
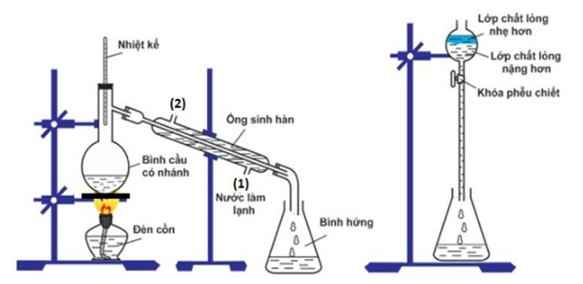
a) Để tăng hiệu suất chiết ethyl acetate từ bình hứng, thêm muối ăn (NaCl) hoặc thêm dung dịch muối ăn bão hòa vào.
b) Phản ứng điều chế ethyl aetate từ các nguyên liệu trên được gọi là phản ứng ester hóa.
c) Vai trò H2SO4 là xúc tác và hút nước để chuyển dịch cân bằng trong phản ứng ester hóa.
d) Trong quá trình phản ứng, phần hơi tách ra từ bình cầu có nhánh sang bình hứng là ethyl acetate và nước.
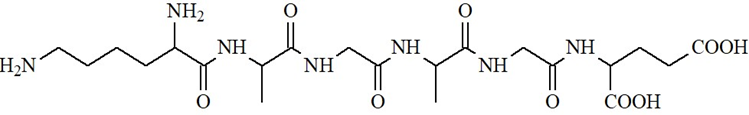
a) Dung dịch X làm quỳ tím chuyển sang màu xanh.
b) Thủy phân X có thể thu được tối đa 5 dipeptide.
c) Thủy phân hoàn toàn X trong dung dịch NaOH dư đun nóng, thu được tối đa 4 muối.
d) X là hexapeptide.
Có hai miếng sắt (hình hộp chữ nhật) kích thước giống hệt nhau, một miếng là khối sắt đặc (A), một miếng sắt có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng sắt vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khí hidro thoát ra theo thời gian. Vẽ đồ thị thể tích khí theo thời gian, được hai đường đồ thị sau:
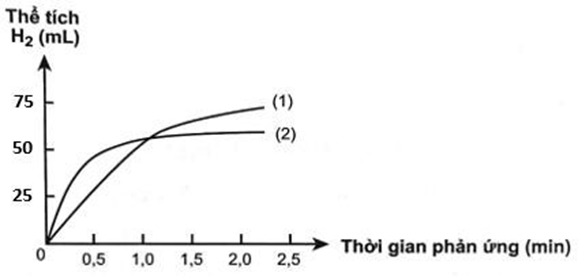
Người ta thấy từ phút thứ 4 trở đi, ở cốc hòa tan miếng sắt (A), số mol khí H2 hầu như không thay đổi và bằng khoảng 3,125.10-3 mol. Giả thiết
- Các nguyên tử sắt chiếm khoảng 74% thể tích miếng sắt, còn lại là khe rỗng giữa các nguyên tử sắt.
- Khối lượng riêng của sắt bằng 7,874 g/cm3.
- Diện tích của miếng sắt (A) bằng 0,4 cm2.
- Coi nguyên tử sắt là hình cầu bán kính R với thể tích Vcầu = (4/3)πR3 với π = 3,14 và NA = 6,02.1023
a) Bề dày của miếng sắt (A) bằng 0,055 (cm)
b) Đường cong số (1) mô tả tốc độ thoát khí từ miếng sắt (A).
c) Đường cong số (2) mô tả tốc độ thoát khí từ miếng sắt (B)
d) Bán kính nguyên tử sắt 1,28A0.
Ethanol có thể được sản xuất từ cellulose. Loại ethanol này được dùng để sản xuất xăng E5 (chứa 5% ethanol về thể tích). Ethanol thu được từ 1 tấn mùn cưa (chứa 50% cellulose, phần còn lại là chất trơ) có thể dùng để pha chế bao nhiêu L xăng E5?
Biết hiệu suất quá trình sản xuất ethanol từ cellulose là 60% và ethanol có khối lượng riêng là 0,8 g.mL–1. (Làm tròn kết quả đến hàng đơn vị)
Đáp án:
Nhôm (Aluminium) được sản xuất bằng phương pháp điện phân Al2O3 tinh khiết. Quặng nhôm thường chứa thạch anh, silicate (chứa Si) và một số tạp chất khác cần được loại bỏ. Một loại quặng bauxite gồm Al2O3.3H2O và 10,0 % kaolin Al2Si2O7.2H2O được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicat (Na6Al6Si5O22.5H2O). (Làm tròn kết quả đến hàng phần trăm)
Đáp án:
Hydrogen hóa chất béo lỏng để chuyển thành chất béo rắn là quá trình phá vỡ các liên kết C=C để chuyển thành các liên kết C-C.
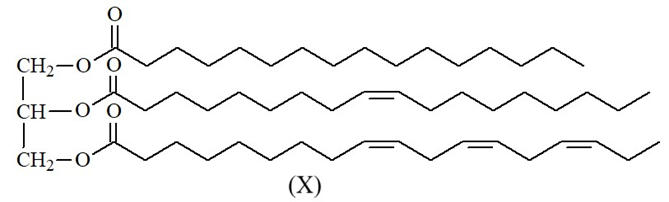
Chất béo E có chứa X và các triglyceride no. Hydrogen hóa hoàn toàn 10 kg E thu được tối đa 10,05 kg chất béo no. Thành phần % theo khối lượng của X có trong E là bao nhiêu %? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Cho sơ đồ sau:
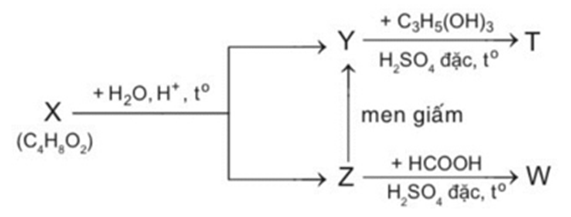
Trong đó: X, Y, Z, T, W là các hợp chất hữu cơ khác nhau; T chỉ chứa một loại nhóm chức. Xác định phân tử khối của T?
Đáp án:
Dùng phương pháp mạ zinc để bảo vệ các tấm thép có tổng diện tích bề mặt là 2m2. Khi đó, các tấm thép cần mạ là cathode; dung dịch mạ chứa phức chất [Zn(OH)4]2- và các tấm zinc nguyên chất là anode. Tiến hành mạ với mật độ dòng điện là 200 A/m2 và lớp mạ có độ dày 6,5 μm. Tính thời gian (theo giờ) hoàn thành lớp mạ đó? (Làm tròn đến hàng phần trăm). Cho biết khối lượng riêng DZn = 7,14 g/cm3 và 1 mol điện lượng = 1F (F: hằng số faraday) = 96485 C.
Đáp án:
Để xác định hàm lượng oxygen (O2) tan trong nước, người ta lấy 100,0 mL nước rồi cho ngay manganese sulphate (MnSO4, dư) và sodium hydroxide (NaOH) vào nước. Sau khi lắc kĩ (không cho tiếp xúc với không khí), manganese(II) hydroxide (Mn(OH)2) bị O2 oxi hóa thành manganese oxohydroxide (MnO(OH)2). Thêm acid (dư) và cho tiếp potassium iodide (KI, dư) vào hỗn hợp, thì ion idodine (I-) bị MnO(OH)2 oxi hóa thành ioddine (I2). Lượng I2 sinh ra phản ứng vừa đủ với 10,5 mL dung dịch Na2S2O3 0,01M (sodium thiosulphate). Biết các phản ứng xảy ra như sau:
Mn2+ + OH- → Mn(OH)2 (1)
Mn(OH)2 + O2 → MnO(OH)2 (2)
MnO(OH)2 + I- + H+ → Mn2+ + I2 + H2O (3)
I2 + Na2S2O3 → Na2S4O6 + NaI (4)
Hàm lượng O2 tan trong nước (tính theo mg O2/1L) là a. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Lời giải và đáp án
Cho biết: .\(E_{A{l^{3 + }}/Al}^o = - 1,676\;{\rm{V}};E_{F{e^2}/Fe}^o = - 0,440\;{\rm{V}};E_{{\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}}^o = + 0,340\;{\rm{V}}\)..Sự sắp xếp nào đúng với tính oxi hóa của các cation Al3+, Fe2+ và Cu2+?
-
A.
Cu2+ > Fe2+ > Al3+.
-
B.
Fe2+ > Cu2+ > Al3+.
-
C.
Cu2+ > Al3+ > Fe2+.
-
D.
Al3+ > Fe2+ > Cu2+.
Đáp án : A
Dựa vào ý nghĩa của giá trị thế điện cực chuẩn của kim loại.
\(E_{A{l^{3 + }}/Al}^o < E_{F{e^2}/Fe}^o < E_{{\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}}^o\). Vậy tính oxi hóa tăng dần từ Al3+ đến Cu2+
Đáp án A
Năng lượng hóa học của một số phản ứng được ghi ở các sơ đồ dưới đây:

Số phản ứng tỏa nhiệt là
-
A.
2
-
B.
4
-
C.
1
-
D.
3
Đáp án : D
Dựa vào sơ đồ năng lượng hoạt hóa. Phản ứng tỏa nhiệt có năng lượng sản phẩm thấp hơn năng lượng ban đầu.
Sơ đồ 1,2,4 có năng lượng hóa học sản phẩm thấp hơn năng hóa học chất tham gia nên thuộc phản ứng tỏa nhiệt.
Đáp án D
Khi cho khí chlorine vào dung dịch KI dư thì thu được dung dịch X. Nhỏ vài giọt hồ tinh bột vào dung dịch X thì dung dịch chuyển màu gì?
-
A.
Vàng lục.
-
B.
Xanh tím.
-
C.
Tím đen
-
D.
Đỏ nâu.
Đáp án : B
Dựa vào tính chất hóa học của tinh bột.
Khi cho khí Cl2 vào dung dịch KI dư thu được dung dịch X gồm KCl và KI dư. Nhỏ vài giọt tinh bột vào dung dịch X thì dung dịch chuyển màu xanh tím.
Đáp án B
-
A.
CH3CH2CH2CH2OH.
-
B.
(CH3)3C-OH và (CH3)2CH-CH2OH.
-
C.
CH3-CH2CH(OH)-CH3 và CH3CH2CH2CH2OH.
-
D.
CH3-CH2-CH(OH)-CH3.
Đáp án : D
Dựa vào tính chất hóa học của dẫn xuất halogen.
![]()
Vậy Y là CH3-CH2-CH(OH)-CH3.
Đáp án D
-
A.
(I).
-
B.
(II).
-
C.
(III).
-
D.
(IV).
Đáp án : A
Dựa vào cấu tạo của polymer.
Trong 4 chất trên chất I là monomer methyl acrylate.
Đáp án A
Chất nào sau đây là thành phần chính của chất giặt rửa tổng hợp ?
-
A.
CH3[CH2]16-COONa.
-
B.
CH3[CH2]11-C6H4-SO3Na.
-
C.
CH3[CH2]14-COOK.
-
D.
(CH3[CH2]16-COO)2Ca.
Đáp án : B
Dựa vào khái niệm chất giặt rửa tổng hợp.
CH3[CH2]11-C6H4-SO3Na. là thành phần chính của chất giặt rửa tổng hợp.
Đáp án B
Dạng mạch vòng của glucose có cấu tạo như hình dưới đây. Nhóm -OH hemiacetal ở vị trí của carbon nào?

-
A.
số 4.
-
B.
số 6.
-
C.
số 1.
-
D.
số 2.
Đáp án : C
Nhóm – OH heniacetal có tính khử, có khả năng mở vòng.
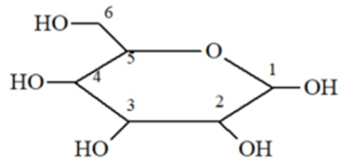
có nhóm – OH hemiacetal ở vị trí carbon số 1.
Đáp án C
Chất nào sau đây có thể điều chế trực tiếp được bằng phản ứng oxi hóa ethylene?
-
A.
CH3-CHO.
-
B.
polyethylene.
-
C.
CH3-CH3.
-
D.
CH3-CH2-OH.
Đáp án : A
Dựa vào tính chất hóa học của ethylene.
Oxi hóa CH≡CH thu được CH3-CHO.
Đáp án A
Trên thực tế, khí thải chứa SO2 được dẫn vào dung dịch Ca(OH)2, sản phẩm cuối cùng thu được là CaSO4.2H2O (thạch cao). Hãy cho biết ngoài khí SO2 còn có khí nào sau đây tham gia phản ứng?
-
A.
H2.
-
B.
H2S.
-
C.
HCl.
-
D.
O2.
Đáp án : D
Dựa vào tính chất hóa học của hợp chất nhóm IIA.
SO2 + ½ O2 + Ca(OH)2 → CaSO4.2H2O
Đáp án D
Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?

-
A.
Oxygen (8O).
-
B.
Nitrogen (7N).
-
C.
Aluminium (13Al).
-
D.
Phosphorus (15P).
Đáp án : D
Dựa vào cách hình thành liên kết hóa học.
Chất Z có 15e nên Z là phosphorus.
Đáp án D
-
A.
Omega-6.
-
B.
Omega-3.
-
C.
Omega-9.
-
D.
Omega-5.
Đáp án : B
Dựa vào cấu tạo của acid béo.
Acid béo trên thuộc loại omega – 3
Đáp án B
Acetic acid trong giấm ăn có thể được sử dụng để loại bỏ CaCO3 bám vào vật dụng. Sử dụng 200 mL dung dịch giấm ăn (D = 1,05 g/mL) chứa CH3COOH 5% có thể làm sạch tối đa bao nhiêu CaCO3 bám vào vật dụng?
-
A.
8,75 gam.
-
B.
9,25 gam.
-
C.
12,00 gam.
-
D.
6,75 gam.
Đáp án : A
Tính số mol của giấm ăn, viết phương trình phản ứng tính số mol CaCO3.
m dd CH3COOH = D.V = 1,05.200 = 210g
m CH3COOH = 210.5% = 10,5g
n CH3COOH = 10,5 : 60 = 0,175 mol
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
0,175 → 0,0875
m CaCO3 = 0,0875.100 = 8,75g
Đáp án A
Cho biết sức điện động chuẩn của các pin sau:
|
Pin điện hóa |
X - Y |
M - Y |
M - Z |
|
Sức điện động chuẩn (V) |
0,20 |
0,60 |
0,30 |
Sự sắp xếp nào đúng với tính khử của các kim loại X, Y, Z, M?
-
A.
M < Z < Y < X.
-
B.
Y < X < Z < M.
-
C.
X < Y < M < Z.
-
D.
X < Y < Z < M.
Đáp án : B
Dựa vào sức điện động chuẩn của pin, từ đó nhận xét tính khử và oxi hóa của các kim loại.
Pin X – Y: X có tính khử mạnh hơn Y
Pin M – Y: M có tính khử mạnh hơn Y
Pin M – Z: M có tính khử mạnh hơn Z.
\(\begin{array}{l}E_{M - Y}^o = E_Y^o - E_M^o = 0,6\\E_{X - Y}^o = E_Y^o - E_X^o = 0,2\\ \to E_X^o - E_M^o = 0,8 > 0\end{array}\)
Vậy X có tính khử yếu hơn M
Sắp xếp theo tính khử tăng dần: Y < X < Z < M.
Đáp án B
Cho 9,48 gam phèn chua (K2SO4.Al2(SO4)3.24H2O) vào nước thu được 500 mL dung dịch. Nồng độ ion K+ có trong phèn chua là
-
A.
0,02.
-
B.
0,01.
-
C.
0,04.
-
D.
0,05.
Đáp án : C
Tính số mol của phèn chua. Từ đó tính được nồng độ ion K+
n phèn chua = 9,48 : 948 = 0,01 mol
n K+ = 0,01.2 = 0,02 mol
CM K+ = 0,02 : 0,5 = 0,04 mol
Đáp án C
Một amino acid có công thức cấu tạo CH3-CH(NH2)-COOH có tên thay thế là
-
A.
α-amino propionic.
-
B.
2-amino propanoic.
-
C.
2-amino propionic.
-
D.
alanine.
Đáp án : B
Dựa vào tên gọi của amino acid.
CH3-CH(NH2)-COOH có tên thay thế là: 2 – amino propanoic
Đáp án B
Glutamic acid có các dạng tồn tại và giá trị pH mà dạng tồn tại đó là chủ yếu (≈ 100%) sau:
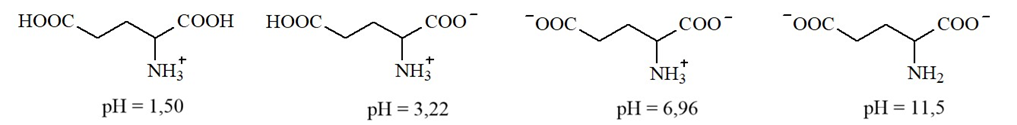
Giá trị pH của dung dịch bằng bao nhiêu thì glutamic acid không bị điện di?
-
A.
11,5.
-
B.
3,22.
-
C.
1,50.
-
D.
6,96.
Đáp án : B
Dựa vào các dạng ion lưỡng cực của glutamic acid.
Tại pH = 3,22 glutamic acid tồn tại ion lưỡng cực nên không bị điện di.
Đáp án B
-
A.
tăng nhiệt độ hệ phản ứng.
-
B.
tăng nhiệt độ hệ phản ứng.
-
C.
giảm áp suất chung của hệ phản ứng.
-
D.
giảm nhiệt độ của hệ phản ứng.
Đáp án : A
Dựa vào nguyên lí chuyển dịch cân bằng Le Chaterlier.
Vì phản ứng thuận là phản ứng thu nhiệt nên khi tăng nhiệt độ của hệ cân bằng chuyển dịch theo chiều thuận.
Đáp án A
Một phương pháp xử lí nước thải chứa các cation kim loại nặng bằng cách điện phân dung dịch nước thải (pH ≤ 5, mật độ dòng điện khoảng 10mA/cm2) để tạo ra các chất kết tủa tại khu vực điện cực. Hãy cho biết quá trình kết tủa này xảy ra ở khu vực điện cực nào trong điện phân?
-
A.
tại cathode.
-
B.
tại bề mặt dung dịch.
-
C.
cả anode và cathode.
-
D.
tại anode.
Đáp án : A
Dựa vào quá trình xảy ra tại bình điện phân.
Khi điện phân dung dịch, các cation kim loại di chuyển đến điện cực cathode, tại đó xảy ra quá trình khử ion kim loại thành kim loại.
Đáp án A
Salbutamol là một hợp chất hữu cơ có hoạt tính sinh học cao. Bên cạnh tác dụng chính dùng trong y học, salbutamol còn sử dụng làm doping trong thi đấu thể thao. Trong thi đấu thể thao vận động viên sử dụng salbutamol với liều lượng vượt quá 20 µg/kg trong vòng 24h được coi là sử dụng doping (Tổ chức phòng chống Doping thế giới, WADA). Salbutamol có công thức cấu tạo như hình dưới.

Salbutamol có những tính chất hóa học đặc trưng như sau: 2 nhóm OH liên kết trực tiếp với nguyên tử carbon no (nhóm chức -OH alcohol) và 1 nhóm -OH liên kết trực tiếp với nguyên tử carbon của vòng benzene (nhóm chức -OH phenol). Sự khác biệt của hai loại nhóm chức này đó là nhóm -OH phenol có lực acid mạnh hơn nhóm -OH alcohol, chúng đều phản ứng với Na kim loại và sản phẩm là sodium alcoholate và sodium phenolate, nhưng phenol còn có khả năng phản ứng với dung dịch NaOH còn alcohol không có phản ứng này. Một tính chất khác biệt nữa đó là nhóm -OH alcohol có khả năng bị thay thế với nguyên tử bromine (Br) khi cho tác dụng với acid HBr mà nhóm -OH phenol không có tính chất này. Ngoài ra, cấu tạo của salbutamol còn có một nhóm amine bậc 2 (R-NH-R' trong đó R và R' là các gốc hydrocarbon) mang tính chất hóa học của một base, có khả năng tạo muối R(R')NH2+Br- khi cho tác dụng với acid HBr.
a) Salbutamol tác dụng với NaOH theo tỉ lệ mol 1 : 3.
b) Một vận động viên thể thao có cân nặng 80 kg thì trong vòng 24h chỉ được sử dụng liều tối đa là 1600 µg salbutamol.
c) Khi cho salbutamol tác dụng với HBr dư thu được hợp chất có công thức phân tử là C13H22NO3Br
d) Salbutamol tác dụng với Na theo tỉ lệ mol 1 : 3.
a) Salbutamol tác dụng với NaOH theo tỉ lệ mol 1 : 3.
b) Một vận động viên thể thao có cân nặng 80 kg thì trong vòng 24h chỉ được sử dụng liều tối đa là 1600 µg salbutamol.
c) Khi cho salbutamol tác dụng với HBr dư thu được hợp chất có công thức phân tử là C13H22NO3Br
d) Salbutamol tác dụng với Na theo tỉ lệ mol 1 : 3.
Dựa vào cấu tạo của salbutamol.
a. sai vì salbutamol tác dụng với NaOH theo tỉ lệ 1 : 1 tại vị trí – OH phenol.
b. đúng
c. sai vì nhóm – OH alcohol có phản ứng thay thể với nguyên tử bromine khi tác dụng với acid HBr vậy công thức phân tử là C13H20NOBr3.
d. đúng
Cho bảng nhiệt độ sôi (oC) đo ở áp suất 1 atm như sau:
|
Công thức chất |
C2H5OH |
CH3COOH |
H2O |
CH3COOC2H5 |
H2SO4 |
|
Nhiệt độ sôi |
78,3 |
118 |
100 |
77 |
337 |
Ethyl acetate được điều chế bằng cách đun nóng hỗn hợp gồm acetic acid, ethanol và dung dịch H2SO4 98%, đựng trong bình cầu có nhánh. Nhiệt độ bếp điện được thiết lập ở 80oC. Mô hình điều chế và tách ethyl acetate được thực hiện như sau:

a) Để tăng hiệu suất chiết ethyl acetate từ bình hứng, thêm muối ăn (NaCl) hoặc thêm dung dịch muối ăn bão hòa vào.
b) Phản ứng điều chế ethyl aetate từ các nguyên liệu trên được gọi là phản ứng ester hóa.
c) Vai trò H2SO4 là xúc tác và hút nước để chuyển dịch cân bằng trong phản ứng ester hóa.
d) Trong quá trình phản ứng, phần hơi tách ra từ bình cầu có nhánh sang bình hứng là ethyl acetate và nước.
a) Để tăng hiệu suất chiết ethyl acetate từ bình hứng, thêm muối ăn (NaCl) hoặc thêm dung dịch muối ăn bão hòa vào.
b) Phản ứng điều chế ethyl aetate từ các nguyên liệu trên được gọi là phản ứng ester hóa.
c) Vai trò H2SO4 là xúc tác và hút nước để chuyển dịch cân bằng trong phản ứng ester hóa.
d) Trong quá trình phản ứng, phần hơi tách ra từ bình cầu có nhánh sang bình hứng là ethyl acetate và nước.
Dựa vào quá trình điều chế ester.
a. đúng
b. đúng
c. đúng
d. sai, phần hơi có ethyl acetate và ethanol
a) Dung dịch X làm quỳ tím chuyển sang màu xanh.
b) Thủy phân X có thể thu được tối đa 5 dipeptide.
c) Thủy phân hoàn toàn X trong dung dịch NaOH dư đun nóng, thu được tối đa 4 muối.
d) X là hexapeptide.
a) Dung dịch X làm quỳ tím chuyển sang màu xanh.
b) Thủy phân X có thể thu được tối đa 5 dipeptide.
c) Thủy phân hoàn toàn X trong dung dịch NaOH dư đun nóng, thu được tối đa 4 muối.
d) X là hexapeptide.
Dựa vào cấu tạo và tính chất peptide.
a. sai, petide X làm quỳ tím không chuyển màu.
b. sai, thủy phân X thu được 3 dipeptide.
c. đúng
d. đúng
Có hai miếng sắt (hình hộp chữ nhật) kích thước giống hệt nhau, một miếng là khối sắt đặc (A), một miếng sắt có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng sắt vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khí hidro thoát ra theo thời gian. Vẽ đồ thị thể tích khí theo thời gian, được hai đường đồ thị sau:

Người ta thấy từ phút thứ 4 trở đi, ở cốc hòa tan miếng sắt (A), số mol khí H2 hầu như không thay đổi và bằng khoảng 3,125.10-3 mol. Giả thiết
- Các nguyên tử sắt chiếm khoảng 74% thể tích miếng sắt, còn lại là khe rỗng giữa các nguyên tử sắt.
- Khối lượng riêng của sắt bằng 7,874 g/cm3.
- Diện tích của miếng sắt (A) bằng 0,4 cm2.
- Coi nguyên tử sắt là hình cầu bán kính R với thể tích Vcầu = (4/3)πR3 với π = 3,14 và NA = 6,02.1023
a) Bề dày của miếng sắt (A) bằng 0,055 (cm)
b) Đường cong số (1) mô tả tốc độ thoát khí từ miếng sắt (A).
c) Đường cong số (2) mô tả tốc độ thoát khí từ miếng sắt (B)
d) Bán kính nguyên tử sắt 1,28A0.
a) Bề dày của miếng sắt (A) bằng 0,055 (cm)
b) Đường cong số (1) mô tả tốc độ thoát khí từ miếng sắt (A).
c) Đường cong số (2) mô tả tốc độ thoát khí từ miếng sắt (B)
d) Bán kính nguyên tử sắt 1,28A0.
Dựa vào các dữ liệu được cung cấp.
a. đúng
b. đúng
c. đúng
d. đúng
Ethanol có thể được sản xuất từ cellulose. Loại ethanol này được dùng để sản xuất xăng E5 (chứa 5% ethanol về thể tích). Ethanol thu được từ 1 tấn mùn cưa (chứa 50% cellulose, phần còn lại là chất trơ) có thể dùng để pha chế bao nhiêu L xăng E5?
Biết hiệu suất quá trình sản xuất ethanol từ cellulose là 60% và ethanol có khối lượng riêng là 0,8 g.mL–1. (Làm tròn kết quả đến hàng đơn vị)
Đáp án:
Đáp án:
Tính số mol cellulose trong 1 tấn mùn cưa và dựa vào phản ứng tạo ethanol để tính V C2H5OH.
Khối lượng cellulose trong 1 tấn mùn cưa là: 1.50% = 0,5 tấn
(C6H10O5)n → 2C2H5OH + 2CO2
162 92
0,5 tấn →
m C2H5OH = \(\frac{{0,5.92}}{{162}}.60\% \tan \)
V C2H5OH = \(\frac{{0,5.92}}{{162}}.60\% \).103 : 0,8
V xăng E5 thu được là: \(\frac{{0,5.92}}{{162}}.60\% \).103 : 0,8 : 5% = 4259L
Đáp số 4259
Nhôm (Aluminium) được sản xuất bằng phương pháp điện phân Al2O3 tinh khiết. Quặng nhôm thường chứa thạch anh, silicate (chứa Si) và một số tạp chất khác cần được loại bỏ. Một loại quặng bauxite gồm Al2O3.3H2O và 10,0 % kaolin Al2Si2O7.2H2O được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicat (Na6Al6Si5O22.5H2O). (Làm tròn kết quả đến hàng phần trăm)
Đáp án:
Đáp án:
Dựa vào lượng nhôm chuyển hóa qua dạng bùn.
Giả sử có 100g quặng.
Khối lượng Al2O3.3H2O là 90g và 10 gam Al2Si2O7.2H2O
Khối lượng Al tối đa thu được = \(\frac{{2.27.90}}{{156}} + \frac{{2.27.10}}{{258}} = 33,247gam\)
n Al bị loại bỏ = 1,2.n Si = \(\frac{{1,2.2.10}}{{258}} = 0,093mol\)
tỉ lệ Al bị hao hụt là = \(\frac{{0,093.27}}{{33,247}} = 7,55\% \)
Đáp án 7,55
Hydrogen hóa chất béo lỏng để chuyển thành chất béo rắn là quá trình phá vỡ các liên kết C=C để chuyển thành các liên kết C-C.

Chất béo E có chứa X và các triglyceride no. Hydrogen hóa hoàn toàn 10 kg E thu được tối đa 10,05 kg chất béo no. Thành phần % theo khối lượng của X có trong E là bao nhiêu %? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Đáp án:
Dựa vào định luật bảo toàn khối lượng để tính khối lượng hydrogen đã dùng để chuyển hóa chất béo không no thành béo no.
Bảo toàn khối lượng: m E + m H2 = m béo no
→ m H2 = 10,05 – 10 = 0,05kg
n H2 = 0,05 : 2 = 0,025 k.mol
→ n X = 0,025 : 4 = 0,00625 k.mol
%X = \(\frac{{0,00625.855}}{{10}}.100 = 53,4\% \)
Cho sơ đồ sau:

Trong đó: X, Y, Z, T, W là các hợp chất hữu cơ khác nhau; T chỉ chứa một loại nhóm chức. Xác định phân tử khối của T?
Đáp án:
Đáp án:
Dựa vào công thức phân tử của X để suy luận hợp chất X.
X thủy phân trong nước tạo Y và Z nên X là ester
Z lên men giấm tạo Y nên Z là C2H5OH và Y là CH3COOH.
X là CH3COOC2H5.
CH3COOH + C3H5(OH)3 ⥦ (CH3COO)3C3H5 + H2O
Phân tử khối của T là: 218amu
Đáp án 218
Dùng phương pháp mạ zinc để bảo vệ các tấm thép có tổng diện tích bề mặt là 2m2. Khi đó, các tấm thép cần mạ là cathode; dung dịch mạ chứa phức chất [Zn(OH)4]2- và các tấm zinc nguyên chất là anode. Tiến hành mạ với mật độ dòng điện là 200 A/m2 và lớp mạ có độ dày 6,5 μm. Tính thời gian (theo giờ) hoàn thành lớp mạ đó? (Làm tròn đến hàng phần trăm). Cho biết khối lượng riêng DZn = 7,14 g/cm3 và 1 mol điện lượng = 1F (F: hằng số faraday) = 96485 C.
Đáp án:
Đáp án:
Tính số mol của Zn cần mạ, dựa vào công thức I.t = n.F
Thể tích kẽm cần mạ là: 2.6,5.10-6 = 13.10-6 m3
Khối lượng kẽm cần dùng là: 13.10-6.106.7,14 = 92,82g
n Zn = 92,82 : 65 = 1,428 mol
t = \(\frac{{n.F}}{I} = \frac{{1,428..96500}}{{200}}:3600 = 0,19(h)\)
Đáp án 0,19
Để xác định hàm lượng oxygen (O2) tan trong nước, người ta lấy 100,0 mL nước rồi cho ngay manganese sulphate (MnSO4, dư) và sodium hydroxide (NaOH) vào nước. Sau khi lắc kĩ (không cho tiếp xúc với không khí), manganese(II) hydroxide (Mn(OH)2) bị O2 oxi hóa thành manganese oxohydroxide (MnO(OH)2). Thêm acid (dư) và cho tiếp potassium iodide (KI, dư) vào hỗn hợp, thì ion idodine (I-) bị MnO(OH)2 oxi hóa thành ioddine (I2). Lượng I2 sinh ra phản ứng vừa đủ với 10,5 mL dung dịch Na2S2O3 0,01M (sodium thiosulphate). Biết các phản ứng xảy ra như sau:
Mn2+ + OH- → Mn(OH)2 (1)
Mn(OH)2 + O2 → MnO(OH)2 (2)
MnO(OH)2 + I- + H+ → Mn2+ + I2 + H2O (3)
I2 + Na2S2O3 → Na2S4O6 + NaI (4)
Hàm lượng O2 tan trong nước (tính theo mg O2/1L) là a. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Đáp án:
Dựa vào các phản ứng xảy ra.
n Na2S2O3 = 10,5.10-3.0,01 = 1,05.10-4 mol
Mn2+ + OH- → Mn(OH)2 (1)
2Mn(OH)2 + O2 → 2MnO(OH)2
0,2625.10-4 ← 0,525.10-4 (2)
MnO(OH)2 + 2I- + 2H+ → Mn2+ + I2 + 2H2O (3)
0,525.10-4 ←0,525.1
n Na2S2O3 = 10,5.10-3.0,01 = 1,05.10-4 mol
Mn2+ + OH- → Mn(OH)2 (1)
2Mn(OH)2 + O2 → 2MnO(OH)2
0,2625.10-4 ← 0,525.10-4 (2)
MnO(OH)2 + 2I- + 2H+ → Mn2+ + I2 + 2H2O (3)
0,525.10-4 ←0,525.10-4
I2 + 2Na2S2O3 → Na2S4O6 + 2Na
0,525.10-4 ← 1,05.10-4
m O2 = 0,2625.10-4 . 32 .103 = 0,84 mg
Hàm lượng O2 tan trong nước là: 0,84 : 0,1 = 8,4 mg/L
Đáp án 8,4
0-4
I2 + 2Na2S2O3 → Na2S4O6 + 2Na
0,525.10-4 ← 1,05.10-4
m O2 = 0,2625.10-4 . 32 .103 = 0,84 mg
Hàm lượng O2 tan trong nước là: 0,84 : 0,1 = 8,4 mg/L
Đáp án 8,4
Tinh bột chứa hỗn hợp chất nào sau đây?
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Fe = 56
Cho khối lượng riêng của các chất như bảng sau:
Tro thực vật được sử dụng như một loại phân bón
Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu
Chất nào sau đây thuộc loại disaccharide?
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ
Điện phân dung dịch CuSO4 với anode
Cho biết số hiệu nguyên tử của sodium là 11. Vị trí của sodium trong bảng tuần hoàn là
Thức uống chứa cồn như rượu, bia, nước trái cây lên men
Cho ba dung dịch có cùng nồng độ mol sau:
Để chuyển hóa dầu mỡ động thực vật thành xà phòng người ta thực hiện quá trình
Vào mùa hè, trong một số khách sạn hay nhà hàng
I. Trắc nghiệm
Cho dung dịch glucose vào ống ng̣hiệm chứa copper
Cấu trúc mạch vòng của carbohydrate nào sau đây không có nhóm -OH hemiacetal hoặc hemiketal?
Trong nước, thế điện cực chuẩn của kim loại Mn+/M
Chất X có công thức cấu tạo là CH3CH2COOCH3. Tên gọi của X là
Các bài khác cùng chuyên mục




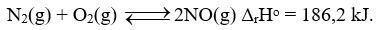






Danh sách bình luận