Đề thi thử THPT môn Hóa lần 2 năm 2025 Sở GD Phú Thọ
Vào mùa hè, trong một số khách sạn hay nhà hàng
Đề bài
Vào mùa hè, trong một số khách sạn hay nhà hàng, người ta thường cho nước đá vào bồn cầu. Thực tế đây là một kinh nghiệm dựa trên cơ sở khoa học. Phát biểu nào sau đây đúng?
-
A.
Ammonia tan nhiều trong nước lạnh nên hạn chế bay lên gây mùi khai.
-
B.
Nước đá tan chảy thành dung dịch làm sạch sau khi đi tiểu.
-
C.
Nước đá có tính axit không thật mùi.
-
D.
Nước đá chỉ còn như hóa mạnh nên oxi hóa ammonia thành nitrogen.
Đá vôi được sử dụng để sản xuất vôi sống, xi măng, vật liệu xây dựng. Thành phần hóa học chính của đá vôi là
-
A.
CaSO₄.
-
B.
Ca(OH)₂.
-
C.
Ca₃(PO₄)₂.
-
D.
CaCO₃.
Hợp chất hữu cơ X chứa nhóm carboxyl và kết quả phân tích phổ khối lượng cho thấy phân tử khối là 46. Chất X là
-
A.
Formic acid.
-
B.
ethyl alcohol.
-
C.
acetone.
-
D.
propane.
Để làm sạch lớp oxide đen bề mặt miếng loại trước khi hàn người ta thường rắc một chất rắn màu trắng. Chất rắn đó là
-
A.
NaOH.
-
B.
bột đá vôi.
-
C.
sodium chloride.
-
D.
ammonium chloride.
Dùng dung dịch nào sau đây có thể hòa tan lớp cặn đá vôi bám vào phích nước?
-
A.
Glucose.
-
B.
Sodium chloride.
-
C.
Calcium hydroxide.
-
D.
Acetic acid.
Cho các kim loại: Sc (Z = 21), Fe (Z = 26), Na (Z = 11), Ca (Z = 20). Ion nào sau đây không có cấu hình electron của khí hiếm ở trạng thái cơ bản là
-
A.
Na⁺.
-
B.
Sc³⁺.
-
C.
Fe²⁺.
-
D.
Ca²⁺.
Cho cấu tạo của một đoạn mạch trong polymer như hình sau:
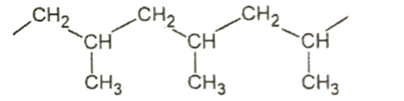
Tên monomer tương ứng tạo polymer trên là
-
A.
propene.
-
B.
vinyl chloride.
-
C.
ethylene.
-
D.
buta-1,3-diene.
Cho các kim loại sau: Al, Ag, Au, Fe. Kim loại dẫn điện kém nhất là
-
A.
Al.
-
B.
Au.
-
C.
Ag.
-
D.
Fe.
Trong ăn mòn điện hóa học, phản ứng hóa học xảy ra là phản ứng nào sau đây?
-
A.
Phản ứng oxi hóa - khử.
-
B.
Phản ứng hóa hợp.
-
C.
Phản ứng trao đổi.
-
D.
Phản ứng phân hủy.
Polysaccharide X là chất rắn, màu trắng, dạng sợi, trong bông nõn có gần 98% chất X. Chất X là
-
A.
glucose.
-
B.
cellulose.
-
C.
maltose.
-
D.
saccharose.
Phương trình hóa học của phản ứng giữa acetic acid với ethyl alcohol thu được ethyl acetate là:
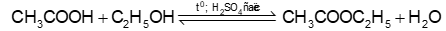
Ion H⁺ tham gia giai đoạn (1) trong cơ chế của phản ứng trên như sau:
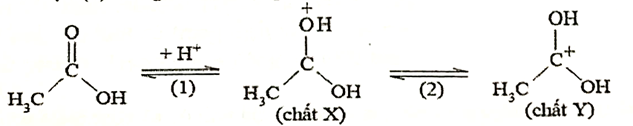
Cho các phát biểu sau:
(a) Trong giai đoạn (1) có sự phân cắt liên kết π.
(b) Chất X và Y kém bền vì mỗi chất đều chứa một nguyên tử chưa đạt cấu hình của khí hiếm.
(c) Trong giai đoạn (1), ion H⁺ nhận hai cặp electron chưa liên kết của nguyên tử oxygen trong acetic acid.
(d) Nếu thay xúc tác H₂SO₄ đặc bằng H₂SO₄ loãng thì hiệu suất phản ứng không thay đổi vì cân bằng đều chuyển dịch theo chiều thuận.
Các phát biểu đúng là
-
A.
(b), (c), (d).
-
B.
(a), (b).
-
C.
(b), (c).
-
D.
(a), (b), (d).
|
Papain là một loại enzyme có nguồn gốc từ thực vật có tác dụng thủy phân protein, được chiết xuất từ quả đu đủ xanh. Enzyme papain rất tốt cho hệ tiêu hóa, giúp tiêu hóa thức ăn giàu protein một cách dễ dàng hơn. Vì vậy, papain cũng là một thành phần chính trong một số loại thuốc điê̂u trị các bệnh tiêu hóa. Cấu tạo của papain như hình bên: |
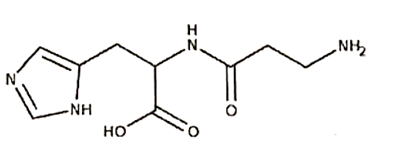 |
Các phát biểu sau:
(a) Thịt được nấu với đu đủ xanh thì sẽ nhanh mềm hơn.
(b) Thủy phân hoàn toàn papain, thu được hai α-amino acid.
(c) Trong phân tử papain có chứa nhóm amino và nhóm carboxyl.
(d) Thủy phân hoàn toàn a mol papain trong dung dịch HCl thì số mol HCl phản ứng tối đa là a.
(e) Những người bị dị ứng với nhựa đu đủ được khuyến cáo không nên sử dụng thuốc chứa papain.
Các phát biểu đúng là
-
A.
(a), (c), (d).
-
B.
(a), (c), (e).
-
C.
(a), (b), (e).
-
D.
(a), (b), (c).
Trimethylamine là một trong các chất gây ra mùi tanh của cá (đặc biệt là cá mè). Công thức phân tử của trimethylamine là:
-
A.
C₄H₇N.
-
B.
CH₃N.
-
C.
C₃H₉N.
-
D.
C₂H₇N.
Ester nào sau đây có bốn nguyên tử carbon trong phân tử?
-
A.
Diethyl oxalate.
-
B.
Methyl acetate.
-
C.
Ethyl acetate.
-
D.
Vinyl propionate.
Cho thế điện cực chuẩn của một số cặp oxi hóa - khử ở bảng sau:
|
Cặp oxi hóa - khử |
Mg²⁺/Mg |
Zn²⁺/Zn |
Fe²⁺/Fe |
Cu²⁺/Cu |
Ag⁺/Ag |
|
E⁰ (V) |
–2,36 |
–0,763 |
–0,440 |
+0,34 |
+0,799 |
Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là:
-
A.
0,459.
-
B.
0,780.
-
C.
0,323.
-
D.
1,597.
“Peptide là hợp chất hữu cơ được cấu tạo từ các đơn vị (...), (...) liên kết với nhau qua liên kết (...).” Nội dung phù hợp trong 6 trống (1), (2), (3) lần lượt là:
-
A.
\(\beta \)-amino acid, amide,
-
B.
α-amino acid, peptide.
-
C.
\(\beta \)-amino acid, peptide.
-
D.
\(\varepsilon \)-amino acid, peptide.
Cho các chất sau sắp xếp theo chiều giảm dần tính oxi hóa. Cặp oxi hóa - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ nhất?
-
A.
Al³⁺/Al.
-
B.
Fe²⁺/Fe.
-
C.
K⁺/K.
-
D.
Mg²⁺/Mg.
Khi đun nóng chất X có công thức phân tử C₂H₄O₂ với dung dịch NaOH, thu được sodium formate. Công thức cấu tạo của X là:
-
A.
CH₃COOH.
-
B.
CH₃COOC₂H₅.
-
C.
HCOOCH3.
-
D.
C₂H₅COOH.
Biểu đồ sau thể hiện độ hoạt động của các enzyme A, B, C xúc tác cho các phản ứng sinh hoá trong cơ thể theo pH của môi trường phản ứng:
Trong số các enzyme đã nêu trong biểu đồ, amylase là một enzyme tiêu hoá chủ yếu được tiết ra bởi tuyến nước bọt, có tác dụng thuỷ phân tinh bột thành maltose. Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non với vai trò phân giải protein. Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ.
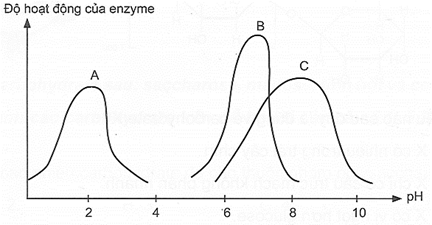
a) Khi con người sử dụng thức ăn có tinh bột, enzyme amylase trong nước bọt sẽ thủy phân tinh bột thành dextrin và maltose.
b) Ở ruột non, phần lớn tinh bột bị oxi hóa thành glucose.
c) Enzyme A là trypsin.
d) Glucose bị thủy phân chậm nhờ enzyme tạo thành CO₂ và H₂O đồng thời giải phóng năng lượng cho các hoạt động sống cơ thể, glucose còn chuyển hóa thành glycogen được lưu trữ ở gan.
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Rót từ từ dung dịch CuSO₄ 0,5M vào ống thủy tinh hình chữ U đến khi mực nước dâng lên cách miệng ống chừng 3 cm thì dừng lại.
Bước 2: Đậy miệng ống bên trái bằng nút cao su có gắn điện cực than chì.
Bước 3: Đậy miệng ống bên phải bằng nút cao su có gắn điện cực than chì và một ống dẫn khí.
Bước 4: Nối điện cực bên trái với cực âm và nối điện cực bên phải với cực dương của nguồn điện một chiều (hiệu điện thế 6V, cường độ dòng điện 1A).
a) Ở cathode, ion Cu²⁺ bị oxi hóa thành kim loại Cu theo phản ứng: Cu²⁺ + 2e⁻ → Cu.
b) Dung dịch sau điện phân có pH < 7.
c) Nếu thay dung dịch CuSO₄ 0,5M bằng dung dịch CuCl₂ 0,5M thì cathode và anode vẫn thu được sản phẩm như thí nghiệm ban đầu.
d) Đến khi cathode có khí thoát ta thì dung dịch thu được không còn màu xanh.
Cân 3,2005 gam quặng sắt chứa \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) và các tạp chất trơ khác đem hòa tan trong dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) (loãng, dư), sau đó khử hoàn toàn hết \({\rm{F}}{{\rm{e}}^{3 + }}\) trong dung dịch bằng Zn thành \({\rm{F}}{{\rm{e}}^{2 + }}\), thu được \(100,0\;{\rm{mL}}\) dung dịch X (sử dụng bình định mức 100,00mL). Lấy chính xác 10,00mL X và dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) loãng, dư cho vào bình tam giác cho mỗi lần thí nghiệm và sau đó chuẩn độ dung dịch thu được bằng \({\rm{KMn}}{{\rm{O}}_4}9,147 \cdot {10^{ - 3}}{\rm{M}}\). Chuẩn độ dung dịch đến khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt trong khoảng 20 giây thấy thề tích dung dịch KMnO4 trên burette tiêu tốn cho ba lần thí nghiệm lần lượt là 8,24 ; 8,28 và \(8,20\;{\rm{mL}}\).
a) Phản ứng hòa \(\tan {\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng: \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 3{{\rm{H}}_2}{\rm{O}}\).
b) Phương trình ion rút gọn của phản ứng chuẩn độ là: \({\rm{MnO}}_4^ - + 5{\rm{F}}{{\rm{e}}^{2 + }} + 8{{\rm{H}}^ + } \to {\rm{M}}{{\rm{n}}^{2 + }} + 5{\rm{F}}{{\rm{e}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}\).
c) Khi màu hồng nhạt trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ.
d) Từ kết quả chuẩn độ, xác định được phần trăm khối lượng của \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng là \(18,8\% \).
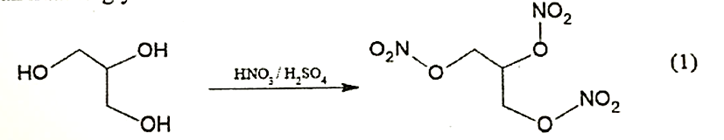
Trinitroglycerol (TNG) đã được Alfred Nobel sử dụng làm chất nổ thương mại, là hợp chất nguy hiểm. TNG được sản xuất từ glycerol theo sơ đồ sau:
Khi nổ, TNG phân hủy theo sơ đồ:
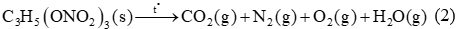
a) Cho giá trị enthalpy chuẩn \(({\rm{kJ}}/{\rm{mol}})\) của các chất \({{\rm{C}}_3}{{\rm{H}}_5}{\left( {{\rm{ON}}{{\rm{O}}_2}} \right)_3}(\;{\rm{s}}),{\rm{C}}{{\rm{O}}_2}(\;{\rm{g}})\) và \({{\rm{H}}_2}{\rm{O}}({\rm{g}})\) lần lượt là \( - 370,15; - 393,5\) và \( - 241,8\). Nhiệt lượng tỏa ra khi phân hủy hoàn toàn 227 kg TNG là 5659600 kJ.
b) TNG chứa ba liên kết \(\pi \) trong phân tử.
c) Nếu glycerol phản ứng với nitric acid theo tỉ lệ mol tương ứng 1: 2 thì thu được tối đa hai đồng phân cấu tạo có cùng công thức phân tử
\({{\rm{C}}_3}{{\rm{H}}_6}{{\rm{O}}_7}\;{{\rm{N}}_2}\).
d) Trong phản ứng (1) có sự thay thế các nguyên tử hydrogen của -OH bằng nhóm \( - {\rm{N}}{{\rm{O}}_2}\).
Đun nóng một loại dầu thực vật với dung dịch NaOH, sản phẩm thu được có chứa muối sodium linolenate (C₁₇H₂₉COONa). Số liên kết π có trong phân tử sodium linolenate là bao nhiêu?
Hầu hết vàng dùng làm đồ trang sức là hợp kim của vàng và các kim loại khác để thêm vào để cho cứng hơn. Vàng nguyên chất đã vàng 24 carat, vì vậy vàng 18 carat là hợp kim của vàng và các kim loại khác theo tỷ lệ tương ứng là 18 : 6 về khối lượng. Một thợ kim hoàn tạo ra một món đồ trang sức hợp kim vàng 18 carat bằng cách sử dụng 9 gam vàng nguyên chất thì món đồ trang sức đó nặng bao nhiêu gam?
Ứng với công thức phân tử C₄H₁₁N, có bao nhiêu amine đồng phân cấu tạo khi tác dụng với dung dịch HNO₂ ở nhiệt độ thường thấy có khí không màu bay lên?
Sự chuyển hóa tinh bột trong cơ thể được biểu diễn bởi sơ đồ sau:

Sắp xếp các phản ứng ứng với pha xảy ra trong sơ đồ trên theo thứ tự từ nhóm đến nhóm một dãy các số.
Copper(II) sulfate pentahydrate (CuSO₄.5H₂O) có khả năng kháng nấm, chống sâu bện cho hoa,…
Sản xuất CuSO₄.5H₂O từ khoáng vật malachit (thành phần chính là Cu(OH)₂.CuCO₃) theo sơ đồ:
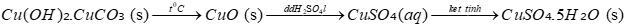
Để sản xuất được 2,0 tấn CuSO₄.5H₂O cần bao nhiêu tấn khoáng vật malachit (làm tròn đến hàng phần trăm)? Biết hiệu suất của quá trình là 80%; Cu(OH)₂.CuCO₃ chiếm 80% khối lượng malachit.
Carbon dioxide (CO₂) là thành phần chính trong khí thải nhà máy nhiệt điện (than, khí,...), nó là một khí thải gây hiệu ứng nhà kính và gây ra sự biến đổi khí hậu toàn cầu. Để giảm tác động của nó tới môi trường, người ta hấp thụ và tách CO₂ từ khí thải nhiệt điện, sau đó lưu trữ hoặc sử dụng CO₂ cho các mục đích khác nhau như tái chế hoặc sản xuất các sản phẩm hóa học (urea, soda,...).
Một nhà máy nhiệt điện khí có sản lượng điện 10⁶ kWh/ngày (1 kWh = 3600 kJ) đã sử dụng khí thiên nhiên làm nhiên liệu (chứa 90% CH₄, 10% C₂H₆ về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn (biết 58% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Toàn bộ lượng khí CO₂ mà nhà máy này thải ra trong 1 ngày được sử dụng để tổng hợp được m tấn urea chứa 98% (NH₂)₂CO, với hiệu suất là 90% (làm tròn đến hàng đơn vị). Biết CH₄, C₂H₆ cháy theo các phương trình:
\({\rm{C}}{{\rm{H}}_4}\left( g \right) + 2{{\rm{O}}_2}\left( g \right) \to {\rm{C}}{{\rm{O}}_2}\left( g \right) + 2{{\rm{H}}_2}{\rm{O}}\left( g \right)\)
\({{\rm{C}}_2}{{\rm{H}}_6}\left( g \right) + \frac{7}{2}{{\rm{O}}_2}\left( g \right) \to 2{\rm{C}}{{\rm{O}}_2}\left( g \right) + 3{{\rm{H}}_2}{\rm{O}}\left( g \right)\)
Các giá trị nhiệt tạo thành (\({\Delta _f}H_{298}^0\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:
|
Chất |
CH₄(g) |
C₂H₆(g) |
CO₂(g) |
H₂O(g) |
|
\({\Delta _f}H_{298}^0\) (kJ/mol) |
–74,6 |
–84,7 |
–393,5 |
–241,8 |
Lời giải và đáp án
Vào mùa hè, trong một số khách sạn hay nhà hàng, người ta thường cho nước đá vào bồn cầu. Thực tế đây là một kinh nghiệm dựa trên cơ sở khoa học. Phát biểu nào sau đây đúng?
-
A.
Ammonia tan nhiều trong nước lạnh nên hạn chế bay lên gây mùi khai.
-
B.
Nước đá tan chảy thành dung dịch làm sạch sau khi đi tiểu.
-
C.
Nước đá có tính axit không thật mùi.
-
D.
Nước đá chỉ còn như hóa mạnh nên oxi hóa ammonia thành nitrogen.
Đáp án : A
Dựa vào tính chất của ammonia.
Ammonia tan nhiều trong nước lạnh nên hạn chế bay lên gây mùi khai.
NH3 + H2O ⥦ NH4+ + OH-
Đá vôi được sử dụng để sản xuất vôi sống, xi măng, vật liệu xây dựng. Thành phần hóa học chính của đá vôi là
-
A.
CaSO₄.
-
B.
Ca(OH)₂.
-
C.
Ca₃(PO₄)₂.
-
D.
CaCO₃.
Đáp án : D
Dựa vào hợp chất nhóm IIA.
Thành phần chính của đá vôi là CaCO3.
Đáp án D
Hợp chất hữu cơ X chứa nhóm carboxyl và kết quả phân tích phổ khối lượng cho thấy phân tử khối là 46. Chất X là
-
A.
Formic acid.
-
B.
ethyl alcohol.
-
C.
acetone.
-
D.
propane.
Đáp án : A
Dựa vào phân tử khối của X.
X chứa nhóm carboxyl và MX = 46 nên X là formic acid.
Đáp án A
Để làm sạch lớp oxide đen bề mặt miếng loại trước khi hàn người ta thường rắc một chất rắn màu trắng. Chất rắn đó là
-
A.
NaOH.
-
B.
bột đá vôi.
-
C.
sodium chloride.
-
D.
ammonium chloride.
Đáp án : D
Dựa vào tính chất của muối ammonium.
Chất rắn màu trắng là NH4Cl
Đáp án D
Dùng dung dịch nào sau đây có thể hòa tan lớp cặn đá vôi bám vào phích nước?
-
A.
Glucose.
-
B.
Sodium chloride.
-
C.
Calcium hydroxide.
-
D.
Acetic acid.
Đáp án : D
Dựa vào tính chất hoá học của carboxylic acid.
Acetic acid có thể hoà tan lớp cặn đá vôi bám vào phích nước.
Đáp án D
Cho các kim loại: Sc (Z = 21), Fe (Z = 26), Na (Z = 11), Ca (Z = 20). Ion nào sau đây không có cấu hình electron của khí hiếm ở trạng thái cơ bản là
-
A.
Na⁺.
-
B.
Sc³⁺.
-
C.
Fe²⁺.
-
D.
Ca²⁺.
Đáp án : C
Dựa vào đặc điểm cấu tạo của kim loại chuyển tiếp.
Fe2+ chưa đạt được cấu hình của khí hiếm vì Fe có khả năng nhường 3 electron.
Đáp án C
Cho cấu tạo của một đoạn mạch trong polymer như hình sau:

Tên monomer tương ứng tạo polymer trên là
-
A.
propene.
-
B.
vinyl chloride.
-
C.
ethylene.
-
D.
buta-1,3-diene.
Đáp án : A
Dựa vào cấu tạo của polymer.
Polymer trên được điều chế từ propene.
Đáp án A
Cho các kim loại sau: Al, Ag, Au, Fe. Kim loại dẫn điện kém nhất là
-
A.
Al.
-
B.
Au.
-
C.
Ag.
-
D.
Fe.
Đáp án : D
Dựa vào khả năng dẫn điện của kim loại.
Fe là kim loại dẫn điện kém.
Đáp án D
Trong ăn mòn điện hóa học, phản ứng hóa học xảy ra là phản ứng nào sau đây?
-
A.
Phản ứng oxi hóa - khử.
-
B.
Phản ứng hóa hợp.
-
C.
Phản ứng trao đổi.
-
D.
Phản ứng phân hủy.
Đáp án : A
Dựa vào khái niệm ăn mòn điện hoá học.
Trong ăn mòn điện hoá học, phản ứng hoá học xảy ra là phản ứng oxi hoá – khử.
Đáp án A
Polysaccharide X là chất rắn, màu trắng, dạng sợi, trong bông nõn có gần 98% chất X. Chất X là
-
A.
glucose.
-
B.
cellulose.
-
C.
maltose.
-
D.
saccharose.
Đáp án : B
Dựa vào trạng thái tự nhiên của carbohydrate.
Polysaccharide X có trong bông nõn nên X là cellulose.
Đáp án B
Phương trình hóa học của phản ứng giữa acetic acid với ethyl alcohol thu được ethyl acetate là:
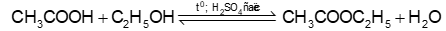
Ion H⁺ tham gia giai đoạn (1) trong cơ chế của phản ứng trên như sau:

Cho các phát biểu sau:
(a) Trong giai đoạn (1) có sự phân cắt liên kết π.
(b) Chất X và Y kém bền vì mỗi chất đều chứa một nguyên tử chưa đạt cấu hình của khí hiếm.
(c) Trong giai đoạn (1), ion H⁺ nhận hai cặp electron chưa liên kết của nguyên tử oxygen trong acetic acid.
(d) Nếu thay xúc tác H₂SO₄ đặc bằng H₂SO₄ loãng thì hiệu suất phản ứng không thay đổi vì cân bằng đều chuyển dịch theo chiều thuận.
Các phát biểu đúng là
-
A.
(b), (c), (d).
-
B.
(a), (b).
-
C.
(b), (c).
-
D.
(a), (b), (d).
Đáp án : B
Dựa vào cơ chế phản ứng.
(a) đúng
(b) đúng
(c) sai, ion H+ nhận 1 cặp electron chưa liên kết của nguyên tử oxygen trong acetic acid.
(d) sai, H2SO4 đặc còn có vai trò hút nước trong phản ứng.
Đáp án B
|
Papain là một loại enzyme có nguồn gốc từ thực vật có tác dụng thủy phân protein, được chiết xuất từ quả đu đủ xanh. Enzyme papain rất tốt cho hệ tiêu hóa, giúp tiêu hóa thức ăn giàu protein một cách dễ dàng hơn. Vì vậy, papain cũng là một thành phần chính trong một số loại thuốc điê̂u trị các bệnh tiêu hóa. Cấu tạo của papain như hình bên: |
 |
Các phát biểu sau:
(a) Thịt được nấu với đu đủ xanh thì sẽ nhanh mềm hơn.
(b) Thủy phân hoàn toàn papain, thu được hai α-amino acid.
(c) Trong phân tử papain có chứa nhóm amino và nhóm carboxyl.
(d) Thủy phân hoàn toàn a mol papain trong dung dịch HCl thì số mol HCl phản ứng tối đa là a.
(e) Những người bị dị ứng với nhựa đu đủ được khuyến cáo không nên sử dụng thuốc chứa papain.
Các phát biểu đúng là
-
A.
(a), (c), (d).
-
B.
(a), (c), (e).
-
C.
(a), (b), (e).
-
D.
(a), (b), (c).
Đáp án : B
Dựa vào cấu tạo của papain.
(a) đúng
(b) sai, thuỷ phân hoàn toàn thu được 1 α – amino acid.
(c) đúng
(d) sai, phản ứng tối đa là 2a mol
(e) đúng
Đáp án B
Trimethylamine là một trong các chất gây ra mùi tanh của cá (đặc biệt là cá mè). Công thức phân tử của trimethylamine là:
-
A.
C₄H₇N.
-
B.
CH₃N.
-
C.
C₃H₉N.
-
D.
C₂H₇N.
Đáp án : C
Dựa vào tên gọi của amine.
Trimethylamine có công thức là C3H9N.
Đáp án C
Ester nào sau đây có bốn nguyên tử carbon trong phân tử?
-
A.
Diethyl oxalate.
-
B.
Methyl acetate.
-
C.
Ethyl acetate.
-
D.
Vinyl propionate.
Đáp án : C
Dựa vào cấu tạo của ester.
Ethyl acetate có 4 nguyên tử carbon trong phân tử: CH3COOC2H5.
Đáp án C
Cho thế điện cực chuẩn của một số cặp oxi hóa - khử ở bảng sau:
|
Cặp oxi hóa - khử |
Mg²⁺/Mg |
Zn²⁺/Zn |
Fe²⁺/Fe |
Cu²⁺/Cu |
Ag⁺/Ag |
|
E⁰ (V) |
–2,36 |
–0,763 |
–0,440 |
+0,34 |
+0,799 |
Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là:
-
A.
0,459.
-
B.
0,780.
-
C.
0,323.
-
D.
1,597.
Đáp án : A
Dựa vào công thức tính sức điện động của pin điện.
Sức điện động của pin Cu – Ag trên là 0,459V
Đáp án A
“Peptide là hợp chất hữu cơ được cấu tạo từ các đơn vị (...), (...) liên kết với nhau qua liên kết (...).” Nội dung phù hợp trong 6 trống (1), (2), (3) lần lượt là:
-
A.
\(\beta \)-amino acid, amide,
-
B.
α-amino acid, peptide.
-
C.
\(\beta \)-amino acid, peptide.
-
D.
\(\varepsilon \)-amino acid, peptide.
Đáp án : B
Dựa vào khái niệm của peptide.
Peptide là hợp chất hữu cơ được cấu tạo từ các đơn vị α – amin acid, peptide liên kết với nhau qua liên kết peptide.
Đáp án B
Cho các chất sau sắp xếp theo chiều giảm dần tính oxi hóa. Cặp oxi hóa - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ nhất?
-
A.
Al³⁺/Al.
-
B.
Fe²⁺/Fe.
-
C.
K⁺/K.
-
D.
Mg²⁺/Mg.
Đáp án : C
Dựa vào ý nghĩa của thế điện cực của kim loại.
Cặp oxi hoá – khử có thế điện cực chuẩn nhỏ nhất là K⁺/K.
Đáp án C
Khi đun nóng chất X có công thức phân tử C₂H₄O₂ với dung dịch NaOH, thu được sodium formate. Công thức cấu tạo của X là:
-
A.
CH₃COOH.
-
B.
CH₃COOC₂H₅.
-
C.
HCOOCH3.
-
D.
C₂H₅COOH.
Đáp án : C
Dựa vào tính chất hoá học của ester.
X có công thức cấu tạo là HCOOCH3.
Đáp án C
Biểu đồ sau thể hiện độ hoạt động của các enzyme A, B, C xúc tác cho các phản ứng sinh hoá trong cơ thể theo pH của môi trường phản ứng:
Trong số các enzyme đã nêu trong biểu đồ, amylase là một enzyme tiêu hoá chủ yếu được tiết ra bởi tuyến nước bọt, có tác dụng thuỷ phân tinh bột thành maltose. Pepsin và trypsin cũng là các enzyme tiêu hoá, lần lượt có trong dịch vị và ruột non với vai trò phân giải protein. Trypsin hoạt động tốt nhất trong môi trường kiềm nhẹ.

a) Khi con người sử dụng thức ăn có tinh bột, enzyme amylase trong nước bọt sẽ thủy phân tinh bột thành dextrin và maltose.
b) Ở ruột non, phần lớn tinh bột bị oxi hóa thành glucose.
c) Enzyme A là trypsin.
d) Glucose bị thủy phân chậm nhờ enzyme tạo thành CO₂ và H₂O đồng thời giải phóng năng lượng cho các hoạt động sống cơ thể, glucose còn chuyển hóa thành glycogen được lưu trữ ở gan.
a) Khi con người sử dụng thức ăn có tinh bột, enzyme amylase trong nước bọt sẽ thủy phân tinh bột thành dextrin và maltose.
b) Ở ruột non, phần lớn tinh bột bị oxi hóa thành glucose.
c) Enzyme A là trypsin.
d) Glucose bị thủy phân chậm nhờ enzyme tạo thành CO₂ và H₂O đồng thời giải phóng năng lượng cho các hoạt động sống cơ thể, glucose còn chuyển hóa thành glycogen được lưu trữ ở gan.
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng.
a) đúng
b) sai, tinh bột bị thuỷ phân thành glucose
c) sai, enzyme A là amylase
d) sai, glucose bị oxi hoá.
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Rót từ từ dung dịch CuSO₄ 0,5M vào ống thủy tinh hình chữ U đến khi mực nước dâng lên cách miệng ống chừng 3 cm thì dừng lại.
Bước 2: Đậy miệng ống bên trái bằng nút cao su có gắn điện cực than chì.
Bước 3: Đậy miệng ống bên phải bằng nút cao su có gắn điện cực than chì và một ống dẫn khí.
Bước 4: Nối điện cực bên trái với cực âm và nối điện cực bên phải với cực dương của nguồn điện một chiều (hiệu điện thế 6V, cường độ dòng điện 1A).
a) Ở cathode, ion Cu²⁺ bị oxi hóa thành kim loại Cu theo phản ứng: Cu²⁺ + 2e⁻ → Cu.
b) Dung dịch sau điện phân có pH < 7.
c) Nếu thay dung dịch CuSO₄ 0,5M bằng dung dịch CuCl₂ 0,5M thì cathode và anode vẫn thu được sản phẩm như thí nghiệm ban đầu.
d) Đến khi cathode có khí thoát ta thì dung dịch thu được không còn màu xanh.
a) Ở cathode, ion Cu²⁺ bị oxi hóa thành kim loại Cu theo phản ứng: Cu²⁺ + 2e⁻ → Cu.
b) Dung dịch sau điện phân có pH < 7.
c) Nếu thay dung dịch CuSO₄ 0,5M bằng dung dịch CuCl₂ 0,5M thì cathode và anode vẫn thu được sản phẩm như thí nghiệm ban đầu.
d) Đến khi cathode có khí thoát ta thì dung dịch thu được không còn màu xanh.
Dựa vào nguyên tắc hoạt động của pin.
a) sai, ở cathode ion Cu2+ bị khử thành kim loại Cu.
b) đúng
c) sai, vì ion SO42- không bị điện phân
d) đúng
Cân 3,2005 gam quặng sắt chứa \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) và các tạp chất trơ khác đem hòa tan trong dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) (loãng, dư), sau đó khử hoàn toàn hết \({\rm{F}}{{\rm{e}}^{3 + }}\) trong dung dịch bằng Zn thành \({\rm{F}}{{\rm{e}}^{2 + }}\), thu được \(100,0\;{\rm{mL}}\) dung dịch X (sử dụng bình định mức 100,00mL). Lấy chính xác 10,00mL X và dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) loãng, dư cho vào bình tam giác cho mỗi lần thí nghiệm và sau đó chuẩn độ dung dịch thu được bằng \({\rm{KMn}}{{\rm{O}}_4}9,147 \cdot {10^{ - 3}}{\rm{M}}\). Chuẩn độ dung dịch đến khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt trong khoảng 20 giây thấy thề tích dung dịch KMnO4 trên burette tiêu tốn cho ba lần thí nghiệm lần lượt là 8,24 ; 8,28 và \(8,20\;{\rm{mL}}\).
a) Phản ứng hòa \(\tan {\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng: \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 3{{\rm{H}}_2}{\rm{O}}\).
b) Phương trình ion rút gọn của phản ứng chuẩn độ là: \({\rm{MnO}}_4^ - + 5{\rm{F}}{{\rm{e}}^{2 + }} + 8{{\rm{H}}^ + } \to {\rm{M}}{{\rm{n}}^{2 + }} + 5{\rm{F}}{{\rm{e}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}\).
c) Khi màu hồng nhạt trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ.
d) Từ kết quả chuẩn độ, xác định được phần trăm khối lượng của \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng là \(18,8\% \).
a) Phản ứng hòa \(\tan {\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng: \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 3{{\rm{H}}_2}{\rm{O}}\).
b) Phương trình ion rút gọn của phản ứng chuẩn độ là: \({\rm{MnO}}_4^ - + 5{\rm{F}}{{\rm{e}}^{2 + }} + 8{{\rm{H}}^ + } \to {\rm{M}}{{\rm{n}}^{2 + }} + 5{\rm{F}}{{\rm{e}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}\).
c) Khi màu hồng nhạt trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ.
d) Từ kết quả chuẩn độ, xác định được phần trăm khối lượng của \({\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}\) trong quặng là \(18,8\% \).
Dựa vào phương pháp chuẩn độ ion Fe2+.
\({\overline V _{KMn{O_4}}} = \frac{{8,24 + 8,28 + 8,2}}{3} = 8,24mL\)
n KMnO4 = 8,24.10-3.9,147.10-3 = 75,37128.10-6 mol
\({\rm{MnO}}_4^ - + 5{\rm{F}}{{\rm{e}}^{2 + }} + 8{{\rm{H}}^ + } \to {\rm{M}}{{\rm{n}}^{2 + }} + 5{\rm{F}}{{\rm{e}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}\).
n Fe2+ = 75,37128.10-6.5 = 376,8564.10-6 mol
→ n Fe2+ trong X là = 376,8564.10-5 mol
a) đúng
b) đúng
c) đúng
d) sai vì % Fe2O3 = \(\frac{{376,{{8564.10}^{ - 5}}.2.160}}{{3,2005}}.100 = 37.68\% \)
Trinitroglycerol (TNG) đã được Alfred Nobel sử dụng làm chất nổ thương mại, là hợp chất nguy hiểm. TNG được sản xuất từ glycerol theo sơ đồ sau:

Khi nổ, TNG phân hủy theo sơ đồ:
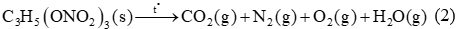
a) Cho giá trị enthalpy chuẩn \(({\rm{kJ}}/{\rm{mol}})\) của các chất \({{\rm{C}}_3}{{\rm{H}}_5}{\left( {{\rm{ON}}{{\rm{O}}_2}} \right)_3}(\;{\rm{s}}),{\rm{C}}{{\rm{O}}_2}(\;{\rm{g}})\) và \({{\rm{H}}_2}{\rm{O}}({\rm{g}})\) lần lượt là \( - 370,15; - 393,5\) và \( - 241,8\). Nhiệt lượng tỏa ra khi phân hủy hoàn toàn 227 kg TNG là 5659600 kJ.
b) TNG chứa ba liên kết \(\pi \) trong phân tử.
c) Nếu glycerol phản ứng với nitric acid theo tỉ lệ mol tương ứng 1: 2 thì thu được tối đa hai đồng phân cấu tạo có cùng công thức phân tử
\({{\rm{C}}_3}{{\rm{H}}_6}{{\rm{O}}_7}\;{{\rm{N}}_2}\).
d) Trong phản ứng (1) có sự thay thế các nguyên tử hydrogen của -OH bằng nhóm \( - {\rm{N}}{{\rm{O}}_2}\).
a) Cho giá trị enthalpy chuẩn \(({\rm{kJ}}/{\rm{mol}})\) của các chất \({{\rm{C}}_3}{{\rm{H}}_5}{\left( {{\rm{ON}}{{\rm{O}}_2}} \right)_3}(\;{\rm{s}}),{\rm{C}}{{\rm{O}}_2}(\;{\rm{g}})\) và \({{\rm{H}}_2}{\rm{O}}({\rm{g}})\) lần lượt là \( - 370,15; - 393,5\) và \( - 241,8\). Nhiệt lượng tỏa ra khi phân hủy hoàn toàn 227 kg TNG là 5659600 kJ.
b) TNG chứa ba liên kết \(\pi \) trong phân tử.
c) Nếu glycerol phản ứng với nitric acid theo tỉ lệ mol tương ứng 1: 2 thì thu được tối đa hai đồng phân cấu tạo có cùng công thức phân tử
\({{\rm{C}}_3}{{\rm{H}}_6}{{\rm{O}}_7}\;{{\rm{N}}_2}\).
d) Trong phản ứng (1) có sự thay thế các nguyên tử hydrogen của -OH bằng nhóm \( - {\rm{N}}{{\rm{O}}_2}\).
Dựa vào phản ứng (1)
a) sai, vì
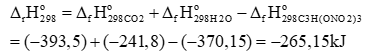
Lượng nhiệt toả ra khi phân huỷ hoàn toàn 1000 mol TNG là: 265150 kJ
b) đúng
c) đúng
d) đúng
Đun nóng một loại dầu thực vật với dung dịch NaOH, sản phẩm thu được có chứa muối sodium linolenate (C₁₇H₂₉COONa). Số liên kết π có trong phân tử sodium linolenate là bao nhiêu?
Dựa vào cấu tạo của chất béo.
Số liên kết pi trong C17H29COONa là 4 (3 liên pi trong gốc C17H29 và 1 liên kết pi trong nhóm -COO-)
Đáp án 4
Hầu hết vàng dùng làm đồ trang sức là hợp kim của vàng và các kim loại khác để thêm vào để cho cứng hơn. Vàng nguyên chất đã vàng 24 carat, vì vậy vàng 18 carat là hợp kim của vàng và các kim loại khác theo tỷ lệ tương ứng là 18 : 6 về khối lượng. Một thợ kim hoàn tạo ra một món đồ trang sức hợp kim vàng 18 carat bằng cách sử dụng 9 gam vàng nguyên chất thì món đồ trang sức đó nặng bao nhiêu gam?
Dựa vào tỉ lệ tương ứng của vàng 18 carat.
Khối lượng của các kim loại khác là: 3 gam
Tổng khối lượng món trang sức là: 3 + 9 = 12gam
Đáp án 12
Ứng với công thức phân tử C₄H₁₁N, có bao nhiêu amine đồng phân cấu tạo khi tác dụng với dung dịch HNO₂ ở nhiệt độ thường thấy có khí không màu bay lên?
Viết amine bậc I.
Các amine bậc I ứng với công thức phân tử C4H11N phản ứng với dung dịch HNO2 có khí thoát lên.
Đáp án 4
Sự chuyển hóa tinh bột trong cơ thể được biểu diễn bởi sơ đồ sau:

Sắp xếp các phản ứng ứng với pha xảy ra trong sơ đồ trên theo thứ tự từ nhóm đến nhóm một dãy các số.
Dựa vào tính chất hoá học của tinh bột.
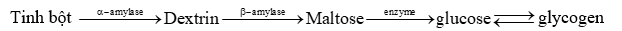
Copper(II) sulfate pentahydrate (CuSO₄.5H₂O) có khả năng kháng nấm, chống sâu bện cho hoa,…
Sản xuất CuSO₄.5H₂O từ khoáng vật malachit (thành phần chính là Cu(OH)₂.CuCO₃) theo sơ đồ:
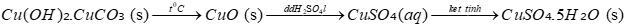
Để sản xuất được 2,0 tấn CuSO₄.5H₂O cần bao nhiêu tấn khoáng vật malachit (làm tròn đến hàng phần trăm)? Biết hiệu suất của quá trình là 80%; Cu(OH)₂.CuCO₃ chiếm 80% khối lượng malachit.
Tính số mol CuSO4.5H2O
n CuSO4.5H2O = \(\frac{2}{{250}} = 0,008\)tấn mol
Bảo toàn nguyên tố theo sơ đồ phản ứng: n Cu(OH)2.CuCO3 = 0,008 : 2 : 80% = 0,005 tấn mol
m Cu(OH)2.CuCO3 = 1,11 tấn
Khối lượng malachit là: 1,11 : 80% = 1,39 tấn
Đáp án 1,39
Carbon dioxide (CO₂) là thành phần chính trong khí thải nhà máy nhiệt điện (than, khí,...), nó là một khí thải gây hiệu ứng nhà kính và gây ra sự biến đổi khí hậu toàn cầu. Để giảm tác động của nó tới môi trường, người ta hấp thụ và tách CO₂ từ khí thải nhiệt điện, sau đó lưu trữ hoặc sử dụng CO₂ cho các mục đích khác nhau như tái chế hoặc sản xuất các sản phẩm hóa học (urea, soda,...).
Một nhà máy nhiệt điện khí có sản lượng điện 10⁶ kWh/ngày (1 kWh = 3600 kJ) đã sử dụng khí thiên nhiên làm nhiên liệu (chứa 90% CH₄, 10% C₂H₆ về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn (biết 58% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Toàn bộ lượng khí CO₂ mà nhà máy này thải ra trong 1 ngày được sử dụng để tổng hợp được m tấn urea chứa 98% (NH₂)₂CO, với hiệu suất là 90% (làm tròn đến hàng đơn vị). Biết CH₄, C₂H₆ cháy theo các phương trình:
\({\rm{C}}{{\rm{H}}_4}\left( g \right) + 2{{\rm{O}}_2}\left( g \right) \to {\rm{C}}{{\rm{O}}_2}\left( g \right) + 2{{\rm{H}}_2}{\rm{O}}\left( g \right)\)
\({{\rm{C}}_2}{{\rm{H}}_6}\left( g \right) + \frac{7}{2}{{\rm{O}}_2}\left( g \right) \to 2{\rm{C}}{{\rm{O}}_2}\left( g \right) + 3{{\rm{H}}_2}{\rm{O}}\left( g \right)\)
Các giá trị nhiệt tạo thành (\({\Delta _f}H_{298}^0\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:
|
Chất |
CH₄(g) |
C₂H₆(g) |
CO₂(g) |
H₂O(g) |
|
\({\Delta _f}H_{298}^0\) (kJ/mol) |
–74,6 |
–84,7 |
–393,5 |
–241,8 |
\({\Delta _r}H_{298}^o(1) = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o({H_2}{\rm{O}}) - {\Delta _f}H_{298}^o(C{H_4}) = ( - 393,5) + 2.( - 241,8) - ( - 74,6) = - 802,5kJ\)
\({\Delta _r}H_{298}^o(2) = 2.{\Delta _f}H_{298}^o(C{O_2}) + 3.{\Delta _f}H_{298}^o({H_2}{\rm{O}}) - {\Delta _f}H_{298}^o({C_2}{H_6}) = 2.( - 393,5) + 3.( - 241,8) - ( - 84,7) = - 1427,7kJ\)
Lượng nhiệt trong 1 ngày khi đốt cháy nhiên liệu là: \({3600.10^6} = 3,{6.10^9}\)kJ
Lượng nhiệt toả ra khi đốt cháy nhiên liệu là: \(3,{6.10^9}:58\% = 6,{21.10^9}kJ\)
Gọi số mol CH4 là 0,9a và số mol C2H6 là 0,1a
Ta có: 802,5.0,9a + 1427,7.0,1a = 6,21.109 → a = 6,96.106 mol
n CO2 = 0,9a + 0,1a.2 = \(0,9.6,{96.10^6} + 0,1.6,{96.10^6}.2 = 7656000mol\)
khối lượng của (NH2)2CO là: 7656000 60.90% = 4133424000g
Khối lượng urea là: 4133424000: 98% = 421861224,5g = 422 tấn
I. Trắc nghiệm
Cho dung dịch glucose vào ống ng̣hiệm chứa copper
Để chuyển hóa dầu mỡ động thực vật thành xà phòng người ta thực hiện quá trình
Cho ba dung dịch có cùng nồng độ mol sau:
Thức uống chứa cồn như rượu, bia, nước trái cây lên men
Cho biết số hiệu nguyên tử của sodium là 11. Vị trí của sodium trong bảng tuần hoàn là
Điện phân dung dịch CuSO4 với anode
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau
Chất nào sau đây thuộc loại disaccharide?
Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu
Tro thực vật được sử dụng như một loại phân bón
Cho khối lượng riêng của các chất như bảng sau:
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Fe = 56
Tinh bột chứa hỗn hợp chất nào sau đây?
Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Cấu trúc mạch vòng của carbohydrate nào sau đây không có nhóm -OH hemiacetal hoặc hemiketal?
Trong nước, thế điện cực chuẩn của kim loại Mn+/M
Chất X có công thức cấu tạo là CH3CH2COOCH3. Tên gọi của X là
Các bài khác cùng chuyên mục









Danh sách bình luận