Đề tham khảo thi THPT môn Hóa - Đề số 7 (hay, chi tiết)
Phần I. Trắc nghiệm nhiều đáp án lựa chọn
Đề bài
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
-
A.
W.
-
B.
Cr.
-
C.
Hg.
-
D.
Pb.
Sodium hydrogen carbonate là chất được dùng làm bột nở, chế thuốc giảm đau dạ dày do thừa acid. Công thức của Sodium hydrogen carbonate là
-
A.
NaOH.
-
B.
NaHS.
-
C.
NaHCO3.
-
D.
Na2CO3
Polymer là chất rắn trong suốt, có khả năng cho ánh sáng truyền qua tốt nên được dùng để
chế tạo thuỷ tinh hữu cơ. Tên gọi của là
-
A.
Poly(methyl methacrylate).
-
B.
Poly(phenol-formaldehyde).
-
C.
Polyethylene.
-
D.
Poly(vinyl chloride).
Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là:
-
A.
Fe, Cu, Ag.
-
B.
K, Zn, Cu.
-
C.
Al, Fe, Cr.
-
D.
Na, Ag, Cu.
Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Ở trạng thái cơ bản, cấu hình electron của ion Al3+ là
-
A.
ls22s22p63s23p1.
-
B.
ls22s22p6.
-
C.
ls22s22p5.
-
D.
ls22s22p63s1
Chất nào sau đây không dùng để làm mềm nước cứng tạm thời?
-
A.
Na2CO3
-
B.
Ca(OH)2
-
C.
Na3PO4
-
D.
NaNO3
Điểm chớp cháy là nhiệt độ thấp nhất ở áp suất của khí quyển mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa.
- Điểm chớp cháy được sử dụng để phân biệt chất lỏng dễ cháy với chất lỏng có thể gây cháy:
+ Chất lỏng có điểm chớp cháy <37,8oC gọi là chất lỏng dễ cháy.
+ Chất lỏng có điểm chớp cháy >37,8oC gọi là chất lỏng có thể gây cháy.
Cho bảng số liệu sau:
|
Nhiên liệu |
Điểm chớp cháy (℃) |
Nhiên liệu |
Điểm chớp cháy (℃) |
|
Propane |
–105 |
Ethylene glycol |
111 |
|
Pentane |
–49 |
Diethyl ether |
–45 |
|
n–Hexane |
–22 |
Acetaldehyde |
–39 |
|
Ethanol |
13 |
Stearic acid |
196 |
|
Methanol |
11 |
Trimethylamine |
–7 |
Số chất lỏng dễ cháy trong bảng trên là
-
A.
6
-
B.
7
-
C.
8
-
D.
9
Phân bón nào sau đây khi bón cho cây trồng có thể làm tăng độ chua của đất?
-
A.
Potassium chloride.
-
B.
Potassium carbonate
-
C.
Potassium nitrate.
-
D.
Ammonium nitrate
Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của hợp chất hữu cơ X là 74. Chất X có thể là
-
A.
Acetic acid.
-
B.
Methyl acetate.
-
C.
Acetone.
-
D.
Trimethylamine.
Ester X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch H2SO4 loãng, đun nóng thu được sản phẩm gồm methyl alcohol và chất hữu cơ Y. Công thức của Y là
-
A.
C2H5OH.
-
B.
HCOOH.
-
C.
CH3COOH.
-
D.
C2H5COOH.
Amine nào sau đây ở trạng thái lỏng ở nhiệt độ thường?
-
A.
Methylamine
-
B.
Ethylamine.
-
C.
Dimethylamine.
-
D.
Aniline.
Carbohydrate nào sau đây thuộc loại polysaccharide?
-
A.
Saccharose.
-
B.
Cellulose.
-
C.
Fructose.
-
D.
Glucose.
Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trọng đời sống: kích thích quả mau chín, điều chế nhựa làm sản phẩm gia dụng,… Phản ứng hóa học của ethylene với dung dịch Br2 như sau:
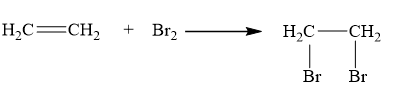
Cơ chế của phản ứng trên xảy ra như sau:
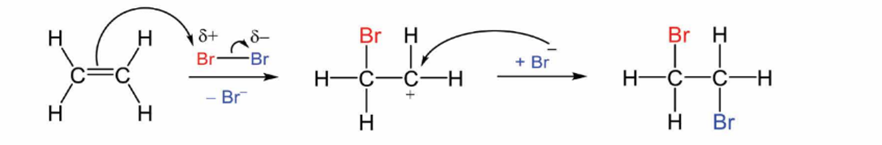
Nhận định nào sau đây không đúng?
-
A.
Phản ứng trên thuộc loại phản ứng cộng.
-
B.
Giai đoạn 1, liên kết đôi phản ứng với tác nhân \(\mathop {Br}\limits^{ - \delta } \) tạo thành phần tử mang điện dương.
-
C.
Giai đoạn 2, phần tử mang điện dương kết hợp với anion tạo thành sản phẩm.
-
D.
Hiện tượng của phản ứng là dung dịch bromine bị mất màu.
Palmitic acid là một acid béo bão hoà phổ biến trong động vật và thực vật. Công thức của palmitic acid là
-
A.
C17H33COOH.
-
B.
НСООН.
-
C.
C15H31COOH.
-
D.
CH3COOH
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
|
Cặp oxi hóa - khử |
Al3+/Al |
Zn2+/Zn |
Fe2+/Fe |
Cu2+/Cu |
Ag+/Ag |
|
E0(V) |
-1,676 |
-0,763 |
-0,440 |
0,340 |
0,799 |
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
-
A.
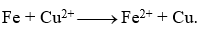
-
B.
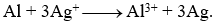
-
C.
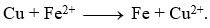
-
D.

Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là 2,475 V. Hai cặp oxi hoá-khử hình thành pin lần lượt là
-
A.
Al3+/Al và Ag+/Ag.
-
B.
Zn2+/Zn và Al3+/Al.
-
C.
Fe2+/Fe và Cu2+/Cu.
-
D.
Al3+/Al và Cu2+/Cu.
Quan sát Hình 6.1 dưới đây:
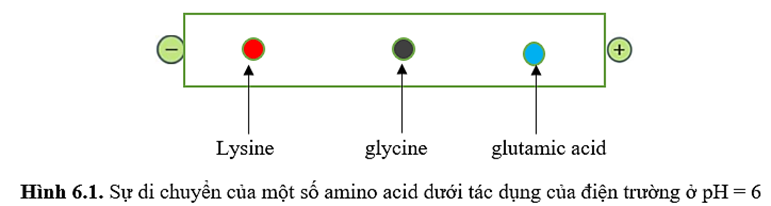
Trong điều kiện thí nghiệm ở pH = 6,0, cho các phát biểu sau:
(a) Lysine dịch chuyển về phía cực âm nên lysine tồn tại chủ yếu ở dạng cation.
(b) Glycine hầu như không dịch chuyển nên glycine tồn tại chủ yếu ở dạng ion lưỡng cực.
(c) Glutamic acid dịch chuyển về phía cực âm nên glutamic acid tồn tại chủ yếu ở dạng anion.
(d) Thí nghiệm trên chứng mình tính điện li của các phân tử amino acid.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Nhúng thanh Cu tinh khiết có khối lượng là m1 (gam) vào dung dịch iron(III) chloride, sau một thời gian, lấy thanh Cu ra cân lại thấy khối lượng là m2 (gam). Cho các phát biểu sau:
a) Thí nghiệm trên có xảy ra ăn mòn điện hóa học.
b) Giá trị của m2 lớn hơn m1.
c) Trên bề mặt thanh Cu có một lớp kim loại Fe bám vào.
d) Phương trình phản ứng xảy ra là: Cu (s) + 2Fe3+(aq) → 2Fe2+(aq)) +Cu²+(aq).
Theo Tiêu chuẩn Việt Nam TCVN 7624 : 2007, khi chế tạo gương, chiều dày lớp bạc phủ trên bề mặt tấm kính (quy ra tổng lượng bạc trên một đơn vị m2 kính) phải đạt tối thiểu 0,7 g.m-2. Một công ty cần sản xuất 30000 m2 gương có độ dày lớp bạc phủ ở mức 0,72 g.m-2. Để tạo ra bạc, người ta tiến hành theo sơ đồ phản ứng như sau:

Biết hiệu suất cả quá trình là 80%.
a) Lượng bạc được tráng lên 30 000m2 gương với độ dày lớp bạc phủ ở mức 0,72 g.m-2 là 21,6 kg.
b) Trong dung dịch A có hai loại monosaccharide.
c) Trong quá trình thủy phân saccharose có thể thay xúc tác acid bằng xúc tác base.
d) Để sản xuất lượng gương với độ phủ bạc như trên, công ty đó cần sử dụng lượng saccharose là 21,375 kg.
Hợp chất E được điều chế từ alcohol X và carboxylic acid Y (biết Y là hợp chất tạp chức chứa vòng benzene). E có trong thành phần của một số thuốc giảm đau, xoa bóp, cao dán, ... dùng để điều trị đau lưng, căng cơ, bong gân,..
Thành phần về khối lượng các nguyên tố trong E như sau: và . Phân tích E bằng phố IR của E cho kết quả sau:
+ peak đặc trưng của liên kết (số sóng 1750-1735 ),
+ liên kết (số sóng )
+ peak đặc trưng của liên kết (số sóng ).
Từ phổ MS , xác định được E có phân tử khối là 152 amu .
Cho các phát biểu sau:
a) X là methyl alcohol.
b) Tổng số nguyên tử trong phân tử E là 20 .
c) Y có nhóm -OH và -COOH .
d) Nếu lấy 1 mol Y tác dụng NaOH thì số mol NaOH cần để phản ứng vừa đủ là 2 mol .
Metalloporphyrin có cấu trúc tương tự heme và được sử dụng việc kiểm soát chứng tăng bilirubin máu ở trẻ sơ sinh ( chứng này gây ra bệnh vàng da ở trẻ sơ sinh). Metalloporphyrin có công thức như sau:
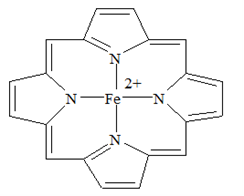
a) Ion trung tâm của phức Metalloporphyrin là Fe
b) Số phối trí của phức là 4.
c) Metalloporphyrin là muối kép không phải là phức chất.
d) Liên kết trong phức Metalloporphyrin được tạo thành do nguyên tử N cho cặp electron chưa liên kết vào orbital trống của nguyên tử Fe.
Một mẫu quặng bauxite có chứa 40% Al2O3. Người ta dùng 150 tấn quặng bauxite để điều chế nhôm bằng phương pháp điện phân nóng chảy Al2O3, giả sử toàn bộ lượng nhôm điều chế được dùng để sản xuất thanh nhôm làm cửa thì sản xuất được x thanh. Biết rằng khối lượng nhôm trong một thanh nhôm là 5 kg và hiệu suất của quá trình điều chế nhôm là 85%. Giá trị của x bằng bao nhiêu?
Đáp án:
Đun nóng một loại dầu thực vật với dung dịch NaOH, sản phẩm thu được chứa muối sodium palmitate. Tính phân tử khối của sodium palmitate ?
Đáp án:
Cho các tính chất sau: (1) chất rắn kết tinh, màu trắng, (2) dễ tan trong nước, (3) có vị ngọt, (4) phản ứng với thuốc thử Tollens, (5) phản ứng với methanol có HCl xúc tác. Tính chất nào đúng với glucose? Liệt kê đáp án theo dãy số thứ tự tăng dần (ví dụ: 1234, 235,…).
Đấp án:
Cho các amine: CH3NH2 CH3NHCH3, C2H5NH2, CH3NHC2H5. Có bao nhiêu chất là amine bậc một trong các chất trên?
Đáp án:
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH4(g) (làm tròn đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%. Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau:
(1) \(CaC{O_3}(s) \to CaO(s) + C{O_2}(s)\)
(2) \(C{H_4}(g) + 2{O_2}(g) \to C{O_2}(g) + 2{H_2}O(g)\)
Biết nhiệt tạo thành (\({\Delta _f}H_{298}^o\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:
|
Chất |
CH4(g) |
CO2(g) |
H2O(g) |
CaCO3(s) |
CaO(s) |
|
\({\Delta _f}H_{298}^o\) (kJ/mol) |
–74,6 |
–393,5 |
–241,8 |
–1207 |
–635 |
Đáp án:
Iron (II)sulfate thường được bảo quản ở dạng muối Mohr màu xanh nhạt có công thức FeSO4.(NH4)2SO4.nH2O
Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Cân 1,96g muối Mohr rồi hòa tan vào nước, sau đó định mức trong bình 50mL. Chuẩn độ 5mL dung dịch vừa pha cần dùng 5mL dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr.
Thí nghiệm 2: Làm lạnh 100g dung dịch muối Mohr bão hòa ở 30oC đến nhiệt độ ổn định ở 0oC thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:
|
Nhiệt độ |
0 |
10 |
20 |
30 |
|
Độ tan |
17,2 |
31 |
36,4 |
45 |
Giá trị của m là bao nhiêu?
Đáp án:
Lời giải và đáp án
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
-
A.
W.
-
B.
Cr.
-
C.
Hg.
-
D.
Pb.
Đáp án : C
Dựa vào ứng dụng của kim loại.
Kim loại Hg ở điều kiện thường tồn tại ở thể lỏng được sử ụng trong nhiệt kế, áp kế.
Đáp án C
Sodium hydrogen carbonate là chất được dùng làm bột nở, chế thuốc giảm đau dạ dày do thừa acid. Công thức của Sodium hydrogen carbonate là
-
A.
NaOH.
-
B.
NaHS.
-
C.
NaHCO3.
-
D.
Na2CO3
Đáp án : C
Dựa vào hợp chất của nhóm IA.
Sodium hydrogencarbonate có công thức là NaHCO3.
Đáp án C
Polymer là chất rắn trong suốt, có khả năng cho ánh sáng truyền qua tốt nên được dùng để
chế tạo thuỷ tinh hữu cơ. Tên gọi của là
-
A.
Poly(methyl methacrylate).
-
B.
Poly(phenol-formaldehyde).
-
C.
Polyethylene.
-
D.
Poly(vinyl chloride).
Đáp án : A
Dựa vào tính chất của polymer X.
Vì polymer X có khả năng cho ánh sáng truyền qua tốt nên được chế tạo thành thủy tinh hữu cơ nên
X là poly(methyl methacrylate)
Đáp án A
Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là:
-
A.
Fe, Cu, Ag.
-
B.
K, Zn, Cu.
-
C.
Al, Fe, Cr.
-
D.
Na, Ag, Cu.
Đáp án : A
Các kim loại trung bình yếu được điều chế bằng phương pháp điện phân dung dịch muối.
Fe, Cu, Ag là những kim loại trung bình yếu nên được điều chế bằng phương pháp điện phân dung dịch.
Đáp án A
Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Ở trạng thái cơ bản, cấu hình electron của ion Al3+ là
-
A.
ls22s22p63s23p1.
-
B.
ls22s22p6.
-
C.
ls22s22p5.
-
D.
ls22s22p63s1
Đáp án : B
Vẽ cấu hình electron của nguyên tử Al, để tạo ra ion Al3+ đã nhường 3e.
Cấu hình của ion Al3+ là ls22s22p6.
Đáp án B
Chất nào sau đây không dùng để làm mềm nước cứng tạm thời?
-
A.
Na2CO3
-
B.
Ca(OH)2
-
C.
Na3PO4
-
D.
NaNO3
Đáp án : D
Nguyên tắc làm mềm nước cứng: loại bỏ ion Ca2+ và Mg2+.
NaNO3 không dùng để làm mềm nước cứng tạm thời vì không tạo kết tủa của Ca2+ và Mg2+
Đáp án D
Điểm chớp cháy là nhiệt độ thấp nhất ở áp suất của khí quyển mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa.
- Điểm chớp cháy được sử dụng để phân biệt chất lỏng dễ cháy với chất lỏng có thể gây cháy:
+ Chất lỏng có điểm chớp cháy <37,8oC gọi là chất lỏng dễ cháy.
+ Chất lỏng có điểm chớp cháy >37,8oC gọi là chất lỏng có thể gây cháy.
Cho bảng số liệu sau:
|
Nhiên liệu |
Điểm chớp cháy (℃) |
Nhiên liệu |
Điểm chớp cháy (℃) |
|
Propane |
–105 |
Ethylene glycol |
111 |
|
Pentane |
–49 |
Diethyl ether |
–45 |
|
n–Hexane |
–22 |
Acetaldehyde |
–39 |
|
Ethanol |
13 |
Stearic acid |
196 |
|
Methanol |
11 |
Trimethylamine |
–7 |
Số chất lỏng dễ cháy trong bảng trên là
-
A.
6
-
B.
7
-
C.
8
-
D.
9
Đáp án : C
Dựa vào bảng số liệu về điểm chớp cháy của các chất.
Propane, Pentane, n – hexane, diethyl ether, acetaldehyde, trimethylamine, ethanol và methanol đều có nhiệt độ < 37,8oC nên là chất lỏng dễ cháy.
Đáp án C
Phân bón nào sau đây khi bón cho cây trồng có thể làm tăng độ chua của đất?
-
A.
Potassium chloride.
-
B.
Potassium carbonate
-
C.
Potassium nitrate.
-
D.
Ammonium nitrate
Đáp án : D
Đất bị chua do dư thừa acid.
NH4NO3 có pH < 7 nên có thể làm tăng độ chua của đất.
Đáp án D
Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của hợp chất hữu cơ X là 74. Chất X có thể là
-
A.
Acetic acid.
-
B.
Methyl acetate.
-
C.
Acetone.
-
D.
Trimethylamine.
Đáp án : A
Dựa vào phân tử khối của X
X không thể là acetic acid (M = 60) vì MX = 74.
Đáp án A
Ester X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch H2SO4 loãng, đun nóng thu được sản phẩm gồm methyl alcohol và chất hữu cơ Y. Công thức của Y là
-
A.
C2H5OH.
-
B.
HCOOH.
-
C.
CH3COOH.
-
D.
C2H5COOH.
Đáp án : D
Dựa vào sản phẩm của X khi thủy phân trong môi trường acid
Vì khi thủy phân X thu được methyl alcohol nên X có CTTQ là : RCOOCH3
Vì X có công thức phân tử là C4H8O2 nên CTCT X là : C2H5COOCH3.
Khi thủy phân X thu được acid C2H5COOH.
Đáp án D
Amine nào sau đây ở trạng thái lỏng ở nhiệt độ thường?
-
A.
Methylamine
-
B.
Ethylamine.
-
C.
Dimethylamine.
-
D.
Aniline.
Đáp án : D
Dựa vào tính chất vật lí của amine.
Aniline tồn tại ở thể lỏng điều kiện thường.
Đáp án D
Carbohydrate nào sau đây thuộc loại polysaccharide?
-
A.
Saccharose.
-
B.
Cellulose.
-
C.
Fructose.
-
D.
Glucose.
Đáp án : B
Dựa vào phân loại polysaccharide.
Cellulose thuộc polysaccharide.
Đáp án B
Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trọng đời sống: kích thích quả mau chín, điều chế nhựa làm sản phẩm gia dụng,… Phản ứng hóa học của ethylene với dung dịch Br2 như sau:
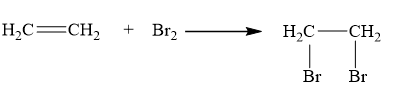
Cơ chế của phản ứng trên xảy ra như sau:

Nhận định nào sau đây không đúng?
-
A.
Phản ứng trên thuộc loại phản ứng cộng.
-
B.
Giai đoạn 1, liên kết đôi phản ứng với tác nhân \(\mathop {Br}\limits^{ - \delta } \) tạo thành phần tử mang điện dương.
-
C.
Giai đoạn 2, phần tử mang điện dương kết hợp với anion tạo thành sản phẩm.
-
D.
Hiện tượng của phản ứng là dung dịch bromine bị mất màu.
Đáp án : B
Dựa vào cơ chế của phản ứng.
A. Đúng
B. Sai vì Giai đoạn 1, liên kết đôi phản ứng với tác nhân \(\mathop {Br}\limits^{ - \delta } \) tạo thành phần tử mang điện tích dương.
C. Đúng
D. Đúng
Palmitic acid là một acid béo bão hoà phổ biến trong động vật và thực vật. Công thức của palmitic acid là
-
A.
C17H33COOH.
-
B.
НСООН.
-
C.
C15H31COOH.
-
D.
CH3COOH
Đáp án : C
Dựa vào tên gọi của acid béo.
Palmitic acid có công thức là C15H31COOH.
Đáp án C
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
|
Cặp oxi hóa - khử |
Al3+/Al |
Zn2+/Zn |
Fe2+/Fe |
Cu2+/Cu |
Ag+/Ag |
|
E0(V) |
-1,676 |
-0,763 |
-0,440 |
0,340 |
0,799 |
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
-
A.

-
B.
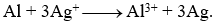
-
C.
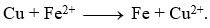
-
D.

Đáp án: C
Dựa vào ý nghĩa của thế điện cực.
C sai vì Cu có tính khử yếu hơn Fe nên không khử được Fe2+.
Đáp án C
Sức điện động chuẩn của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là 2,475 V. Hai cặp oxi hoá-khử hình thành pin lần lượt là
-
A.
Al3+/Al và Ag+/Ag.
-
B.
Zn2+/Zn và Al3+/Al.
-
C.
Fe2+/Fe và Cu2+/Cu.
-
D.
Al3+/Al và Cu2+/Cu.
Đáp án: A
Dựa vào giá trị thể điện cực chuẩn của kim loại.
Hai cặp oxi hóa – khử hình thành pin lần lượt là Al3+/Al và Ag+/Ag. Vì \(E_{Al - Ag}^o = E_{A{g^ + }/Ag}^o - E_{A{l^{3 + }}/Al}^o = 0,799 - ( - 1,676) = 2,475V\)
Đáp án A
Quan sát Hình 6.1 dưới đây:

Trong điều kiện thí nghiệm ở pH = 6,0, cho các phát biểu sau:
(a) Lysine dịch chuyển về phía cực âm nên lysine tồn tại chủ yếu ở dạng cation.
(b) Glycine hầu như không dịch chuyển nên glycine tồn tại chủ yếu ở dạng ion lưỡng cực.
(c) Glutamic acid dịch chuyển về phía cực âm nên glutamic acid tồn tại chủ yếu ở dạng anion.
(d) Thí nghiệm trên chứng mình tính điện li của các phân tử amino acid.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : B
Dựa vào tính chất điện di của dung dịch amino acid.
(a) đúng
(b) đúng
(c) đúng
Đáp án B
Nhúng thanh Cu tinh khiết có khối lượng là m1 (gam) vào dung dịch iron(III) chloride, sau một thời gian, lấy thanh Cu ra cân lại thấy khối lượng là m2 (gam). Cho các phát biểu sau:
a) Thí nghiệm trên có xảy ra ăn mòn điện hóa học.
b) Giá trị của m2 lớn hơn m1.
c) Trên bề mặt thanh Cu có một lớp kim loại Fe bám vào.
d) Phương trình phản ứng xảy ra là: Cu (s) + 2Fe3+(aq) → 2Fe2+(aq)) +Cu²+(aq).
a) Thí nghiệm trên có xảy ra ăn mòn điện hóa học.
b) Giá trị của m2 lớn hơn m1.
c) Trên bề mặt thanh Cu có một lớp kim loại Fe bám vào.
d) Phương trình phản ứng xảy ra là: Cu (s) + 2Fe3+(aq) → 2Fe2+(aq)) +Cu²+(aq).
Dựa vào tính chất hóa học của kim loại.
a) sai, thí nghiệm trên xảy ra ăn mòn hóa học.
b) sai, giá trị của m2 nhỏ hơn m1 do phản ứng không tạo ra kim loại.
c) sai, không có lớp kim loại Fe bám vào.
d) đúng
Theo Tiêu chuẩn Việt Nam TCVN 7624 : 2007, khi chế tạo gương, chiều dày lớp bạc phủ trên bề mặt tấm kính (quy ra tổng lượng bạc trên một đơn vị m2 kính) phải đạt tối thiểu 0,7 g.m-2. Một công ty cần sản xuất 30000 m2 gương có độ dày lớp bạc phủ ở mức 0,72 g.m-2. Để tạo ra bạc, người ta tiến hành theo sơ đồ phản ứng như sau:

Biết hiệu suất cả quá trình là 80%.
a) Lượng bạc được tráng lên 30 000m2 gương với độ dày lớp bạc phủ ở mức 0,72 g.m-2 là 21,6 kg.
b) Trong dung dịch A có hai loại monosaccharide.
c) Trong quá trình thủy phân saccharose có thể thay xúc tác acid bằng xúc tác base.
d) Để sản xuất lượng gương với độ phủ bạc như trên, công ty đó cần sử dụng lượng saccharose là 21,375 kg.
a) Lượng bạc được tráng lên 30 000m2 gương với độ dày lớp bạc phủ ở mức 0,72 g.m-2 là 21,6 kg.
b) Trong dung dịch A có hai loại monosaccharide.
c) Trong quá trình thủy phân saccharose có thể thay xúc tác acid bằng xúc tác base.
d) Để sản xuất lượng gương với độ phủ bạc như trên, công ty đó cần sử dụng lượng saccharose là 21,375 kg.
Dựa vào tính chất hóa học của sacchaorose.
a) đúng
b) đúng
c) sai, phản ứng thủy phân saccharose chỉ xảy ra trong môi trường acid.
d) đúng
Hợp chất E được điều chế từ alcohol X và carboxylic acid Y (biết Y là hợp chất tạp chức chứa vòng benzene). E có trong thành phần của một số thuốc giảm đau, xoa bóp, cao dán, ... dùng để điều trị đau lưng, căng cơ, bong gân,..
Thành phần về khối lượng các nguyên tố trong E như sau: và . Phân tích E bằng phố IR của E cho kết quả sau:
+ peak đặc trưng của liên kết (số sóng 1750-1735 ),
+ liên kết (số sóng )
+ peak đặc trưng của liên kết (số sóng ).
Từ phổ MS , xác định được E có phân tử khối là 152 amu .
Cho các phát biểu sau:
a) X là methyl alcohol.
b) Tổng số nguyên tử trong phân tử E là 20 .
c) Y có nhóm -OH và -COOH .
d) Nếu lấy 1 mol Y tác dụng NaOH thì số mol NaOH cần để phản ứng vừa đủ là 2 mol .
a) X là methyl alcohol.
b) Tổng số nguyên tử trong phân tử E là 20 .
c) Y có nhóm -OH và -COOH .
d) Nếu lấy 1 mol Y tác dụng NaOH thì số mol NaOH cần để phản ứng vừa đủ là 2 mol .
Dựa vào số sóng đặc trưng của từng liên kết.
C : H : O = \(\frac{{63,16}}{{12}}:\frac{{5,26}}{1}:\frac{{31,58}}{{16}} = 5,26:5,26:1,97 = 8:8:3\)
CTPT E: C8H8O3 vì trong E có chứa vòng benzene và có chứa ester nên E có thể là HOC6H4COOCH3.
a) đúng
b) sai, tổng số nguyên tử trong E là 19.
c) đúng
d) đúng
Metalloporphyrin có cấu trúc tương tự heme và được sử dụng việc kiểm soát chứng tăng bilirubin máu ở trẻ sơ sinh ( chứng này gây ra bệnh vàng da ở trẻ sơ sinh). Metalloporphyrin có công thức như sau:

a) Ion trung tâm của phức Metalloporphyrin là Fe
b) Số phối trí của phức là 4.
c) Metalloporphyrin là muối kép không phải là phức chất.
d) Liên kết trong phức Metalloporphyrin được tạo thành do nguyên tử N cho cặp electron chưa liên kết vào orbital trống của nguyên tử Fe.
a) Ion trung tâm của phức Metalloporphyrin là Fe
b) Số phối trí của phức là 4.
c) Metalloporphyrin là muối kép không phải là phức chất.
d) Liên kết trong phức Metalloporphyrin được tạo thành do nguyên tử N cho cặp electron chưa liên kết vào orbital trống của nguyên tử Fe.
Dựa vào công thức của phức chất.
a) sai, ion trung tâm trong phức là Fe2+.
b) đúng
c) sai, metalloporphyrin là phức chất.
d) đúng
Một mẫu quặng bauxite có chứa 40% Al2O3. Người ta dùng 150 tấn quặng bauxite để điều chế nhôm bằng phương pháp điện phân nóng chảy Al2O3, giả sử toàn bộ lượng nhôm điều chế được dùng để sản xuất thanh nhôm làm cửa thì sản xuất được x thanh. Biết rằng khối lượng nhôm trong một thanh nhôm là 5 kg và hiệu suất của quá trình điều chế nhôm là 85%. Giá trị của x bằng bao nhiêu?
Đáp án:
Đáp án:
Tính khối lượng Al2O3 trong quặng. Tính số mol của Al2O3.
Khối lượng Al2O3 có trong quặng bauxite là: 40%.150 = 60 tấn => n Al2O3 = 60 : 102 = 10/17 tấn mol.
2Al2O3 → 4Al + 3O2
\(\frac{{10}}{{17}}\)→ \(\frac{{10}}{{17}}.4:2.85\% = 1mol\)
m Al = 1.27 = 27 tấn = 27000 kg
Số thanh nhôm sản xuất được là: 27000 : 5 = 5400 thanh
Đun nóng một loại dầu thực vật với dung dịch NaOH, sản phẩm thu được chứa muối sodium palmitate. Tính phân tử khối của sodium palmitate ?
Đáp án:
Đáp án:
Dựa vào công thức của acid béo.
Sodium palimate có CTPT : C15H31COONa có M = 278 amu.
Cho các tính chất sau: (1) chất rắn kết tinh, màu trắng, (2) dễ tan trong nước, (3) có vị ngọt, (4) phản ứng với thuốc thử Tollens, (5) phản ứng với methanol có HCl xúc tác. Tính chất nào đúng với glucose? Liệt kê đáp án theo dãy số thứ tự tăng dần (ví dụ: 1234, 235,…).
Đấp án:
Đấp án:
Dựa vào tính chất hóa học của glucose.
Tính chất hóa học của glucose là: (2), (3), (4), (5)
Đáp án 2345.
Cho các amine: CH3NH2 CH3NHCH3, C2H5NH2, CH3NHC2H5. Có bao nhiêu chất là amine bậc một trong các chất trên?
Đáp án:
Đáp án:
Các amine bậc I có dạng RNH2.
CH3NH2, C2H5NH2 là amine bậc I
Đáp án 2
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH4(g) (làm tròn đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%. Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau:
(1) \(CaC{O_3}(s) \to CaO(s) + C{O_2}(s)\)
(2) \(C{H_4}(g) + 2{O_2}(g) \to C{O_2}(g) + 2{H_2}O(g)\)
Biết nhiệt tạo thành (\({\Delta _f}H_{298}^o\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:
|
Chất |
CH4(g) |
CO2(g) |
H2O(g) |
CaCO3(s) |
CaO(s) |
|
\({\Delta _f}H_{298}^o\) (kJ/mol) |
–74,6 |
–393,5 |
–241,8 |
–1207 |
–635 |
Đáp án:
Đáp án:
Tính enthalpy của phản ứng (1) và (2).
\({\Delta _r}H_{298}^o(1) = {\Delta _f}H_{298}^o(CaO) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) = - 635 + ( - 393,5) - ( - 1207) = 178,5kJ\)
\({\Delta _r}H_{298}^o(2) = {\Delta _f}H_{298}^o(C{O_2}) + 2.{\Delta _f}H_{298}^o({H_2}O) - {\Delta _f}H_{298}^o(C{H_4}) = ( - 393,5) + 2.( - 241,8) - ( - 74,6) = - 802,5kJ\)
Cần số gam CH4 đốt cháy để cung cấp đủ nhiệt lượng cho phản ứng (1) là: mCH4 = \(\frac{{178,5}}{{802,5}}.16 = 3,56g\)
Iron (II)sulfate thường được bảo quản ở dạng muối Mohr màu xanh nhạt có công thức FeSO4.(NH4)2SO4.nH2O
Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Cân 1,96g muối Mohr rồi hòa tan vào nước, sau đó định mức trong bình 50mL. Chuẩn độ 5mL dung dịch vừa pha cần dùng 5mL dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr.
Thí nghiệm 2: Làm lạnh 100g dung dịch muối Mohr bão hòa ở 30oC đến nhiệt độ ổn định ở 0oC thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:
|
Nhiệt độ |
0 |
10 |
20 |
30 |
|
Độ tan |
17,2 |
31 |
36,4 |
45 |
Giá trị của m là bao nhiêu?
Đáp án:
Đáp án:
nKMnO4 = 10-4 (mol) => nFeSO4 = 5.10-4 (mol)
Ta có (1,96)/(5.10-4.10)=392 => n = 6
Vậy công thức muối là FeSO4.(NH4)2SO4.6H2O
- Tại 30oC: 100g nước hòa tan 45g muối Mohr
- 100g dung dịch có khối lượng muối Mohr là = 45.100/(100+45) = 31 (gam)
- Tại OoC giả sử có x gam muối Mohr kết tinh thì khối lượng phần dung dịch bão hòa còn lại là 100-x gam
- Khối lượng muối Mohr kết tinh ở ở 0oC = 17,2.(100-x)/100 (gam)
Bảo toàn khối lượng ta có x + 17,2.(100-x)/100 = 31 => x =16,6 gam
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
Kim loại cứng nhất, thường được pha vào thép để tăng độ cứng và khả năng chống gỉ cho thép là
Trong ăn mòn hóa học, phản ứng hóa học xảy ra là loại phản ứng nào sau đây?
Hợp chất nào sau đây là ester ?
Khi thay thế nhóm …(1) ở nhóm …(2) của carboxylic acid bằng nhóm
Phức chất đơn giản thường có một
Cho phản ứng oxi hóa – khử:
Các bài khác cùng chuyên mục









Danh sách bình luận