Đề tham khảo thi THPT môn Hóa - Đề số 9 (hay, chi tiết)
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
Đề bài
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
-
A.
Ca → Ca2+ + 2e.
-
B.
Ca → Ca2+ + 1e.
-
C.
Ca + 2e → Ca2+.
-
D.
Ca + 1e → Ca2+.
Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
-
A.
+2
-
B.
+3.
-
C.
+ 5.
-
D.
+6.
Dung dịch H2SO4 loãng không phản ứng với kim loại nào dưới đây?
-
A.
Fe.
-
B.
Al
-
C.
Cu
-
D.
Mg.
Phát biểu nào sau đây sai?
-
A.
HNO3 thể hiện tính oxi hóa mạnh khi tác dụng với Cu hoặc Fe2O3.
-
B.
Hiện tượng phú dưỡng làm suy giảm lượng oxygen trong nước.
-
C.
Theo Brønsted-Lowry, trong phản ứng với OH-, NH4+ có vai trò là acid.
-
D.
Ammonia dễ tan trong nước vì có khả năng tạo liên kết hydrogen với nước.
Đặt hỗn hợp các amino acid gồm lysine, alanine, glycine và glutamic acid ở pH = 6 vào trong một điện trường. Amino acid dịch chuyển về phía cực dương là
-
A.
Lysine.
-
B.
Glycine.
-
C.
Glutamic acid.
-
D.
Alanine.
Cho các polymer sau đây: Nylon-6,6, tơ olon, polyisoprene, poly(vinyl chloride), cao su buna. Số polymer được điều chế bằng phản ứng trùng hợp là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Các kim loại có thể điều chế bằng phương pháp điện phân dung dịch muối của chúng là
-
A.
Al, Cu, Ag.
-
B.
Zn, Cu, Ag.
-
C.
Na, Mg, Al.
-
D.
Mg, Fe, Cu.
Một hộ gia đình sử dụng gas (khí hóa lỏng) loại 12kg để đun nấu. Giả sử bình gas chỉ chứa hỗn hợp propane (C3H8) và butane (C4H10) với tỉ lệ mol tương ứng là 1 : 2.
Cho biết các phản ứng:
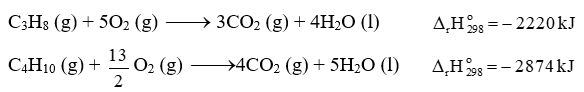
Biết sau 45 ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg và hiệu suất hấp thụ nhiệt là 80%. Trung bình mỗi ngày, hộ gia đình cần cung cấp bao nhiêu kJ nhiệt để đun nấu?
-
A.
16600.
-
B.
13280.
-
C.
10624.
-
D.
10000.
Thực hiện phản ứng hóa học sau: CaCO3 + 2HCl → CaCl2 + CO2+ H2O
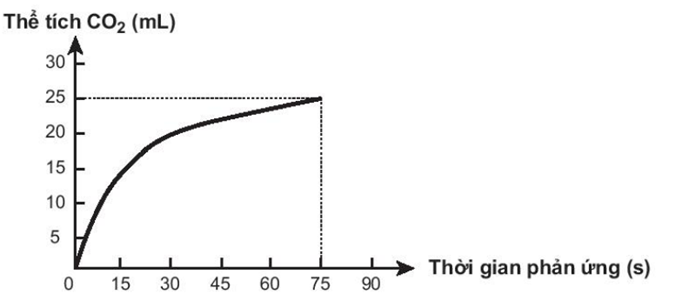
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
Cho các phát biểu sau:
(a) Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
(b) Tốc độ phản ứng giảm dần theo thời gian.
(c) Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33mL/s.
(d) Để hoà tan hết một mẫu CaCO3 trong dung dịch acid HCl ở 20oC cần 27 phút. Cũng mẫu CaCO3 đó tan hết trong dung dịch acid nói trên ở 40oC trong 3 phút. Vậy để hoà tan hết mẫu CaCO3 đó trong dung dịch acid nói trên ở 55oC thì cần thời gian 0,5774 phút.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
4
-
D.
3
Yếu tố nào sau đây luôn luôn không làm chuyển dịch cân bằng của hệ phản ứng?
-
A.
Nồng độ.
-
B.
nhiệt độ
-
C.
Áp suất.
-
D.
Chất xúc tác.
Cho X là một hợp chất hữu cơ dùng để làm sạch dụng cụ trong phòng thí nghiệm, tẩy rửa sơn móng tay và là chất đầu trong nhiều quá trình tổng hợp hữu cơ. Phân tử X có chứa nhóm ketone. Hình ảnh phổ khối lượng của X như sau:
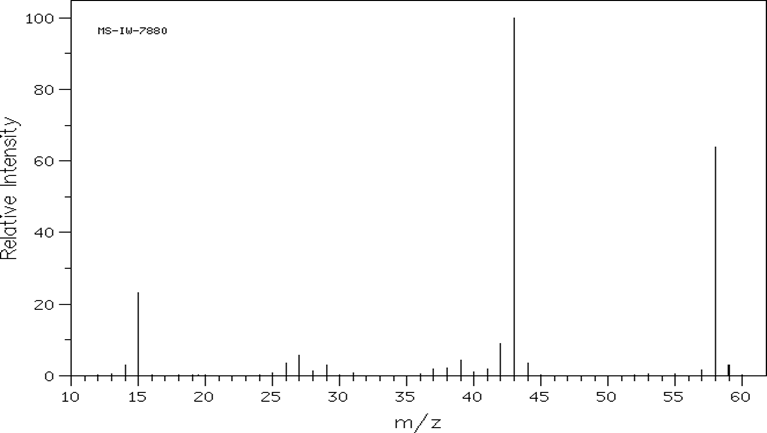
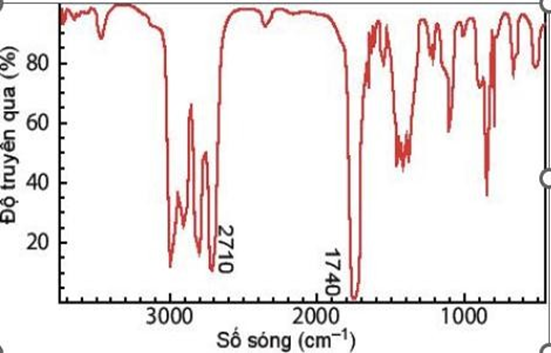
Hợp chất Y là đồng phân của X. Khi đo phổ hồng ngoại cho kết quả như hình bên dưới:
Cho các phát biểu sau:
(a) Phổ khối lượng được sử dụng để xác định phân tử khối của hợp chất hữu cơ.
(b) X là acetone.
(c) Công thức cấu tạo của Y là CH2=CH-CH2-OH.
(d) X tan tốt trong nước nên không thể dùng phương pháp chưng cất thường để tách X ra khỏi hỗn hợp với nước.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cho các phát biểu sau:
(a) Fructose và glucose đều có khả năng tham gia phản ứng tráng bạc với thuốc thử Tollens.
(b) Saccharose và tinh bột đều bị thủy phân khi đun nóng (có xúc tác acid).
(c) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(d) Thủy phân cellulose và tinh bột trong môi trường acid sản phẩm cuối cùng thu được là fructose.
(e) Quá trình lên men các sản phẩm hữu cơ như tinh bột, cellulose dùng để sản xuất xăng sinh học.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Tiến hành thí nghiệm xà phòng hóa tristearin theo các bước sau:
Bước 1: Cho vào bát sứ khoảng 1 gam tristearin và 2 – 2,5 ml dung dịch NaOH nồng độ 40%.
Bước 2: Đun sôi nhẹ hỗn hợp khoảng 30 phút và khuấy liên tục bằng đũa thủy tinh, thỉnh thoảng thêm vài giọt nước cất để giữ cho thể tích của hỗn hợp không đổi.
Bước 3: Rót thêm vào hỗn hợp 4 – 5 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ rồi để nguội.
Phát biểu nào sau đây sai?
-
A.
Sau bước 3, hỗn hợp tách thành hai lớp: phía trên là chất rắn màu trắng, phía dưới là chất lỏng.
-
B.
Sau bước 2, thu được chất lỏng đồng nhất.
-
C.
Mục đích chính của việc thêm dung dịch NaCl là làm tăng tốc độ cho phản ứng xà phòng hóa.
-
D.
Phần chất lỏng sau khi tách hết xà phòng hòa tan Cu(OH)2 thành dung dịch màu xanh lam.
Cho cân bằng sau:

Cho hỗn hợp chứa 0,5 mol mỗi khí X2 và Y2 vào bình kín rồi đun nóng để hệ đạt trạng thái cân bằng. Đồ thị sau biểu diễn sự thay đổi số mol mỗi khí theo thời gian.

Hằng số cân bằng KC của phản ứng trên ở nhiệt độ thí nghiệm bằng
-
A.
1,5.
-
B.
3,0.
-
C.
9,0.
-
D.
18,0.
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Thí nghiệm nào sau đây có xảy ra sự ăn mòn điện hóa học?
-
A.
Đốt cháy bột kim loại nhôm (aluminum) trong bình chứa khí oxygen.
-
B.
Thả miếng kim loại kẽm (zinc) vào dung dịch hydrochloric acid.
-
C.
Cho miếng kim loại sắt (đã xử lý sạch bề mặt) vào dung dịch chứa CuSO4 và H2SO4 loãng.
-
D.
Đốt cháy phoi bào sắt (iron) trong khí chlorine.
Xét thí nghiệm điện phân dung dịch CuSO4. Phát biểu nào sau đây không đúng?
-
A.
Ở cathode xảy ra quá trình khử Cu2+.
-
B.
Ở anode xảy ra quá trình oxi hóa SO42-.
-
C.
Ở anode xảy ra quá trình oxi hóa H2O.
-
D.
Khối lượng cathode tăng là khối lượng của Cu bám vào.
Một số bạn trẻ cho rằng hút thuốc là “sành điệu”, thuốc lá điện tử không gây hại. Khói thuốc lá và thuốc lá điện tử chứa các thành phần nicotine, carbon monoxide, benzene, formaldehyde, acetaldehyde, hydrogen cyanide,. là những chất tác động trực tiếp lên não, thần kinh, tim mạch, hệ hô hấp và nguy cơ dẫn đến ung thư. Trong các chất trên, chất thuộc loại hợp chất amine là
-
A.
nicotine.
-
B.
carbon monoxide.
-
C.
formaldehyde.
-
D.
hydrogen cyanide.
Tinh chế đường đỏ thành đường trắng
Đường được làm từ mật mía và chưa qua tinh luyện thường được gọi là đường đỏ (hoặc đường vàng). Trong đường đỏ có các chất màu và tạp chất. Để tinh luyện đường đỏ thành đường trắng, người ta làm như sau:
- Hoà tan đường đỏ vào nước nóng, thêm than hoạt tính để khử màu, khuấy, lọc để thu được dung dịch trong suốt không màu.
- Cô cạn, để nguội thu được đường trắng ở dạng tinh thể.
a. Đường trắng tinh khiết hơn đường đỏ.
b. Tinh chế đường đỏ thành đường trắng là phương pháp kết tinh.
c. Tinh chế đường đỏ thành đường trắng là phương pháp chiết lỏng – rắn.
d. Có thể thay than hoạt tính bằng nước chlorine.
Cho dãy chuyển hoá sau (mỗi ký hiệu là một chất khác nhau):
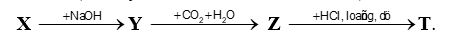
Biết X và Z được dùng làm bột nở trong công nghiệp thực phẩm; Z được dùng làm thuốc chữa đau dạ dày do thừa acid.
a. Z là baking soda.
b. Chất X có thể làm mềm được nước cứng vĩnh cửu.
c. Chất Y và T tan tốt trong nước, chất Z tan trong nước ít hơn so với Y và T.
d. Sử dụng thuốc muối Nabica (có thành phần chính là chất Z) để chữa đau dạ dày dễ bị đầy hơi trong bụng, dễ gây ợ.
a. SO2 gây viêm đường hô hấp; NOx là một trong số các nguyên nhân gây mưa acid, thủng tầng ozone.
b. Để hạn chế sự phát thải khí NOx, SO2 cần tăng cường sử dụng các nguồn năng lượng mới, năng lượng tái tạo.
c. Khối lượng SO2 mà nhà máy X phát thải vào không khí là 12 mg.
d. Nồng độ SO2 trong 40 lít không khí của Thành phố Y nằm trong ngưỡng cho phép, không khí ở thành phố Y không bị ô nhiễm.
Cho chất hữu cơ E có công thức phân tử là C9H8O4 và các sơ đồ phản ứng theo đúng tỉ lệ mol:
(1) E + 3NaOH → 2X + Y + H2O
(2) 2X + H2SO4 → Na2SO4 + 2Z
(3) Z + 2Ag[(NH3)2]OH → T + 2Ag + 3NH3 + H2O.
(4) Y + HCl → F + NaCl.
a. Z là formic acid.
b. E là ester hai chức tạo bởi carboxylic acid và các alcohol.
c. Dung dịch Y tác dụng được với khí CO2.
d. Chất E có 3 công thức cấu tạo phù hợp.
Một số nước ngầm có chứa nhiều ion Fe2+ (như muối Fe(HCO3)2) ảnh hưởng không tốt khi sử dụng để sinh hoạt, chăn nuôi. Người ta thường sử dụng phương pháp giàn phun mưa để loại bỏ Fe2+ theo phản ứng:
4 Fe(HCO3)2 + O2 + 2H2O → 4Fe(OH)3 + 8CO2.
Có các nhận định sau:
(1) Fe2+ là chất khử.
(2) Xuất hiện kết tủa nâu đỏ.
(3) Có thể tách kết tủa Fe(OH)3 ra khỏi nước bằng phương pháp lọc.
(4) Sử dụng giàn mưa để tăng tốc độ phản ứng oxi hóa ion Fe2+ thành ion Fe3+.
Có bao nhiêu phát biểu đúng?
Đáp án:
Thực hiện 5 thí nghiệm sau:
(a) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2.
(b) Cho dung dịch NH4HCO3 vào dung dịch Ba(OH)2.
(c) Đun nóng nước cứng tạm thời.
(d) Cho kim loại Al vào dung dịch NaOH dư.
(e) Cho kim loại Na vào dung dịch CuSO4.
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được cả kết tủa và chất khí?
Đáp án:
Paracetamol (còn có tên gọi khác là acetaminophen) là hoạt chất giúp giảm đau và hạ sốt được sử dụng nhiều trong y học. Thuốc paracetamol được tổng hợp từ phenol qua nhiều giai đoạn, trong đó giai đoạn tạo ra paracetamol từ p-amino phenol và acetic anhydride xảy ra theo phương trình hóa học sau:
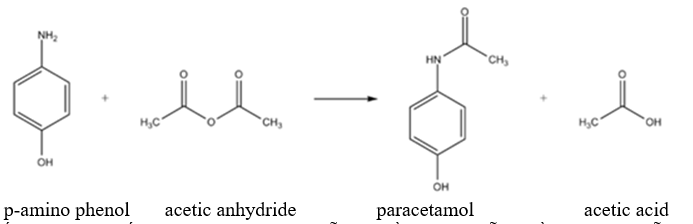
Để sản xuất 4530 hộp thuốc pracetamol 500 mg (mỗi hộp gồm 10 vỉ, mỗi vỉ gồm 10 viên, mỗi viên chứa 500 mg paracetamol) cần dùng tối thiểu m kg p-amino phenol. Biếu hiệu suất phản ứng tính theo p-amino phenol là 80%. Tính giá trị của m. (Làm tròn kết quả tính toán đến hàng đơn vị.
Đáp án:
Ở t°C khi cho 2 gam MgSO4 vào 200 gam dung dịch MgSO4 bão hòa đã làm cho m gam tinh thể muối MgSO4.nH2O (A) kết tinh. Nung m gam tinh thể (A) cho đến khi mất nước hoàn toàn thì thu được 3,16 gam MgSO4. Cho biết ở t°C, 100 gam nước hoàn tan tối đa 35,1 gam MgSO4 tạo thành dung dịch bão hòa. Tính giá trị của n.
Đáp án:
Chất béo là nguồn cung cấp năng lượng đáng kể cho cơ thể người. Trung bình 1 gam chất béo cung cấp 38 kJ và năng lượng từ chất béo đóng góp 20% tổng năng lượng cần thiết trong ngày. Một ngày, một học sinh trung học phổ thông cần năng lượng 9120 kJ thì cần ăn bao nhiêu gam chất béo cho phù hợp?
Đáp án:
Một nhà máy gang thép sản xuất thép thành phẩm từ 500 tấn quặng hematite đỏ (chứa 80% Fe2O3 về khối lượng, còn lại là tạp chất không chứa sắt) với hiệu suất cả quá trình đạt 90% theo sơ đồ:
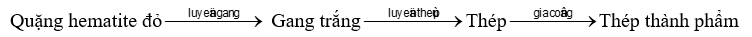
Biết thép thành phẩm chứa 98% sắt về khối lượng và có khối lượng riêng là 7,9 tấn/m3. Toàn bộ lượng thép thành phẩm là k cuộn thép, mỗi cuộn được tạo ra từ một dây thép hình trụ “phi 10” (đường kính 10 mm) dài 500 m. Cho π = 3,14. Giá trị của k là bao nhiêu? (Làm tròn kết quả tính toán đến hàng đơn vị).
Đáp án:
Lời giải và đáp án
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
-
A.
Ca → Ca2+ + 2e.
-
B.
Ca → Ca2+ + 1e.
-
C.
Ca + 2e → Ca2+.
-
D.
Ca + 1e → Ca2+.
Đáp án : A
Các kim loại có tính khử, nhường electron để trở thành cation.
Ca nhường 2e để tạo thành Ca2+
Ca → Ca2+ + 2e.
Đáp án A
Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
-
A.
+2
-
B.
+3.
-
C.
+ 5.
-
D.
+6.
Đáp án : D
Dựa vào cách tính số oxi hóa.
Gọi x là số oxi hóa của S ta có: x + 3.(-2) = 0 => x = +6
Đáp án D
Dung dịch H2SO4 loãng không phản ứng với kim loại nào dưới đây?
-
A.
Fe.
-
B.
Al
-
C.
Cu
-
D.
Mg.
Đáp án : C
Các kim loại có thế điện cực chuẩn cao hơn 2H+/H2 không phản ứng với acid loãng.
Cu không phản ứng với H2SO4 loãng.
Đáp án C
Phát biểu nào sau đây sai?
-
A.
HNO3 thể hiện tính oxi hóa mạnh khi tác dụng với Cu hoặc Fe2O3.
-
B.
Hiện tượng phú dưỡng làm suy giảm lượng oxygen trong nước.
-
C.
Theo Brønsted-Lowry, trong phản ứng với OH-, NH4+ có vai trò là acid.
-
D.
Ammonia dễ tan trong nước vì có khả năng tạo liên kết hydrogen với nước.
Đáp án : A
Dựa vào tính chất vật lí của hợp chất nitrogen.
A sai vì HNO3 chỉ thể hiện tính acid với Fe2O3.
Đáp án A
Đặt hỗn hợp các amino acid gồm lysine, alanine, glycine và glutamic acid ở pH = 6 vào trong một điện trường. Amino acid dịch chuyển về phía cực dương là
-
A.
Lysine.
-
B.
Glycine.
-
C.
Glutamic acid.
-
D.
Alanine.
Đáp án : C
Dựa vào tính điện di của amino acid.
Glutamic di chuyển về phía cực dương.
Đáp án C
Cho các polymer sau đây: Nylon-6,6, tơ olon, polyisoprene, poly(vinyl chloride), cao su buna. Số polymer được điều chế bằng phản ứng trùng hợp là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : C
Dựa vào phương pháp điều chế polymer.
Tơ olon, polyisoprene, poly(vinyl chloride), cao su buna được sản xuất bằng phương pháp trùng hợp.
Đáp án C
Các kim loại có thể điều chế bằng phương pháp điện phân dung dịch muối của chúng là
-
A.
Al, Cu, Ag.
-
B.
Zn, Cu, Ag.
-
C.
Na, Mg, Al.
-
D.
Mg, Fe, Cu.
Đáp án : B
Các kim loại trung bình yếu được sản xuất bằng phương pháp điện phân dung dịch muối.
Zn, Cu, Ag là các kim loại trung bình yếu có thể điều chế bằng phương pháp điện phân dung dịch muối.
Đáp án B
Một hộ gia đình sử dụng gas (khí hóa lỏng) loại 12kg để đun nấu. Giả sử bình gas chỉ chứa hỗn hợp propane (C3H8) và butane (C4H10) với tỉ lệ mol tương ứng là 1 : 2.
Cho biết các phản ứng:
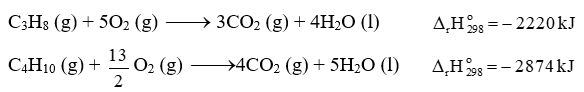
Biết sau 45 ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg và hiệu suất hấp thụ nhiệt là 80%. Trung bình mỗi ngày, hộ gia đình cần cung cấp bao nhiêu kJ nhiệt để đun nấu?
-
A.
16600.
-
B.
13280.
-
C.
10624.
-
D.
10000.
Đáp án : C
Tính số mol butane và propane. Tính lượng nhiệt tỏa ra khi đốt cháy 12kg gas.
Gọi n C3H8 và n C4H10 lần lượt là a và 2a.
m gas = m C3H8 + m C4H10 = 44a + 58.2a = 12 000 (g)
=> a = 75 mol => n C3H8 = 75 mol; n C4H10 = 150 mol
Mỗi ngày hộ gia đình cần cung cấp nhiệt lượng tỏa ra khi sử dụng hết bình gas là: (75.2220 + 150.2874).80% : 45 = 10624 kJ
Đáp án C
Thực hiện phản ứng hóa học sau: CaCO3 + 2HCl → CaCl2 + CO2+ H2O

Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
Cho các phát biểu sau:
(a) Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
(b) Tốc độ phản ứng giảm dần theo thời gian.
(c) Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33mL/s.
(d) Để hoà tan hết một mẫu CaCO3 trong dung dịch acid HCl ở 20oC cần 27 phút. Cũng mẫu CaCO3 đó tan hết trong dung dịch acid nói trên ở 40oC trong 3 phút. Vậy để hoà tan hết mẫu CaCO3 đó trong dung dịch acid nói trên ở 55oC thì cần thời gian 0,5774 phút.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
4
-
D.
3
Đáp án : D
Dựa vào sơ đồ phản ứng.
a) đúng vì phản ứng kết thúc ở 75s
b) đúng vì lượng chất tham gia giảm dần.
c) đúng
d) đúng
khi nhiệt độ tăng từ 20 đến 40 độ thì tốc độ phản ứng tăng 9 lần => \(\gamma \)= 3
khi tăng nhiệt độ từ 20 đến 55 độ thì tốc độ tăng: \({\gamma ^{\frac{{55 - 20}}{{10}}}} = {3^{\frac{{55 - 20}}{{10}}}} = 46,765\)lần.
=> t = 27 : 46,765 = 0,577 phút
Yếu tố nào sau đây luôn luôn không làm chuyển dịch cân bằng của hệ phản ứng?
-
A.
Nồng độ.
-
B.
nhiệt độ
-
C.
Áp suất.
-
D.
Chất xúc tác.
Đáp án : D
Dựa vào các yếu tố ảnh hưởng đến cân bằng hoá học.
Chất xúc tác không làm thay đổi cân bằng hóa học.
Đáp án D
Cho X là một hợp chất hữu cơ dùng để làm sạch dụng cụ trong phòng thí nghiệm, tẩy rửa sơn móng tay và là chất đầu trong nhiều quá trình tổng hợp hữu cơ. Phân tử X có chứa nhóm ketone. Hình ảnh phổ khối lượng của X như sau:

Hợp chất Y là đồng phân của X. Khi đo phổ hồng ngoại cho kết quả như hình bên dưới:

Cho các phát biểu sau:
(a) Phổ khối lượng được sử dụng để xác định phân tử khối của hợp chất hữu cơ.
(b) X là acetone.
(c) Công thức cấu tạo của Y là CH2=CH-CH2-OH.
(d) X tan tốt trong nước nên không thể dùng phương pháp chưng cất thường để tách X ra khỏi hỗn hợp với nước.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào phổ khối lượng và phổ IR.
a) đúng
b) đúng
c) sai, vì không có số sóng của nhóm – OH.
d) sai, chất X không tan trong nước.
đáp án B
Cho các phát biểu sau:
(a) Fructose và glucose đều có khả năng tham gia phản ứng tráng bạc với thuốc thử Tollens.
(b) Saccharose và tinh bột đều bị thủy phân khi đun nóng (có xúc tác acid).
(c) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(d) Thủy phân cellulose và tinh bột trong môi trường acid sản phẩm cuối cùng thu được là fructose.
(e) Quá trình lên men các sản phẩm hữu cơ như tinh bột, cellulose dùng để sản xuất xăng sinh học.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Đáp án : D
Dựa vào tính chất hóa học của tinh bột.
a. đúng
b. đúng
c. đúng
d. sai, sản phẩm cuối cùng thu được là glucose.
e. đúng
đáp án D
Tiến hành thí nghiệm xà phòng hóa tristearin theo các bước sau:
Bước 1: Cho vào bát sứ khoảng 1 gam tristearin và 2 – 2,5 ml dung dịch NaOH nồng độ 40%.
Bước 2: Đun sôi nhẹ hỗn hợp khoảng 30 phút và khuấy liên tục bằng đũa thủy tinh, thỉnh thoảng thêm vài giọt nước cất để giữ cho thể tích của hỗn hợp không đổi.
Bước 3: Rót thêm vào hỗn hợp 4 – 5 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ rồi để nguội.
Phát biểu nào sau đây sai?
-
A.
Sau bước 3, hỗn hợp tách thành hai lớp: phía trên là chất rắn màu trắng, phía dưới là chất lỏng.
-
B.
Sau bước 2, thu được chất lỏng đồng nhất.
-
C.
Mục đích chính của việc thêm dung dịch NaCl là làm tăng tốc độ cho phản ứng xà phòng hóa.
-
D.
Phần chất lỏng sau khi tách hết xà phòng hòa tan Cu(OH)2 thành dung dịch màu xanh lam.
Đáp án : C
Dựa vào thí nghiệm điều chế chất béo.
C sai, mục đích chính của việc thêm dung dịch NaCl là phân tách lớp chất béo so với hỗn hợp còn lại.
Đáp án C
Cho cân bằng sau:

Cho hỗn hợp chứa 0,5 mol mỗi khí X2 và Y2 vào bình kín rồi đun nóng để hệ đạt trạng thái cân bằng. Đồ thị sau biểu diễn sự thay đổi số mol mỗi khí theo thời gian.

Hằng số cân bằng KC của phản ứng trên ở nhiệt độ thí nghiệm bằng
-
A.
1,5.
-
B.
3,0.
-
C.
9,0.
-
D.
18,0.
Đáp án : B
Dựa vào sơ đồ phản ứng.
KC = \(\frac{{{\rm{[}}XY]}}{{{{{\rm{[}}{X_2}{\rm{]}}}^{1/2}}.{{{\rm{[}}Y]}^{1/2}}}} = \frac{{0,6}}{{{{(0,2)}^{1/2}}.{{(0,2)}^{1/2}}}} = 3\)
Đáp án B
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Amine bậc 2 có cấu tạo RNHR.
Có 2 chất là:
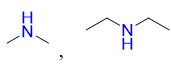
Đáp án B
Thí nghiệm nào sau đây có xảy ra sự ăn mòn điện hóa học?
-
A.
Đốt cháy bột kim loại nhôm (aluminum) trong bình chứa khí oxygen.
-
B.
Thả miếng kim loại kẽm (zinc) vào dung dịch hydrochloric acid.
-
C.
Cho miếng kim loại sắt (đã xử lý sạch bề mặt) vào dung dịch chứa CuSO4 và H2SO4 loãng.
-
D.
Đốt cháy phoi bào sắt (iron) trong khí chlorine.
Đáp án : C
Dựa vào khái niệm ăn mòn điện hóa.
Thí nghiệm C xảy ra ăn mòn điện hóa vì đủ điều kiện 2 điện cực cùng nhúng trong một chất điện li.
Đáp án C
Xét thí nghiệm điện phân dung dịch CuSO4. Phát biểu nào sau đây không đúng?
-
A.
Ở cathode xảy ra quá trình khử Cu2+.
-
B.
Ở anode xảy ra quá trình oxi hóa SO42-.
-
C.
Ở anode xảy ra quá trình oxi hóa H2O.
-
D.
Khối lượng cathode tăng là khối lượng của Cu bám vào.
Đáp án : B
Dựa vào nguyên tắc điện phân dung dịch.
Khi điện phân dung dịch CuSO4, ở cathode xảy ra quá trình khử ion Cu2+, ở anode xảy ra quá trình oxi hóa H2O.
Đáp án B
Một số bạn trẻ cho rằng hút thuốc là “sành điệu”, thuốc lá điện tử không gây hại. Khói thuốc lá và thuốc lá điện tử chứa các thành phần nicotine, carbon monoxide, benzene, formaldehyde, acetaldehyde, hydrogen cyanide,. là những chất tác động trực tiếp lên não, thần kinh, tim mạch, hệ hô hấp và nguy cơ dẫn đến ung thư. Trong các chất trên, chất thuộc loại hợp chất amine là
-
A.
nicotine.
-
B.
carbon monoxide.
-
C.
formaldehyde.
-
D.
hydrogen cyanide.
Đáp án : A
Dựa vào thành phần của khối thuốc.
Nicotine thuộc hợp chất amine.
Đáp án A
Tinh chế đường đỏ thành đường trắng
Đường được làm từ mật mía và chưa qua tinh luyện thường được gọi là đường đỏ (hoặc đường vàng). Trong đường đỏ có các chất màu và tạp chất. Để tinh luyện đường đỏ thành đường trắng, người ta làm như sau:
- Hoà tan đường đỏ vào nước nóng, thêm than hoạt tính để khử màu, khuấy, lọc để thu được dung dịch trong suốt không màu.
- Cô cạn, để nguội thu được đường trắng ở dạng tinh thể.
a. Đường trắng tinh khiết hơn đường đỏ.
b. Tinh chế đường đỏ thành đường trắng là phương pháp kết tinh.
c. Tinh chế đường đỏ thành đường trắng là phương pháp chiết lỏng – rắn.
d. Có thể thay than hoạt tính bằng nước chlorine.
a. Đường trắng tinh khiết hơn đường đỏ.
b. Tinh chế đường đỏ thành đường trắng là phương pháp kết tinh.
c. Tinh chế đường đỏ thành đường trắng là phương pháp chiết lỏng – rắn.
d. Có thể thay than hoạt tính bằng nước chlorine.
Dựa vào các phương pháp tinh chế và tách biệt hợp chất hữu cơ.
a. đúng
b. đúng
c. sai, phương pháp kết tinh.
d. sai vì nước chlorine độc.
Cho dãy chuyển hoá sau (mỗi ký hiệu là một chất khác nhau):
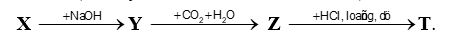
Biết X và Z được dùng làm bột nở trong công nghiệp thực phẩm; Z được dùng làm thuốc chữa đau dạ dày do thừa acid.
a. Z là baking soda.
b. Chất X có thể làm mềm được nước cứng vĩnh cửu.
c. Chất Y và T tan tốt trong nước, chất Z tan trong nước ít hơn so với Y và T.
d. Sử dụng thuốc muối Nabica (có thành phần chính là chất Z) để chữa đau dạ dày dễ bị đầy hơi trong bụng, dễ gây ợ.
a. Z là baking soda.
b. Chất X có thể làm mềm được nước cứng vĩnh cửu.
c. Chất Y và T tan tốt trong nước, chất Z tan trong nước ít hơn so với Y và T.
d. Sử dụng thuốc muối Nabica (có thành phần chính là chất Z) để chữa đau dạ dày dễ bị đầy hơi trong bụng, dễ gây ợ.
Dựa vào ứng dụng của X và Z để xác định công thức.
X là NH4HCO3
Y là Na2CO3
Z là NaHCO3
T là NaCl
a. Đúng.
b. Sai. Chất X không làm mềm được nước cứng vĩnh cửu
c. Đúng. NaHCO3 ít tan trong nước
d. Đúng
a. SO2 gây viêm đường hô hấp; NOx là một trong số các nguyên nhân gây mưa acid, thủng tầng ozone.
b. Để hạn chế sự phát thải khí NOx, SO2 cần tăng cường sử dụng các nguồn năng lượng mới, năng lượng tái tạo.
c. Khối lượng SO2 mà nhà máy X phát thải vào không khí là 12 mg.
d. Nồng độ SO2 trong 40 lít không khí của Thành phố Y nằm trong ngưỡng cho phép, không khí ở thành phố Y không bị ô nhiễm.
a. SO2 gây viêm đường hô hấp; NOx là một trong số các nguyên nhân gây mưa acid, thủng tầng ozone.
b. Để hạn chế sự phát thải khí NOx, SO2 cần tăng cường sử dụng các nguồn năng lượng mới, năng lượng tái tạo.
c. Khối lượng SO2 mà nhà máy X phát thải vào không khí là 12 mg.
d. Nồng độ SO2 trong 40 lít không khí của Thành phố Y nằm trong ngưỡng cho phép, không khí ở thành phố Y không bị ô nhiễm.
Tính nồng độ của khí SO2 và NOx sau đó đánh giá mức độ ô nhiễm.
a. đúng
b. đúng
c. đúng vì
m S = 100.109.3,5% = 3,5.109 mg
khối lượng (mg) SO2 mà nhà máy X phát thải vào không khí:
m SO2 = 64.3,5.109: 32 = 7.109 mg
m SO2 trong 40 lít không khí: 64.1,875.10-4 = 0,012 gam = 12mg
d. sai, vì
nồng độ SO2 = 12 : 40 = 0,3 mg/L = 300 mg/m3
Nhà máy X ở gần thành phố Y thuộc khu vực loại 1 và dùng nhiên liệu than nên C max = 255 mg/m3
Dễ thấy nồng độ SO2 đo được = 300 > 255 nên không khí thành phố Y bị xếp vào loại ô nhiễm
Cho chất hữu cơ E có công thức phân tử là C9H8O4 và các sơ đồ phản ứng theo đúng tỉ lệ mol:
(1) E + 3NaOH → 2X + Y + H2O
(2) 2X + H2SO4 → Na2SO4 + 2Z
(3) Z + 2Ag[(NH3)2]OH → T + 2Ag + 3NH3 + H2O.
(4) Y + HCl → F + NaCl.
a. Z là formic acid.
b. E là ester hai chức tạo bởi carboxylic acid và các alcohol.
c. Dung dịch Y tác dụng được với khí CO2.
d. Chất E có 3 công thức cấu tạo phù hợp.
a. Z là formic acid.
b. E là ester hai chức tạo bởi carboxylic acid và các alcohol.
c. Dung dịch Y tác dụng được với khí CO2.
d. Chất E có 3 công thức cấu tạo phù hợp.
Xác định công thức của hợp chất E.
Từ (2) → Z là acid HCOOH
T là (NH4)2CO3
E : HCOO-C6H4- CH2- OOCH (o,p,m)
a. Đúng.
b. Sai. Có 1 chức ester phenol
c. Đúng.
d. Đúng.
Một số nước ngầm có chứa nhiều ion Fe2+ (như muối Fe(HCO3)2) ảnh hưởng không tốt khi sử dụng để sinh hoạt, chăn nuôi. Người ta thường sử dụng phương pháp giàn phun mưa để loại bỏ Fe2+ theo phản ứng:
4 Fe(HCO3)2 + O2 + 2H2O → 4Fe(OH)3 + 8CO2.
Có các nhận định sau:
(1) Fe2+ là chất khử.
(2) Xuất hiện kết tủa nâu đỏ.
(3) Có thể tách kết tủa Fe(OH)3 ra khỏi nước bằng phương pháp lọc.
(4) Sử dụng giàn mưa để tăng tốc độ phản ứng oxi hóa ion Fe2+ thành ion Fe3+.
Có bao nhiêu phát biểu đúng?
Đáp án:
Đáp án:
Xác định số oxi hóa của các chất.
(1) đúng
(2) đúng
(3) đúng
(4) đúng
Đáp án 4
Thực hiện 5 thí nghiệm sau:
(a) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2.
(b) Cho dung dịch NH4HCO3 vào dung dịch Ba(OH)2.
(c) Đun nóng nước cứng tạm thời.
(d) Cho kim loại Al vào dung dịch NaOH dư.
(e) Cho kim loại Na vào dung dịch CuSO4.
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được cả kết tủa và chất khí?
Đáp án:
Đáp án:
Viết các phản ứng trong các thí nghiệm trên.
(a) có kết tủa BaSO4
(b) có kết tủa BaCO3
(c) có kết tủa MgCO3, CaCO3.
(d) không có kết tủa
(e) có kết tủa Cu(OH)2.
Đáp án 4.
Paracetamol (còn có tên gọi khác là acetaminophen) là hoạt chất giúp giảm đau và hạ sốt được sử dụng nhiều trong y học. Thuốc paracetamol được tổng hợp từ phenol qua nhiều giai đoạn, trong đó giai đoạn tạo ra paracetamol từ p-amino phenol và acetic anhydride xảy ra theo phương trình hóa học sau:

Để sản xuất 4530 hộp thuốc pracetamol 500 mg (mỗi hộp gồm 10 vỉ, mỗi vỉ gồm 10 viên, mỗi viên chứa 500 mg paracetamol) cần dùng tối thiểu m kg p-amino phenol. Biếu hiệu suất phản ứng tính theo p-amino phenol là 80%. Tính giá trị của m. (Làm tròn kết quả tính toán đến hàng đơn vị.
Đáp án:
Đáp án:
Tính khối lượng paracetamol có trong 4530 hộp.
Số mg paracetamol có trong 4530 hộp là: 10.10.500.4530 = 226500000mg = 226500g.
n paracetamol là: 226500 : 151 = 1500 mol
n p – amino phenol là: 1500 : 80% = 1875 mol
m p – amino phenol = 1875 . 109 = 204375g = 204 kg
đáp án 204
Ở t°C khi cho 2 gam MgSO4 vào 200 gam dung dịch MgSO4 bão hòa đã làm cho m gam tinh thể muối MgSO4.nH2O (A) kết tinh. Nung m gam tinh thể (A) cho đến khi mất nước hoàn toàn thì thu được 3,16 gam MgSO4. Cho biết ở t°C, 100 gam nước hoàn tan tối đa 35,1 gam MgSO4 tạo thành dung dịch bão hòa. Tính giá trị của n.
Đáp án:
Đáp án:
Tính khối lượng MgSO4 ban đầu và còn lại trong dung dịch.
mMgSO4 ban đầu = 2 + 200.35,1/(100 + 35,1) = 53,96 gam
mMgSO4 còn lại trong dung dịch = 53,96 – 3,16 = 50,8
mdd còn lại = 50,8(100 + 35,1).35,1 = 195,53
mA = 2 + 200 – 195,53 = 6,47
nA = nMgSO4 tách ra = 3,16/120 = 0,0263
→ MA = 120 + 18k = 6,47/0,0263
→ k = 7
Chất béo là nguồn cung cấp năng lượng đáng kể cho cơ thể người. Trung bình 1 gam chất béo cung cấp 38 kJ và năng lượng từ chất béo đóng góp 20% tổng năng lượng cần thiết trong ngày. Một ngày, một học sinh trung học phổ thông cần năng lượng 9120 kJ thì cần ăn bao nhiêu gam chất béo cho phù hợp?
Đáp án:
Đáp án:
Tính năng lượng cơ thể cần cung cấp.
Khối lượng chất béo cần cung cấp: 9120.20% : 38 = 48g
Một nhà máy gang thép sản xuất thép thành phẩm từ 500 tấn quặng hematite đỏ (chứa 80% Fe2O3 về khối lượng, còn lại là tạp chất không chứa sắt) với hiệu suất cả quá trình đạt 90% theo sơ đồ:
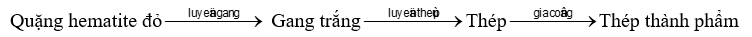
Biết thép thành phẩm chứa 98% sắt về khối lượng và có khối lượng riêng là 7,9 tấn/m3. Toàn bộ lượng thép thành phẩm là k cuộn thép, mỗi cuộn được tạo ra từ một dây thép hình trụ “phi 10” (đường kính 10 mm) dài 500 m. Cho π = 3,14. Giá trị của k là bao nhiêu? (Làm tròn kết quả tính toán đến hàng đơn vị).
Đáp án:
Đáp án:
Tính khối lượng Fe2O3 trong quặng và khối lượng Fe2O3 cần sản xuất.
Khối lượng Fe2O3 = 500.80% = 400 Tấn
n Fe2O3 = 400 : 160 = 2,5 tấn mol
=> n Fe sản xuất = 2,5.2.90% = 4,5 tấn mol
Khối lượng thép thành phẩm: 4,5.56 : 98% tấn => Thể tích thép là: m : D = \(\frac{{4,5.56:98\% }}{{7,9}}\)
Thể tích 1 cuộn thép là: 3,14.500.(5.10-3)2 = 0,039375 m3
Số cuộn thép thu được là: \(\frac{{4,5.56:98\% }}{{7,9}}\): 0,039375= 794
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
Phần I. Trắc nghiệm nhiều đáp án lựa chọn
Kim loại cứng nhất, thường được pha vào thép để tăng độ cứng và khả năng chống gỉ cho thép là
Trong ăn mòn hóa học, phản ứng hóa học xảy ra là loại phản ứng nào sau đây?
Hợp chất nào sau đây là ester ?
Khi thay thế nhóm …(1) ở nhóm …(2) của carboxylic acid bằng nhóm
Phức chất đơn giản thường có một
Cho phản ứng oxi hóa – khử:
Các bài khác cùng chuyên mục









Danh sách bình luận