Đề thi thử THPT môn Hóa lần 1 năm 2025 Sở GD Quảng Ninh
Cho ba dung dịch có cùng nồng độ mol sau:
Đề bài
Cho ba dung dịch có cùng nồng độ mol sau: (1) CH3CH2COOH, (2) CH3CH(NH2)COOH,
(3) CH3CH2NH2. Dãy sắp xếp theo chiều tăng dần pH của các dung dịch trên là
-
A.
(3), (2), (1).
-
B.
(3), (1), (2).
-
C.
(1), (3), (2).
-
D.
(1), (2), (3).
PE là một polymer thông dụng, dùng làm chất dẻo (chất dẻo chứa PE chiếm gần 1/3 tổng lượng chất dẻo được sản xuất hàng năm). Trong đời sống, PE được dùng làm màng bọc thực phẩm, túi nylon, bao gói, chai lọ đựng hoá mĩ phẩm,... PE được điều chế từ monomer có tên gọi là
-
A.
styrene.
-
B.
vinyl chloride.
-
C.
ethylene.
-
D.
propylene.
Cho sức điện động chuẩn của các pin điện hoá: \(E_{Pin\;(T - X)}^o = 2,46\;V\); \(E_{Pin\;(T - Y)}^o = 2,00\;V\); \(E_{Pin\;(Z - Y)}^o = 0,90\;V\) (với X, Y, Z, T là 4 kim loại, kim loại ở bên trái trong kí hiệu pin đóng vai trò anode). Dãy sắp xếp các kim loại theo chiều tăng dần tính khử là
-
A.
Z < X < Y < T.
-
B.
X < Y < Z < T.
-
C.
Y < T < Z < X.
-
D.
T < Z < Y < X.
Hãy chọn giải thích đúng về sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động.
-
A.
Do CaO tác dụng với SO2 và O2 tạo thành CaSO4
-
B.
Do sự phân hủy Ca(HCO3)2 → CaCO3 + CO2 + H2O
-
C.
Do quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 ⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu.
-
D.
Do phản ứng của CO2 trong không khí với CaO tạo thành CaCO3
Số nguyên tử oxygen trong một phân tử ester đơn chức là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Kim loại có những tính chất vật lí chung nào sau đây?
-
A.
Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
-
B.
Tính dẻo, có ánh kim, rất cứng.
-
C.
Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
-
D.
Tính dẻo, tính dẫn điện, có khối lượng riêng lớn và có ánh kim.
X là một kim loại có độ cứng cao nhất trong các kim loại. Người ta dùng X để chế tạo các loại thép không gỉ. X là kim loại nào sau đây?
-
A.
Chromium.
-
B.
Tungsten.
-
C.
Osmium.
-
D.
Titanium.
Khi thế thay thế nguyên tử hydrogen trong ammonia bằng gốc hydrocarbon ta thu được hợp chất nào sau đây?
-
A.
Carbohydrate.
-
B.
Amine.
-
C.
Ester.
-
D.
Carboxylic acid.
Nhúng dây kim loại platinum vào ống nghiệm chứa dung dịch NaCl bão hoà rồi hơ nóng đầu dây trên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu
-
A.
đỏ tía.
-
B.
đỏ cam.
-
C.
tím nhạt.
-
D.
vàng.
-
A.
Chiết.
-
B.
Kết tinh.
-
C.
Sắc kí cột.
-
D.
Chưng cất.
Quá trình Solvay đóng vai trò quan trọng trong công nghiệp để sản xuất NaHCO3 và Na2CO3.
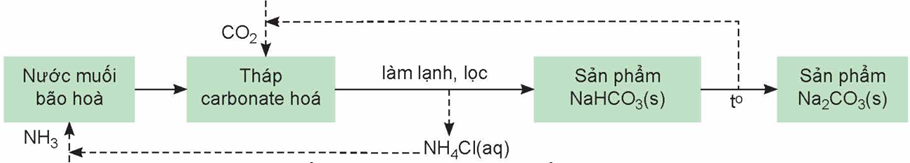
Quá trình Solvay là một ví dụ về quy trình tuần hoàn trong ngành công nghiệp hóa học
Phát biểu nào sau đây sai?
-
A.
Nguyên liệu chính của quá trình Solvay là đá vôi, muối ăn, ammonia, nước.
-
B.
Dựa trên tính lưỡng tính của NaHCO3 để chuyển hoá chất này thành Na2CO3.
-
C.
Quá trình Solvay đã tái sử dụng các sản phẩm trung gian như NH3 và CO2.
-
D.
NaHCO3 được tách biệt khỏi hệ phản ứng bằng phương pháp kết tinh.
Qiana là tên thương mại của một loại tơ nylon được sử dụng để sản xuất vải lụa chống nhăn cao cấp. Qiana có công thức cấu tạo sau đây:
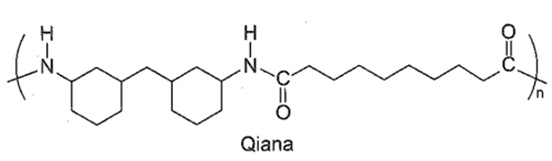
Nhận xét nào sau đây đúng?
-
A.
Các monomer dùng để tổng hợp Qiana có cấu tạo như sau:
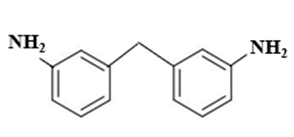 và
và 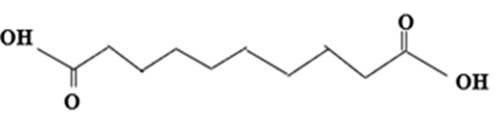
-
B.
Tơ này kém bền trong môi trường acid hoặc base mạnh.
-
C.
Tơ nylon làm từ tơ Qiana thuộc loại tơ nhân tạo.
-
D.
Qiana thuộc loại loại polyamide được điều chế từ phản ứng trùng hợp các monomer đa chức tương ứng.
Trong quá trình pin điện hoá Zn – Ag hoạt động, ta nhận thấy
-
A.
khối lượng của điện cực Zn tăng.
-
B.
khối lượng của điện cực Ag giảm.
-
C.
nồng độ của ion Zn2+ trong dung dịch tăng.
-
D.
nồng độ của ion Ag+ trong dung dịch tăng.
Xét cân bằng trong dung dịch gồm NH4Cl 0,10M và NH3 0,05M ở 250C:
NH3 + H2O ⇌ NH4+ + OH- Kc = 1,74.10-5
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên
-
A.
2,5.
-
B.
6,7.
-
C.
5,06.
-
D.
8,94.
Trong phân tử amylose có chứa loại liên kết nào sau đây?
-
A.
α-1,4-glycoside.
-
B.
β-1,6-glycoside.
-
C.
β-1,4-glycoside.
-
D.
β-1,4-glycoside.
Nguyên tố X thuộc nhóm IIA. Cấu hình của X có tổng số electron các phân lớp p là 12. X là nguyên tố nào sau đây?
-
A.
Be.
-
B.
Ca.
-
C.
Mg.
-
D.
Ba.
Xét phản ứng giữa methane với chlorine:
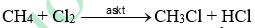
Phản ứng xảy ra theo cơ chế gốc tự do, trong đó giai đoạn phát triển mạch có sự hình thành các gốc tự do và . Giai đoạn tắt mạch có sự kết hợp 2 gốc tự do nói trên, tạo thành CH3Cl như sau:
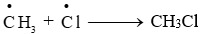
Bên cạnh sản phẩm thế mong muốn CH3Cl, phản ứng còn tạo sản phẩm phụ nào dưới đây?
-
A.
C2H2.
-
B.
C2H4.
-
C.
C2H6.
-
D.
C2H5OH.
Khi thủy phân CH3COOC2H5 bằng dung dịch NaOH dư thì sản phẩm của phản ứng là
-
A.
CH3COONa và C2H5OH.
-
B.
CH3COONa và C2H5OH.
-
C.
CH3COOH và C2H5OH.
-
D.
CH3COONa và C2H5ONa.
a) Thế điện cực chuẩn \({{\rm{E}}^o}_{Z{n^{2 + }}/Zn} = - 0,76V\).
b) Khi pin hoạt động, ion âm trong cầu muối di chuyển về phía điện cực hydrogen.
c) Tại điện cực dương xảy ra quá trình khử ion H+(aq) thành khí H2(g).
d) Phản ứng xảy ra trong pin là: H2(g) + Zn2+(aq) → Zn(s) + 2H+(aq).
Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới sự chuyển dịch cân bằng của phản ứng:
CH3COONa + H2O ⇌ CH3COOH + NaOH ΔrHo298 > 0.
- Chuẩn bị: dung dịch CH3COONa 0,5M; phenolphthalein; cốc nước nóng, cốc nước đá, ba ống nghiệm
- Tiến hành: Cho khoảng 10 mL dung dịch CH3COONa 0,5M vào cốc thuỷ tinh, thêm 1-2 giọt phenolphthalein, khuấy đều. Chia dung dịch vào 3 ống nghiệm với thể tích gần bằng nhau
+ Ống nghiệm (1) để so sánh.
+ Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 – 2 phút.
+ Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 – 2 phút.
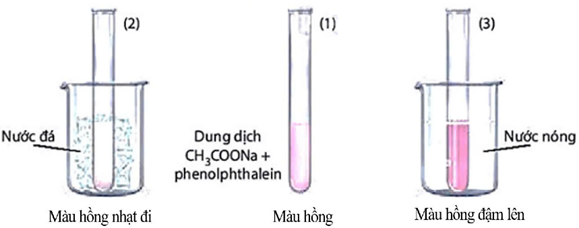
a) Ở cân bằng trên, phản ứng thuận toả nhiệt, phản ứng nghịch thu nhiệt.
b) Ống nghiệm (2) khi ngâm vào nước đá, màu hỗn hợp nhạt đi so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều thuận.
c) Ống nghiệm (3) khi ngâm vào nước nóng, màu hỗn hợp đậm hơn so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều phản ứng thu nhiệt.
d) Nếu cho thêm vào ống nghiệm (1) vài giọt dung dịch CH3COOH thấy màu của dung dịch nhạt dần.
Methadone là một loại thuốc dùng trong cai nghiện ma túy, nó thực chất cũng là một loại chất gây nghiện nhưng “nhẹ” hơn các loại ma túy thông thường và dễ kiểm soát hơn. Công thức cấu tạo của nó như hình dưới.
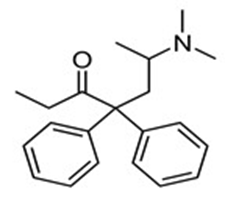
a) Phân tử methadone chứa nhóm chức amine.
b) Công thức phân tử methadone là C21H27ON.
c) Số liên kết π trong phân tử methadone là 6.
d) Phân tử methadone chứa nhóm chức của carboxylic acid.
Điểm đẳng điện pI là giá trị pH mà tại đó tổng điện tích của một phân tử amino acid bằng 0.
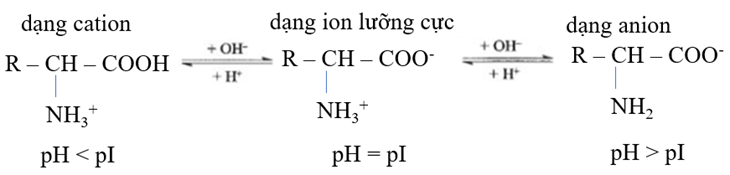
Các giá trị pI của amino acid được cung cấp trong bảng như sau:
|
Amino acid |
Gly |
His |
Arg |
|
pI |
5,97 |
7,59 |
10,76 |
Một học sinh tiến hành thực nghiệm thí nghiệm điện di. Có các giả thuyết như sau:
a) Nếu tiến hành điện di hỗn hợp 3 amino acid trong môi trường có pH = 8,0 thì sẽ có hai amino acid di chuyển về phía cực dương.
b) Nếu điện di ở pH =6,5 sẽ thấy Gly di chuyển về phía cực dương còn His và Arg di chuyển về phía cực âm.
c) Điểm đẳng điện (pI) của amino acid là pH mà tại đó phân tử không di chuyển trong điện trường.
d) Không có giá trị pH nào để cả 3 amino acid cùng di chuyển về phía cực dương.
Trong thực tế, người ta dùng hỗn hợp tecmit (gồm Al và Fe2O3 với tỉ lệ mol tương ứng là 2 :1) để hàn vết nứt trên đường ray tàu hoả. Cần m gam hỗn hợp tecmit để hàn vết nứt có thể tích là 6,72 cm3. Biết lượng Fe cần hàn cho vết nứt bằng 85% lượng Fe sinh ra và khối lượng riêng của sắt là 7,9 gam/cm3. Giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe. Hiệu suất của phản ứng là 96%. Xác định giá trị của m? (làm tròn đến hàng đơn vị).
Thủy phân 7,2 gam methyl formate trong dung dịch chứa 6,4 gam NaOH đun nóng. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch thì thu được chất rắn A. Giá trị của chất rắn A là bao nhiêu gam?
Cho các chất sau: tinh bột, benzyl acetate, tripalmitin, glucose, maltose và saccharose. Có bao nhiêu chất tham gia phản ứng thủy phân?
Ứng với công thức phân tử C4H11N có bao nhiêu amine đồng phân cấu tạo khi tác dụng với dung dịch acid HNO2 ở nhiệt độ thường thấy có khí không màu bay lên?
Pin nhiên liệu sử dụng ethanol được đặc biệt quan tâm do có nguồn nhiên liệu sinh học dồi dào. Phản ứng xảy ra khi một pin ethanol - oxygen phóng điện ở 25oC trong dung dịch chất điện li là potassium hydroxide như sau:
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\left( l \right) + 3{{\rm{O}}_2}\left( {\rm{g}} \right) \to 2{\rm{C}}{{\rm{O}}_2}\left( {\rm{g}} \right) + 3{{\rm{H}}_2}{\rm{O}}\left( l \right)\) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{298}^ \circ \)
Một pin ethanol - oxygen được dùng để thắp sáng 5 bóng đèn LED, mỗi bóng có công suất 3 W (3 J/s) liên tục trong t giờ, tiêu thụ hết 230 gam ethanol với hiệu suất quá trình oxi hoá ethanol ở anode là 60%.
Cho biết nhiệt tạo thành chuẩn của các chất:
|
Chất |
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\left( l \right)\) |
\({{\rm{O}}_2}\left( {\rm{g}} \right)\) |
\({\rm{C}}{{\rm{O}}_2}\left( {\rm{g}} \right)\) |
\({{\rm{H}}_2}{\rm{O}}\left( l \right)\) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{298}^ \circ \left( {{\rm{kJ}}/{\rm{mol}}} \right)\) |
\( - 277,6\) |
0 |
\( - 393,5\) |
\( - 285,8\) |
Giá trị của t bằng bao nhiêu? (kết quả làm tròn đến hàng đơn vị).
Mùn là loại vật chất hữu cơ phức tạp trong đất, độ màu mỡ của đất phụ thuộc vào hàm lượng mùn trong đất. Xác định carbon trong đất để tính hàm lượng mùn trong đất theo phương pháp Tiurin như sau:
Bước 1: Cân 0,35 gam một mẫu đất khô rồi cho phản ứng với 11,7 mL dung dịch K2Cr2O7 0,1 M trong H2SO4 loãng, dư, đun nóng (cho biết có 90% lượng carbon đã bị oxi hóa ở phản ứng này) thu được dung dịch X, sơ đồ phản ứng xảy ra như sau:
K2Cr2O7 + C + H2SO4 → K2SO4 + Cr2(SO4)3 + CO2 + H2O (1)
Bước 2: Chuẩn độ dung dịch X thu được ở bước 1 bằng dung dịch FeSO4 0,1221 M trong H2SO4 loãng với chất chỉ thị thích hợp (cho biết phản ứng xảy ra hoàn toàn) thì dùng hết 18,7 mL, sơ đồ phản ứng xảy ra như sau:
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O (2)
Theo phương pháp Tiurin, khối lượng mùn trong đất bằng khối lượng carbon trong đất nhân với hệ số 1,724 và từ đó xác định được hàm lượng mùn trong đất là a% khối lượng. Giá trị của a bằng bao nhiêu? (Không làm tròn khi tính toán và kết quả cuối cùng làm tròn đến hàng phần mười).
Lời giải và đáp án
Cho ba dung dịch có cùng nồng độ mol sau: (1) CH3CH2COOH, (2) CH3CH(NH2)COOH,
(3) CH3CH2NH2. Dãy sắp xếp theo chiều tăng dần pH của các dung dịch trên là
-
A.
(3), (2), (1).
-
B.
(3), (1), (2).
-
C.
(1), (3), (2).
-
D.
(1), (2), (3).
Đáp án : D
Dựa vào tính base của amine.
(1) CH3CH2COOH < (2) CH3CH(NH2)COOH < (3) CH3CH2NH2.
Đáp án D
PE là một polymer thông dụng, dùng làm chất dẻo (chất dẻo chứa PE chiếm gần 1/3 tổng lượng chất dẻo được sản xuất hàng năm). Trong đời sống, PE được dùng làm màng bọc thực phẩm, túi nylon, bao gói, chai lọ đựng hoá mĩ phẩm,... PE được điều chế từ monomer có tên gọi là
-
A.
styrene.
-
B.
vinyl chloride.
-
C.
ethylene.
-
D.
propylene.
Đáp án : C
Dựa vào kí hiệu của polymer.
PE được điều chế từ ethylene.
Đáp án C
Cho sức điện động chuẩn của các pin điện hoá: \(E_{Pin\;(T - X)}^o = 2,46\;V\); \(E_{Pin\;(T - Y)}^o = 2,00\;V\); \(E_{Pin\;(Z - Y)}^o = 0,90\;V\) (với X, Y, Z, T là 4 kim loại, kim loại ở bên trái trong kí hiệu pin đóng vai trò anode). Dãy sắp xếp các kim loại theo chiều tăng dần tính khử là
-
A.
Z < X < Y < T.
-
B.
X < Y < Z < T.
-
C.
Y < T < Z < X.
-
D.
T < Z < Y < X.
Đáp án : B
Dựa vào sức điện động của pin.
\(E_{Pin\;(T - X)}^o = 2,46\;V\)> \(E_{Pin\;(T - Y)}^o = 2,00\;V\)→ X có tính khử yếu hơn Y, T có tính khử mạnh hơn X, Y.
Z có tính khử mạnh hơn Y
Vậy tính khử tăng dần là: X < Y < Z < T.
Đáp án B
Hãy chọn giải thích đúng về sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động.
-
A.
Do CaO tác dụng với SO2 và O2 tạo thành CaSO4
-
B.
Do sự phân hủy Ca(HCO3)2 → CaCO3 + CO2 + H2O
-
C.
Do quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 ⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu.
-
D.
Do phản ứng của CO2 trong không khí với CaO tạo thành CaCO3
Đáp án : C
Dựa vào tính chất hoá học của hợp chất nhóm IIA.
Do quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 ⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu.
Đáp án C
Số nguyên tử oxygen trong một phân tử ester đơn chức là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : A
Dựa vào cấu tạo của ester.
Số nguyên tử oxygen trong một phân tử ester đơn chức là 2.
Đáp án A
Kim loại có những tính chất vật lí chung nào sau đây?
-
A.
Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
-
B.
Tính dẻo, có ánh kim, rất cứng.
-
C.
Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
-
D.
Tính dẻo, tính dẫn điện, có khối lượng riêng lớn và có ánh kim.
Đáp án : A
Dựa vào tính chất vật lí của kim loại.
Kim loại có tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
Đáp án A
X là một kim loại có độ cứng cao nhất trong các kim loại. Người ta dùng X để chế tạo các loại thép không gỉ. X là kim loại nào sau đây?
-
A.
Chromium.
-
B.
Tungsten.
-
C.
Osmium.
-
D.
Titanium.
Đáp án : A
Dựa vào ứng dụng của kim loại.
X có trong thép không gỉ nên X là Cr.
Đáp án A
Khi thế thay thế nguyên tử hydrogen trong ammonia bằng gốc hydrocarbon ta thu được hợp chất nào sau đây?
-
A.
Carbohydrate.
-
B.
Amine.
-
C.
Ester.
-
D.
Carboxylic acid.
Đáp án : B
Dựa vào khái niệm của amine.
Khi thay thế nguyên tử hydrogen trong ammonia bằng gốc hydrocarbon ta được hợp chất amine.
Đáp án B
Nhúng dây kim loại platinum vào ống nghiệm chứa dung dịch NaCl bão hoà rồi hơ nóng đầu dây trên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu
-
A.
đỏ tía.
-
B.
đỏ cam.
-
C.
tím nhạt.
-
D.
vàng.
Đáp án : D
Dựa vào ngọn lửa của hợp chất nhóm IA.
Khi nhúng dây kim loại platinum vào ống nghiệm chứa dung dịch NaCl bão hoà rồi hơ nóng đầu dây trên ngọn lửa đèn khí sẽ thấy ngọn lửa màu vàng.
Đáp án D
-
A.
Chiết.
-
B.
Kết tinh.
-
C.
Sắc kí cột.
-
D.
Chưng cất.
Đáp án : B
Dựa vào các phương pháp tách biệt và tinh chế.
Các bước trên là các bước thực hiện phương pháp kết tinh.
Đáp án B
Quá trình Solvay đóng vai trò quan trọng trong công nghiệp để sản xuất NaHCO3 và Na2CO3.

Quá trình Solvay là một ví dụ về quy trình tuần hoàn trong ngành công nghiệp hóa học
Phát biểu nào sau đây sai?
-
A.
Nguyên liệu chính của quá trình Solvay là đá vôi, muối ăn, ammonia, nước.
-
B.
Dựa trên tính lưỡng tính của NaHCO3 để chuyển hoá chất này thành Na2CO3.
-
C.
Quá trình Solvay đã tái sử dụng các sản phẩm trung gian như NH3 và CO2.
-
D.
NaHCO3 được tách biệt khỏi hệ phản ứng bằng phương pháp kết tinh.
Đáp án : B
Dựa vào quá trình solvay
NaHCO3 chuyển hoá thành Na2CO3 là do tính nhiệt phân của muối hydrcarbonate.
Đáp án B
Qiana là tên thương mại của một loại tơ nylon được sử dụng để sản xuất vải lụa chống nhăn cao cấp. Qiana có công thức cấu tạo sau đây:

Nhận xét nào sau đây đúng?
-
A.
Các monomer dùng để tổng hợp Qiana có cấu tạo như sau:
 và
và 
-
B.
Tơ này kém bền trong môi trường acid hoặc base mạnh.
-
C.
Tơ nylon làm từ tơ Qiana thuộc loại tơ nhân tạo.
-
D.
Qiana thuộc loại loại polyamide được điều chế từ phản ứng trùng hợp các monomer đa chức tương ứng.
Đáp án : B
Dựa vào cấu tạo của qiana.
Tơ này có liên kết – CO – NH nên kém bền trong môi trường acid hoặc base mạnh.
Đáp án B
Trong quá trình pin điện hoá Zn – Ag hoạt động, ta nhận thấy
-
A.
khối lượng của điện cực Zn tăng.
-
B.
khối lượng của điện cực Ag giảm.
-
C.
nồng độ của ion Zn2+ trong dung dịch tăng.
-
D.
nồng độ của ion Ag+ trong dung dịch tăng.
Đáp án : C
Dựa vào cấu tạo của pin điện.
Nồng độ ion Zn2+ trong dung dịch tăng lên.
Đáp án C
Xét cân bằng trong dung dịch gồm NH4Cl 0,10M và NH3 0,05M ở 250C:
NH3 + H2O ⇌ NH4+ + OH- Kc = 1,74.10-5
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên
-
A.
2,5.
-
B.
6,7.
-
C.
5,06.
-
D.
8,94.
Đáp án : D
Dựa vào công thức tính pH.
NH3 + H2O ⇌ NH4+ + OH- Kc = 1,74.10-5
Trước phản ứng: 0,05 0,1 0
Phản ứng: a a a
Cân bằng: 0,05 – a 0,1 + a a
\({K_C} = \frac{{{\rm{[}}NH_4^ + {\rm{]}}.{\rm{[}}O{H^ - }{\rm{]}}}}{{{\rm{[}}N{H_3}{\rm{]}}}} = \frac{{(0,1 + a).a}}{{0,05 - a}} = 1,{74.10^{ - 5}} \to a = 8,{7.10^{ - 6}}M\)
pOH = -log[OH-] = -log(8,7.10-6) = 5,06
pH = 14 – 5,06 = 8,94
đáp án D
Trong phân tử amylose có chứa loại liên kết nào sau đây?
-
A.
α-1,4-glycoside.
-
B.
β-1,6-glycoside.
-
C.
β-1,4-glycoside.
-
D.
β-1,4-glycoside.
Đáp án : A
Dựa vào cấu tạo của amylose.
Trong phân tử amylose có chứa liên kết α-1,4-glycoside.
Đáp án A
Nguyên tố X thuộc nhóm IIA. Cấu hình của X có tổng số electron các phân lớp p là 12. X là nguyên tố nào sau đây?
-
A.
Be.
-
B.
Ca.
-
C.
Mg.
-
D.
Ba.
Đáp án : B
Viết cấu hình của nguyên tố X để xác định.
Cấu hình của X là : \(1{{\rm{s}}^2}2{{\rm{s}}^2}2{p^6}3{{\rm{s}}^2}3{p^6}4{{\rm{s}}^2}\)
Vậy X là Ca
Xét phản ứng giữa methane với chlorine:
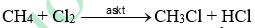
Phản ứng xảy ra theo cơ chế gốc tự do, trong đó giai đoạn phát triển mạch có sự hình thành các gốc tự do và . Giai đoạn tắt mạch có sự kết hợp 2 gốc tự do nói trên, tạo thành CH3Cl như sau:
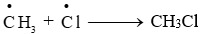
Bên cạnh sản phẩm thế mong muốn CH3Cl, phản ứng còn tạo sản phẩm phụ nào dưới đây?
-
A.
C2H2.
-
B.
C2H4.
-
C.
C2H6.
-
D.
C2H5OH.
Đáp án : C
Dựa vào cơ chế của phản ứng.
2 gốc tự do \(\mathop {\rm{C}}\limits^ \bullet {{\rm{H}}_{\rm{3}}}\)kết hợp với nhau tạo C2H6.
Đáp án C
Khi thủy phân CH3COOC2H5 bằng dung dịch NaOH dư thì sản phẩm của phản ứng là
-
A.
CH3COONa và C2H5OH.
-
B.
CH3COONa và C2H5OH.
-
C.
CH3COOH và C2H5OH.
-
D.
CH3COONa và C2H5ONa.
Đáp án : A
Dựa vào tính chất hoá học của ester.
Khi thuỷ phân CH3COOC2H5 bằng dung dịch NaOH dư thì sản phẩm: CH3COONa và C2H5OH.
Đáp án A
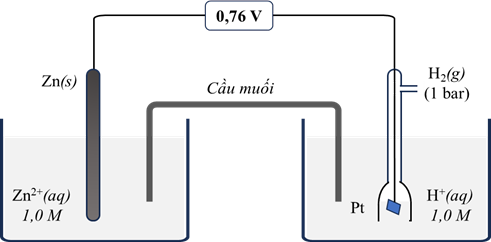
a) Thế điện cực chuẩn \({{\rm{E}}^o}_{Z{n^{2 + }}/Zn} = - 0,76V\).
b) Khi pin hoạt động, ion âm trong cầu muối di chuyển về phía điện cực hydrogen.
c) Tại điện cực dương xảy ra quá trình khử ion H+(aq) thành khí H2(g).
d) Phản ứng xảy ra trong pin là: H2(g) + Zn2+(aq) → Zn(s) + 2H+(aq).
a) Thế điện cực chuẩn \({{\rm{E}}^o}_{Z{n^{2 + }}/Zn} = - 0,76V\).
b) Khi pin hoạt động, ion âm trong cầu muối di chuyển về phía điện cực hydrogen.
c) Tại điện cực dương xảy ra quá trình khử ion H+(aq) thành khí H2(g).
d) Phản ứng xảy ra trong pin là: H2(g) + Zn2+(aq) → Zn(s) + 2H+(aq).
Dựa vào cấu tạo của pin điện.
a) đúng
b) sai vì ion âm trong cầu muối di chuyển về phía điện cực Zn để trung hòa điện tích với lượng Zn2+ mới được sinh ra.
c) đúng
d) sai vì Zn(s) + 2H+(aq)→ Zn2+(aq) +H2(g)
Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới sự chuyển dịch cân bằng của phản ứng:
CH3COONa + H2O ⇌ CH3COOH + NaOH ΔrHo298 > 0.
- Chuẩn bị: dung dịch CH3COONa 0,5M; phenolphthalein; cốc nước nóng, cốc nước đá, ba ống nghiệm
- Tiến hành: Cho khoảng 10 mL dung dịch CH3COONa 0,5M vào cốc thuỷ tinh, thêm 1-2 giọt phenolphthalein, khuấy đều. Chia dung dịch vào 3 ống nghiệm với thể tích gần bằng nhau
+ Ống nghiệm (1) để so sánh.
+ Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 – 2 phút.
+ Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 – 2 phút.

a) Ở cân bằng trên, phản ứng thuận toả nhiệt, phản ứng nghịch thu nhiệt.
b) Ống nghiệm (2) khi ngâm vào nước đá, màu hỗn hợp nhạt đi so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều thuận.
c) Ống nghiệm (3) khi ngâm vào nước nóng, màu hỗn hợp đậm hơn so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều phản ứng thu nhiệt.
d) Nếu cho thêm vào ống nghiệm (1) vài giọt dung dịch CH3COOH thấy màu của dung dịch nhạt dần.
a) Ở cân bằng trên, phản ứng thuận toả nhiệt, phản ứng nghịch thu nhiệt.
b) Ống nghiệm (2) khi ngâm vào nước đá, màu hỗn hợp nhạt đi so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều thuận.
c) Ống nghiệm (3) khi ngâm vào nước nóng, màu hỗn hợp đậm hơn so với ống nghiệm (1). Cân bằng chuyển dịch theo chiều phản ứng thu nhiệt.
d) Nếu cho thêm vào ống nghiệm (1) vài giọt dung dịch CH3COOH thấy màu của dung dịch nhạt dần.
Dưạ vào các yếu tố cân bằng hoá học.
a) sai vì phản ứng thuận thu nhiệt, phản ứng nghịch tỏa nhiệt.
b) sai vì nhiệt độ giảm cân bằng chuyển dịch theo chiều tỏa nhiệt, tức chiều nghịch.
c) đúng
d) đúng
Methadone là một loại thuốc dùng trong cai nghiện ma túy, nó thực chất cũng là một loại chất gây nghiện nhưng “nhẹ” hơn các loại ma túy thông thường và dễ kiểm soát hơn. Công thức cấu tạo của nó như hình dưới.

a) Phân tử methadone chứa nhóm chức amine.
b) Công thức phân tử methadone là C21H27ON.
c) Số liên kết π trong phân tử methadone là 6.
d) Phân tử methadone chứa nhóm chức của carboxylic acid.
a) Phân tử methadone chứa nhóm chức amine.
b) Công thức phân tử methadone là C21H27ON.
c) Số liên kết π trong phân tử methadone là 6.
d) Phân tử methadone chứa nhóm chức của carboxylic acid.
Dựa vào cấu tạo của methadone.
a) đúng
b) đúng
c) sai vì có 7 π
d) sai vì methadone chứa nhóm chức amine và ketone
Điểm đẳng điện pI là giá trị pH mà tại đó tổng điện tích của một phân tử amino acid bằng 0.
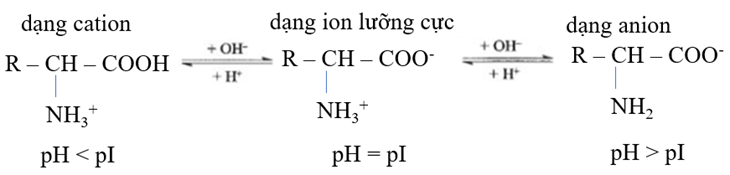
Các giá trị pI của amino acid được cung cấp trong bảng như sau:
|
Amino acid |
Gly |
His |
Arg |
|
pI |
5,97 |
7,59 |
10,76 |
Một học sinh tiến hành thực nghiệm thí nghiệm điện di. Có các giả thuyết như sau:
a) Nếu tiến hành điện di hỗn hợp 3 amino acid trong môi trường có pH = 8,0 thì sẽ có hai amino acid di chuyển về phía cực dương.
b) Nếu điện di ở pH =6,5 sẽ thấy Gly di chuyển về phía cực dương còn His và Arg di chuyển về phía cực âm.
c) Điểm đẳng điện (pI) của amino acid là pH mà tại đó phân tử không di chuyển trong điện trường.
d) Không có giá trị pH nào để cả 3 amino acid cùng di chuyển về phía cực dương.
a) Nếu tiến hành điện di hỗn hợp 3 amino acid trong môi trường có pH = 8,0 thì sẽ có hai amino acid di chuyển về phía cực dương.
b) Nếu điện di ở pH =6,5 sẽ thấy Gly di chuyển về phía cực dương còn His và Arg di chuyển về phía cực âm.
c) Điểm đẳng điện (pI) của amino acid là pH mà tại đó phân tử không di chuyển trong điện trường.
d) Không có giá trị pH nào để cả 3 amino acid cùng di chuyển về phía cực dương.
d) Không có giá trị pH nào để cả 3 amino acid cùng di chuyển về phía cực dương.
a) đúng
b) đúng
c) đúng
d) sai để di chuyển về cực dương thì pH > pI (dạng anion)
Trong thực tế, người ta dùng hỗn hợp tecmit (gồm Al và Fe2O3 với tỉ lệ mol tương ứng là 2 :1) để hàn vết nứt trên đường ray tàu hoả. Cần m gam hỗn hợp tecmit để hàn vết nứt có thể tích là 6,72 cm3. Biết lượng Fe cần hàn cho vết nứt bằng 85% lượng Fe sinh ra và khối lượng riêng của sắt là 7,9 gam/cm3. Giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe. Hiệu suất của phản ứng là 96%. Xác định giá trị của m? (làm tròn đến hàng đơn vị).
Dựa vào phương pháp tách kim loại.
m Fe cần \( = 6,72.7,9\,\,(\;{\rm{g)}}\) => m Fe tạo ra\( = \frac{{6,72.7,9}}{{0,85}}({\rm{g)}}\)
m Fe lí thuyết \( = \frac{{6,72.7,9}}{{0,85.0,96}}\) => n Fe lí thuyết \( = \frac{{6,72.7,9}}{{0,85.0,96.56}} \approx 1,1625\;{\rm{mol}}\)
Từ phương trình hóa học: 2Al + Fe2O3 → 2Fe + Al2O3 => \(\left\{ \begin{array}{l}{n_{{\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}}} = \frac{{1,1625}}{2} \approx 0,58125\;{\rm{mol}}\\{n_{{\rm{Al}}}} = 1,1625\;{\rm{mol}}\end{array} \right.\)
\(m = 0,58125.160 + 1,1625.27 = 124,39\;{\rm{g}}\)
Thủy phân 7,2 gam methyl formate trong dung dịch chứa 6,4 gam NaOH đun nóng. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch thì thu được chất rắn A. Giá trị của chất rắn A là bao nhiêu gam?
Tính số mol methyl formate và số mol NaOH.
n HCOOCH3 = 7,2 : 60 = 0,12 mol
n NaOH = 6,4 : 40 = 0,16 mol > n HCOOCH3 nên NaOH dư.
Bảo toàn khối lượng: m HCOOCH3 + m NaOH = m chất rắn A + m CH3OH
→ m chất rắn A = 7,2 + 6,4 – 0,12.32 = 9,76g
Đáp số: 9,76
Cho các chất sau: tinh bột, benzyl acetate, tripalmitin, glucose, maltose và saccharose. Có bao nhiêu chất tham gia phản ứng thủy phân?
Dựa vào tính chất hoá học của tinh bột.
Tinh bột, benzyl acetate, tripalmitin, maltose và saccharose bị thuỷ phân.
Đáp số: 5
Ứng với công thức phân tử C4H11N có bao nhiêu amine đồng phân cấu tạo khi tác dụng với dung dịch acid HNO2 ở nhiệt độ thường thấy có khí không màu bay lên?
Các amine bậc 1 có phản ứng với dung dịch acid nitrous có khí không mày bay lên.
CH3 – CH2 – CH2 – CH2 – NH2
CH3 – CH(CH3) – CH2 – NH2
(CH3)3 – C – NH2
CH3 – CH(NH2) – CH2 – CH3
Đáp số: 4
Pin nhiên liệu sử dụng ethanol được đặc biệt quan tâm do có nguồn nhiên liệu sinh học dồi dào. Phản ứng xảy ra khi một pin ethanol - oxygen phóng điện ở 25oC trong dung dịch chất điện li là potassium hydroxide như sau:
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\left( l \right) + 3{{\rm{O}}_2}\left( {\rm{g}} \right) \to 2{\rm{C}}{{\rm{O}}_2}\left( {\rm{g}} \right) + 3{{\rm{H}}_2}{\rm{O}}\left( l \right)\) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{298}^ \circ \)
Một pin ethanol - oxygen được dùng để thắp sáng 5 bóng đèn LED, mỗi bóng có công suất 3 W (3 J/s) liên tục trong t giờ, tiêu thụ hết 230 gam ethanol với hiệu suất quá trình oxi hoá ethanol ở anode là 60%.
Cho biết nhiệt tạo thành chuẩn của các chất:
|
Chất |
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}\left( l \right)\) |
\({{\rm{O}}_2}\left( {\rm{g}} \right)\) |
\({\rm{C}}{{\rm{O}}_2}\left( {\rm{g}} \right)\) |
\({{\rm{H}}_2}{\rm{O}}\left( l \right)\) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{298}^ \circ \left( {{\rm{kJ}}/{\rm{mol}}} \right)\) |
\( - 277,6\) |
0 |
\( - 393,5\) |
\( - 285,8\) |
Giá trị của t bằng bao nhiêu? (kết quả làm tròn đến hàng đơn vị).
Dựa vào công thức tính biến thiên enthalpy của phản ứng.
Đáp số: 76
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{298}^ \circ = - 1366,8\,\,\,kJ/mol\)
\({n_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}\)phản ứng \( = \frac{{230}}{{46}}.0,60 = 5\;{\rm{mol}}\)=> Q tỏa = 1366,8.5= 6834 kJ = 6834.103 J
Q thực tế = 6834.103. 0,6 = 4100400 J
\(P = 5.3 = 15\;{\rm{W}} = 15\;{\rm{J}}/{\rm{s}}\)=> \(t = \frac{Q}{P} = \frac{{4100400}}{{15.3600}}\)= 75,9 giờ
Mùn là loại vật chất hữu cơ phức tạp trong đất, độ màu mỡ của đất phụ thuộc vào hàm lượng mùn trong đất. Xác định carbon trong đất để tính hàm lượng mùn trong đất theo phương pháp Tiurin như sau:
Bước 1: Cân 0,35 gam một mẫu đất khô rồi cho phản ứng với 11,7 mL dung dịch K2Cr2O7 0,1 M trong H2SO4 loãng, dư, đun nóng (cho biết có 90% lượng carbon đã bị oxi hóa ở phản ứng này) thu được dung dịch X, sơ đồ phản ứng xảy ra như sau:
K2Cr2O7 + C + H2SO4 → K2SO4 + Cr2(SO4)3 + CO2 + H2O (1)
Bước 2: Chuẩn độ dung dịch X thu được ở bước 1 bằng dung dịch FeSO4 0,1221 M trong H2SO4 loãng với chất chỉ thị thích hợp (cho biết phản ứng xảy ra hoàn toàn) thì dùng hết 18,7 mL, sơ đồ phản ứng xảy ra như sau:
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O (2)
Theo phương pháp Tiurin, khối lượng mùn trong đất bằng khối lượng carbon trong đất nhân với hệ số 1,724 và từ đó xác định được hàm lượng mùn trong đất là a% khối lượng. Giá trị của a bằng bao nhiêu? (Không làm tròn khi tính toán và kết quả cuối cùng làm tròn đến hàng phần mười).
Dựa vào phản ứng chuẩn độ ion Fe2+
2K2Cr2O7 + 3C + 8H2SO4 → 2K2SO4 + 2Cr2(SO4)3 + 3CO2 + 8H2O (1)
K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O (2)
\({n_{{{\rm{K}}_2}C{r_2}{O_7}}} = 0,1.11,{7.10^{ - 3}} = 1,{17.10^{ - 3}}{\rm{mol}}\)
\({n_{{\rm{FeS}}{{\rm{O}}_4}}} = 0,1221.18,{7.10^{ - 3}} = 2,28427\;{.10^{ - 3}}\,\,{\rm{mol}}\)
\({n_{{\rm{C}}{{\rm{r}}_2}O_7^{2 - }}}\) dư \( = \frac{{2,28427\;}}{6}\;{.10^{ - 3}}{\rm{mol}}\)
\({n_{{\rm{C}}{{\rm{r}}_2}{\rm{O}}_7^{2 - }{\rm{ }}}}\)phản ứng với C\( = 1,{17.10^{ - 3}} - \frac{{2,28427\;}}{6}{.10^{ - 3}} = 0,{78929.10^{ - 3}}\;{\rm{mol}}\)
n C bị oxi hóa \( = \frac{3}{2}.0,{78929.10^{ - 3}} = 1,{184.10^{ - 3}}\;{\rm{mol}}\)
n C thực tế \( = \frac{{1,{{184.10}^{ - 3}}}}{{0,90}} = 1,{3156.10^{ - 3}}\;{\rm{mol}}\) (hiệu suất 90%)
\({m_C} = 1,{3156.10^{ - 3}}.12 = 0,01579\;{\rm{g}} \Rightarrow {m_{{\rm{mu n }}}} = 0,01579.1,724 = 0,02721\;{\rm{g}}\)
\(a = \frac{{0,02721}}{{0,35}}.100\% = 7,774\% \)
Để chuyển hóa dầu mỡ động thực vật thành xà phòng người ta thực hiện quá trình
Vào mùa hè, trong một số khách sạn hay nhà hàng
I. Trắc nghiệm
Cho dung dịch glucose vào ống ng̣hiệm chứa copper
Thức uống chứa cồn như rượu, bia, nước trái cây lên men
Cho biết số hiệu nguyên tử của sodium là 11. Vị trí của sodium trong bảng tuần hoàn là
Điện phân dung dịch CuSO4 với anode
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau
Chất nào sau đây thuộc loại disaccharide?
Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu
Tro thực vật được sử dụng như một loại phân bón
Cho khối lượng riêng của các chất như bảng sau:
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Fe = 56
Tinh bột chứa hỗn hợp chất nào sau đây?
Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Cấu trúc mạch vòng của carbohydrate nào sau đây không có nhóm -OH hemiacetal hoặc hemiketal?
Trong nước, thế điện cực chuẩn của kim loại Mn+/M
Chất X có công thức cấu tạo là CH3CH2COOCH3. Tên gọi của X là
Các bài khác cùng chuyên mục









Danh sách bình luận