40 bài tập điện phân mức độ vận dụng cao có lời giải (phần 1)
Làm đề thiCâu hỏi 1 :
Điện phân dung dịch X chứa 0,03 mol Fe2(SO4)3 và 0,02 mol CuSO4 trong 4632 giây với dòng điện một chiều có cường độ I = 2,5A. Biết hiệu suất điện phân là 100%. Khối lượng dung dịch giảm sau điện phân là:
- A 1,96 gam
- B 1,42 gam
- C 2,80 gam
- D 2,26 gam
Đáp án: C
Phương pháp giải:
viết các bán phản ứng tại catot và anot. Dùng phương pháp bảo toàn e
Lời giải chi tiết:
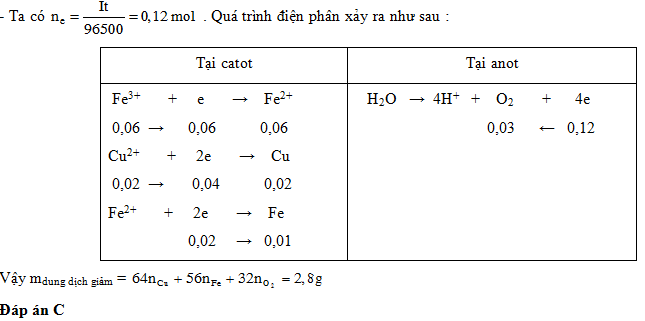
Câu hỏi 2 :
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (tỉ lệ mol 1 : 1) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h), thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được a mol khí H2. Dung dịch Y tác dụng với bột Al dư, thu được 4a mol khí H2. Phát biểu nào sau đây không đúng ?
- A Tại thời điểm 2t (h), tổng số mol khí thoát ra ở hai cực là 9a mol.
- B Khi thời gian là 1,75t (h), tại catot đã có khí thoát ra.
- C Tại thời điểm 1,5t (h), Cu2+ chưa điện phân hết.
- D Nước bắt đầu điện phân tại anot ở thời điểm 0,75t (h).
Đáp án: D
Phương pháp giải:
Bảo toàn điện tích
Lời giải chi tiết:
Chọn nCuSO4 = nNaCl = 2 mol
Do 2nCu2+ > nCl- nên Cl- đp hết trước Cu2+
Thứ tự điện phân là:
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
(2) CuSO4 + H2O → Cu + 0,5O2 + H2SO4
(3) H2O → H2 + 0,5O2
Khi cho dd sau điện phân tác dụng với Al dư thì ta luôn có: nH2SO4 = nH2 (áp dụng bảo toàn H)
Mặt khác, tăng thời gian từ t (h) lên 2t (h) số mol khí H2 thu được tăng từ a lên 4a ⇒ Lượng axit tăng
⇒ Ở t(h) thì (2) đang điện phân
- Tại t (h):
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
1 ← 2 → 1 → 1
(2) CuSO4 + H2O → Cu + 0,5O2 + H2SO4
a ← a ← 0,5a ← a
⇒ ne(t) = 2nCu = 2 + 2a (mol)
- Tại 2t (h):
Do chưa biết phản ứng (2) điện phân hết hay chưa hết nên ta xét 2 trường hợp:
*Trường hợp 1: (2) vẫn đang điện phân
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
1 ← 2 → 1 → 1
(2) CuSO4 + H2O → Cu + 0,5O2 + H2SO4
4a ← 4a ← 2a ← 4a
⇒ ne(2t) = 2nCu = 2 + 8a (mol)
Ta có: ne(2t) = ne(t) ⇔ 2 + 8a = 2(2 + 2a) ⇒ a = 0,5
Loại trường hợp này vì ∑nCuSO4 bị đp (= 1 + 4a = 3 mol) > nCuSO4 ban đầu (2 mol)
*Trường hợp 2: Cu2+ bị điện phân hết, H2O đang điện phân
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
1 ← 2 → 1 → 1
(2) CuSO4 + H2O → Cu + 0,5O2 + H2SO4
4a ← 4a ← 2a ← 4a
(3) H2O → H2 + 0,5O2
b b 0,5b
Cu2+ điện phân hết nên suy ra 1 + 4a = 2 ⇒ a = 0,25
⇒ ne(t) = 2 + 2a = 2,5 ⇒ ne(2t) = 2.2,5 = 5
BT e tại catot trong trong 2t giờ: ne(2t) = 2nCu + 2nH2 ⇔ 2.2 + 2.b = 5 => b = 0,5
Khí tại 2 điện cực có: H2 (0,5); Cl2 (1) và O2 (0,75)
Sau 2t thì ∑n khí = 0,5 + 1 + 0,75 = 2,25 = 9a => A đúng
Sau 1,75t giờ thì ne = 1,75(2+2a) = 4,375 > 2nCu2+ = 4 nên catot đã có khí thoát ra => B đúng
Sau 1,5t giờ thì ne = 1,5(2+2a) = 3,75 < 2nCu2+ = 4 nên Cu2+ chưa hết => C đúng
Sau 0,75t giờ thì ne = 0,75(2+2a) = 1,875 < nCl- = 2 nên Cl- chưa hết, H2O chưa bị điện phân => D sai
Đáp án D
Câu hỏi 3 :
Điện phân 150ml dd AgNO3 1M với điện cực trơ trong t phút, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dd Y và khí Z. Cho 12,6g Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5g hh kim loại và khí NO (sp khử duy nhất của N+5), Giá trị của t là:
- A 60
- B 48
- C 18
- D 30
Đáp án: A
Phương pháp giải:
Bảo toàn e; tăng giảm khối lượng
Lời giải chi tiết:
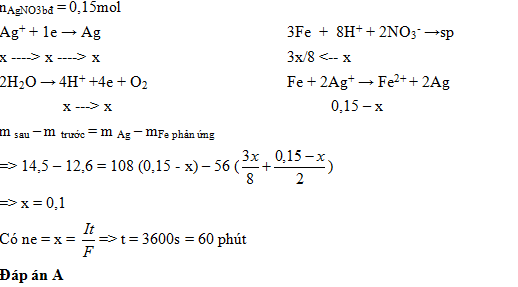
Câu hỏi 4 :
Tiến hành điện phân với điện cực trơ và màng ngăn xốp một dung dịch chứa m gam hỗn hợp CuSO4và NaCl cho đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng lại. Ở anot thu được 0,896 lít khí (đkc). Dung dịch sau khi điện phân có thể hòa tan tối đa 3,2 gam CuO. Giá trị của m là:
- A 11,94
- B 9,60
- C 5,97.
- D 6,40
Đáp án: A
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
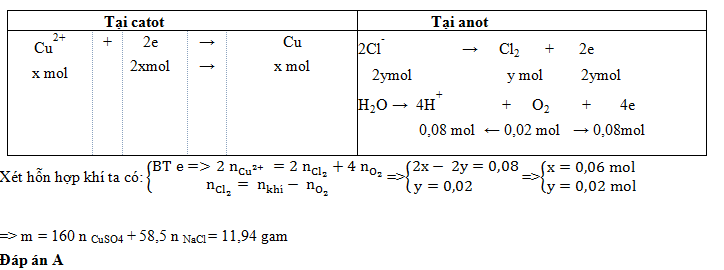
Câu hỏi 5 :
Cho một dòng điện có cường độ I không đổi đi qua 2 bình điện phân mắc nối tiếp, bình 1 chứa 100ml dung dịch CuSO4 0,01M, bình 2 chứa 100 ml dung dịch AgNO3 0,01M. Biết rằng sau thời gian điện phân 500 giây thì bên bình 2 xuất hiện khí ở catot, tính cường độ I và khối lượng Cu bám bên catot của bình 1 và thể tích khí(đktc) xuất hiện bên anot của bình 1.
- A 0,386A; 0,64g Cu; 22,4 ml O2
- B 0,193A; 0,032g Cu; 22,4 ml O2
- C 0,193A; 0,032g Cu; 5,6 ml O2
- D 0,193A; 0,032g Cu; 11,2 ml O2
Đáp án: C
Phương pháp giải:
bảo toàn e
Lời giải chi tiết:
Theo bài ra, tiến hành điện phân trong thời gian 500 giây thì bình 2 bắt đầu xuất hiện khí ở catot.
=>sau 500 giây thì Ag+ chuyển hóa hoàn tàn thành Ag và không có quá trình điện phân H2O ở catot
=>I=0,193(A)
- Bình 1, sau 500 giây thì số mol Cu2+ bị điện phân là nCu phản ứng = 0,0005 mol
=> m = 0,032 gam và VO2 = 5,6 ml
Đáp án C
Câu hỏi 6 :
Người ta mạ niken lên mặt vật kim loại (X) bằng phương pháp mạ điện. Dung dịch điện phân chứa NiSO4, cực dương là Ni kim loại, cực âm là vật kim loại X có hình trụ (bán kính 2,5cm chiều cao 20cm). Sự điện phân với cường độ dòng điện I = 9A. Vật X cần được phủ đều một lớp niken dày 0,4mm trên bề mặt. biết hiệu suất điện phân đạt 100% ; khối lượng riêng của Ni là 8,9 g/cm2. Thời gian của quá trình mạ điện là :
- A 12,832 giờ
- B 12,697 giờ
- C 16,142 giờ
- D 15,678 giờ
Đáp án: B
Phương pháp giải:
CT tính diện tích xung quanh: Sxq = 2.∏.r.h với ∏ = 3,14; r, h là bán kính và chiều cao của hình trụ.
CT tính diện tích toàn phần của hình trụ: Stp = Sxq + 2Sđáy = 2.∏.r.h + 2∏r2
Khối lượng kim loại cần mạ: m = V.D = d( độ dày). Stp. D
Lời giải chi tiết:
m Ni phủ = D . d dày . Sxq của X = 8,9 . 0,04 . ( 20.2,5.2.3,14 + 2.3,14.2,52)= 125,757 g
=> n Ni = 2,131 mol
=> t = 45 708,88 s = 12,697 h
Đáp án B
Câu hỏi 7 :
Cho hỗn hợp X gồm CuO và NaOH có tỉ lệ mol là 1 : 1 tác dụng vừa đủ với dung dịch hỗn hợp HCl 1M và H2SO4 0,5M thu được dung dịch Y gồm m gam hỗn hợp muối trung hòa. Điện phân dung dịch Y với điện cực trơ màng ngăn xốp cường dộ I = 2,68A đến khi khối lượng dung dịch giảm 20,225 gam mất t giây thì dừng lại thu được dung dịch Z. Cho m gam Fe vào Z, sau khi phản ứng kết thúc thu được 0,9675m gam hỗn hợp 2 kim loại. Giá trị của t là
- A 11523.
- B 10684.
- C 12124.
- D 14024.
Đáp án: A
Phương pháp giải:
Bảo toàn điện tích, tăng giảm khối lượng
Lời giải chi tiết:
Đặt nCuO = a mol; nNaOH = a mol; nHCl = b; nH2SO4 = 0,5b
- Xét quá trình: (CuO, NaOH) + (HCl, H2SO4) → (Cu2+, Na+, Cl-, SO42-) + H2O
+ Bảo toàn nguyên tố → dd Y chứa: Cu2+ (a mol); Cl- (b mol); Na+ (a mol); SO42- (0,5b mol)
+ BTĐT dd Y: 2nCu2+ + nNa+ = nCl- + 2nSO4 → 2a + a = b + 2.0,5b → b = 1,5a (1)
+ Khối lượng muối: 64a + 35,5b + 23a + 96.0,5b = m (2)
- Xét quá trình điện phân dd Y:
+ Dung dịch sau điện phân tác dụng với Fe được chất rắn Z chứa 2 kim loại → Cu2+ chưa điện phân hết
+ Khi cho Fe vào nhận thấy khối lượng chất rắn giảm nên dd sau điện phân có chứa H+ ⇒ Cl- đã điện phân hết
*Catot: Cu2+ + 2e → Cu
c 2c c (đặt nCu2+ bị đp = c mol)
*Anot: 2Cl- → Cl2 + 2e
b → 0,5b → b
2H2O → 4H+ + O2 + 4e
2c-b ← 0,5c-0,25b ← (2c-b)
→ mdd giảm = mCu đp + mO2 + mCl2 ⇒ 64c + 71.0,5b + 32.(0,5c-0,25b) = 20,225 (3)
- Xét quá trình: m(g) Fe + dung dịch Z (Cu2+, Na+, H+, SO42-) → (Fe2+, Na+, SO42-) + H2 + 0,9675m (g) (Cu, Fe)
Fe + 2H+ → Fe2+ + H2
c-0,5b ← 2c-b
Fe + Cu2+ → Fe2+ + Cu
a-c ← a-c → a-c
Phương pháp tăng giảm khối lượng ta có: mKL giảm = mFe pư - mCu
⇒ 56(c - 0,5b + a - c) - 64(a-c) = m - 0,9675m (4)
Giải (1)(2)(3)(4) → a = 0,18; b = 0,27; c = 0,16; m = 38,2
Vậy ne trao đổi = 2c = 0,32 mol
→ t = ne.96500/I = 11522 (s)
Đáp án A
Câu hỏi 8 :
Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 6,96 gam và tại catot chỉ thu được a gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 11,78 gam và tại catot thoát ra 0,224 lít khí (đktc). Giá trị của a là
- A 8,64.
- B 6,40.
- C 6,48.
- D 5,60.
Đáp án: C
Phương pháp giải:
Đặt ẩn phụ để giải, bảo toàn electron
Lời giải chi tiết:
Kim loại M hóa trị x . Đặt x/M = k
Trong t giây tại mỗi điện cực trao đổi
ne = a/M = ka => nO2 = ka/4
=> a + 32ka/4 = 6,96
=> a + 8ka = 6.96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
Tại catot: nH2 = 0,01 => nM = (2ka – 0,02)/x
Tại anot: nO2 = 2ka/4 = ka/2
=> 0,01 . 2 + M (2ka – 0,02 )/x + 32ka/2 = 11,78
=> (2ka – 0,02)/k + 16ka = 11,76
=> a – 0,01/k + 8ka = 5,88 (2)
Thế (1) vào (2) => 6,96 – 0,01/k = 5,88
=> k = 1/108
Từ (1 ) => a = 6,48g
Ta có x/M = 1/108
=> x = 1 và M = 108
Đáp án C
Câu hỏi 9 :
Điện phân dung dịch X gồm FeCl2 và NaCl (tỉ lệ mol tương ứng là 1 : 2) với điện cực trơ màng ngăn xốp thu được dung dịch Y chứa hai chất tan, biết khối lượng dung dịch X lớn hơn khối lượng dung dịch Y là 4,54 gam. Dung dịch Y hòa tan tối đa 0,54 gam Al. Mặt khác, cho toàn bộ dung dịch X tác dụng với lượng dư dung dịch AgNO3, sau khi phản ứng xong thu được m gam kết tủa. Giá trị của m là
- A 20,46.
- B 14,35.
- C 17,22.
- D 17,59.
Đáp án: A
Phương pháp giải:
Viết các bán phản ứng xảy ra tại catot, anot.
Bảo toàn electron
Lời giải chi tiết:
nFeCl2 = x ; nNaCl = 2x => nCl = 4x
Vì Y chỉ chứa 2 chất tan nên chỉ có thể là : NaCl và NaOH
Catot :
Fe2+ + 2e -> Fe
x -> 2x
2H2O + 2e -> 2OH- + H2
y -> y -> y -> 0,5y
Anot :
2Cl- -> Cl2 + 2e
(2x + y)
=> Y gồm : 2x mol Na+ ; (2x – y) mol Cl- ; y mol OH-
=> mX – mY = 4,54 = (127x + 58,5.2x) – [ 23.2x + 35,5(2x – y) + 17y](1)
Mặt khác Y hòa tan Al2O3 : OH- + Al + H2O -> AlO2- + 1,5H2
=> nOH = nAl = 0,02 mol = y
Từ (1) => x = 0,03 mol
Khi cho AgNO3 vào X thì :
Ag+ + Cl- -> AgCl
Ag+ + Fe2+ -> Fe3+ + Ag
=> Kết tủa gồm : 0,12 mol AgCl ; 0,03 mol Ag
=> m = 20,46g
Đáp án A
Câu hỏi 10 :
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Lấy catot ra khỏi bình điện phân, khuấy đều dung dịch để phản ứng xẩy ra hoàn toàn thì thu được dung dịch Y. Giả thiết kim loại sinh ra đều bám lên catot, sản phẩm khử của N+5 (nếu có) là NO duy nhất, hiệu suất điện phân là 100%. Hiệu khối lượng dung dịch X và Y gần nhất là
- A 91 gam.
- B 102 gam.
- C 101 gam.
- D 92 gam.
Đáp án: C
Phương pháp giải:
Viết các bán phản ứng tại 2 điện cực; bảo toàn electron; bảo toàn điện tích
CT e trao đổi: ne = It/F.
Lời giải chi tiết:
Dung dịch X chứa: 0,6 mol Cu2+; 0,4 mol Fe3+; 1,2 mol Cl-; 1,2 mol NO3-
- Tại anot:
Ta thấy: nCl2 max (= 0,6 mol) < nkhí (= 0,8 mol)
⇒ Ở anot còn sinh ra O2
⇒ Khí sinh ra ở anot gồm 0,6 mol Cl2 và 0,2 mol O2
Cl- → 0,5 Cl2 + 1e
0,6 → 1,2
H2O → 2H+ + 0,5 O2 + 2e
0,2 → 0,8
⇒ ne = 1,2 + 0,8 = 2 mol
- Tại catot thì thứ tự điện phân là: Fe3+ → Cu2+ → Fe2+ → H2O
Đặt ne = 2 mol vào các bán phản ứng điện phân:
Fe3+ + 1e → Fe2+
0,4 → 0,4còn 1,6 → 0,4
Cu2+ + 2e → Cu
0,6 → 1,2còn 0,4 → 0,6
Fe2+ + 2e → Fe
0,2 ← 0,4 → 0,2
⇒ nFe dư = 0,4 - 0,2 = 0,2 mol
Vậy dung dịch sau điện phân có chứa 0,2 mol Fe2+; 1,2 mol NO3-; H+
BTĐT ⇒ nH+ = nNO3- - 2nFe2+ = 1,2 - 2.0,2 = 0,8 mol
Lấy catot ra khỏi bình điện phân và khuấy đều sẽ có phản ứng:
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,2 → 0,2/3 (mol)
Sự chênh lệch khối lượng dung dịch đầu (dd X) và khối lượng dd sau (dd Y) chính là khối lượng của các chất tách ra khỏi dung dịch:
⇒ mX – mY = mCu + mFe + mO2 + mCl2 + mNO
= 0,6.64 + 0,2.56 + 0,2.32 + 0,6.71 + 30.(0,2/3)
= 100,6g
Đáp án C
Câu hỏi 11 :
Điện phân 200ml dung dịch hỗn hợp Cu(NO3)2 xM; KCl yM (điện cực trơ, màng năng) đến khi nước bắt đầu điện phân ở cả 2 đầu điện cực thì dừng lại. Dung dịch sau điện phân có khối lượng giảm 14 gam so với dung dịch ban đầu và dung dịch này hòa tan tối đa 3,96 gam Zn(OH)2. Biết thời gian điện phân là 19300 giây. Giá trị của x, y, cường độ dòng điện là:
- A 0,6M; 0,8M; 1,2A
- B 1M; 1,5M; 1A
- C 1M;2M; 2A
- D 0,6M;2M;2A
Đáp án: A
Phương pháp giải:
CT: ne = It/F. Tăng giảm khối lượng
Dd sau phản ứng được với Zn(OH)2 phải chia 2 trường hợp
TH1: bị OH- hòa tan => ở catot H2O bị oxi hóa
TH2: bị H+ hòa tan => ở anot H2O bị khử
Lời giải chi tiết:
+/ TH1 : Nếu Zn(OH)2 bị OH- hòa tan thì:
+ Anot : 2Cl- → Cl2 + 2e
+ Catot : Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
=> n OH- = 2n Zn(OH)2 = 0,04.2 = 0,08 mol
=> n e trao đổi = 0,2y = 0,4x + 0,08
Và m giảm = 71. 0,1y + 64. 0,2x + 0,04.2 = 14 g
=> x = 0,41 ; y = 1,22 không có đáp án phù hợp => Loại
+/TH2 : Nếu Zn(OH)2 bị H+ hòa tan thì:
+ Anot : 2Cl- → Cl2 + 2e
2H2O → O2 + 4e + 4H+
+ Catot : Cu2+ + 2e → Cu
=> n H+ = 2n Zn(OH)2 = 0,04.2 = 0,08 mol
=> n e trao đổi = 0,4x = 0,2y + 0,08
Và m giảm = 71. 0,1y + 64. 0,2x + 0,02.32 = 14 g
=> x = 0,6 M ; y = 0,8 M
Đáp án A
Câu hỏi 12 :
Điện phân dung dịch chứa 17,55 gam NaCl và a gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 32,25 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 3,9 gam và thấy thoát ra khí NO (sản phẩm khử duy nhất). Giá trị của a là:
- A 112,8
- B 94
- C 75,2
- D 103,4
Đáp án: A
Phương pháp giải:
tăng giảm khối lượng, bảo toàn electron
CT e trao đổi ne = It/F
Lời giải chi tiết:
n NaCl = 0,3 mol
Do cho thanh Fe vào X tạo khí NO nên quá trình điện phân tạo H+
+Catot: Cu2+ +2e → Cu
+Anot : 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
Gọi n O2 = ymol
n e trao đổi = 0,3 + 4y mol
=> m giảm = m Cu + m O2 + m Cl2 = 32(0,3 + 4y) + 32.y + 0,3.71 =32,55
=>y=0,075 mol
Giả sử vẫn còn xmol Cu2+ dư trong dung dịch sau điện phân .Thanh sắt dư nên phản ứng chỉ tạo muối sắt II
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Fe + Cu2+ → Fe2+ + Cu
=> m thanh sắt giảm = m Fe phản ứng – m Cu tạo ra = 0,1125.56-8x = 3,9
=> x = 0,3 mol
=> n Cu2+ ban đầu = 0,3 + ½ n e trao đổi =0,6 mol
=> a = 112,8g
Đáp án A
Câu hỏi 13 :
Điện phân với điện cực trơ dung dịch chứa 0,3 mol AgNO3 bằng cường độ dòng điện 2,68 ampe, trong thời gian t giờ thu được dung dịch X. Cho 22,4 gam bột Fe vào dung dịch X thấy thoát ra khí NO (sản phẩm khử duy nhất) thu được 34,28 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của t là
- A 1,25.
- B 1,0.
- C 1,2.
- D 1,4.
Đáp án: C
Phương pháp giải:
Viết phương trình điện phân, đặt mol dưới chân PTPU và tính toán
CT số mol e ne = It/F
Lời giải chi tiết:
Khối lượng rắn sau phản ứng = 34,28g => mAg = 0,3 . 108 = 32,4
=> AgNO3 còn dư sau điện phân 2y
2AgNO3 + H2O → 2Ag + 0,5O2 + 2HNO3
x → x → x
Dung dịch sau phản ứng gồm AgNO3 dư 2y mol và HNO3 x mol
Fe + 2AgNO3→ Fe(NO3)2+ 2 Ag
y 2y y
3Fe + 8 HNO3 → 3 Fe(NO3)2 + 2 NO + 4 H2O
3x/8 →x
n AgNO3 = x + 2y = 0,3
m rắn = 108. 2y + 22,4 – 56 . (y + 3x/8) = 34,28
=> x = 0,12 và y = 0,09
Thời gian t = (0,12 . 26,8 . 1 )2,68 = 1,2 giờ
Đáp án C
Câu hỏi 14 :
Điện phân dung dịch hỗn hợp HCl và 0,4 mol CuNO3 với điện cực trơ, cường độ dòng điện không đổi I=10A trong khoảng thời gian t (s). Ở anot thu được hỗn hợp khí. Nhúng thanh Fe vào dung dịch sau phản ứng đến khi phản ứng xảy ra hoàn toàn có khí NO duy nhất thoát ra đồng thời thanh Fe tăng 1,2g. Giá trị của t là?
- A 772 (s)
- B 1544 (s)
- C 2316 (s)
- D 386 (s)
Đáp án: A
Phương pháp giải:
Viết phương trình điện phân, đặt mol vào PTHH và tính toán. Phương pháp tăng giảm khối lượng.
CT số mol e ne = It/F.
Lời giải chi tiết:
Nhúng thanh Fe vào dd sau điện phân thấy khối lượng thanh Fe tăng
→ Cu(NO3)2 còn dư sau điện phân
Do ở anot thu được hỗn hợp khí → Cl2 và O2
Các PTHH điện phân là:
Cu(NO3)2 + 2 HCl → Cu + Cl2 + 2 HNO3 (1)
Cu(NO3)2 + H2O → Cu + 0,5 O2 + 2 HNO3 (2)
Dung dịch sau điện phân chứa: Cu(NO3)2 dư và HNO3
Từ (1) (2) ta thấy: nHNO3 = 2nCu2+ đp
Đặt nCu2+ đp = a mol và nHNO3 = 2a mol
→ nCu2+ dư = 0,4 - a (mol)
Cho thanh Fe vào dd sau điện phân, do Fe còn dư → chỉ sinh ra Fe2+
3 Fe + 8 HNO3 → 3 Fe(NO3)2 + 2 NO + 4 H2O
0,75a ← 2a
Fe + Cu2+ → Fe2+ + Cu
0,4-a ← 0,4-a → 0,4-a
m thanh Fe tăng = mCu - mFe pư
⇔ 64.(0,4-a) - 56.(0,75a + 0,4 - a) = 1,2
⇔ a = 0,04 mol
Thời gian điện phân t = (2.0,04.96500) : 10 = 772 giây
Đáp án A
Câu hỏi 15 :
Dung dịch X chứa m gam chất tan gồm Cu(NO3)2 và NaCl, trong đó khối lượng của Cu(NO3)2 lớn hơn 5g. Điện phân dung dịch X với cường độ dòng điện không đổi. Sau thời gian t giây thì thu được dung dịch Y chứa (m – 18,79)g chất tan và có khí thoát ra ở catot. Nếu thời gian điện phân là 2t giây thì dung dịch Z chứa a1 gam chất tan và hỗn hợp khí T gồm 3 khí có tỉ khối so với H2 là 16. Cho Z vào dung dịch chứa 0,1 mol FeCl2 và 0,2 mol HCl thì thu được dung dịch chứa (a1 + 16,46)g chất tan và có khí thoát ra. Giá trị của m là :
- A 26,8
- B 16,6
- C 72,76
- D 45,96
Đáp án: D
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
Phương pháp : Bảo toàn electron.
Lời giải :
B1 : Xác định các thành phần trong Z sau khi điện phân
Đặt a, b lần lượt là số mol Cu(NO3)2 và NaCl trong X
+) Trong t giây :
Tại Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> 2OH- + H2
nCu = a ; nH2 = x (ne = 2nCu + 2nH2)
=> ne = 2a + 2x
Tại Anot :
2Cl- -> Cl2 + 2e
=> nCl2 = a + x
(Bảo toàn electron)
+) mgiảm = mH2O – mCu – mH2 – mCl2 = - 18,79
=> 18.2x – 64a – 2x – 71(a + x) = -18,79
=> 37x + 135a = 18,79(1)
+) Trong 2t giây thì : ne = 4a + 4x
Tại Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> 2OH- + H2
nCu = a và nH2 = a + 2x (ne = 2nCu + 2nH2)
Tại Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
nCl2 = 0,5b ; nO2 = a + x – 0,25b (ne = 2nCl2 + 4nO2)
Mkhí = 32 => cũng là MO2 nên H2 và Cl2 có Mtb = 32
=> mH2 + mCl2 = mhh (H2 , Cl2)
=> 2(a + 2x) + 71.0,5b = 32(a + 2x + 0,5b)
=> 60x + 30a – 19,5b = 0(2)
Lúc này dung dịch Z chứa :
Na+ (b mol) ; NO3- (2a mol) => nOH = (b – 2a) mol (Bảo toàn điện tích)
=> mchất tan = 90a + 40b = a1
B2 : Xác định thành phần các chất trong dung dịch sau khi trộn thêm FeCl2 và HCl
Từ đó Tìm ra số mol các chất ban đầu.
Thêm vào Z : Fe2+ (0,1 mol) ; H+ (0,2 mol) ; Cl- (0,4 mol)
Sau trung hòa thì : nH+ dư = 0,2 + 2a – b
Do mCu(NO3)2> 5g => nNO3 = 2a > 0,053 trong khi nFe2+= 0,1 mol
=> nNO3 sẽ dư.
+) TH1 : Nếu H+ hết => nNO = ¼ nH+ = (0,2 + 2a – b)/4
=> nNO3 dư = 2a – (0,2 + 2a – b)/4 = 1,5a + 0,25b – 0,05
mchất tan = mNa+ + mNO3 dư + mFe3+ + mCl-
=> 23b + 62.(1,5a + 0,25b – 0,05) + 0,1.56 + 0,4.35,5 = 90a + 40b + 16,46(3)
Từ (1,2,3) => x = 0,07 ; a = 0,12 ; b = 0,4
=> m = 45,96g (Đáp án D)
+) TH2 : Nếu H+ dư => nNO = 1/3.nFe2+ = 0,1/3 mol
=> nH+ dư = (0,2 + 2a – b) – 4nNO = (1/15 + 2a – b) mol ; nNO3- dư = (2a – 1/30)
=> mchất tan = mNa+ + mNO3- + mH+ + mFe3+ + mCl-
=> 23b + 62.(2a – 1/30) + 1.(1/15 + 2a – b) + 0,1.56 + 0,4.35,5 = 90a + 40b + 16,46
=> x = 0,043 ; a = 0,127 ; b = 0,329
=> nH+ dư = 1/15 + 2a – b < 0 => Loại
Đáp án D
Câu hỏi 16 :
Tiến hành điện phân dung dịch chứa 43,24 gam hỗn hợp gồm MSO4 và NaCl bằng điện cực trơ màng ngăn xốp với cường độ dòng điện không đổi. sau thời gian t giây thì nước bắt đầu điện phân ở cả 2 điện cực, thấy khối lượng catot tăng so với ban đầu, đồng thời anot thoát ra một khí duy nhất có thể tích là 4,48 lit (dktc). Nếu thời gian điện phân là 2t giây thì khối lượng dung dịch giảm 25,496g. Kim loại M là :
- A Ni
- B Cu
- C Fe
- D Zn
Đáp án: A
Phương pháp giải:
Phương pháp : Bảo toàn e trong bài toán điện phân
Lời giải chi tiết:
Lời giải :
Khi điện phân t (s)
43,24 = (M + 96).x + 58,5.y(1)
Catot(-) : M2+ + 2e -> M
Mol x -> 2x
2H2O + 2e -> H2 + 2OH-
Mol (0,4 – 2x)
Anot(+) : 2Cl- -> Cl2 + 2e
ne = 0,4 mol
=> nCl2 = 0,2 mol ; nNaCl = 0,4 mol = y
=> (M + 96)x = 19,84(2)
(Vì điện phân chỉ ngừng khi nước bắt đầu điện phân ở cả 2 điện cực, mà ở Anot chỉ có Cl2
=> nước chưa bị điện phân ở anot)
Với 2t (s) => ne = 0,8 mol
Anot : 2H2O + 2e -> O2 + 4H+ + 4e
=> mdd giảm = M.x + 2.(0,2 – x + 0,2) + 0,2.71 + 0,1.32 = 25,496(3)
Từ (2,3) => x = 0,128 ; M = 59 (Ni)
Đáp án A
Câu hỏi 17 :
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và NaCl (hiệu suất 100%, điện cực trơ, màng ngăn xốp) đến khi nước bắt đầu điện phân ở cả 2 điện cực thì ngừng điện phân, thu được dung dịch X và 3,36 lit khí (dktc) ở anot. Dung dịch X hòa tan tối đa 10,2g Al2O3. Giá trị của m là :
- A 25,55
- B 25,20
- C 11,75
- D 12,80
Đáp án: A
Phương pháp giải:
Phương pháp : Bảo toàn electron trong bài toán điện phân
Lời giải chi tiết:
Lời giải :
nAl2O3 = 0,1 ; nkhí = 0,15
Dung dịch X hòa tan được Al2O3 => X có môi trường axit hoặc bazo
(*)TH1 : Dung dịch X có môi trường axit
Catot (-) : Cu2+ + 2e -> Cu
Anot (+) : 2Cl- -> Cl2 + 2e
2H2O -> O2 + 4H+ + 4e
Al2O3 + 6H+ -> 2Al3+ + 3H2O
=> nO2 = ¼ nH+= ¼ . 6nAl2O3 = 0,15 mol = nkhí. Tức là Cl- chưa tham gia phản ứng điện phân (Loại)
(*)TH2 : Dung dịch X có môi trường bazo
Catot (-) : Cu2+ + 2e -> Cu
2H2O + 2e -> 2OH- + H2
Anot (+) : 2Cl- -> Cl2 + 2e
Al2O3 + 2OH- -> 2AlO2- + H2O
=> nOH = 2nAl2O3 = 0,2 mol
nCl2 = 0,15 mol => Bảo toàn e : 2nCu + nOH = 2nCl2 => nCu = 0,05 mol
=> nNaCl = nCl = 0,3 mol ; nCuSO4 = nCu2+ = 0,05 mol
=> m = 25,55g
Đáp án A
Câu hỏi 18 :
Hòa tan hoàn toàn hỗn hợp rắn gồm Fe3O4 (1,2x mol) và Cu ( x mol) vào dung dịch HCl ( vừa đủ), kết thúc phản ứng chỉ thu được dung dịch X. Thêm dung dịch chứa 7,6 gam MgCl2 vào X, được dung dịch Y. Điện phân dung dịch Y đến khi nước bắt đầu điện phân ở anot thì ngừng điện phân, khi đó khối lượng dung dịch Y giảm 71,12 gam. Khối lượng muối khan thu được khi cô cạn dung dịch Y là
- A 54,80 gam.
- B 60,64 gam.
- C 73,92 gam.
- D 68,24 gam.
Đáp án: D
Phương pháp giải:
Viết phương trình các bán phản ứng tại anot, catot. Bảo toàn electron.
Khối lượng dung dịch giảm ∆= m↓ + m↑
Lời giải chi tiết:
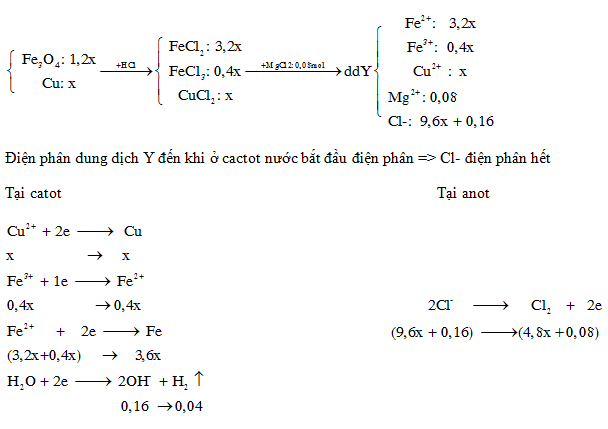
nOH- = 2nMg(OH)2 = 2.0,08 = 0,16 (mol)
Khối lượng dung dịch giảm :
∆ = m↓ + m↑ = mCu + mFe + mMg(OH)2 + mCl2 +mH2
<=> 71,12 = 64x + 56.3,6x + 0,08.58 + (9,6x + 0,08).35,5 + 0,04.2
=> x = 0,1 (mol)
mY = mkl + mCl-
= 64. 0,1 + 56.3,6.0,1 + 0,08.24 + (9,6.0,1 + 0,16).35,5
=68, 24(g)
Đáp án D
Câu hỏi 19 :
Hoà tan 4,5 gam tinh thể MSO4.5H2O vào nước được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện 1,93A. Nếu thời gian điện phân là t (s) thì thu được kim loại M ở catot và 156,8ml khí ở anot. Nếu thời gian điện phân là 2t (s) thì thu được 537 ml khí. Biết thể tích khí đo ở đktc. Kim loại M và thời gian t lần lượt là:
- A Ni và 1400s.
- B Ni và 2800s.
- C Cu và 1400s.
- D Cu và 2800s.
Đáp án: C
Câu hỏi 20 :
Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và NaCl ( tỉ lệ mol tương ứng 1: 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2,68A. Sau thời gian điện phân t (giờ), thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Dung dịch Y phản ứng vừa hết với 2,55 gam Al2O3. Giá trị của t gần nhất với giá trị nào sau đây?
- A 4.
- B 5.
- C 6.
- D 3,5.
Đáp án: D
Phương pháp giải:
ne=It/F
Lời giải chi tiết:
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al2O3+2OH- → 2AlO2-+H2O
=>nOH-=2nAl2O3=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm=64a+71a+71.0,5a+2.0,5a=8,575 gam<10,375
=> H2O bị điện phân: mH2O=10,375-8,575=1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne=0,075.2+0,05.4=0,35 mol=>t=ne.96500/I=0,35.96500/2,68=12602,6 giây=3,5 giờ.
Đáp án D.
Câu hỏi 21 :
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với cường độ dòng điện 1,34A.Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 1,68 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước. Giá trị của t là
- A 7.
- B 6.
- C 5.
- D 4.
Đáp án: A
Phương pháp giải:
+ Bảo toàn electron
+ Viết các quá trình điện phân
+ m giảm = m↓ + m↑
Lời giải chi tiết:
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al + OH-→AlO2-+ 1,5H2
=>nOH-=nH2/1,5=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O= 10,375-8,575 = 1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne= 0,075.2 + 0,05.4 = 0,35 mol=> t = ne.96500/I=0,35.96500/1,34=25205,2 giây = 7 giờ.
Đáp án A
Câu hỏi 22 :
Điện phân dung dịch muối MSO4 (M là kim loại) với điện cực trơ cường độ dòng điện không đổi. Sau thời gian t giây thu được a mol khí ở anot. Nếu thời gian điện phân là 2t giây thì tống số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%. Khí sinh ra không tan trong nước. Phát biều nào sau đây sai?
- A Tại thời điểm t giây, ion M2+ chưa bị điện phân hết
- B Khi thu được 1,8a mol khí ở anot thì vẫn chưa xuất hiện bọt khí ở catot
- C Dung dịch sau điện phân có pH <7
- D Tại thời điểm 2t giây, có bọt khí ở catot
Đáp án: B
Lời giải chi tiết:
+ t giây
Catot: Mn+ +ne → M
4a
Anot: H2O -2e → 0,5O2 + 2H+
4a a
+ 2t giây
Catot:
Mn+ +ne → M
7a 7a
H2O + 1e → 0,5H2+OH-
a 0,5a
Anot: H2O -2e → 0,5O2 + 2H+
8a 2a
Đáp án B
Câu hỏi 23 :
Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau phản ứng xảy ra hoàn toàn thu được 0,336g hỗn hợp kim loại; 0,112 lit hỗn hợp khí Z(dktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04g muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lit khí H2 (dktc). Giá trị của t là :
- A 2267,75
- B 2895,10
- C 2316,00
- D 2219,40
Đáp án: C
Phương pháp giải:
Phương pháp :
- Bảo toàn e
- Định luật Faraday : ne.F = It
Lời giải chi tiết:
Hướng dẫn giải :
Khi điện phân AgNO3 :
Catot : Ag+ + 1e -> Ag
Anot : 2H2O -> 4H+ + 4e + O2
- Mg + X thu được hỗn hợp kim loại => Ag+ dư
- Hỗn hợp kim loại + HCl => nMg = nH2 = 0,005 mol => nAg = 0,002 mol
Hỗn hợp khí là sản phẩm khử của Mg với H+ và NO3- (Mg dư)
nNO + nN2O = 0,005 mol
mNO + mN2O = 2.19,2.0,005 = 0,192g
=> nNO = 0,002 ; nN2O = 0,003 mol
Gọi nNH4NO3 = x mol
Bảo toàn e : nMg(NO3)2 = nMg + HNO3 + nMg + Ag+ = ½ (3nNO + 8nN2O + 8nNH4NO3) + ½ nAg
= ½ (3.0,002 + 8.0,003 + 8x) + ½ .0,002 = 0,016 + 4x
=> mmuối = mMg(NO3)2 + mNH4NO3 = 148(0,016 + 4x) + 80x = 3,04g
=> x = 0,001 mol
=> nH+(X) = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol = ne
Định luật Faraday : ne.F = It => t = 2316 (s)
Đáp án C
Câu hỏi 24 :
Cho hai bình điện phân, bình (1) đựng 20 ml dung dịch NaOH 1,73 M; bình (2) đựng dung dịch gồm 0,225 mol Cu(NO3)2 và 0,2 mol HCl. Mắc nối tiếp bình (1) và Bình (2). Điện phân các dung dịch bằng dòng điện một chiều với cường độ dòng điện không đổi một thời gian. Khi dừng điện phân, tháo ngay catot ở các bình. Sau phản ứng thấy nồng độ NaOH ở bình (1) là 2M, Cho tiếp 14 gam bột Fe vào bình (2) đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất N+5. Giá trị m là:
- A 9,8
- B 10,4
- C
8,3
- D
9,4
Đáp án: C
Lời giải chi tiết:
+ Bình 1: nNaOH=0,0346 mol
Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
=> CM=0,0346/[(20-18x)/1000] = 2
=> x=0,15
=> ne = 2x = 0,3
Bình 2:
Tại catot:
Cu2+ +2e → Cu
0,15.....0,3
Cu2+ dư 0,225-0,15=0,075 mol
Tại anot:
Cl- -1e → 0,5 Cl2
0,2→0,2
H2O – 2e → 0,5O2 + 2H+
0,1 → 0,1
Dung dịch trong bình 2 sau điện phân gồm: 0,075 mol Cu2+; H+: 0,2+0,1=0,3 mol
Khi cho 0,25 mol Fe vào:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ: 0,25 0,3 0,45
Pư: 0,1125← 0,3 →0,075
Sau: 0,1375
Fe + Cu2+ → Fe2+ + Cu
Bđ:0,1375 0,075
Pư:0,075 ← 0,075 →0,075
Sau:0,0625 0,075
=> m chất rắn = 0,0625.56+0,075.64=8,3 gam
Đáp án C
Câu hỏi 25 :
Hòa tan hết 27,2 gam hỗn hợp rắn X gồm Fe3O4, Fe2O3 và Cu trong dung dịch chứa 0,9 mol HCl (dung dư) thu được dung dịch y có chứa 13,0 gam FeCl3 . Tiến hành điện phân dung dịch Y bằng điện cực trơ đến khi catot bắt đầu có khí thoát ra thì dừng điện phân thấy khối lượng dưng dịch giảm 13,64 gam. Cho dung dịch AgNO3 dư vào dung dịch sau điện phân , kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất) đồng thời thu được m gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây
- A 116,31
- B 118,64
- C 117,39
- D 116,85
Đáp án: D
Phương pháp giải:
- Viết các bán phản ứng xảy ra quá trình điện phân tại catot và anot
- Bảo toàn khối lượng, bảo toàn nguyên tố
- Viết phương trình ion rút gọn
Lời giải chi tiết:
nFe3+ = 0,08 (mol); H+ còn dư
Dd Y gồm: FeCl3 , FeCl2, CuCl2, HCl dư
Qúa trình điện phân dd Y
Catôt (Fe3+, Fe2+, Cu2+, H+) Anốt (Cl-)
Fe3+ +1e → Fe2+ 2Cl- + 2e → Cl2
0,08 → 0,08
Cu 2+ + 2e → Cu
x → 2x
2H+ + 2e → H2
Khi catốt có khí thì ngừng => chưa xảy ra phản ứng điện phân H+
Gọi nCuCl2 = x (mol)
=> ne trao đổi = 0,08 + 2x = 2nCl2
mdd giảm = mCu + mCl2 = 64x + 71( 0,04 + x) = 13,64
=> x = 0,08 (mol)
Gọi số mol Fe3O4 và Fe2O3 lần lượt là a và b mol
BTKL: 232a + 160b + 0,08.64 = 27,2 (1)
2Fe3+ + Cu → Fe2+ + Cu2+
=> nFe3+ sau = nFe3+ ban đầu – nCu
<=> 2a + 2b – 2.0,08 = 0,08 (2)
Từ (1) và (2) => a = 0,04 ; b = 0,08 mol
BTNT Fe: nFe2+ = nFe bđ – nFe3+ sau = 0,2 mol
nH+ dư = nHCl dư = nHCl bđ – 3nFeCl3 – 2nFeCl2 – 2nCuCl2 = 0,1 mol
Sau điện phân thì nFe2+ = 0,28 (mol); nCl- = 0,66 (mol); nH+ = 0,1 (mol)
Khi cho AgNO3 vào:
3Fe2+ + 4H+ + NO3- →3Fe3+ + NO + H2O
0,075← 0,1
Ag+ + Fe2+ → Fe3+ + Ag↓
(0,28 – 0,075)→ 0,205
Ag+ + Cl- → AgCl↓
0,66 → 0,66
m↓ = mAg + mAgCl = 0,205.108 + 0,66.143,5 = 116,85(g)
Đáp án D
Câu hỏi 26 :
Điện phân dung dịch AgNO3 với điện cực trơ, sau một thời gian thu được dung dịch X chứa 2 chất tan có cùng nồng độ (mol/lít), và thấy khối lượng dung dịch giảm đi 9,28 gam so với ban đầu. Cho tiếp 2,8 gam bột Fe vào dung dịch X, thu được dung dịch Y và chất rắn Z và khí NO ( sản phẩm khử duy nhất của N5+). Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối trong dung dịch Y là:
- A 11,48.
- B 15,08.
- C 10,24.
- D 13,64
Đáp án: A
Phương pháp giải:
B1: Viết phương trình phản ứng điện phân: : 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
+ mdd giảm = m↓ + m↑ => tính được nAgNO3 bị điện phân => tính được nAgNO3 dư = nHNO3
B2: Viết thứ tự xảy ra các PTHH khi cho Fe vào dd X
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O
Fe + 2Ag+ → Fe2+ + 2Ag↓
Ag+ + Fe2+ → Fe3+ + Ag↓
+ Bảo toàn nguyên tố Fe, N
Lời giải chi tiết:
PTHH: 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
x → x → 0,25x → x
Gọi nAgNO3 bị điện phân là x (mol)
Ta có: mdd giảm = mAg + mO2
=> 108x + 0,25x. 32 = 9,28
=> x = 0,08 (mol)
Theo đề bài dd X là AgNO3 và HNO3 có nồng độ mol/l bằng nhau => nAgNO3 dư = nHNO3 = 0,08 (mol)
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O (1)
PƯ 0,02 ←0,08→0,02→ 0,02
Dư 0,03 0,14
Fe + 2Ag+ → Fe2+ + 2Ag↓ (2)
Pư 0,03 → 0,06 → 0,03
Dư 0,02
Ag+ + Fe2+ → Fe3+ + Ag↓ (3)
Pư 0,02 → 0,02→ 0,02
Sau phản ứng (1), (2) (3) => nFe2+ = nFe2+ (2) – nFe2+ (3) = 0,03- 0,02 = 0,01 (mol)
nFe3+ = nFe3+ (1) + nFe3+ (3) = 0,02 + 0,02 = 0,04 (mol)
Vậy dd Y gồm : Fe(NO3)2: 0,01 mol; Fe(NO3)3: 0,04 (mol)
=> m= 0,01. 180 + 0,04. 242 = 11,48 (g)
Đáp án A
Câu hỏi 27 :
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và NaCl (hiệu suất 100%, điện cực trơ, màng ngăn xốp), đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân, thu được dung dịch X ( biết dung dịch X làm phenolphtalein hóa hồng) và 8,96 lít khí (đktc) ở anot. Dung dịch X hòa tan tối đa 20,4 gam Al2O3. Giá trị của mlà:
- A 123,7
- B 51,1
- C 78,8
- D 67,1
Đáp án: C
Lời giải chi tiết:
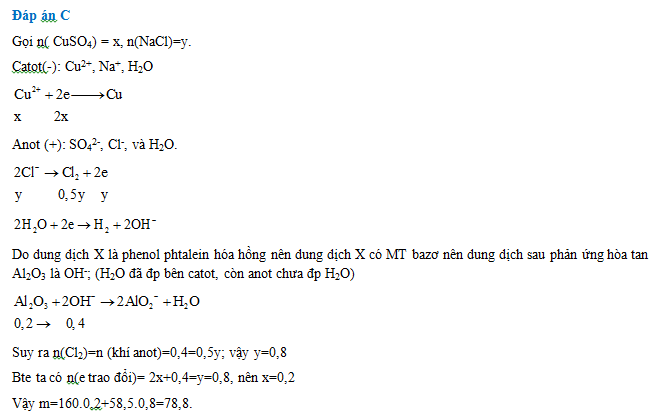
Câu hỏi 28 :
Tiến hành điện phân (với điện cực trơ, hiệu suất 100%, dòng điện có cường độ không đổi), với dung dịch X gồm 0,4 mol CuSO4 và 0,25 mol NaCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 17,625g so với khối lượng dung dịch X. Cho 18g bột sắt Fe vào Y đến khi kết thức các phản ứng thu được m gam chất rắn. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước. Giá trị m là:
- A 14,52
- B 19,56
- C 21,76
- D 16,96
Đáp án: B
Phương pháp giải:
+Lập luận => Cu2+ dư; H2O bị điện phân ở anot
+Viết phương trình điện phân dưới dạng bán phản ứng
+Đặt ẩn dựa vào m dung dịch giảm và số mol e trao đổi ở catot và anot như nhau lập hệ và giải hệ
Lời giải chi tiết:
Do cho Fe vào X thu được chất rắn => Y có Cu2+ dư tức là Cu2+ chưa bị điện phân hết
Do 0,125.71+0,125.64=16,876<17,625=> Cl- bị điện phân hết, H2O bị điện phân ở anot
Catot: Cu2+ +2e→ Cu
x 2x x
Anot: Cl- -1e→ 0,5Cl2
0,25 0,25 0,125
H2O -2e→ 0,5O2 + 2H+
4y y 4y
+ m dd giảm=mCu+mCl2+mO2=>64x+0,125.71+32y=17,625
+ n e trao đổi=>2x=0,25+4y
=>x=0,135; y=0,005
Vậy Y gồm: Cu2+ dư (0,4-0,135=0,265 mol); H+ (0,02 mol)
nFe>nCu2++2nH+ => Fe dư
Fe +2H+→ Fe2+ + H2
0,01← 0,02
Fe +Cu2+→ Fe2+ + Cu
0,265←0,265 0,265
m chất rắn=mCu+mFe dư=0,265.64+18-0,275.56=19,56 gam
Đáp án B
Câu hỏi 29 :
Điện phân dung dịch hỗn hợp CuSO4 0,05 mol và NaCl bằng dòng điện có cường độ không đổi 2A (điện cực trơ, màng ngăn xốp). Sau thời gian t giây thì ngừng điện phân, thu được dung dịch Y và khí ở hai điện cực có tổng thể tích là 2,24 lít (đktc). Dung dịch Y hòa tan tối đa 0,8g MgO. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là:
- A 6755
- B 772
- C 8685
- D 4825
Đáp án: C
Phương pháp giải:
Dung dịch Y hòa tan tối đa 0,8g MgO ⟹ dung dịch Y có môi trường H+
Khi ngừng điện phân thu được khí ở cả 2 điện cực ⟹ chứng tỏ Cu2+ điện phân hết, có sự điện phân của H2O ở cả hai điện cực
Sử dụng bảo toàn điện tích với dd Y
Sử dụng bảo toàn e
Lời giải chi tiết:
nhh khí = 0,1 mol ; nMgO = 0,02 mol
Dung dịch Y hòa tan tối đa 0,8g MgO ⟹ dung dịch Y có môi trường H+
Khi ngừng điện phân thu được khí ở cả 2 điện cực ⟹ chứng tỏ Cu2+ điện phân hết, có sự điện phân của H2O ở cả hai điện cực
Thứ tự điện phân:
Catot (-) : Cu2+ , Na+, H2O Anot (+) : Cl-, SO42-, H2O
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
2H2O + 2e → H2 + 2OH- 2H2O → O2 + 4H+ + 4e
Xét dd Y thu được gồm: H+ dư, SO42-: 0,05 (mol) và Na+.
Cho dd Y pư với MgO chỉ có H+ tham gia phản ứng:
MgO + 2Hdư+ → Mg2+ + H2O (1)
0,02 → 0,04
Theo (1): nH+ dư = 2nMgO = 2.0,02 = 0,04 (mol)
Bảo toàn điện tích với các chất trong dd Y ta có: nNa+ + nH+ dư = 2nSO42- ⟹ nNa+ = 2.0,05 – 0,04 = 0,06 (mol)
BTNT Na: nNaCl = nNa+ = 0,06 (mol) ⟹ nCl- = nNaCl = 0,06 (mol) ⟹ nCl2 = 1/2nCl- = 0,06/2 = 0,03 (mol)
Catot: Đặt nH2 = x (mol);
Anot: nCl2 = 0,03 (mol); đặt nO2 = y (mol)
∑nhh khí = 0,1 mol → nH2 + nCl2 + nO2 = 0,1 ⟹ x + 0,03 + y = 0,1 ⟹ x + y = 0,07 (I)
Theo ĐLBT e: ∑ne (catot nhận) = ∑ne (anot nhường)
⟹ 2nCu + 2nH2 = 2nCl2 + 4nO2
⟹ 2.0,05 + 2x = 2.0,03 + 4z
⟹ x – 2z = - 0,02 (II)
Giải hệ (I) và (II) ta được x = 0,04 và y = 0,03
⟹ số mol e trao đổi = 2nCu2+ + 2nH2 = 2.0,05 + 2.0,04 = 0,18 (mol)
Mặt khác: ne trao đổi = \(\frac{{It}}{F} \to t = \frac{{0,18.96500}}{2} = 8685\,\,s\)
Đáp án C
Câu hỏi 30 :
Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi). Trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của a là:
- A 0,15
- B 0,24
- C 0,26
- D 0,18
Đáp án: A
Phương pháp giải:
Trong thời gian t giây, nkhí anot = 0,11 mol; trong thời gian 2t giây, nkhí ở 2 cực = 0,26 mol
Catot (-) : Cu2+ , K+, H2O Anot (+) : Cl-, SO42-, H2O
Xét trong thời gian t giây
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,2→ 0,1 0,2
Khi điện phân hết ion Cl- chỉ thu được 0,1 mol khí ở anot => H2O tiếp tục điện phân
H2O →1/2 O2 + 2 H+ + 2e
0,01→ 0,04
→ số mol e nhường trong thời gian t giây = 0,2 + 0,04 = 0,24 mol
→ số mol e nhường trong thời gian 2t giây = 0,24. 2 = 0,48 mol
Xét trong thời gian 2t giây
Khí thu được ở cả 2 điện cực = 0,26 mol, chứng tỏ bên cực catot có sự điện phân của H2O
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
a mol→ 2a 0,2 → 0,1 0,2
2H2O + 2e → H2 + 2OH- H2O →1/2 O2 + 2 H+ + 2e
0,18 ←0,09 x → 4x
ne nhường = 0,2 + 4x = 0,48 → x → nH2
=>a
Lời giải chi tiết:
Trong thời gian t giây, nkhí anot = 0,11 mol; trong thời gian 2t giây, nkhí ở 2 cực = 0,26 mol
Catot (-) : Cu2+ , K+, H2O Anot (+) : Cl-, SO42-, H2O
Xét trong thời gian t giây
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,2→ 0,1 0,2
Khi điện phân hết ion Cl- chỉ thu được 0,1 mol khí ở anot => H2O tiếp tục điện phân
H2O → 1/2 O2 + 2 H+ + 2e
0,01→ 0,04
→ số mol e trao đổi trong thời gian t giây = 0,2 + 0,04 = 0,24 mol
→ số mol e trao đổi trong thời gian 2t giây = 0,24. 2 = 0,48 mol
Xét trong thời gian 2t giây
Khí thu được ở cả 2 điện cực = 0,26 mol, chứng tỏ bên cực catot có sự điện phân của H2O
nCl2 = 0,1 mol
nO2 = (ne - 2nCl2)/4 = (0,48 - 2.0,1)/4 = 0,07 mol
nH2 = 0,26 - nCl2 - nO2 = 0,26 - 0,1 - 0,07 = 0,09 mol
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
a → 2a 0,2 → 0,1 0,2
2H2O + 2e → H2 + 2OH- H2O → 1/2 O2 + 2 H+ + 2e
0,18 ← 0,09 0,07 ← (0,48 - 0,2)
→ ne(catot) = 2a + 0,18 = 0,48 → a = 0,15 mol
Đáp án A
Câu hỏi 31 :
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và NaCl ( hiệu suất 100%), điện cực trơ, màng ngăn xốp), đến khi nước bắt đầu điện phân ở hai điện cực thì ngừng điện phân, thu dược dung dịch X và 6,72 lít khí ( đktc) ở anot. Dung dịch X hòa tan tối đa 20,4 gam Al2O3. Giá trị của m là
- A 25,6.
- B 50,4.
- C 51,1.
- D 23,5.
Đáp án: C
Phương pháp giải:
Xét 2 TH sau, viết quá trình điện phân ở từng trường hợp:
+ TH1: Cl- bị đp hết trước Cu2+, H2O ở anot bị điện phân
+ TH2: Cu2+ bị điện phân hết trước Cl-, H2O ở catot bị điện phân sinh ra OH-
Lời giải chi tiết:
TH1: Cl- bị đp hết trước Cu2+, H2O ở anot bị điện phân
Al2O3+6H+→2Al3++3H2O
0,2.…1,2
Catot:
Cu2+ + 2e → Cu
Anot:
Cl- -1e → 0,5Cl2
H2O - 2e→0,5O2 + 2H+
0,3 1,2
Ta thấy nO2=0,3 => nCl2 = 0 (vô lí)
TH2: Cu2+ bị điện phân hết trước Cl-, H2O ở catot bị điện phân sinh ra OH-
Al2O3+2OH-→2AlO2-+H2O
0,2…….0,4
Catot:
Cu2+ +2e→Cu
x 2x
H2O+1e→OH-+0,5H2
0,4 0,4
Anot:
Cl- -1e → 0,5Cl2
0,6...0,3
=>2x+0,4=0,6=>x=0,1 mol
=>nCuSO4=0,1 mol; nNaCl=0,6 mol
=>m=0,1.160+0,6.58,5=51,1 gam
Đáp án C
Câu hỏi 32 :
Tiến hành điện phân dung dịch chứa Cu(NO3)2 1,2M và NaCl 0,8M bằng điện cực trơ đến khi khối lượng dung dịch giảm 10,2g thì dừng điện phân. Cho 0,2 mol bột Fe vào dung dịch sau điện phân, kết thúc phản ứng thấy thoát ra 0,672 lit khí NO (sản phẩm khử duy nhất, dktc) và còn lại m gam chất rắn không tan. Giá trị của m là :
- A 8,84g
- B 7,56g
- C 25,92g
- D 5,44g
Đáp án: A
Phương pháp giải:
Phương pháp : Bảo toàn electron
Lời giải chi tiết:
Lời giải :
nCu2+ = 1,2a ; nCl = 0,8a
nNO = 0,03 mol => nH+ = nHNO3 = 0,12 mol
nFe = 0,2 mol
Cu(NO3)2 + 2NaCl -> Cu + Cl2 + 2NaNO3
0,4a 0,8a 0,4a 0,4a
Cu(NO3)2 + H2O -> Cu + 0,5O2 + 2HNO3
0,06 0,06 0,03 0,12
mgiảm = 64(0,4a + 0,06) + 71.0,4a + 32.0,03 = 10,2
=> a = 0,1
=> nCu2+ dư = 1,2a – 0,4a – 0,06 = 0,02 mol
Bảo toàn electron : 2nFe = 3nNO (Vì lượng Fe quá lớn so với NO sinh ra => Fe chỉ tạo Fe2+)
=> nFe pứ = 0,045 mol
Fe + Cu2+ -> Fe2+ + Cu
0,02 0,02 -> 0,02
=> chất rắn gồm : 0,135 mol Fe và 0,02 mol Cu
=> mrắn = 8,84g
Đáp án A
Câu hỏi 33 :
Hòa tan hoàn toàn hỗn hợp rắn gồm Fe3O4 (1,4x mol) và Cu (x mol) vào dung dịch HCl (vừa đủ), kết thúc phản ứng chỉ thu được dung dịch X. Thêm dung dịch chứa 5,7g MgCl2 vào X, được dung dịch Y. Điện phân dung dịch Y đến khi nước bắt đầu điện phân ở anot thì ngừng điện phân, khi đó khối lượng dung dịch Y giảm 77,54g. Khối lượng muối khan thu được khi cô cạn dung dịch Y là :
- A 78,98g
- B 71,84g
- C 78,86g
- D 75,38g
Đáp án: C
Phương pháp giải:
Phương pháp : Bảo toàn e
Lời giải chi tiết:
Fe3O4 + 8HCl -> FeCl2 + 2FeCl3 + 4H2O
1,4x -> 1,4x -> 2,8x
Cu + 2FeCl3 -> CuCl2 + 2FeCl2
x -> 2x
Y gồm : 0,06 mol MgCl2 ; x mol CuCl2 ; 3,4x mol FeCl2 ; 0,8x mol FeCl3
Điện phân đến khi anot xuất hiện khí :
Catot : 0,06 mol Mg2+ ; x mol Cu2+ ; 3,4x mol Fe2+ ; 0,8x mol Fe3+
Anot : (0,12 + 11,2x) mol Cl-
(Mg2+ không bị điện phân)
Vậy Catot : 2H2O + 2e -> H2 + 2OH-
Mol 0,12-> 0,06
mgiảm = mCu + mFe+ mH2 + mCl2
mmuối = mgiảm – mH2 + mMg (Vì bảo toàn e, số mol e H2 nhận đúng bằng số mol điện tích Mg2+ )
=> mmuối khan Y = 77,54 - 0,06.2 + 0,06.24 = 78,86g
Đáp án C
Câu hỏi 34 :
Hòa tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t (giây) được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t (giây) thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là:
- A 1,680
- B 4,788
- C 4,480
- D 3,920
Đáp án: C
Phương pháp giải:
Tại anot, trong t giây thu được nO2 = 0,035
=> Trong 2t giây thu được nO2 = 0,07
=> nH2
Bảo toàn electron trong 2t giây:
2nM + 2nH2 = 4nO2 => nM => M
Lời giải chi tiết:
Tại anot, trong t giây thu được nO2 = 0,035
=> Trong 2t giây thu được nO2 = 0,07
=> nH2 = 0,1245 - 0,07 = 0,0545 mol
Bảo toàn electron trong 2t giây:
2nM + 2nH2 = 4nO2 => nM = 0,0855
=>M+ 96 = 13,68/0,0855
=> M = 64: Cu
Bảo toàn electron trong t giây:
2nCu = 4nO2 => nCu = 0,07 => mCu = y = 4,48
Đáp án C
Câu hỏi 35 :
Điện phân dung dịch gồm 28,08 gam NaCl và m gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm 51,60 gam thì ngừng điện phân thu được dung dịch X. Cho thanh sắt vào X, sau khi các phản ứng kết thúc thấy khối lượng thanh sắt giảm 6,24 gam và thu được khí NO (sản phẩm khử). Giá trị của m gần nhất với giá trị nào sau đây?
- A 170
- B 180
- C 190
- D 160
Đáp án: B
Phương pháp giải:
Do khi cho Fe vào dung dịch X thì thấy thoát ra khí NO là sản phẩm khử duy nhất nên H2O đã bị điện phân ở anot.
Viết phương trình điện phân ở 2 cực.
Tính toán theo bán phản ứng.
Lời giải chi tiết:
nNaCl = 0,48 mol
Do khi cho Fe vào dung dịch X thì thấy thoát ra khí NO là sản phẩm khử duy nhất nên H2O đã bị điện phân ở anot.
Catot:
Cu2+ +2e → Cu
x…….2x……x
Anot:
Cl- -1e → 0,5Cl2
0,48…0,48…0,24
2H2O - 4e → O2 + 4H+
4y…..y…..4y
n e trao đổi = 2x = 0,48 + 4y (1)
m dung dịch giảm = mCu + mCl2 + mO2 => 64x + 71.0,24 + 32y = 51,6 (2)
Giải (1) và (2) => x = 0,48; y = 0,12
=> nH+ = 0,48 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,18 ← 0,48
Fe + Cu2+ → Fe2+ + Cu
z z z
Khối lượng thanh sắt giảm: (z+0,18).56 – 64z = 6,24 => z = 0,48 mol
=> nCu(NO3)2 ban đầu = x + z = 0,48 + 0,48 = 0,96 mol
=> m = 0,96.188 = 180,48 gam
Đáp án B
Câu hỏi 36 :
Tiến hành điện phân dung dịch chứa NaCl và 0,15 mol Cu(NO3)2 bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A trong thời gian 6176 giây thì dừng điện phân, thấy khối lượng dung dịch giảm 14,93 gam. Dung dịch sau điện phân hòa tan tối đa m gam bột Fe, phản ứng tạo khí NO (sản phẩm khử duy nhất của N+5). Giá trị m là
- A 3,08 gam
- B 4,20 gam
- C 3,36 gam
- D 4,62 gam
Đáp án: B
Phương pháp giải:
Tính n e trao đổi = It/F
Cho Fe tác dụng với dung dịch sau đp thấy thoát ra khí NO => Có H+ => Nước bị điện phân ở anot
Viết PT đp ở mỗi cực, đặt mol vào tính (nNaCl = x mol)
m dd giảm = mCu + mH2 + mCl2 + mO2 => x
=> Thành phần thu được dung dịch sau đp
Chú ý: Hòa tan tối đa Fe nên sẽ tạo Fe2+
Lời giải chi tiết:

Câu hỏi 37 :
Dung dịch X chứa m gam chất tan gồm Cu(NO3)2 và NaCl, trong đó khối lượng của Cu(NO3)2 lớn hơn 5g. Điện phân dung dịch X với cường độ dòng điện không đổi. Sau thời gian t giây thì thu được dung dịch Y chứa (m – 18,79)g chất tan và có khí thoát ra ở catot. Nếu thời gian điện phân là 2t giây thì dung dịch Z chứa a1 gam chất tan và hỗn hợp khí T gồm 3 khí có tỉ khối so với H2 là 16. Cho Z vào dung dịch chứa 0,1 mol FeCl2 và 0,2 mol HCl thì thu được dung dịch chứa (a1 + 16,46)g chất tan và có khí thoát ra. Giá trị của m là :
- A 26,8
- B 16,6
- C 72,76
- D 45,96
Đáp án: D
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
B1 : Xác định các thành phần trong Z sau khi điện phân
Đặt a, b lần lượt là số mol Cu(NO3)2 và NaCl trong X
+) Trong t giây :
Tại Catot :
Cu2+ + 2e → Cu
2H2O + 2e →2OH- + H2
nCu = a ; nH2 = x (ne = 2nCu + 2nH2)
=> ne = 2a + 2x
Tại Anot :
2Cl- → Cl2 + 2e
=> nCl2 = a + x
(Bảo toàn electron)
+) mgiảm = mH2O – mCu – mH2 – mCl2 = - 18,79
=> 18.2x – 64a – 2x – 71(a + x) = -18,79
=> 37x + 135a = 18,79(1)
+) Trong 2t giây thì : ne = 4a + 4x
Tại Catot :
Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
nCu = a và nH2 = a + 2x (ne = 2nCu + 2nH2)
Tại Anot :
2Cl- →Cl2 + 2e
2H2O → 4H+ + O2 + 4e
nCl2 = 0,5b ; nO2 = a + x – 0,25b (ne = 2nCl2 + 4nO2)
Mkhí = 32 => cũng là MO2 nên H2 và Cl2 có Mtb = 32
=> mH2 + mCl2 = mhh (H2 , Cl2)
=> 2(a + 2x) + 71.0,5b = 32(a + 2x + 0,5b)
=> 60x + 30a – 19,5b = 0(2)
Lúc này dung dịch Z chứa :
Na+ (b mol) ; NO3- (2a mol) => nOH = (b – 2a) mol (Bảo toàn điện tích)
=> mchất tan = 90a + 40b = a1
B2 : Xác định thành phần các chất trong dung dịch sau khi trộn thêm FeCl2 và HCl
Từ đó Tìm ra số mol các chất ban đầu.
Thêm vào Z : Fe2+ (0,1 mol) ; H+ (0,2 mol) ; Cl- (0,4 mol)
Sau trung hòa thì : nH+ dư = 0,2 + 2a – b
Do mCu(NO3)2 > 5g => nNO3 = 2a > 0,053 trong khi nFe2+= 0,1 mol
=> nNO3 sẽ dư.
+) TH1 : Nếu H+ hết => nNO = ¼ nH+ = (0,2 + 2a – b)/4
=> nNO3 dư = 2a – (0,2 + 2a – b)/4 = 1,5a + 0,25b – 0,05
mchất tan = mNa+ + mNO3 dư + mFe3+ + mCl-
=> 23b + 62.(1,5a + 0,25b – 0,05) + 0,1.56 + 0,4.35,5 = 90a + 40b + 16,46(3)
Từ (1,2,3) => x = 0,07 ; a = 0,12 ; b = 0,4
=> m = 45,96g (Đáp án D)
+) TH2 : Nếu H+ dư => nNO = 1/3.nFe2+ = 0,1/3 mol
=> nH+ dư = (0,2 + 2a – b) – 4nNO = (1/15 + 2a – b) mol ; nNO3- dư = (2a – 1/30)
=> mchất tan = mNa+ + mNO3- + mH+ + mFe3+ + mCl-
=> 23b + 62.(2a – 1/30) + 1.(1/15 + 2a – b) + 0,1.56 + 0,4.35,5 = 90a + 40b + 16,46
=> x = 0,043 ; a = 0,127 ; b = 0,329
=> nH+ dư = 1/15 + 2a – b < 0 => Loại
Đáp án D
Câu hỏi 38 :
Hỗn hợp X gồm Na2SO3, CuO, CuCO3,. Hòa tan m gam hỗn hợp X trong dung dịch hỗn hợp HCl 1M và H2SO4 0,5M vừa đủ, thu được dung dịch Y chứa (m+8,475) gam chất tan gồm muối clorua và sunfat trung hòa; 5,6 lít hỗn hợp khí (đktc) có tỉ khối so với hidro là 27,6. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp đến khi lượng Cu2+ còn lại bằng 6% lượng Cu2+ trong dung dịch Y thì dừng lại thu được dung dịch Z. Cho 0,14m gam Fe vào dung dịch Z đến khi phản ứng kết thúc thu được m1 gam chất rắn. Giá trị của m1 là
- A 4,9216.
- B 4,5118.
- C 4,6048.
- D 4,7224.
Đáp án: C
Lời giải chi tiết:
nCuCO3 = nCO2 = 0,11 mol
nNa2SO3 = nSO2 = 0,14 mol
Thể tích dung dịch axit là x lít => nHCl = x và nH2SO4 = 0,5x => nH2O = x
BTKL:36,5x+98.0,5x+m=m+8,475+0,25.55,2+18x => x = 0,33
Dung dịch Y chứa SO42- (0,165), Cl- (0,33), Na+ (0,28) => nCu2+ = 0,19 => nCuO = 0,08
=> m = 37,68 và nFe = 0,0942
nCu2+ bị đp = 0,19.94% = 0,1786
=> n e trao đổi = nCl- + 4nO2 => nO2 = 0,068
=> nH+ = 4nO2 = 0,0272
Fe với dung dịch Z: nFe pư = nCu2+ + nH+/2 = 0,025
=> m1 = mFe dư + mCu = 4,6048 gam
Đáp án C
Câu hỏi 39 :
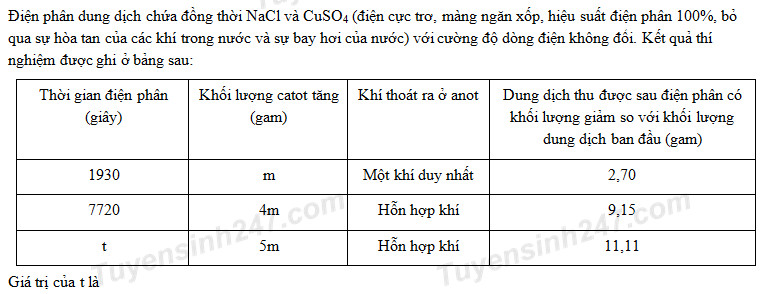
- A 10615.
- B 9650.
- C 11580.
- D 8202,5.
Đáp án: C
Phương pháp giải:
Do từ t2 đến t3 khối lượng catot tăng nên Cu2+ điệp phân chưa hết ở t2
*Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 (1)
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I (2)
Giải (1) và (2) => m; I
*Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x; y
*Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => (3)
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => (4)
Giải (3) và (4) thu được: a; b
=> n e3 => t
Lời giải chi tiết:
Do tại 3 thời điểm khối lượng catot đều tăng nên Cu2+ điệp phân chưa hết ở t1 và t2
*Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 (1)
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I (2)
Giải (1) và (2) => m = 1,28; I = 2
*Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x = 0,1; y = 0,06
*Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => 11,11 = 5.1,28 + 2a + 0,05.71 + 32b (3)
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => 2.0,1 + 2a = 0,05.2 + 4b (4)
Giải (3) và (4) thu được: a = 0,02; b = 0,035
n e3 = 2.0,1 + 2.0,02 = 0,24 mol => t = 0,24.96500/2 = 11580 giây
Đáp án C
Câu hỏi 40 :
Tiến hành điện phân dung dịch chứa x mol Cu(NO3)2 và y mol NaCl bằng điện cực trơ, với cường độ dòng điện không đổi I = 5A trong thời gian 2895 giây thì dừng điện phân, thu được dung dịch X. Cho 0,125 mol bột Fe vào dung dịch X, kết thúc phản ứng, thấy thoát ra 0,504 lít khí NO (sản phẩm khử duy nhất ở đktc); đồng thời còn lại 5,43 gam rắn không tan. Tỉ lệ x : y gần nhất là
- A 1,95.
- B 1,90.
- C 1,75.
- D 1,80.
Đáp án: B
Phương pháp giải:
+ Tính ne = It/F
+ Do khi cho Fe vào dung dịch điện phân sinh ra khí NO nên H2O ở anot đã bị điện phân tạo H+.
Giả sử dung dịch sau phản ứng không có Cu2+
Tính được khối lượng Fe sau phản ứng, giá trị này khác với khối lượng chất rắn thu được nên dung dịch sau điện phân có chứa Cu2+
+ Viết các quá trình điện phân ở 2 cực, đặt ẩn và tính toán.
Lời giải chi tiết:
ne = It/F = 5.2895/96500 = 0,15 mol
Do khi cho Fe vào dung dịch điện phân sinh ra khí NO nên H2O ở anot đã bị điện phân tạo H+.
Giả sử dung dịch sau phản ứng không có Cu2+
nFe = 3nNO/2 = 0,03375 mol => mFe pư = 1,89 gam, chất rắn sau phản ứng có khối lượng là 0,125.56 – 1,89 = 5,11 gam (loại)
Vậy dung dịch sau điện phân có chứa Cu2+
Catot :
Cu2+ +2e → Cu
0,15 0,075 mol
Anot :
Cl- - 1e → 0,5Cl2
y 0,5y
H2O - 2e → 0,5O2 + 2H+
0,09 0,09
3Fe + 8H+ +2NO3- → 3Fe2+ + 2NO + 4H2O
0,03375 0,09 0,0225
Fe + Cu2+ → Fe2+ + Cu
x-0,075 x-0,075 x-0,075
m chất rắn = mCu + mFe dư = 64(x-0,075) + 0,125.56 - 56(0,03375+x-0,0075) = 5,43 => x = 0,115 mol
n e trao đổi (anot) = y+0,09 = 0,15 => y = 0,06
x:y = 1,917
Đáp án B
Tổng hợp 50 bài tập điện phân mức độ vận dụng đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 50 câu hỏi lý thuyết vê điều chế kim loại theo phương pháp thủy luyện và nhiệt luyện đầy đủ các dạng trắc nghiệm, tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 30 câu hỏi lý thuyết về điện phân mức độ vận dụng đầy đủ các dạng trắc nghiệm và tự luận từ dễ đến khó, có đáp án và lời giải chi tiết
Tổng hợp 40 câu hỏi lý thuyết về điện phân đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
Tổng quan 40 câu hỏi lý thuyết mức độ nhận biết về điều chế kim loại đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 40 bài tập vận dụng về khử oxit kim loại bằng (CO, H2, C) đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









