30 câu hỏi lý thuyết về điện phân mức độ vận dụng có lời giải
Làm đề thiCâu hỏi 1 :
Điện phân dung dịch hỗn hợp AgNO3, Cu(NO3)2, Fe(NO3)3. Các chất lần lượt xuất hiện tại catot theo thứ tự
- A H2-Cu-Ag.
- B Cu-Ag-Fe.
- C Ag-Cu-Fe.
- D Ag-Cu-H2.
Đáp án: C
Phương pháp giải:
Khi điện phân, ở catot, ion có tính oxi hóa mạnh hơn bị điện phân trước.
Lời giải chi tiết:
Khi điện phân, ở catot, ion có tính oxi hóa mạnh hơn bị điện phân trước.
Do đó thứ tự điện phân ở catot như sau:
Ag+ + 1e → Ag
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
Các chất lần lượt xuất hiện tại catot theo thứ tự Ag, Cu, Fe.
Đáp án C
Câu hỏi 2 :
Khi điện phân dung dịch X với điện cực trơ thì pH của dung dịch tăng. Dung dịch X là:
- A Dung dịch Na2SO4
- B Dung dịch HCl
- C Dung dịch H2SO4
- D Dung dịch CuSO4
Đáp án: B
Phương pháp giải:
Điện phân X thì pH dung dịch tăng có 2 khả năng:
+) Giảm H+(điện phân H+)
+) Tăng tạo OH- (khi điện phân muối halogen của KLK, KLKT)
Lời giải chi tiết:
Xét các phản ứng điện phân:
A. Na+ và SO42- không bị điện phân nên nước điện phân hộ: H2O → H2 + O2
→ pH không đổi
B. 2H+ + 2Cl- → H2 + Cl2
→ Nồng độ H+ giảm → pH tăng
C. 2H+ + H2O → H2 + 0,5 O2 + 2H+ hay H2O → H2 + O2
→ Nồng độ H+ không đổi → pH không đổi
D. Cu2+ + H2O → Cu + 0,5 O2 + 2H+
→ Nồng độ H+ tăng → pH giảm
Đáp án B
Câu hỏi 3 :
Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ:
- A
ion Cu2+ nhường electron ở anot.
- B
ion Cu2+ nhận electron ở catot.
- C
ion Cl- nhận electron ở anot.
- D
ion Cl- nhường electron ở catot.
Đáp án: B
Phương pháp giải:
Lý thuyết về điện phân.
Lời giải chi tiết:
Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ:
Catot (-): Cu2+ + 2e → Cu
Anot (+): 2Cl- → Cl2 + 2e
Vậy phát biểu đúng là: Ion Cu2+ nhận electron ở catot.
Đáp án B
Câu hỏi 4 :
Trả lời các câu hỏi dưới đây.
Câu 1:
Cho các phương trình điều chế Cu từ CuSO4 sau:
(1) \(2CuS{O_4} + 2{H_2}O\xrightarrow{{dpdd}}2Cu + 2{H_2}S{O_4} + {O_2}\)
(2) \(CuS{O_4} + Ba \to BaS{O_4} + Cu\)
(3) \(CuS{O_4} + Fe \to FeS{O_4} + Cu\)
(4) \(CuS{O_4}\xrightarrow{{dpnc}}Cu + S{O_2} + {O_2}\)
Số phương trình đúng là
- A 1.
- B 2.
- C 3.
- D 4.
Đáp án: B
Phương pháp giải:
Lý thuyết điều chế kim loại.
Lời giải chi tiết:
Phương trình đúng là:
(1) \(2CuS{O_4} + 2{H_2}O\xrightarrow{{dpdd}}2Cu + 2{H_2}S{O_4} + {O_2}\)
(3) \(CuS{O_4} + Fe \to FeS{O_4} + Cu\)
Vậy có 2 phương trình đúng.
Đáp án B
Câu 2:
Sơ đồ điều chế Fe từ FeS nào sau đây không đúng ?
- A \(F{\text{eS}}\xrightarrow{{ + HCl}}F{\text{e}}C{l_2}\xrightarrow{{dpd{\text{d}}}}F{\text{e}}\)
- B \(FeS\xrightarrow{{ + {O_2},{t^o}}}F{{\text{e}}_2}{O_3}\xrightarrow{{ + CO,{t^o}}}F{\text{e}}\)
- C \(FeS\xrightarrow{{ + HCl}}F{\text{e}}C{l_2}\xrightarrow{{ + Cu}}F{\text{e}}\)
- D \(FeS\xrightarrow{{ + {O_2},{t^o}}}F{{\text{e}}_2}{O_3}\xrightarrow{{ + Al,{t^o}}}F{\text{e}}\)
Đáp án: C
Phương pháp giải:
Lý thuyết điều chế kim loại.
Lời giải chi tiết:
Sơ đồ không đúng là:
\(FeS\xrightarrow{{ + HCl}}F{\text{e}}C{l_2}\xrightarrow{{ + Cu}}F{\text{e}}\)
Vì Cu yếu hơn Fe nên không thể đẩy Fe ra khỏi dung dịch muối FeCl2.
Đáp án C
Câu hỏi 5 :
Có thể thu được kim loại nào trong số các kim loại sau : Cu, Na, Ca, Al bằng cả 3 phương pháp điều chế kim loại phổ biến (nhiệt luyện, thuỷ luyện, điện phân) ?
- A
Na.
- B
Ca.
- C Cu.
- D Al.
Đáp án: C
Lời giải chi tiết:
Cu được điều chế bằng ba phương pháp nhiệt luyện, thuỷ luyện, điện phân.
Đáp án C
Câu hỏi 6 :
Khi điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước thì xảy ra hiện tượng nào trong số các hiện tượng cho dưới đây ?
- A Khí oxi thoát ra ở catot và khí clo thoát ra ở anot.
- B Khí hiđro thoát ra ở catot và khí clo thoát ra ở anot.
- C
Kim loại natri thoát ra ở catot và khí clo thoát ra ở anot.
- D
Nước Gia-ven được tạo thành trong bình điện phân.
Đáp án: B
Phương pháp giải:
Lý thuyết về điện phân.
Lời giải chi tiết:
Catot: \(Na^+\), \(H_2O\) nước điện phân trước thu được khí hiđro
\(2H_2O +2 e\to 2OH^- + H_2\)
Anot: \(Cl^-\), \(H_2O\), ion \(Cl^-\) điện phân trước thu được khí Clo
\(2Cl^- \to Cl_2 +2e\)
Đáp án B
Câu hỏi 7 :
Trong số những công việc sau, công việc nào không được thực hiện trong công nghiệp bằng phương pháp điện phân ?
- A
Điều chế kim loại Zn.
- B
Điều chế kim loại Cu.
- C
Điều chế kim loại Fe.
- D
Mạ niken.
Đáp án: C
Lời giải chi tiết:
Điều chế kim loại Fe không được thực hiện trong công nghiệp bằng phương pháp điện phân
Đáp án C
Câu hỏi 8 :
Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là
- A
Na, Ca, Al.
- B
Na, Ca, Zn.
- C
Na, Cu, Al.
- D
Fe, Ca, Al.
Đáp án: A
Lời giải chi tiết:
Na, Ca, Al điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng.
Đáp án A
Câu hỏi 9 :
Điện phân dung dịch chứa a mol CuSO4 và b mol NaCl ( với điện cực trơ, có màng ngăn xốp). Để dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng thì điều kiện của a và b là:
- A b = 2a
- B 2b = a
- C b > 2a
- D b < 2a
Đáp án: C
Lời giải chi tiết:
Ban đầu xảy ra phản ứng điện phân:
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
Ban đầu: a mol b mol
Do dung dịch sau điện phân làm phenolphtalein chuyển hồng nên có OH- tức là có phản ứng điện phân:
(2) 2NaCl + 2H2O → 2NaOH + Cl2 + H2
Như vậy ta suy ra ở (1) thì CuSO4 điện phân hết trước so với NaCl
→ \(\frac{a}{1} < \frac{b}{2} \Leftrightarrow 2{\rm{a}} < b\)
Đáp án C
Câu hỏi 10 :
Điện phân (với điện cực trơ) một dung dịch gồm NaCl và CuSO4 có cùng số mol, đến khi ở catot xuất hiện bọt khí thì dừng điện phân. Trong cả quá trình điện phân trên, sản phẩm thu được ở anot là
- A khí Cl2 và O2.
- B khí H2 và O2.
- C chỉ có khí Cl2.
- D khí Cl 2 và H2.
Đáp án: A
Lời giải chi tiết:
Đáp án A
Câu hỏi 11 :
Điện phân hoàn toàn dung dịch hỗn hợp gồm a mol Cu(NO3)2 và b mol NaCl với điện cực trơ , màng ngăn xốp. Để dung dịch thu được sau khi điện phân có khả năng phản ứng với Al2O3 thì
- A b = 2a
- B b > 2a
- C b < 2a
- D b < 2a hoặc b > 2a
Đáp án: D
Phương pháp giải:
Viết các bán phản ứng tại catot và anot Bảo toàn electron
Lời giải chi tiết:
Cu(NO3)2 → Cu2+ + 2NO3-
a a
NaCl → Na+ + Cl-
b b
Catot(-) Anot (+)
Na+ không bị điện phân NO3- không bị điện phân.
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
→ Phương trình : Cu2+ + 2Cl- → Cu + Cl2 (1)
a b
Nếu dư Cu2+ sau (1): a > b/2 (2a > b) thì có phản ứng
Cu2+ + 2H2O → Cu + 4H+ + O2
→ Dung dịch thu được có axit nên có phản ứng với Al2O3
6H+ + Al2O3 → 2Al3+ + 3H2O
Nếu dư Cl- sau (1) : a < b/2 (b > 2a) thì có phản ứng
2H2O + 2Cl- → 2OH- + H2 + Cl2
→ Dung dịch thu được có môi trường bazơ nên có phản ứng với Al2O3
2OH- + Al2O3 → 2AlO2- + H2O
Đáp án D
Câu hỏi 12 :
Khi điện phân điện cực trơ, có màng ngăn một dd chứa các ion Fe2+,Fe3+,Cu+,H+ thì thứ tự các ion bị điện phân ở catot là :
- A Fe3+,Fe2+,H+,Cu2+
- B Cu2+,H+,Fe3+,Fe2+
- C Cu2+,H+,Fe2+,Fe3+
- D Fe3+,Cu2+,H+,Fe2+
Đáp án: D
Phương pháp giải:
Ghi nhớ dãy điện hóa của kim loại
Lời giải chi tiết:
- Tại catot (cực âm) xảy ra quá trình khử M+, H+ (axit), H2O theo quy tắc: + Các cation nhóm IA, IIA, Al3+ không bị khử (khi đó H2O bị khử) + Các ion H+ (axit) và cation kim loại khác bị khử theo thứ tự trong dãy thế điện cực chuẩn (ion có tính oxi hóa mạnh hơn bị khử trước): Mn+ + ne → M
Đáp án D
Câu hỏi 13 :
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X thấy pH tăng, dung dịch Y thấy pH giảm. Vậy dung dịch X và dung dịch Y là dung dịch nào sau đây?
- A (X) KBr, (Y) Na2SO4
- B (X) AgNO3, (Y) BaCl2
- C (X) BaCl2, (Y) CuSO4
- D (X) NaCl, (Y) HCl
Đáp án: C
Phương pháp giải:
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X thấy pH tăng chứng tỏ điện phân X phải sinh ra kiềm. Vậy X là muối của kim loại mạnh và anion gốc axit không có Oxi.
Điện phân dung dịch Y thấy pH giảm nên Y là muối của kim loại yếu và gốc axit có oxi.
Lời giải chi tiết:
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X thấy pH tăng chứng tỏ điện phân X phải sinh ra kiềm. Vậy X là muối của kim loại mạnh và anion gốc axit không có Oxi. Vậy X là KBr hoặc NaCl hoặc BaCl2.
Điện phân dung dịch Y thấy pH giảm nên Y là muối của kim loại yếu và gốc axit có oxi.
Vậy Y là CuSO4.
BaCl2 + 2H2O → Ba(OH)2 + Cl2+ H2
CuSO4 + H2O \(\xrightarrow{{dp{\text{dd}}}}\) Cu ↓+ H2SO4 + ½ O2↑
Đáp án C
Câu hỏi 14 :
Phản ứng điện phân dung dịch CuCl2 (với điện cực trơ) và phản ứng ăn mòn điện hoá xảy ra khi nhúng hợp kim Zn - Cu vào dung dịch HCl có đặc điểm là:
- A Phản ứng ở cực âm có sự tham gia của kim loại hoặc ion kim loại.
- B Phản ứng xảy ra luôn kèm theo sự phát sinh dòng điện.
- C Đều sinh ra Cu ở cực âm.
- D Phản ứng ở cực dương đều là sự oxi hoá Cl–.
Đáp án: A
Phương pháp giải:
Phân tích các quá trình khử và oxi hóa tại các điện cực của sự điện phân và ăn mòn điện hóa. Từ đó xác định đặc điểm chung ở 2 quá trình.
Lời giải chi tiết:
- Điện phân dung dịch CuCl2:
Cực âm (catot): Cu2+ + 2e → Cu
Cực dương (anot): 2Cl- -2e → Cl2
=> Phản ứng không phát sinh ra dòng điện mà chỉ diễn ra nhờ tác dụng của dòng điện.
- Ăn mòn điện hóa Zn - Cu trong dung dịch HCl:
Cực âm: Zn -2e → Zn2+
Cực dương: 2H+ + 2e → H2
Bảng so sánh:
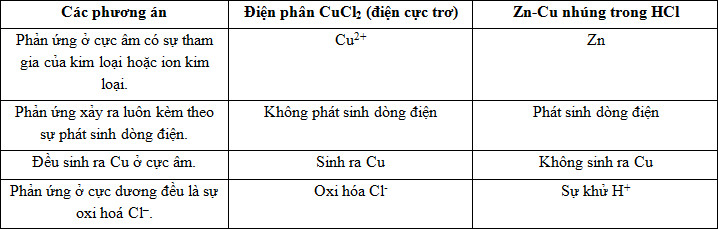
Đáp án A
Câu hỏi 15 :
Điện phân dung dịch chứa a mol CuSO4 và b mol NaCl (với điện cực trơ, có màng ngăn xốp). Để dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng thì điều kiện của a và b là :
- A b > 2a
- B b = 2a
- C b < 2a
- D 2b = a
Đáp án: A
Phương pháp giải:
Dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng nên dung dịch có tính bazo
CuSO4+ 2NaCl → Cu + Na2SO4+ Cl2 (1)
2NaCl +2 H2O → 2NaOH + H2+ Cl2 (2)
Lời giải chi tiết:
Dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng nên dung dịch có tính bazo
CuSO4+ 2NaCl → Cu + Na2SO4+ Cl2 (1)
2NaCl +2 H2O → 2NaOH + H2+ Cl2 (2)
Để dung dịch thu được có tính bazo thì sau phản ứng (1) NaCl còn dư để tiếp tục phản ứng (2)
→ nNaCl > 2.nCuSO4 → b > 2a
Đáp án A
Câu hỏi 16 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau
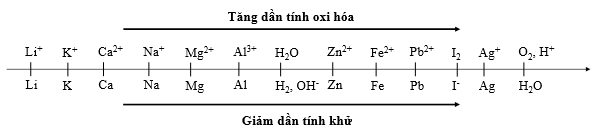
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4 và FeSO4 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.

Sau một thời gian, sinh viên quan sát thấy có 1,62 gam kim loại bạc bám lên điệc cực của bình 2. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Zn và Al lần lượt là 108; 65 và 27 đvC.
Câu 1:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra ở anot?
- A Cu → Cu2+ + 2e
- B Fe → Fe2+ + 2e
- C 2H2O → O2 + 4H+ + 4e
- D SO42- → SO2 + O2 + 2e
Đáp án: C
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Bán phản ứng xảy ra ở anot là 2H2O → O2 + 4H+ + 4e
Chọn C.
Câu 2:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Giá trị pH của dung dịch thay đổi như thế nào?
- A pH giảm do H+ sinh ra ở anot.
- B pH tăng do H+ sinh ra ở catot.
- C pH giảm do có OH- sinh ra ở catot.
- D pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot.
Đáp án: A
Phương pháp giải:
Viết các quá trình điện phân ở hai cực của thiết bị
Đánh giá giá trị pH của dung dịch
Lời giải chi tiết:
+ Tại catot (-): xảy ra quá trình khử theo thứ tự
Cu2+ → Cu + 2e
Fe2+ → Fe + 2e
+ Tại anot (+): xảy ra quá trình oxi hóa
2H2O → O2 + 4H+ + 4e
Do H+ sinh ra ở anot nên pH của dung dịch giảm dần
Chọn A
Câu 3:
Từ Thí nghiệm 2, hãy tính:
Số gam kim loại Zn bám lên điện cực trong bình 1 là:
- A 0 gam
- B 0,4875 gam
- C 0,975 gam
- D 0,325 gam
Đáp án: B
Phương pháp giải:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
Lời giải chi tiết:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
→ Zn2+ và Ag+ bị điện phân; Al3+ không bị điện phân.
Catot của bình 2 (-): Ag+ + 1e → Ag
⟹ ne trao đổi (2) = nAg = \(\frac{{1,62}}{{108}}\) = 0,015 mol
Catot của bình 1 (-): Zn2+ + 2e → Zn
⟹ ne trao đổi (1) = 2.nZn
Do 3 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
⟹ ne trao đổi (1) = ne trao đổi (2) ⟹ 2.nZn = 0,015 ⟹ nZn = 0,0075 mol
Khối lượng Zn bám lên điện cực trong bình 1 là: mZn = 0,0075.65 = 0,4875 gam
Chọn B.
Câu hỏi 17 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
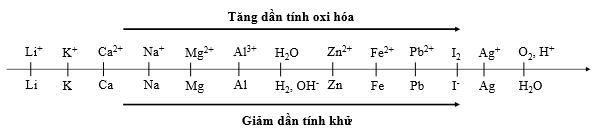
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời NaCl và MgCl2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
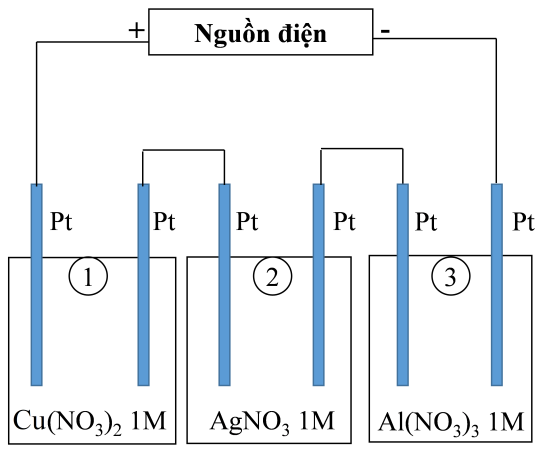
Sau một thời gian, sinh viên quan sát thấy có 3,24 gam kim loại bạc bám lên điệc cực của bình 2. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Câu 1:
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- A Mg → Mg2+ + 2e.
- B Na → Na+ + e.
- C 2H2O → O2 + 4H+ + 4e.
- D 2Cl- → Cl2 + 2e.
Đáp án: D
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Bán phản ứng xảy ra ở anot là: 2Cl- → Cl2 + 2e
Chọn D.
Câu 2:
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào?
- A pH tăng do OH- sinh ra ở catot.
- B pH giảm do H+ sinh ra ở anot.
- C pH không đổi do không có H+ và OH- sinh ra.
- D pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot.
Đáp án: A
Phương pháp giải:
Viết các quá trình điện phân ở hai cực của thiết bị.
Đánh giá giá trị pH của dung dịch.
Lời giải chi tiết:
Bán phản ứng xảy ra trên mỗi điện cực:
+ Tại catot (-): \(2{H_2}O + 2{\rm{e}} \to 2{\rm{O}}{H^ - } + {H_2}\)
+ Tại anot (+): \(2C{l^ - } \to C{l_2} + 2{\rm{e}}\)
Do tại catot sinh ra ion OH- nên pH của dung dịch tăng.
Chọn A.
Câu 3:
Trong thí nghiệm 2, số gam kim loại Al bám lên điện cực trong bình 3 là
- A 0 gam.
- B 3,9 gam.
- C 0,975 gam.
- D 1,95 gam.
Đáp án: A
Phương pháp giải:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
Lời giải chi tiết:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
⟹ Al3+ không bị điện phân.
⟹ Không có kim loại Al bám lên điện cực ở bình 3.
Chọn A.
Câu hỏi 18 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra.Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
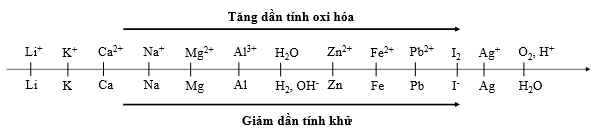
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời NaCl và BaCl2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch MgCl2. Sau một thời gian, sinh viên quan sát thấy có 2,24 lít khí thoát ra ở anot. Biết nguyên tử khối của Mg và Cl lần lượt là 24 và 35,5.
Câu 1:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra ở catot?
- A Ba2+ + 2e → Ba
- B Na+ + e → Na
- C 2H2O + 2e → 2OH- + H2
- D Cl2 + 2e → 2Cl-
Đáp án: C
Phương pháp giải:
Tại catot (-) xảy ra quá trình khử.
Lời giải chi tiết:
Tại catot xảy ra quá trình 2H2O + 2e → 2OH- + H2
Chọn C.
Câu 2:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Dung dịch thu được sau khi điện phân hoàn toàn dung dịch X không có khả năng tác dụng với chất nào sau đây?
- A CuO
- B Na2CO3
- C Cl2
- D Al2O3
Đáp án: A
Phương pháp giải:
Viết các quá trình điện phân ở hai cực của thiết bị
Xác định các chất có trong dung dịch sau điện phân
Xét các chất phản ứng được với dung dịch sau điện phân
Lời giải chi tiết:
+ Tại catot (-): xảy ra quá trình khử
2H2O + 2e → 2OH- + H2
+ Tại anot (+): xảy ra quá trình oxi hóa
2Cl- → Cl2 + 2e
Vậy dung dịch sau khi điện phân hoàn toàn bao gồm Na+, Ba2+, OH-, H2O (hay gồm: NaOH và Ba(OH)2)
A. Không phản ứng
B. PTHH minh họa: Ba(OH)2 + Na2CO3 → BaCO3↓ + H2O
C. PTHH minh họa: 2NaOH + Cl2 → NaCl + NaClO + H2O
2Ba(OH)2 + 2Cl2 → BaCl2 + Ba(ClO)2 + 2H2O
D. PTHH minh họa: 2NaOH + Al2O3 → 2NaAlO2 + H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
Chọn A.
Câu 3:
Từ thí nghiệm 2, hãy tính:
Số gam kim loại Mg bám lên điện cực catot là:
- A 0 gam
- B 2,4 gam
- C 4,8 gam
- D 1,2 gam
Đáp án: A
Phương pháp giải:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu bằng cách điện phân dung dịch muối của chúng.
Lời giải chi tiết:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng
→ Mg2+ không bị điện phân → số gam Mg bám trên catot = 0
Chọn A.
Câu hỏi 19 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
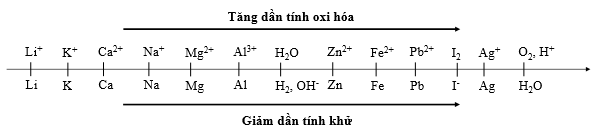
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Câu 1:
Trong thí nghiệm 1, thứ tự điện phân các cation tại catot là
- A Ag+, Cu2+, Fe3+, Fe2+.
- B Ag+, Fe3+, Cu2+, Fe2+.
- C Ag+, Fe2+, Cu2+, Fe3+.
- D Fe3+, Ag+, Cu2+, Fe2+.
Đáp án: B
Phương pháp giải:
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Ag+ > Fe3+ > Cu2+ > Fe2+
Vậy thứ tự điện phân là Ag+, Fe3+, Cu2+, Fe2+.
Chọn B.
Câu 2:
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào ?
- A pH tăng do OH- sinh ra ở catot.
- B pH giảm do H+ sinh ra ở anot.
- C pH không đổi do không có H+ và OH- sinh ra.
- D pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot.
Đáp án: B
Phương pháp giải:
Viết các quá trình điện phân ở hai cực của thiết bị.
Đánh giá giá trị pH của dung dịch.
Lời giải chi tiết:
Các quá trình xảy ra trên điện cực:
+ Tại catot:
Ag+ + 1e → Ag
Fe3++ 1e → Fe2+
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
+ Tại anot: 2H2O → O2 + 4H+ + 4e
Do tại anot sinh ra ion H+ nên pH của dung dịch giảm dần.
Chọn B.
Câu 3:
Trong thí nghiệm 2, thể tích khí thoát ra tại điện cực anot là
- A 0,224 lít.
- B 2,24 lít.
- C 0,448 lít.
- D 4,48 lít.
Đáp án: A
Phương pháp giải:
- Từ khối lượng kim loại bám trên catot tính được số mol Cu.
- Áp dụng định luật bảo toàn electron tính được số mol Cl2.
- Tính thể tích khí thoát ra ở anot.
Lời giải chi tiết:
Các quá trình trao đổi electron:
+ Tại catot: Cu2+ + 2e → Cu
+ Tại anot: 2Cl- → Cl2 + 2e
Ta có: \({n_{Cu}} = \frac{{6,4}}{{64}} = 0,1\,\,mol\)
Áp dụng định luật bảo toàn electron: \(2{n_{Cu}} = 2{n_{C{l_2}}} \to {n_{C{l_2}}} = {n_{Cu}} = 0,1\,\,mol\)
\( \to {V_{C{l_2}}} = 0,1.22,4 = 2,24\) (lít)
Chọn A.
Câu hỏi 20 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Nếu điện phân chứa các gốc axit có chứa oxi \(NO_3^ - ,SO_4^{2 - },PO_4^{3 - },CO_3^{2 - },ClO_4^ - ,....\) thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị oxi hóa: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu điện phân dung dịch có các cation K+,Na+, Ca2+, Ba2+, Mg2+, Al3+thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2 + 2OH-
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag,… thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa – khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5
Câu 1:
Từ thí nghiệm 1, cho biết bán phản ứng nào xảy ra ở anot?
- A Cu → Cu2+ + 2e
- B 2Cl- → Cl2 + 2e
- C 2H2O → O2 + 4H+ + 4e
- D Cu2+ + 2e → Cu
Đáp án: A
Phương pháp giải:
Khi điện phân không dùng các anot trơ mà dùng các kim loại thì các kim loại dễ bị oxi hóa hơn các anion và do đó chúng tan vào dung dịch
Lời giải chi tiết:
Sử dụng điện cực là Cu nên tại anot: xảy ra quá trình oxi hóa Cu chứ không phải Cl-
Bán phản ứng: Cu → Cu2+ + 2e
Chọn A.
Câu 2:
Nếu trong thí nghiệm 1, sinh viên đó thay điện cực Cu bằng điện cực than chì thì bán phản ứng xảy ra ở anot là:
- A Cu → Cu2+ + 2e
- B 2Cl- → Cl2 + 2e
- C 2H2O → O2 + 4H+ + 4e
- D Cu2+ + 2e → Cu
Đáp án: B
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Sử dụng điện cực bằng than chì thì tại anot sẽ xảy ra quá trình oxi hóa Cl-
Bán phản ứng: 2Cl- → Cl2 + 2e
Chọn B.
Câu 3:
Từ thí nghiệm 2, hãy tính: Khối lượng dung dịch giảm là:
- A 13,5 gam
- B 6,4 gam
- C 7,1 gam
- D 6,75 gam
Đáp án: A
Phương pháp giải:
- Từ số mol kim loại bám trên catot, tính được số mol e trao đổi
- Từ số mol e trao đổi, tính được số mol khí bên anot
- Tính khối lượng dung dịch giảm: mdd giảm = mkết tủa + mkhí thoát ra
Lời giải chi tiết:
Tại catot (-) có các cation đi về: Cu2+; Na+ và H2O
Tại anot (+) có các anion đi về: Cl-; NO3- và H2O
\({n_{Cu}} = \frac{{6,4}}{{64}} = 0,1\,\,mol\)
Các quá trình trao đổi electron:

Áp dụng bảo toàn e: \(2{n_{Cu}} = 2{n_{C{l_2}}} \to {n_{C{l_2}}} = {n_{Cu}} = 0,1\,\,mol\)
Ta có: mdd giảm = mCu↓ + mCl2↑ = 6,4 + 0,1.71 = 13,5 gam
Chọn A.
Câu hỏi 21 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
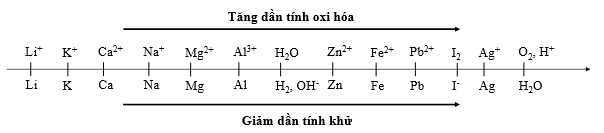
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
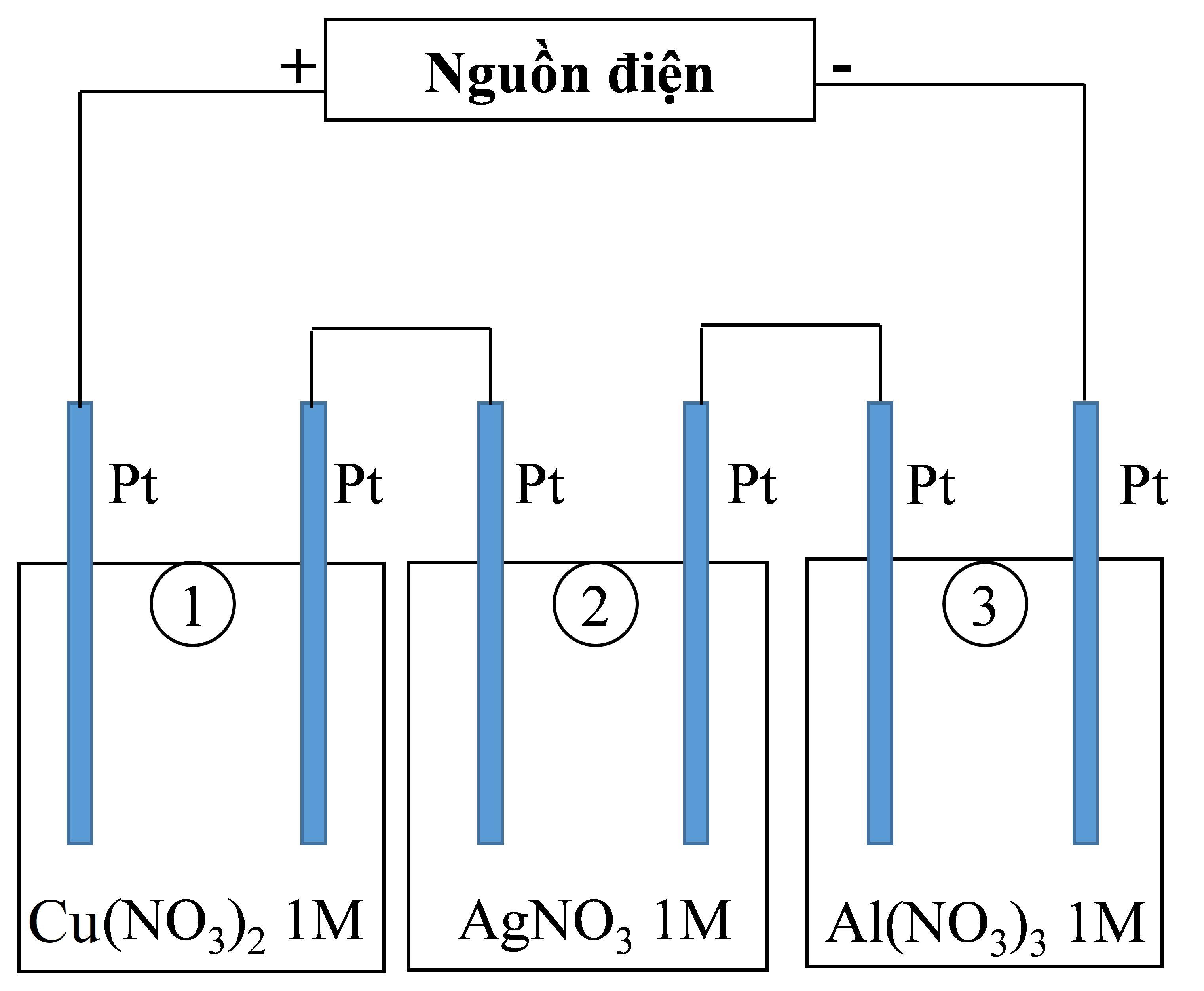
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Câu 1:
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở catot?
- A Pb2+ + 2e → Pb.
- B Al3+ + 3e → Al.
- C O2 + 4H+ + 4e → 2H2O.
- D H2O + 2e → H2 + 2OH-.
Đáp án: A
Phương pháp giải:
Catot của thiết bị là nơi xảy ra bán phản ứng khử.
Lời giải chi tiết:
Bán phản ứng xảy ra ở catot là Pb2+ + 2e → Pb.
Chú ý: Al3+ không bị điện phân.
Chọn A.
Câu 2:
Nếu trong thí nghiệm 1, người sinh viên đổi 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
- A Catot: Pb2+ + 2e → Pb; Anot: 2H2O → O2 + 4H+ + 4e.
- B Catot: Al3+ + 3e → Al; Anot: Pb → Pb2++ 2e.
- C Catot: 2H2O + 2e → H2 + 2OH-; Anot: Pb → Pb2+ + 2e.
- D Catot: Pb2+ + 2e → Pb; Anot: Pb → Pb2+ + 2e.
Đáp án: D
Phương pháp giải:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Khi điện phân dung dịch sử dụng kim loại làm cực dương trùng với ion kim loại bị điện phân thì sẽ xảy ra hiện tượng dương cực tan.
Lời giải chi tiết:
Tại catot xảy ra bán phản ứng: Pb2+ + 2e → Pb
Tại anot xảy ra bán phản ứng: Pb → Pb2+ + 2e (cực dương tan dần nên được gọi là hiện tượng dương cực tan).
Chọn D.
Câu 3:
Trong thí nghiệm 2, số gam kim loại Ag bám lên điện cực trong bình 2 là
- A 0 gam.
- B 3,24 gam.
- C 12,96 gam.
- D 6,48 gam.
Đáp án: C
Phương pháp giải:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
Lời giải chi tiết:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
→ Cu2+ và Ag+ bị điện phân; Al3+ không bị điện phân.
Catot của bình 1 (-): Cu2+ + 2e → Cu
⟹ ne trao đổi (1) = 2.nCu = 2.\(\frac{{3,84}}{{64}}\) = 0,12 mol
Catot của bình 2 (-): Ag+ + 1e → Ag
⟹ ne trao đổi (1) = nAg
Do 3 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
⟹ ne trao đổi (1) = ne trao đổi (2) ⟹ nAg = 0,12 mol
Khối lượng Ag bám lên điện cực trong bình 2 là: mAg = 0,12.108 = 12,96 gam.
Chọn C.
Câu hỏi 22 :
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:

Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4 và NaCl có cùng nồng độ mol bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 200 ml dung dịch CuSO4 1M.
- Bình (2) chứa 300 ml dung dịch Fe(NO3)3 1M.
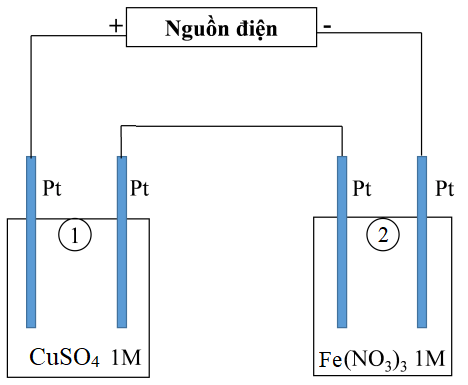
Sau một thời gian, sinh viên quan sát thấy có 5,6 gam kim loại sắt bám lên điệc cực của bình (2). Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Fe lần lượt là 64 và 56 đvC.
Câu 1:
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở catot?
- A H2O + 2e → H2 + 2OH-.
- B Na+ + 1e → Na.
- C O2 + 4H+ + 4e → 2H2O.
- D Cu2+ + 2e → Cu.
Đáp án: D
Phương pháp giải:
Catot của thiết bị là nơi xảy ra bán phản ứng khử.
Lời giải chi tiết:
Bán phản ứng xảy ra ở catot là Cu2+ + 2e → Cu.
Chú ý: Khi điện phân dung dịch, ion Na+ không bị điện phân.
Chọn D.
Câu 2:
Trong thí nghiệm 1, dung dịch sau điện phân có pH như thế nào?
- A pH > 7.
- B pH < 7.
- C pH = 7.
- D Không xác định.
Đáp án: B
Phương pháp giải:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Dựa vào số mol ban đầu của mỗi muối ⟹ Các phản ứng điện phân.
- Từ sản phẩm của quá trình điện phân suy ra giá trị pH của dung dịch điện phân.
Lời giải chi tiết:
Do trong cùng dung dịch, CuSO4 và NaCl có cùng nồng độ mol nên số mol của chúng bằng nhau.
Đặt \({n_{CuS{O_4}}} = {n_{NaCl}} = a\left( {mol} \right)\)
Phương trình điện phân:
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
a a ⟹ Ta thấy: \(\frac{a}{1} > \frac{a}{2}\) nên NaCl hết, CuSO4 còn dư
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Dung dịch sau điện phân có chứa H2SO4 nên có pH < 7.
Chọn B.
Câu 3:
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) là
- A 0 gam.
- B 16,0 gam.
- C 12,8 gam.
- D 6,4 gam.
Đáp án: C
Phương pháp giải:
*Bình (2): Các phản ứng điện phân tại catot bình (2):
Fe3+ + 1e → Fe2+
Fe2+ + 2e → Fe
Từ số mol của Fe3+ và Fe tính được số mol e trao đổi ở bình (2).
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2)
*Bình (1):
So sánh ne (bình 1) với \(2.{n_{C{u^{2 + }}}}\) ⟹ CuSO4 đã bị điện phân hết, H2O đang bị điện phân
Từ đó tính được lượng Cu bám vào catot bình (1).
Lời giải chi tiết:
*Bình (2):
Ta có: \({n_{F{\rm{e}}{{(N{O_3})}_3}}} = 0,3.1 = 0,3\left( {mol} \right);{n_{F{\rm{e}}}} = \frac{{5,6}}{{56}} = 0,1\left( {mol} \right)\)
Tại catot (-):
Fe3+ + 1e → Fe2+
0,3 → 0,3 (mol)
Fe2+ + 2e → Fe
0,2 ← 0,1 (mol)
⟹ ne (bình 2) = 0,3 + 0,2 = 0,5 mol
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
⟹ ne (bình 1) = ne (bình 2) = 0,5 mol
*Bình (1):
Ta có: \({n_{CuS{O_4}}} = 0,2.1 = 0,2\left( {mol} \right)\)
So sánh thấy: \({n_{e(binh\,1)}} > 2.{n_{C{u^{2 + }}}}\) ⟹ CuSO4 đã bị điện phân hết, H2O đang bị điện phân
Khối lượng Cu bám vào catot của bình (1) là: mCu = 0,2.64 = 12,8 gam.
Chọn C.
Câu hỏi 23 :
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)2, Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuSO4. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu; S và O lần lượt là 64; 32 và 16 đvC.
Câu 1:
Trong thí nghiệm 1, thứ tự điện phân tại catot là
- A Ag+, Cu2+, Fe2+, H2O.
- B Ag+, Fe3+, Cu2+, Fe2+, H2O.
- C Ag+, Cu2+, Fe2+, Al3+, H2O.
- D Ag+, Cu2+, Fe2+.
Đáp án: A
Phương pháp giải:
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Lời giải chi tiết:
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
- Ta thấy, ion Al3+ không bị điện phân.
- Mặt khác, dựa vào dãy điện hóa ta có tính oxi hóa của các cation kim loại: Ag+ > Cu2+ > Fe2+.
Vậy thứ tự điện phân tại catot là: Ag+, Cu2+, Fe2+, H2O.
Chọn A.
Câu 2:
Khi bắt đầu xuất hiện khí ở catot ta dừng điện phân. Chất tan có trong dung dịch sau điện phân là
- A HNO3.
- B Al(NO3)3 và HNO3.
- C Al(NO3)3.
- D Al(OH)3 và HNO3.
Đáp án: B
Phương pháp giải:
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như H2O chưa bị điện phân.
- Viết các bán phản ứng xảy ra tại catot và anot.
- Xác định chất tan có trong dung dịch sau điện phân.
Lời giải chi tiết:
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như H2O chưa bị điện phân.
- Bán phản ứng điện phân:
*Tại catot:
Ag+ + 1e → Ag
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
⟹ Al3+ không bị điện phân nên còn nguyên trong dung dịch
*Tại anot:
Ion NO3- không bị điện phân nên nước điện phân hộ:
2H2O → 4H+ + O2 + 4e
Vậy dung dịch sau phản ứng có chứa: Al3+, NO3-, H+
⟹ Chất tan có trong dung dịch sau điện phân là: Al(NO3)3 và HNO3.
Chọn B.
Câu 3:
Trong thí nghiệm 2, thể tích khí thoát ra tại anot ở điều kiện tiêu chuẩn là
- A 0,224 lít.
- B 2,24 lít.
- C 0,112 lít.
- D 1,12 lít.
Đáp án: D
Phương pháp giải:
- Viết bán phản ứng điện phân tại catot và anot.
- Từ khối lượng kim loại bám trên catot tính được số mol Cu.
- Áp dụng định luật bảo toàn electron tính được số mol O2.
- Tính thể tích khí thoát ra ở anot.
Lời giải chi tiết:
Các bán phản ứng điện phân tại catot và anot:
+ Tại catot: Cu2+ + 2e → Cu
+ Tại anot: 2H2O → 4H+ + O2 + 4e
Ta có: \({n_{Cu}} = \frac{{6,4}}{{64}} = 0,1\,\,mol\)
Áp dụng định luật bảo toàn electron ta có:
ne(catot) = ne(anot) ⇔ \(2{n_{Cu}} = 4{n_{{O_2}}} \to {n_{{O_2}}} = \frac{1}{2}{n_{Cu}} = \frac{1}{2}.0,1 = 0,05\left( {mol} \right)\)
\( \to {V_{{O_2}}} = 0,05.22,4 = 1,12\) (lít)
Vậy thể tích khí thoát ra ở anot là 1,12 lít.
Chọn D.
Câu hỏi 24 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 100 ml dung dịch CuSO4 1M.
- Bình (2) chứa 100 ml dung dịch AgNO3 1M.
Sau thời gian t giây, sinh viên quan sát thấy ở bình (2) bắt đầu xuất hiện khí. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Ag lần lượt là 64 và 108 đvC.

Câu 1:
Trong thí nghiệm 1, bán phản ứng xảy ra tại catot là
- A Na+ + 1e → Na.
- B Na → Na+ + 1e.
- C 2H2O + 2e → H2 + 2OH-.
- D 2H2O → 4H+ + O2 + 4e.
Đáp án: C
Phương pháp giải:
Catot của thiết bị là nơi xảy ra bán phản ứng khử.
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot ion Na+ không bị điện phân nên xảy ra sự điện phân H2O. Bán phản ứng xảy ra tại catot là: 2H2O + 2e → H2 + 2OH-.
Chọn C.
Câu 2:
Trong thí nghiệm 1, phát biểu nào sau đây đúng khi nói về dung dịch X?
- A Dung dịch X làm phenolphtalein chuyển sang màu xanh.
- B Dung dịch X làm phenolphtalein chuyển sang màu hồng.
- C Dung dịch X làm quỳ tím chuyển sang màu hồng.
- D Dung dịch X không làm phenolphtalein hay quỳ tím đổi màu.
Đáp án: B
Phương pháp giải:
- Viết các quá trình điện phân ở hai cực của thiết bị.
- Đánh giá MT của dung dịch sau điện phân.
- Chọn phát biểu đúng.
Lời giải chi tiết:
Bán phản ứng xảy ra trên mỗi điện cực:
+ Tại catot (-): \(2{H_2}O + 2{\rm{e}} \to 2{\rm{O}}{H^ - } + {H_2}\)
+ Tại anot (+): \(2C{l^ - } \to C{l_2} + 2{\rm{e}}\)
Do đó dung dịch thu được có môi trường kiềm nên làm phenolphtalein chuyển sang màu hồng.
Chọn B.
Câu 3:
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) tại thời điểm t giây là
- A 3,2 gam.
- B 4,8 gam.
- C 6,4 gam.
- D 12,8 gam.
Đáp án: A
Phương pháp giải:
*Bình (2):
- Tính được số mol AgNO3
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân.
- Viết bán phản ứng điện phân tại catot. Từ số mol Ag+ tính được số mol e trao đổi của bình (2).
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2)
*Bình (1): Tính được số mol CuSO4
- So sánh thấy thấy: \({n_{e(binh\,2)}} < 2{n_{C{u^{2 + }}}}\) nên Cu2+ chưa bị điện phân hết.
- Từ số mol e trao đổi tính được số mol Cu ⟹ khối lượng Cu bám vào catot của bình (1).
Lời giải chi tiết:
*Bình (2): \({n_{AgN{O_3}}} = 0,1.1 = 0,1\left( {mol} \right)\)
Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân.
Tại catot (-): Ag+ + 1e → Ag
0,1 → 0,1 (mol)
⟹ ne (bình 1) = 0,1 mol
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2) = 0,1 mol
*Bình (1): \({n_{CuS{O_4}}} = 0,1.1 = 0,1\left( {mol} \right)\)
Ta thấy: \({n_{e(binh\,2)}} < 2{n_{C{u^{2 + }}}}\) nên Cu2+ chưa bị điện phân hết
Tại catot (-): Cu2+ + 2e → Cu
0,1 → 0,05 (mol)
Khối lượng Cu bám lên điện cực trong bình (1) là: mCu = 0,05.64 = 3,2 (g)
Chọn A.
Câu hỏi 25 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3 và Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 200 ml dung dịch AgNO3 1M.
- Bình (2) chứa 300 ml dung dịch Fe(NO3)2 1M.
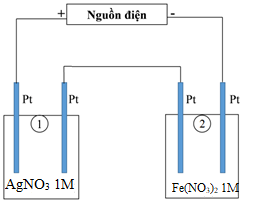
Sau một thời gian, sinh viên quan sát thấy có 8,4 gam kim loại sắt bám lên điệc cực của bình (2). Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag và Fe lần lượt là 108 và 56 đvC.
Câu 1:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra đầu tiên ở catot?
- A H2O + 2e → H2 + 2OH-.
- B Fe2+ + 2e → Fe.
- C O2 + 4H+ + 4e → 2H2O
- D Ag+ + 1e → Ag.
Đáp án: D
Phương pháp giải:
Catot là nơi xảy ra quá trình khử, do vậy ion có tính oxi hóa cao sẽ bị khử trước
Dựa vào dãy điện hóa ta thấy thứ tự oxi hóa: Ag+ > Fe2+ > H2O. Do vậy Ag+ bị khử trước.
Lời giải chi tiết:
Catot là nơi xảy ra quá trình khử:
Dựa vào dãy điện hóa ta thấy thứ tự tính oxi hóa: Ag+ > Fe2+ > H2O. Do vậy Ag+ bị khử trước.
Ag+ + 1e → Ag
Chọn D.
Câu 2:
Dung dịch sau khi điện phân hoàn toàn các chất không có khả năng phản ứng với chất nào sau đây:
- A Al2O3
- B Cu
- C NaOH
- D NaCl
Đáp án: D
Phương pháp giải:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Từ sản phẩm của quá trình điện phân suy ra được dd chứa chất gì, từ đó chọn được đáp án chất không pư phù hợp.
Lời giải chi tiết:
Điện phân hoàn toàn, phản ứng xảy ra theo thứ tự:
Phương trình điện phân:
AgNO3 \(\xrightarrow{{dpdd}}\) Ag + O2↑ + HNO3
Fe(NO3)2 \(\xrightarrow{{dpdd}}\) Fe + O2↑ + HNO3
Sau khi điện phân hoàn toàn, dung dịch thu được có chứa HNO3
A. Có phản ứng theo PTHH: Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
B. Có phản ứng theo PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
C. Có phản ứng theo PTHH: NaOH + HNO3 → NaNO3 + H2O
D. Không phản ứng vì không thỏa mãn điều kiện axit tác dụng với muối phải sinh ra chất kết tủa hoặc bay hơi.
Chọn D.
Câu 3:
Từ Thí nghiệm 2, hãy tính:
Số gam kim loại Ag bám lên điện cực trong bình (1) là
- A 21,6 gam.
- B 10,8 gam.
- C 16,2 gam
- D 32,4 gam.
Đáp án: A
Phương pháp giải:
*Bình (2): xảy ra bán phản ứng:
Fe2+ + 2e → Fe
Từ số mol của Fe tính được số mol e trao đổi ở bình (2).
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên → ne (bình 1) = ne (bình 2)
*Bình (1):
So sánh ne (bình 1) với nAg+ → AgNO3 đã bị điện phân hết, H2O đang bị điện phân
Từ đó tính được lượng Ag bám vào catot bình (1).
Lời giải chi tiết:
*Bình (2):
Ta có: \({n_{F{\rm{e}}{{(N{O_3})}_2}}} = 0,3.1 = 0,3\left( {mol} \right);{n_{F{\rm{e}}}} = \frac{{8,4}}{{56}} = 0,15\left( {mol} \right)\)
Ta thấy: 2nFe < nFe(NO3)2 nên Fe(NO3)2 chưa điện phân hết, mọi tính toán theo số mol Fe
Tại catot (-):
Fe2+ + 2e → Fe
0,3 ← 0,15 (mol)
→ ne (bình 2) = 2nFe = 2.0,15 = 0,3 (mol)
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
→ ne (bình 1) = ne (bình 2) = 0,3 mol
*Bình (1):
Ta có: nAgNO3 = 0,2.1 = 0,2 (mol)
So sánh thấy: \({n_{e(binh\,1)}} > {n_{A{g^ + }}}\) → AgNO3 đã bị điện phân hết, H2O đang bị điện phân
Khối lượng Ag bám vào catot của bình (1) là: mAg = 0,2.108 = 21,6 gam.
Chọn A.
Câu hỏi 26 :
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Một sinh viên thực hiện thí nghiệm điện phân dung dịch CuSO4 với một điện cực bằng graphit và một điện cực bằng đồng.
Thí nghiệm 1: Sinh viên nối điện cực graphit với cực (+) và điện cực đồng với cực (-) của nguồn điện.
Thí nghiệm 2: Đảo lại, sinh viên nối điện cực graphit với cực (-) và điện cực đồng với cực (+) của nguồn điện.
Câu 1:
Trong Thí nghiệm 1, bán phản ứng xảy ra tại catot (-) là
- A 2H2O + 2e → 2OH- + H2.
- B 2H2O → 4H+ + O2 + 4e.
- C Cu2+ + 2e → Cu.
- D Cu → Cu2+ + 2e.
Đáp án: C
Phương pháp giải:
Catot của thiết bị là nơi xảy ra bán phản ứng khử.
Lời giải chi tiết:
Điện phân dung dịch CuSO4 với catot (-) làm bằng graphit, anot (+) làm bằng Cu:
Catot (-): Cu2+ + 2e → Cu
Anot (+): 2H2O → 4H+ + O2 + 4e
Chọn C.
Câu 2:
Sau khi kết thúc Thí nghiệm 1, bạn sinh viên rửa sạch catot bằng nước cất sau đó sấy khô và đem cân thấy khối lượng catot tăng lên 28,80 gam so với ban đầu. Biết trong suốt quá trình điện phân không thấy khí thoát ra tại catot. Thể tích khí thoát ra ở anot (đktc) là
- A 2,52 lít.
- B 5,04 lít.
- C 3,78 lít.
- D 6,30 lít.
Đáp án: B
Phương pháp giải:
- Khối lượng catot tăng là khối lượng của Cu bám vào. Từ đó xác định lượng Cu.
- Viết bán phản ứng tại các điện cực.
- Áp dụng định luật bảo toàn electron để tính lượng O2 sinh ra ở anot ⟹ Thể tích khí thu được ở anot.
Lời giải chi tiết:
Khối lượng catot tăng là khối lượng của Cu bám vào.
\( \to {n_{Cu}} = \frac{{28,8}}{{64}} = 0,45\left( {mol} \right)\)
Xét các điện cực:
*Catot (-): Do trong quá trình điện phân không thấy khí thoát ra ở catot nên H2O không bị điện phân tại catot.
Cu2+ + 2e → Cu
*Anot (+): Ion SO42- không bị điện phân nên H2O bị điện phân.
2H2O → 4H+ + O2 + 4e+HH
Áp dụng bảo toàn e: \({n_{e(cat{\rm{o}}t)}} = {n_{e(an{\rm{o}}t)}} \Leftrightarrow 2{n_{Cu}} = 4{n_{{O_2}}}\)
\( \Rightarrow {n_{{O_2}}} = \frac{1}{2}{n_{Cu}} = \frac{1}{2}.0,45 = 0,225\left( {mol} \right)\)
Thể tích khí O2 thoát ra tại anot là: \({V_{{O_2}}} = 0,225.22,4 = 5,04\left( l \right)\)
Chọn B.
Câu 3:
Trong Thí nghiệm 2, bán phản ứng xảy ra tại 2 cực của bình điện phân là
- A Catot: Cu2+ + 2e → Cu; Anot: 2H2O → O2 + 4H+ + 4e.
- B Catot: 2H2O → O2 + 4H+ + 4e; Anot: Cu2+ + 2e → Cu.
- C Catot: 2H2O + 2e → H2 + 2OH-; Anot: Cu → Cu2+ + 2e.
- D Catot: Cu2+ + 2e → Cu; Anot: Cu → Cu2+ + 2e.
Đáp án: D
Phương pháp giải:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Khi điện phân dung dịch sử dụng kim loại làm cực dương trùng với ion kim loại bị điện phân thì sẽ xảy ra hiện tượng dương cực tan.
Lời giải chi tiết:
- Tại catot xảy ra bán phản ứng: Cu2+ + 2e → Cu
- Tại anot xảy ra bán phản ứng: Cu → Cu2+ + 2e (cực dương tan dần nên được gọi là hiện tượng dương cực tan).
Chọn D.
Câu hỏi 27 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời FeCl3, CuCl2, HCl bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2 với các điện cực làm bằng than chì. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và không có khí thoát ra. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Câu 1:
Trong Thí nghiệm 1, bán phản ứng điện phân tại anot là
- A 2Cl- → Cl2 + 2e.
- B Cl2 + 2e → 2Cl-.
- C 2H2O + 2e → 2OH- + H2.
- D 2H2O → 4H+ + O2 + 4e.
Đáp án: A
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Bán phản ứng tại anot là: 2Cl- → Cl2 + 2e.
Chọn A.
Câu 2:
Trong Thí nghiệm 1, thứ tự điện phân các cation tại catot là
- A Cu2+, H+, Fe3+.
- B Fe3+, Cu2+, H+, Fe2+.
- C Fe2+, H+, Cu2+, Fe3+.
- D Fe3+, Cu2+, H+.
Đáp án: B
Phương pháp giải:
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+.
Vậy thứ tự điện phân là Fe3+, Cu2+, H+, Fe2+.
Chọn B.
Câu 3:
Sau khi kết thúc Thí nghiệm 2, người ta rửa sạch catot bằng nước cất sau đó sấy khô và đem cân thấy khối lượng catot tăng lên 6,4 gam so với ban đầu. Biết trong suốt quá trình điện phân không thấy khí thoát ra tại catot. Dung dịch thu được sau điện phân có khối lượng giảm bao nhiêu gam so với dung dịch ban đầu?
- A 6,4 gam.
- B 7,1 gam.
- C 13,5 gam.
- D 9,95 gam.
Đáp án: C
Phương pháp giải:
- Từ khối lượng catot tăng tính được số mol Cu.
- Áp dụng định luật bảo toàn electron tính được số mol Cl2.
- Tính khối lượng dung dịch giảm.
Lời giải chi tiết:
Khối lượng catot tăng là khối lượng của Cu bám vào.
Ta có: \({n_{Cu}} = \frac{{6,4}}{{64}} = 0,1\,\,mol\)
Các quá trình trao đổi electron:
+ Tại catot: Cu2+ + 2e → Cu
+ Tại anot: 2Cl- → Cl2 + 2e
Áp dụng định luật bảo toàn electron: \(2{n_{Cu}} = 2{n_{C{l_2}}} \to {n_{C{l_2}}} = {n_{Cu}} = 0,1\,\,mol\)
Dung dịch sau phản ứng có khối lượng giảm:
\({m_{dd\,giam}} = {m_{Cu}} + {m_{C{l_2}}} = 6,4 + 0,1.71 = 13,5\left( g \right)\)
Chọn C.
Câu hỏi 28 :
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời FeSO4 và Al2(SO4)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
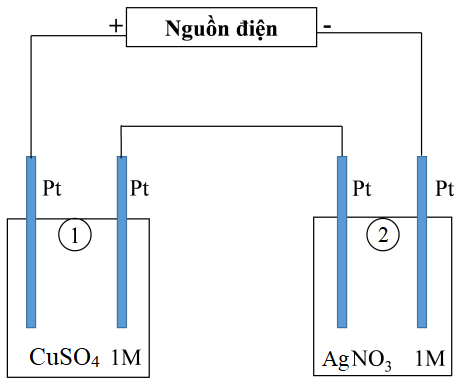
Điện phân được một thời gian, sinh viên nhấc các điện cực ra khỏi hai bình điện phân. Sau đó, đem cân dung dịch thu được thấy khối lượng bình 2 giảm 3,48 gam so với ban đầu. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau và trong suốt quá trình điện phân không có khí thoát ra ở catot mỗi bình, sự bay hơi nước không đáng kể.
(Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Câu 1:
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- A Fe → Fe2+ + 2e.
- B Al → Al3+ + 3e.
- C 2SO42- → 2SO3 + O2 + 4e.
- D 2H2O → O2 + 4H+ + 4e.
Đáp án: D
Phương pháp giải:
- Catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Các bán phản ứng xảy ra tại mỗi cực của thiết bị điện phân là:
*Catot (-): Fe2+ + 2e → Fe
*Anot (+): 2H2O → O2 + 4H+ + 4e
Chọn D.
Câu 2:
Trong Thí nghiệm 1, dung dịch sau điện phân có pH như thế nào?
- A pH > 7.
- B pH < 7.
- C pH = 7.
- D Không xác định.
Đáp án: B
Phương pháp giải:
- Viết phản ứng điện phân dưới dạng phân tử
- Xác định thành phần của dung dịch sau điện phân
- Đánh giá pH của dung dịch
Lời giải chi tiết:
Khi điện phân đồng thời dung dịch hỗn hợp chứa FeSO4 và Al2(SO4)3:
- Al2(SO4)3 không bị điện phân
- FeSO4 bị điện phân theo phản ứng: 2FeSO4 + 2H2O → 2Fe + O2 + 2H2SO4
Vậy dung dịch sau điện phân có chứa: H2SO4, Al2(SO4)3
⟹ Dung dịch thu được có pH < 7.
Chọn B.
Câu 3:
Trong thí nghiệm 2, khối lượng của bình 1 giảm so với ban đầu là
- A 0,96 gam.
- B 1,20 gam.
- C 0,24 gam.
- D 2,16 gam.
Đáp án: B
Phương pháp giải:
Do trong quá trình điện phân, cả 2 cực chưa thoát ra khí ⟹ Cu2+ và Ag+ chưa bị điện phân hết
*Bình 2:
- Gọi số mol Ag+ bị điện phân là x (mol).
- Viết bán phản ứng điện phân tại mỗi cực. Đặt ẩn vào các bán phản ứng điện phân.
- Từ khối lượng bình 2 giảm lập được phương trình ẩn x ⟹ giá trị của x ⟹ số mol e trao đổi ở bình 2.
- Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau ⟹ ne (bình 1) = ne (bình 2).
*Bình 1:
- Viết bán phản ứng điện phân tại mỗi cực.
- Đặt số mol e trao đổi vào suy ra số mol của Cu, O2.
- Tính được khối lượng bình 1 giảm.
Lời giải chi tiết:
Do trong quá trình điện phân, cả 2 cực chưa thoát ra khí ⟹ Cu2+ và Ag+ chưa bị điện phân hết
*Bình 2:
Gọi số mol Ag+ bị điện phân là x (mol)
Catot: Ag+ + 1e → Ag
x → x → x (mol)
Anot: 2H2O → 4H+ + O2 + 4e
0,25x ← x (mol)
Ta thấy, Ag bám vào điện cực và bị rút ra khỏi bình điện phân, còn khí O2 thoát ra khỏi bình
⟹ Khối lượng bình 2 giảm là tổng khối lượng của Ag và O2
⟹ 108x + 32.0,25x = 3,48 ⟹ x = 0,03 mol
⟹ ne (bình 2) = 0,03 mol
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2) = 0,03 mol
*Bình 1:
Catot: Cu2+ + 2e → Cu
0,03 → 0,015 (mol)
Anot: 2H2O → 4H+ + O2 + 4e
0,0075 ← 0,03 (mol)
Tương tự, khối lượng bình 1 giảm là tổng khối lượng của Cu và O2
⟹ mbình 1 giảm = 0,015.64 + 0,0075.32 = 1,2 gam
Chọn B.
Câu hỏi 29 :
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
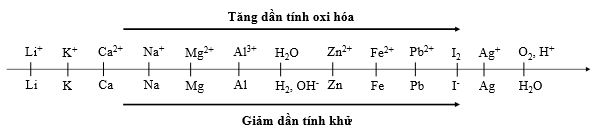
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)3, Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Câu 1:
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- A Ag+ + 1e → Ag.
- B 2H2O + 2e → 2OH- + H2.
- C 2H2O → O2 + 4H+ + 4e.
- D 4NO3- → 2N2O5 + O2 + 4e.
Đáp án: C
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Tại anot, ion NO3- không bị điện phân → xảy ra sự điện phân H2O
Vậy bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e
Chọn C.
Câu 2:
Trong Thí nghiệm 1, thứ tự kim loại sinh ra tại catot là
- A Ag, Fe, Cu.
- B Ag, Cu, Fe, Mg.
- C Fe, Cu, Ag.
- D Ag, Cu, Fe.
Đáp án: D
Phương pháp giải:
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Ta thấy tại catot ion Mg2+ không bị điện phân nên không xét đến.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Ag+ > Fe3+ > Cu2+ > Fe2+
Vậy thứ tự điện phân tại catot là Ag+, Fe3+, Cu2+, Fe2+.
Ag+ + 1e → Ag
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
⟹ Thứ tự kim loại sinh ra tại catot là Ag, Cu, Fe.
Chọn D.
Câu 3:
Trong Thí nghiệm 2, giá trị của t là
- A 2520,5.
- B 1440.
- C 1800.
- D 1440,5.
Đáp án: A
Phương pháp giải:
- So sánh khối lượng catot tăng với khối lượng lớn nhất của Ag ⟹ có Fe bám vào catot
→ Xác định chất bị điện phân
- Từ khối lượng catot tăng xác định khối lượng của mỗi kim loại.
- Viết các bán phản ứng điện phân tại catot. Tính toán theo các bán phản ứng điện phân xác định được số mol e trao đổi.
- Tính thời gian điện phân dựa vào công thức: \(t = \frac{{{n_e}.F}}{I}\)
Lời giải chi tiết:
Ta thấy: \({n_{Ag\,\max }} = {n_{AgN{O_3}}} = 0,04\left( {mol} \right) \to {m_{Ag\,\max }} = 0,04.108 = 4,32\left( g \right) < 5,44\left( g \right)\) ⟹ có Fe bám vào catot
⟹ Ag+ và Fe3+ đã bị điện phân hết, Fe2+ bị điện phân một phần.
Khối lượng Fe bám vào catot là: \({m_{F{\rm{e}}}} = 5,44 - 4,32 = 1,12\left( g \right) \to {n_{F{\rm{e}}}} = \frac{{1,12}}{{56}} = 0,02\left( {mol} \right)\)
Tại catot (-):
Ag+ + 1e → Ag
0,04 → 0,04 → 0,04 (mol)
Fe3+ + 1e → Fe2+
0,06 → 0,06 → 0,06 (mol)
Fe2+ + 2e → Fe
0,04 ← 0,02 (mol)
→ Số mol e trao đổi là: ne = 0,04 + 0,06 + 0,04 = 0,14 mol
→ Thời gian điện phân là: \(t = \frac{{{n_e}.F}}{I} = \frac{{0,14.96500}}{{5,36}} = 2520,5\left( s \right)\)
Chọn A.
Câu hỏi 30 :
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
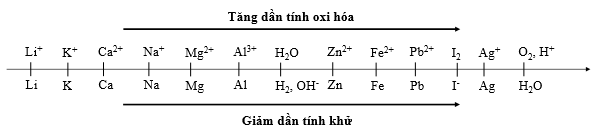
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4, Fe2(SO4)3, HNO3, Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Câu 1:
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- A 2SO42- → 2SO3 + O2 + 4e.
- B 2H2O → O2 + 4H+ + 4e.
- C 2H2O + 2e → 2OH- + H2.
- D 4NO3- → 2N2O5 + O2 + 4e.
Đáp án: B
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Tại anot, ion SO42- và NO3- không bị điện phân → xảy ra sự điện phân H2O
Vậy bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e.
Chọn B.
Câu 2:
Trong Thí nghiệm 1, kim loại bám vào catot sau khi dừng điện phân là
- A Cu, Fe.
- B Cu, Fe, Al.
- C Cu.
- D Fe, Al.
Đáp án: C
Phương pháp giải:
- Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
- Xác định các bán phản ứng điện phân đã diễn ra tại catot ⟹ kim loại bám vào catot
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Ta thấy tại catot ion Al3+ không bị điện phân nên không xét đến.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+
Vậy thứ tự điện phân tại catot là Fe3+, Cu2+, H+, Fe2+:
(1) Fe3+ + 1e → Fe2+
(2) Cu2+ + 2e → Cu
(3) 2H+ + 2e → H2
(4) Fe2+ + 2e → Fe
Theo đề bài, ta dừng điện phân khi bắt đầu xuất hiện khí thoát ra tại catot ⟹ bán phản ứng (2) vừa kết thúc
Các bán phản ứng đã diễn ra là:
(1) Fe3+ + 1e → Fe2+
(2) Cu2+ + 2e → Cu
Vậy sau khi dừng điện phân chỉ có kim loại Cu bám vào catot.
Chọn C.
Câu 3:
Trong Thí nghiệm 2, giá trị của m là
- A 7,24 gam.
- B 3,12 gam.
- C 6,5 gam.
- D 6,24 gam.
Đáp án: D
Phương pháp giải:
- Tính số mol e trao đổi
- Viết các bán phản ứng điện phân tại catot, đặt mol e vào và tính toán theo các bán phản ứng điện phân đó
- Xác định các kim loại bám vào catot → khối lượng catot tăng
Lời giải chi tiết:
32 phút 10 giây = 1930 giây
Số mol electron trao đổi là: \({n_e} = \frac{{It}}{F} = \frac{{5 \times 1930}}{{96500}} = 0,1\left( {mol} \right)\)
Thứ tự điện phân tại catot:
(1) Ag+ + 1e → Ag
0,04 → 0,04/0,06 → 0,04 (mol)
(2) Cu2+ + 2e → Cu
0,03/0,02 ← 0,06 → 0,03 (mol)
Vậy có 0,04 mol Ag và 0,03 mol Cu bám vào catot.
Khối lượng catot tăng là: m = 0,04.108 + 0,03.64 = 6,24 gam
Chọn D.
Tổng hợp 40 câu hỏi lý thuyết về điện phân đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
Tổng quan 40 câu hỏi lý thuyết mức độ nhận biết về điều chế kim loại đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 50 câu hỏi lý thuyết vê điều chế kim loại theo phương pháp thủy luyện và nhiệt luyện đầy đủ các dạng trắc nghiệm, tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 50 bài tập điện phân mức độ vận dụng đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 40 bài tập điện phân mức độ vận dụng cao đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết (phần 1)
Tổng hợp 40 bài tập vận dụng về khử oxit kim loại bằng (CO, H2, C) đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









