20 bài tập vận dụng cao về kim loại kiềm thổ và hợp chất có lời giải
Làm đề thiCâu hỏi 1 :
Hấp thụ hoàn toàn V lít CO2 vào dung dịch Ca(OH)2 a M thì thu được m1 gam kết tủa. Nếu hấp thụ (V + 3,36) lít CO2 vào dung dịch Ca(OH)2 trên thì thu được m2 gam kết tủa. Nếu thêm (V+V1) lít CO2 vào dung dịch Ca(OH)2 đã cho thì thu được lượng kết tủa cực đại. Biết m1 : m2 = 3 : 2 ; m1 bằng 3/7 khối lượng kết tủa cực đại ; các khí đều ở đktc). Giá trị của V1 là
- A 1.008.
- B 0.672.
- C 1.493.
- D 2.016.
Đáp án: C
Lời giải chi tiết:
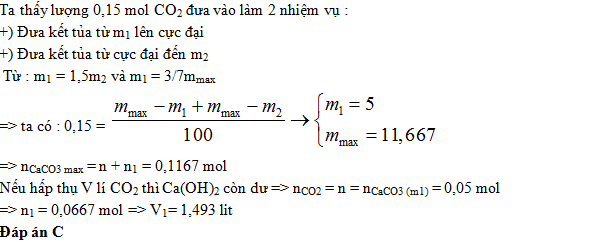
Câu hỏi 2 :
Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau khi các phản ứng kết thúc thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỷ khối so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
- A 154,0.
- B 150,0.
- C 135,0.
- D 143,0.
Đáp án: D
Phương pháp giải:
- Áp dụng qui tắc đường chéo tìm số mol NO và CO2
- Bảo toàn e
Lời giải chi tiết:
Áp dụng qui tắc đường chéo => nNO = nCO2 = 0,1mol
Hỗn hợp ban đầu gồm: Mg (a mol), MgO (b mol), MgCO3 (0,1 mol)
=> 24a + 40b + 84 . 0,1 = 30 => 24a + 40b = 21,6 (1)
X chứa: Mg(NO3)2 ( a + b + 0,1 mol), NH4NO3 (c mol)
Bảo toàn N: 2 (a + b + 0,1) + 2c + 0,1 = 2,15 => 2a + 2b + 2c = 1,85 (2)
Bảo toàn e: 2a = 0,1 . 3 + c . 8 => 2a – 8c = 0,3 (3)
Giải hệ (1) (2) (3) ta có a = 0,65, b = 0,15, c = 0,125
=> m= mMg(NO3)2 + mNH4NO3 = 148 . 0,9 + 80 . 0,125=143,2 g
Đáp án D
Câu hỏi 3 :
Hòa tan hết m gam hỗn hợp X gồm Mg, MgO, Mg(HCO3)2, MgSO3 bằng một lượng vừa đủ dung dịch H2SO4 30%, thu được 11,2 lít (đktc) hỗn hợp khí Y và dung dịch Z có nồng độ 36%. Tỉ khối của Y so với He bằng 8. Cô cạn Z được 72 gam muối khan. Giá trị của m là
- A 20
- B 10
- C 15
- D 25
Đáp án: A
Phương pháp giải:
Định luật bảo toàn khối lượng
Định luật bảo toàn nguyên tố
Lời giải chi tiết:
X + dd H2SO4 →dd Z : MgSO4 +↑ Y (CO2 + SO2+ H2)
Dd Z có C% =36% và có chứa 72 g muối nên mddZ = 72:36.100=200 g
nMgSO4= 0,6 mol → nSO4= 0,6 mol → nH2SO4 = 0,6 mol
→ mdd H2SO4 = 0,6.98 : 30.100= 196g
mY = nY. MY = 0,5.32=16(g)
Bảo toàn khối lượng
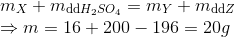
Đáp án A
Câu hỏi 4 :
Sục khí 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M. Sau phản ứng thu được dung dịch Y. Cho dung dịch Y tác dụng với 200 ml dung dịch hỗn hợp BaCl2 1,2M và KOH 1,5M thu được m gam kết tủa. Giá trị của m là:
- A 66,98
- B 39,4
- C 47,28
- D 59,1
Đáp án: D
Phương pháp giải:
Bảo toàn nguyên tố
Lời giải chi tiết:
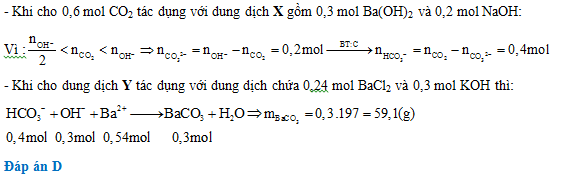
Câu hỏi 5 :
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa đồng thời 0,1 mol Ba(OH)2; 0,255 mol KOH và 0,2 mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và kết tủa Y. Nhỏ từ từ đến hết dung dịch X vào dung dịch chứa 0,35 mol HCl, sinh ra 0,25 mol CO2. Giá trị của V là
- A 9,520.
- B 12,432.
- C 7,280.
- D 5,600.
Đáp án: A
Phương pháp giải:
Tính nOH-
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = nB2(OH)2
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3-
=> V
Lời giải chi tiết:
nOH- = 0,1.2 + 0,225 + 0,2 = 0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3- = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít
Đáp án A
Câu hỏi 6 :
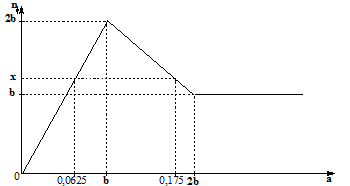
Hoà tan hết 37,86 gam hỗn hợp gồm: Ba, BaO, Al và Al2O3 vào lượng nước dư, thu được dung dịch X và 0,12 mol khí H2. Cho dung dịch HCl dư vào X, số mol kết tủa phụ thuộc và số mol HCl được biểu diễn trong đồ thị sau:
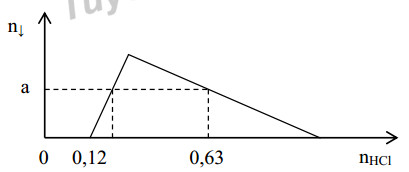
Giá trị của a là:
- A 0,15.
- B 0,18.
- C 0,12.
- D 0,16.
Đáp án: A
Lời giải chi tiết:
Đáp án A
Câu hỏi 7 :
Trên hai đĩa cân A, B đặt hai cốc thuỷ tinh: Cốc ở đĩa cân A chứa dung dịch H2SO4 và cốc ở đĩa cân B chứa dung dịch HCl, cân ở vị trí cân bằng. Cho 6,48 gam kim loại Mg vào cốc A và 6,16 gam kim loại hoá trị II vào cốc B. sau khi các phản ứng xảy ra, cân vẫn ở vị trí thăng bằng. Biết răng ở cả 2 cốc, kim loại đều tan hết. Kim loại B là:
- A Fe
- B Cr
- C Zn
- D Ba
Đáp án: A
Lời giải chi tiết:
Đáp án A
Câu hỏi 8 :
Hòa tan hoàn toàn 3,60 gam Mg trong 500 ml dung dịch HNO3 0,80M, phản ứng kết thúc thu được 448 ml một khí X (ở đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2,00M. Giá trị của V là:
- A 167,50.
- B 230,00.
- C 156,25.
- D 173,75.
Đáp án: D
Phương pháp giải:
m dd tăng = mMg – m khí => m khí
=> M khí = m khí : n khí
=> Khí là N2
Nhận thấy: 2nMg > 10nN2 => có tạo muối NH4NO3
BT electron: 2nMg = 10nN2 + 8nNH4NO3 => nNH4NO3
BTNT “N”: nHNO3 ban đầu = 2nMg(NO3)2 + 2nNH4NO3 + 2nN2 + nHNO3 dư
=> nHNO3 dư
Thành phần dung dịch Y là: Mg(NO3)2, NH4NO3 và HNO3 dư
Khi cho NaOH vào dd Y: nNaOH = nHNO3 dư + 2nMg(NO3)2 + nNH4NO3
=> V dd NaOH = n : CM
Lời giải chi tiết:
nMg = 3,6 : 24 = 0,15 mol; n khí = 0,448 : 22,4 = 0,02 mol
m dd tăng = mMg – m khí => m khí = mMg – m dd tăng = 3,6 – 3,04 = 0,56 gam
=> M khí = m khí : n khí = 0,56 : 0,02 = 28
=> Khí là N2
Nhận thấy: 2nMg (= 0,3 mol) > 10nN2 (= 0,2 mol) => có tạo muối NH4NO3
BT electron: 2nMg = 10nN2 + 8nNH4NO3 => 2.0,15 = 10.0,02 + 8nNH4NO3
=> nNH4NO3 = 0,0125 mol
BTNT “N”: nHNO3 ban đầu = 2nMg(NO3)2 + 2nNH4NO3 + 2nN2 + nHNO3 dư
=> 0,5.0,8 = 2.0,15 + 2.0,0125 + 2.0,02+ nHNO3 dư
=> nHNO3 dư = 0,035 mol
Thành phần dung dịch Y là: Mg(NO3)2 (0,15 mol), NH4NO3 (0,0125 mol) và HNO3 dư (0,035 mol)
Khi cho NaOH vào dd Y: nNaOH = nHNO3 dư + 2nMg(NO3)2 + nNH4NO3 = 0,035 + 2.0,15 + 0,0125 = 0,3475 mol
=> V dd NaOH = n : CM = 0,3475 : 2 = 0,17375 lít = 173,75 ml
Đáp án D
Câu hỏi 9 :
Cho hỗn hợp X gồm 6,12 gam kim loại M và 3,6 gam oxit của nó (M có hóa trị không đổi) tác dụng với 400 ml dung dịch chứa hỗn hợp H2SO4 1M và KNO3 vừa đủ, sau phản ứng thu được dung dịch Y chỉ chứa các muối sunfat trung hòa và 1,47 gam hỗn hợp khí T gồm N2, N2O, H2. Cho dung dịch NaOH 1M dư vào dung dịch Y, sau khi các phản ứng xảy ra hoàn toàn thì có 705 ml dung dịch NaOH phản ứng, lượng kết tủa thu được đem nung trong không khí đến khối lượng không đổi thu được 13,8 gam chất rắn khan. Xác định % theo số mol từng khí trong T?
- A 20,4%; 20,4% và 59,2%
- B 36,36%; 36,36% ; 27,28%
- C 38,38%; 38,38%; 23,24%
- D 25%; 25%; 50%
Đáp án: B
Phương pháp giải:
- Bảo toàn điện tích
- Bảo toàn khối lượng
- Bảo toàn nguyên tố
Lời giải chi tiết:
Gọi n là hóa trị của kim loại M → Oxit của M là M2On
- Khi cho dung dịch NaOH vào dung dịch Y thu được kết tủa vầ khối lượng chất rắn khan lớn hơn khối lượng của X → Chất rắn khan là oxit (M2On)
- Dung dịch Y sau phản ứng chứa các ion Mn+, K+, SO42- có thể có NH4+
- Khối lượng oxi trong oxit do M tạo ra là: (13,8- 6,12- 3,6): 16 = 0,255 mol
\( \to {n_M} = \frac{2}{n}{n_O} = \frac{{2.0,255}}{n} = \frac{{0,51}}{n}mol \to M = \frac{{6,12}}{{0,51}}n = 12n\)
Xét n = 2 thì M = 24 (Mg)
Ta có: nMg2+ = nMg+ nMgO = 0,345 mol
*Khi cho dung dịch Y tác dụng với dung dịch NaOH
OH- + NH4+→ NH3 + H2O
2OH- + Mg2+ → Mg(OH)2
→ nOH- = nNH4+ + 2.nMg2+ = 0,705 mol → nNH4+ = 0,705- 2.0,345 = 0,015 mol
Áp dụng định luật bảo toàn điện tích cho dung dịch Y ta có nK+ = nKNO3 = 0,095 mol
*Áp dụng định luật bảo toàn khối lượng ta có: mX + mH2SO4 + mKNO3 = mmuối trong Y + mT + mH2O
→ mH2O = 6,39 gam → nH2O = 0,355 mol
*Áp dụng bảo toàn nguyên tố H: 2.nH2SO4 = 2.nH2+ 4.nNH4++ 2.nH2O → nH2 = 0,4- 2.0,105- 0,355 = 0,015 mol
*Gọi số mol khí N2 và N2O lần lượt là x, y (x, y>0)
Ta có: mN2+ mN2O+ mH2 = 1,47 gam → 28x + 44y = 1,44 (1)
Mặt khác: nKNO3 = 2.nN2+ 2.nN2O+ nNH4+ → 2x + 2y = 0,08 (2)
Từ (1 và (2) ta có x = 0,02 và y = 0,02
Vậy các khí trong T có số mol là 0,02 mol N2; 0,02 mol N2O và 0,015 mol H2
Từ đó ta tính được % số mol N2 là 36,36%; %số mol N2O là 36,36% và %H2 là 27,28%
Đáp án B
Câu hỏi 10 :
Cho 3,64 gam hỗn hợp R gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M. Xác định kim loại M và tính % khối lượng hiđroxit của kim loại M có trong hỗn hợp R.
- A Mg; 31,87%
- B Ca; 46,15%
- C Mg; 21,98%
- D Ca; 24,55%
Đáp án: A
Phương pháp giải:
Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng
(1) MO + H2SO4 -> MSO4 + H2O
(2) M(OH)2 + H2SO4 -> MSO4 + 2H2O
(3) MCO3 + H2SO4 -> MSO4 + H2O + CO2
Nếu tạo muối axít ta có các phản ứng
(4) MO + 2H2SO4 -> M(HSO4)2 + H2O
(5) M(OH)2 + 2H2SO4 -> M(HSO4)2 + 2H2O
(6) MCO3 + 2H2SO4 -> M(HSO4)2 + H2O + CO2
Ta có :
m dd muối = D.V.1000 => m muối = D.V.C%.1000 (V đơn vị là lít)
n muối = CM.V (V đơn vị lít)
M = m muối : n muối = D.C%.1000/CM = 1,093.10,867%.1000/0,545 = 218 gam/mol
Xét 2 trường hợp :
- TH1: Nếu muối là MSO4
- TH2: Nếu là muối M(HSO4)2
Lời giải chi tiết:
a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng
(1) MO + H2SO4 MSO4 + H2O
(2) M(OH)2 + H2SO4 MSO4 + 2H2O
(3) MCO3 + H2SO4 MSO4 + H2O + CO2
Nếu tạo muối axít ta có các phản ứng
(4) MO + 2H2SO4 M(HSO4)2 + H2O
(5) M(OH)2 + 2H2SO4 M(HSO4)2 + 2H2O
(6) MCO3 + 2H2SO4 M(HSO4)2 + H2O + CO2
Ta có :
m dd muối = D.V.1000 => m muối = D.V.C%.1000 (V đơn vị là lít)
n muối = CM.V (V đơn vị lít)
M = m muối : n muối = D.C%.1000/CM = 1,093.10,867%.1000/0,545 = 218 gam/mol
- TH1: Nếu muối là MSO4 => M +96 = 218 => M =122 (loại)
- TH2: Nếu là muối M(HSO4)2 => M + 97.2 = 218 => M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4,5,6) => Số mol CO2 = 0,448/22,4 = 0,02 mol => z = 0,02 (I)
n H2SO4 = 117,6.10/98 = 0,12 mol => 2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III) : x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%
Đáp án A
Câu hỏi 11 :
Cho 9,6 gam Mg tác dụng với dung dịch chứa 1,2 mol HNO3, thu được dung dịch X và m gam hỗn hợp khí. Thêm 500 ml dung dịch NaOH 2M vào X, thu được dung dịch Y, kết tủa và 1,12 lít khí Z (đktc). Lọc bỏ kết tủa, cô cạn Y thu được chất rắn T. Nung T đến khối lượng không đổi, thu được 67,55 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
- A 5,8
- B 6,8
- C 4,4
- D 7,6
Đáp án: D
Lời giải chi tiết:
Nhận xét nếu 1 mol NaOH cho vào X mà phản ứng vừa đủ → nNaNO3 = 1 mol
Nung đến khối lượng không đổi thu được NaNO2: nNaNO2 = nNaNO3 = 1 mol
Khi đó mNaNO2 = 1. 69 = 69 gam > 67,55 gam
→ Chứng tỏ T có chứa x mol NaNO3 và y mol NaOH dư
Nung T đến khối lượng không đổi thu được NaNO2 (x mol) và NaOH (y mol)
BTNT “Na”: nNaOH = nNaNO2 + nNaOH dư => x + y = 1 (1)
m chất rắn = 69x + 40y = 67,55 (2)
Giải hệ trên ta có: x = 0,95 và y = 0,05
Mặt khác: NaOH + X → dung dịch Y và 0,05 mol khí Z (khí NH3)
Nên chứng tỏ dung dịch Y có chứa 0,05 muối NH4NO3
Ta có sơ đồ phản ứng:
0,4 mol Mg + 1,2 mol HNO3 → 0,4 mol Mg2+, 0,05 mol NH4+, H+ còn dư và 0,95 mol NO3- + (N; O) + H2O
Áp dụng định luật bảo toàn điện tích với dung dịch Y ta có:
nH+ = 0,95 - (0,4.2+ 0,05) = 0,1mol
Bảo toàn nguyên tố H ta tính được nH2O = (1,2- 0,05.4- 0,1)/2 = 0,45 mol
Bảo toàn nguyên tố O ta tính được nO (spk) = 0,3 mol
Bảo toàn nguyên tố N ta tính được nN (spk) = 0,2 mol
Vậy mspk = mO+ mN = 0,3. 16 + 0,2.14 = 7,6 gam
Đáp án D
Câu hỏi 12 :
Cho 15,12 gam hỗn hợp X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó nguyên tố oxi chiếm 28,57% về khối lượng) vào dung dịch chứa 0,06 mol HNO3 và 0,82 mol NaHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa các muối trung hòa có khối lượng 107,54 gam và a gam hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Giá trị gần nhất của a là.
- A 3,50.
- B 3,30.
- C 3,25.
- D 3,00.
Đáp án: B
Phương pháp giải:
\(X\left\{ \matrix{
Mg \hfill \cr
MgC{O_3} \hfill \cr
Mg{(N{O_3})_2} \hfill \cr} \right. + \left\{ \matrix{
HN{O_3}:0,6 \hfill \cr
NaHS{O_4}:0,82 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \left\langle \matrix{
Y\left. {\left\{ \matrix{
M{g^{2 + }} \hfill \cr
N{a^ + }:0,82 \hfill \cr
N{H_4}^ + \hfill \cr
S{O_4}^{2 - }:0,82 \hfill \cr} \right.} \right\}107,54\,g \hfill \cr
Z\left\{ \matrix{
{N_2}O \hfill \cr
C{O_2} \hfill \cr
{N_2} \hfill \cr
{H_2} \hfill \cr} \right. \hfill \cr} \right. + {H_2}O\)
Trong Y đặt:
\(\left\{ \matrix{
{n_{Mg2 + }} = u(mol) \hfill \cr
{n_{N{H_4} + }} = v(mol) \hfill \cr} \right.\)
Ta có hệ phương trình: \(\left\{ \matrix{
\buildrel {BT\,dien\,tich} \over
\longrightarrow 2{n_{M{g^{2 + }}}} + {n_{N{a^ + }}} + {n_{N{H_4}^ + }} = 2{n_{S{O_4}^{2 - }}} \hfill \cr
{m_Y} = {m_{M{g^{2 + }}}} + {m_{N{a^ + }}} + {m_{N{H_4}^ + }} + {m_{S{O_4}^{2 - }}} = 107,54 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
u = ? \hfill \cr
v = ? \hfill \cr} \right.\)
Trong X đặt số mol Mg, MgCO3 và Mg(NO3)2 lần lượt là x, y, z (mol)
Ta có hệ 3 phương trình:
\(\left\{ \matrix{
{m_X} = 24x + 84y + 148z = 15,12 \hfill \cr
{n_O} = 3y + 6z = {{15,12.28,75\% } \over {100\% .16}} = 0,27 \hfill \cr
{n_{Mg}} = x + y + z = u \hfill \cr} \right. \Rightarrow \left\{ \matrix{
x = ? \hfill \cr
y = ? \hfill \cr
z = ? \hfill \cr} \right.\)
BTNT “C”=> nN2O = nCO2 = y=? (mol)
Trong Z: đặt nH2 = b (mol); nN2 = c (mol)
BTNT “H”: nHNO3 + nNaHSO4 = 4nNH4+ + 2nH2 + 2nH2O => nH2O = 0,4 – b (mol)
=> nH+ bđ = 10nN2O + 12nN2 + 10nNH4+ + 2nH2 + 2nCO2
=> 2b +12c = 0,32 (1)
BTNT “O” nO(X) + 3nHNO3 + 4nNaHSO4 = 4nSO42- + nN2O + 2nCO2 + nH2O
=> b = ? (mol)
Từ (1) => c = ?
=> mZ = mN2O + mCO2 + mN2 + mH2 = ?
Lời giải chi tiết:
\(X\left\{ \matrix{
Mg \hfill \cr
MgC{O_3} \hfill \cr
Mg{(N{O_3})_2} \hfill \cr} \right. + \left\{ \matrix{
HN{O_3}:0,6 \hfill \cr
NaHS{O_4}:0,82 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \left\langle \matrix{
Y\left. {\left\{ \matrix{
M{g^{2 + }} \hfill \cr
N{a^ + }:0,82 \hfill \cr
N{H_4}^ + \hfill \cr
S{O_4}^{2 - }:0,82 \hfill \cr} \right.} \right\}107,54\,g \hfill \cr
Z\left\{ \matrix{
{N_2}O \hfill \cr
C{O_2} \hfill \cr
{N_2} \hfill \cr
{H_2} \hfill \cr} \right. \hfill \cr} \right. + {H_2}O\)
Trong Y đặt:
\(\left\{ \matrix{
{n_{Mg2 + }} = u(mol) \hfill \cr
{n_{N{H_4} + }} = v(mol) \hfill \cr} \right.\)
Ta có hệ phương trình:
\(\eqalign{
& \left\{ \matrix{
\buildrel {BT\,dien\,tich} \over
\longrightarrow 2{n_{M{g^{2 + }}}} + {n_{N{a^ + }}} + {n_{N{H_4}^ + }} = 2{n_{S{O_4}^{2 - }}} \hfill \cr
{m_Y} = {m_{M{g^{2 + }}}} + {m_{N{a^ + }}} + {m_{N{H_4}^ + }} + {m_{S{O_4}^{2 - }}} = 107,54 \hfill \cr} \right. \cr
& \Rightarrow \left\{ \matrix{
2u + 0,82 + v = 2.0,82 \hfill \cr
24u + 0,82.23 + 18v + 0,82.96 = 107,54 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
u = 0,4 \hfill \cr
v = 0,02 \hfill \cr} \right. \cr} \)
Trong X đặt số mol Mg, MgCO3 và Mg(NO3)2 lần lượt là x, y, z (mol)
Ta có hệ 3 phương trình:
\(\left\{ \matrix{
{m_X} = 24x + 84y + 148z = 15,12 \hfill \cr
{n_O} = 3y + 6z = {{15,12.28,75\% } \over {100\% .16}} = 0,27 \hfill \cr
{n_{Mg}} = x + y + z = 0,4 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
x = 0,34 \hfill \cr
y = 0,03 \hfill \cr
z = 0,03 \hfill \cr} \right.\)
BTNT “C”=> nCO2 = 0,03 => nN2O = nCO2 = 0,03 (mol)
Trong Z: đặt nH2 = b (mol); nN2 = c (mol)
BTNT “H”: nHNO3 + nNaHSO4 = 4nNH4+ + 2nH2 + 2nH2O
=> 0,06 + 0,82 = 4.0,02 + 2b + 2nH2O
=> nH2O = 0,4 – b (mol)
2NO3- + 10H+ + 8e → N2O + 5H2O
2NO3- + 12H+ + 10e → N2 + 5H2O
NO3- + 10H+ +8e → NH4+ + 3H2O
2H+ +2e → H2
2H+ + CO32- → CO2 + H2O
=> nH+ bđ = 10nN2O + 12nN2 + 10nNH4+ + 2nH2 + 2nCO2
=> 0,88 = 10.0,03 + 12c + 10.0,02 + 2b + 2.0,03
=> 2b +12c = 0,32 (1)
BTNT “O” nO(X) + 3nHNO3 + 4nNaHSO4 = 4nSO42- + nN2O + 2nCO2 + nH2O
=> 0,27 + 3.0,06 + 4.0,82 = 4.0,82 + 0,03 + 2.0,03 + 0,4 - b
=> b = 0,04 (mol)
Từ (1) => c = 0,02
=> mZ = mN2O + mCO2 + mN2 + mH2 = 0,03.44 + 0,03.44 + 0,02.28 + 0,04.2 = 3,28 (g) gần nhất với 3,3
Đáp án B
Câu hỏi 13 :
Cho từ từ dung dịch chứa a mol Ba(OH)2 vào dung dịch chứa b mol ZnSO4. Đồ thị biểu diễn số mol kết tủa theo giá trị của a như sau:
Giá trị của b + x là:
- A 0,225.
- B 0,275.
- C 0,125.
- D 0,100.
Đáp án: A
Phương pháp giải:
- Tại a = 0,0625 thì Zn(OH)2 chưa bị hòa tan và BaSO4 chưa đạt cực đại:
nBaSO4 = nBa(OH)2 => nZn(OH)2
x = n↓ = nBaSO4 + nZn(OH)2
- Tại a = 0,175 mol thì Zn(OH)2 bị hòa tan một phần, BaSO4 vẫn đạt cực đại:
nBaSO4 = b mol
nZn(OH)2 = x – b = 0,125 – b (mol)
nOH- = 4nZn2+ - 2nZn(OH)2 => b
Tính được b + x
Lời giải chi tiết:
- Tại a = 0,0625 thì Zn(OH)2 chưa bị hòa tan và BaSO4 chưa đạt cực đại:
nBaSO4 = nBa(OH)2 = 0,0625 mol
nZn(OH)2 = 0,0625 mol
x = n↓ = nBaSO4 + nZn(OH)2 = 0,125 mol
- Tại a = 0,175 mol thì Zn(OH)2 bị hòa tan một phần, BaSO4 vẫn đạt cực đại:
nBaSO4 = b mol
nZn(OH)2 = x – b = 0,125 – b (mol)
nOH- = 4nZn2+ - 2nZn(OH)2 => 0,175.2 = 4b – 2.(0,125 – b) => b = 0,1
Vậy b + x = 0,1 + 0,125 = 0,225
Đáp án A
Câu hỏi 14 :
Cho 30,24 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó, nguyên tố oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,12 mol HNO3 và 1,64 mol NaHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 215,08 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Tỉ khối hơi của Z so với He bằng a. Giá trị gần nhất của a là
- A 7,0
- B 6,5
- C 8,0
- D 7,5
Đáp án: A
Phương pháp giải:
Do khí thu được có chứa H2 nên dd Y không chứa NO3-.
Sơ đồ bài toán:
\(30,24(g)X\left\{ \matrix{
Mg \hfill \cr
MgC{O_3} \hfill \cr
Mg{(N{O_3})_2} \hfill \cr} \right. + \left\{ \matrix{
HN{O_3}:0,12 \hfill \cr
NaHS{O_4}:1,64 \hfill \cr} \right. \to 215,08(g)\left\{ \matrix{
M{g^{2 + }} \hfill \cr
N{a^ + }:1,64 \hfill \cr
N{H_4}^ + \hfill \cr
S{O_4}^{2 - }:1,64 \hfill \cr} \right. + Z\left\{ \matrix{
{N_2}O \hfill \cr
C{O_2} \hfill \cr
{N_2} \hfill \cr
{H_2} \hfill \cr} \right. + {H_2}O\)
Sử dụng định luật bảo toàn điện tích, bảo toàn nguyên tố để tính số mol của các chất, ion.
Lời giải chi tiết:
Do khí thu được có chứa H2 nên dd Y không chứa NO3-.
Sơ đồ bài toán:
\(30,24(g)X\left\{ \matrix{
Mg \hfill \cr
MgC{O_3} \hfill \cr
Mg{(N{O_3})_2} \hfill \cr} \right. + \left\{ \matrix{
HN{O_3}:0,12 \hfill \cr
NaHS{O_4}:1,64 \hfill \cr} \right. \to 215,08(g)\left\{ \matrix{
M{g^{2 + }} \hfill \cr
N{a^ + }:1,64 \hfill \cr
N{H_4}^ + \hfill \cr
S{O_4}^{2 - }:1,64 \hfill \cr} \right. + Z\left\{ \matrix{
{N_2}O \hfill \cr
C{O_2} \hfill \cr
{N_2} \hfill \cr
{H_2} \hfill \cr} \right. + {H_2}O\)
- Xét dd Y: Đặt nMg2+ = x và nNH4+ = y (mol)
+ m muối = mMg2+ + mNa+ + mNH4+ + mSO42- => 24x + 1,64.23 + 18y + 1,64.96 = 215,08 (1)
+ BTĐT: 2nMg2+ + nNa+ + nNH4+ = 2nSO42- => 2x + 1,64 + y = 1,64.2 (2)
Giải hệ (1) và (2) thu được x = 0,8 và y = 0,04
- Xét hỗn hợp X: mO = 30,24.28,57% = 8,64 gam => nO = 0,54 mol
Đặt nMg = a; nMgCO3 = b; nMg(NO3)2 = c (mol)
+ BTNT “Mg”: nMg2+ = a + b + c = 0,8 (3)
+ mX = 24a + 84b + 148c = 30,24 (4)
+ nO(X) = 3b + 6c = 0,45 (5)
Giải hệ (3), (4), (5) được a = 0,68; b = 0,06; c = 0,06
- Xét hỗn hợp khí Z:
nCO2 = nMgCO3 = 0,06 mol => nN2O = 0,06 mol (theo giả thiết số mol N2O bằng số mol CO2)
BTNT “N”: 2nMg(NO3)2 + nHNO3 = nNH4+ + 2nN2O + 2nN2
=> 2.0,06 + 0,12 = 0,04 + 2.0,06 + 2nN2 => nN2 = 0,04 mol
Mặt khác, BTNT “O”: nO(X) + 3nHNO3 + 4nNaHSO4 = 4nSO42- + nN2O + 2nCO2 + nH2O
=> 0,54 + 0,12.3 + 1,64.4 = 1,64.4 + 0,06 + 2.0,06 + nH2O => nH2O = 0,72 mol
BTNT “H”: nHNO3 + nNaHSO4 = 4nNH4+ + 2nH2 + 2nH2O
=> 0,12 + 1,64 = 4.0,04 + 2nH2 + 2.0,72 => nH2 = 0,08 mol
Vậy hỗn hợp khí Z gồm có: N2O (0,06 mol); CO2 (0,06 mol); N2 (0,04 mol); H2 (0,08 mol)
MZ = \({{0,06.44 + 0,06.44 + 0,04.28 + 0,08.2} \over {0,06 + 0,06 + 0,04 + 0,08}}\) = 82/3
=> dZ/He = 82/3 : 4 = 41/6 = 6,83 gần nhất với 7
Đáp án A
Câu hỏi 15 :
Cho 6,048 gam Mg phản ứng hết với 189 gam dung dịch HNO3 40% thu được dung dịch X (không chứa muối amoni) và hỗn hợp khí là oxit của nitơ. Thêm 392 gam dung dịch KOH 20% vào dung dịch X, đun (cả phần dung dịch và kết tủa) đến cạn được chất rắn Y, nung Y đến khối lượng không đổi thu được 118,06 gam chất rắn Z. Hãy xác định nồng độ % của Mg(NO3)2 trong X ?
- A 19,7%.
- B 17,2%.
- C 21,2%.
- D 24,8%.
Đáp án: A
Phương pháp giải:
Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn electron.
Lời giải chi tiết:
nMg = 0,252 mol; nHNO3 = 1,2 mol; nKOH = 1,4 mol
Chất rắn gồm 0,252 mol MgO và KNO2: x mol ; y mol KOH
=> x + y = nKOH = 1,4 mol ; mrắn = 0,252.40 + 85x + 56y = 118,06g
=> x = 1,02 ; y = 0,38 mol
=> nMg(NO3)2 = nMgO = 0,252 mol
Bảo toàn N: nN(sản phẩm khử) = nHNO3 – nKNO2 = 0,18 mol
Gọi số electron mà N+5 nhận trung bình là n, ta có 0,18.n = 0,252.2 => n = 2,8
Vậy CT oxit thoát ra là N2O2,2 với số mol là 0,18/2 = 0,09
=> mkhí = 0,09.(28 + 16.2,2) = 5,688
BTKL: mdung dịch X = 6,048 +189 - 5,688 = 189,36 gam
Dung dịch X chứa 0,252 mol Mg(NO3)2; 0,516 mol HNO3 dư (1,2 - 2.0,252 - 0,18 = 0,516 )
C%Mg(NO3)2 = 19,696% ≈ 19,7%
Đáp án A
Câu hỏi 16 :
Hòa tan hết m gam hỗn hợp X gồm Na, K, Ba, Na2O, K2O, BaO (trong X oxi chiếm 7,5% về khối lượng) vào nước thu được dung dịch Y và 0,896 lít khí H2. Cho hết Y vào 200 ml dung dịch AlCl3 0,2M, sau khi các phản ứng kết thúc, thu được 1,56 gam kết tủa. Giá trị của m là:
- A 7,2
- B 5,6
- C 6,4
- D 6,8
Đáp án: C
Phương pháp giải:
Quy đổi hỗn hợp X thành Na, K, Ba và O Suy ra mO = 0,075m (gam)
Dung dịch Y có chứa Na+, K+, Ba2+ và OH-.
Ta có: nAlCl3 = 0,04 mol; nAl(OH)3 = 0,02 mol
Do nAl3+ > nAl(OH)3 nên có 2 trường hợp sau:
*Trường hợp 1: Al3+ dư.
*Trường hợp 2: Al3+ phản ứng hết.
Trong 2 trường hợp dùng bảo toàn e và bảo toàn điện tích để tìm giá trị m.
Lời giải chi tiết:
Quy đổi hỗn hợp X thành Na, K, Ba và O
Suy ra mO = 0,075m (gam)
Dung dịch Y có chứa Na+, K+, Ba2+ và OH-.
Ta có: nAlCl3 = 0,04 mol; nAl(OH)3 = 0,02 mol
Do nAl3+ > nAl(OH)3 nên có 2 trường hợp sau:
*Trường hợp 1: Al3+ dư.
Khi đó nOH- = 3nAl(OH)3 = 0,06 mol
Dung dịch Y có chứa x mol Na+, y mol K+, z mol Ba2+ và 0,06 mol OH-.
Theo bảo toàn điện tích ta có x + y + 2z = 0,06 mol
Theo định luật bảo toàn electron ta có: x + y + 2z = 2.nO + 2nH2 = 2.0,075m/16 + 2. 0,04
→ 0,06 = 2.0,075m/16 + 2. 0,04 → m < 0 nên loại.
*Trường hợp 2: Al3+ phản ứng hết.
Khi đó nOH- = 4nAl3+ - nAl(OH)3 = 4.0,04 - 0,02 = 0,14mol
Dung dịch Y có chứa x mol Na+, y mol K+, z mol Ba2+ và 0,14 mol OH-.
Theo bảo toàn điện tích ta có x + y + 2z = 0,14 mol
Theo định luật bảo toàn electron ta có: x + y + 2z = 2.nO + 2nH2 = 2.0,075m/16 + 2. 0,04
→ 0,14 = 2.0,075m/16 + 2. 0,04 → m = 6,4 (gam)
Đáp án C
Câu hỏi 17 :
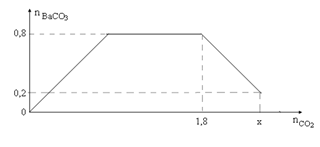
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị bên. Tổng nồng độ phần trăm khối lượng của các chất tan có trong dung dịch sau phản ứng là
- A 51,08%.
- B 42,17%.
- C 45,11%.
- D 55,45%.
Đáp án: C
Phương pháp giải:
Thứ tự phản ứng:
Ba(OH)2 + CO2 → BaCO3 + H2O (1)
2KOH + CO2 → K2CO3 + H2O (2)
K2CO3 + H2O + CO2 → 2KHCO3 (3)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (4)
Phân tích đồ thị ứng với các phản ứng xảy ra:
+ Đoạn 1: Đồ thị đi lên xảy ra (1)
+ Đoạn 2: Đồ thị nằm ngang xảy ra (2) (3)
+ Đoạn 3: Đồ thị đi xuống xảy ra (4)
Áp dụng các định luật bảo toàn nguyên tố, bảo toàn khối lượng tìm số mol sản phẩm tại các điểm.
Lời giải chi tiết:
Thứ tự phản ứng:
Ba(OH)2 + CO2 → BaCO3 + H2O (1)
2KOH + CO2 → K2CO3 + H2O (2)
K2CO3 + H2O + CO2 → 2KHCO3 (3)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (4)
Phân tích đồ thị ứng với các phản ứng xảy ra:
+ Đoạn 1: Đồ thị đi lên xảy ra (1)
+ Đoạn 2: Đồ thị nằm ngang xảy ra (2) (3)
+ Đoạn 3: Đồ thị đi xuống xảy ra (4)
nBaCO3 max = 0,8 mol => nBa(OH)2 = nBaCO3 max = 0,8 mol
- Tại nCO2 = 0,8 mol: Phản ứng (3) vừa kết thúc
Sản phẩm gồm: KHCO3 và BaCO3 (0,8 mol)
BTNT "C": nCO2 = nBaCO3 + nKHCO3 => 1,8 = 0,8 + nKHCO3 => nKHCO3 = 1 mol
=> nKOH bđ = nKHCO3 = 1 mol
- Tại nCO2 = x mol thì kết tủa đã bị hòa tan 1 phần
=> nBaCO3 bị tan = 0,8 - 0,2 = 0,6 mol
=> nBa(HCO3)2 = nBaCO3 bị tan = 0,6 mol
Lúc này sản phầm gồm: KHCO3 (1 mol), BaCO3 (0,2 mol) và Ba(HCO3)2 (0,6 mol)
BTNT "C": nCO2 = nKHCO3 + nBaCO3 + 2nBa(HCO3)2 = 1 + 0,2 + 2.0,6 = 2,4 mol
*Xét dung dịch tại nCO2 = 2,4 mol:
- BTKL: m dd sau pư = mCO2 + m dd KOH+Ba(OH)2 - mBaCO3 = 2,4.44 + 500 - 0,2.197 = 566,2 gam
- Khối lượng các chất tan: m chất tan = mKHCO3 + mBa(HCO3)2 = 1.100 + 0,6.259 = 255,4 gam
=> ∑C% chất tan = 255,4/566,2.100% = 45,11%
Đáp án C
Câu hỏi 18 :
Hỗn hợp X gồm C và S. Cho m gam X tác dụng với dung dịch HNO3 đặc, nóng dư sau phản ứng thu được hỗn hợp X gồm 3 chất khí, trong đó NO2 có thể tích là 8,96 lít (sản phẩm khử duy nhất). Mặt khác, nếu đốt cháy hoàn toàn m gam X rồi hấp thụ vào lượng dư dung dịch Ba(OH)2 0,5M. Thể tích dung dịch Ba(OH)2 đã tham gia phản ứng là
- A 100ml.
- B 200ml.
- C 300ml.
- D 400ml.
Đáp án: B
Lời giải chi tiết:
Đáp án B
Câu hỏi 19 :
Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,01 mol Ca(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn như đồ thị:
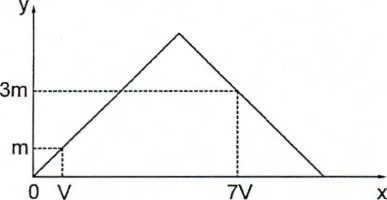
Giá trị của m là
- A 0,20.
- B 0,24.
- C 0,72.
- D 1,00.
Đáp án: A
Lời giải chi tiết:
Đáp án A
Câu hỏi 20 :
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
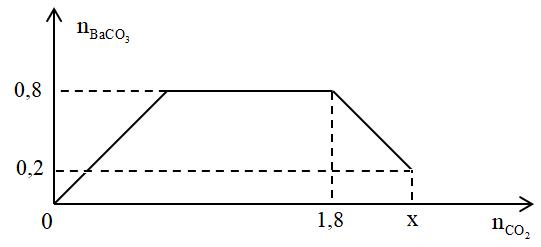
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
- A 45,11%.
- B 51,08%.
- C 42,17%.
- D 55,45%.
Đáp án: A
Lời giải chi tiết:
Đáp án A
30 bài tập CO2 tác dụng với Ca(OH)2; Ba(OH)2 có đáp án và lời giải
30 bài tập vận dụng về kim loại kiềm thổ và hợp chất có đáp án và lời giải chi tiết
20 câu hỏi lý thuyết về nước cứng có đáp án và lời giải chi tiết
15 bài tập về nước cứng có đáp án và lời giải chi tiết
50 câu hỏi lý thuyết mức độ nhận biết về kim loại kiềm thổ và hợp chất có đáp án và lời giải chi tiết
20 bài tập CO2 tác dụng với dung dịch kiềm thổ có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









