Đề số 4 - Đề kiểm tra giữa học kì II - Hóa học 9 có đáp án và lời giải chi tiết
Đề số 4 - Đề kiểm tra giữa học kì II - Hóa học 9 có đáp án và lời giải chi tiết
Đề bài
I. TRẮC NGHIỆM (3 điểm)
Câu 1 : Hợp chất nào sau đây là hợp chất hữu cơ?
A. CaC2.
B. KCN.
C. C4H10O.
D. CO2.
Câu 2 : Clo hóa metan (tỉ lệ mol 1 : 1) dưới điều kiện ánh sáng thu được sản phẩm hữu cơ là
A. CH2Cl2.
B. CH3Cl.
C. CCl4.
D. CHCl3.
Câu 3 : Để nhận biết khí axetilen trong hỗn hợp khí X gồm metan, etilen và axetilen có thể sử dụng thuốc thử là
A. dung dịch brom.
B. dung dịch nước vôi trong.
C. dung dịch axit sunfuric.
D. dung dịch AgNO3/NH3.
Câu 4 : V lít khí etilen (đktc) làm mất màu vừa đủ 60 gam dung dịch brom 40%. Giá trị của V là
A. 3,36.
B. 1,68.
C. 2,24.
D. 4,48.
Câu 5 : Hiđrocacbon X có tỉ khối hơi so với khí oxi là 0,875. Phần trăm khối lượng cacbon trong X là 85,71%. Tên gọi của X là
A. metan.
B. benzen.
C. etilen.
D. axetilen.
Câu 6 : Công thức cấu tạo của hợp chất hữu cơ X có công thức phân tử C3H6 là
A. CH3 – CH2 – CH3.
B. CH2 = CH – CH3.
C. CH2 ≡ CH – CH3.
D. CH2 = CH2 = CH2.
II. TỰ LUẬN (7 điểm)
Câu 7 : Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện phản ứng nếu có)
Câu 8 : Đốt cháy hoàn toàn 0,075 mol hợp chất hữu cơ X cần vừa đủ 0,225 mol khí oxi thu được 3,36 lít khí CO2 (đktc) và 4,05 g hơi nước.
a) Xác định công thức phân tử của X.
b) Xác định tất cả các công thức cấu tạo có thể có của X.
Câu 9 : Dẫn V lít hỗn hợp khí X gồm benzen, metan và etilen vào bình đựng dung dịch brom dư thấy 1,232 lít khí Y thoát ra và khối lượng bình đựng dung dịch brom tăng 0,42 g. Đốt cháy hoàn toàn lượng khí Y thoát ra cần vừa đủ 30,8 lít không khí (đktc). Biết không khí chứa 20% khí oxi.
a) Viết phương trình hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có).
b) Xác định thành phần phần trăm về thể tích mỗi khí trong hỗn hợp X.
Lời giải chi tiết
Hợp chất hữu cơ là hợp chất của cacbon, chỉ có một số ít không là hợp chất hữu cơ (như CO, CO2, H2CO3, các muối cacbonat kim loại…)
C4H10O là hợp chất hữu cơ.
Đáp án C
Câu 2
CH4 + Cl2 \(\xrightarrow{a/s}\) CH3Cl + HCl
Đáp án B
Câu 3
Để nhận biết khí axetilen trong hỗn hợp khí X gồm metan, etilen và axetilen có thể sử dụng dung dịch AgNO3/NH3.
PTHH: C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
Hiện tượng: xuất hiện kết tủa vàng.
Đáp án D
Câu 4
\({{n}_{B{{r}_{2}}}}=\frac{m}{M}=\frac{{{m}_{\text{dd}}}.C%}{M.100%}=0,15(mol)\)
PTHH: C2H4 + Br2 → C2H4Br2
Theo PTHH ⟹ \({{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{r}_{2}}}}=0,15(mol)\)
Vậy V = 0,15.22,4 = 3,36 lít.
Đáp án A
Câu 5
Ta có: \({{M}_{X}}=0,875.{{M}_{{{O}_{2}}}}=0,875.32=28\)
Gọi CTPT của X là CxHy
\(x=\frac{%{{m}_{C}}.{{M}_{X}}}{12.100%}=\frac{85,71.28}{12.100}=2\)
\(y=\frac{%{{m}_{H}}.{{M}_{X}}}{1.100%}=\frac{(100-85,71).28}{1.100}=4\)
Vậy công thức phân tử của X là C2H4 (etilen).
Đáp án C
Câu 6
Công thức cấu tạo của X có công thức phân tử C3H6 là CH2 = CH – CH3.
Đáp án B
Câu 7
(1) C + 2H2 \(\xrightarrow{{{t}^{0}}}\) CH4
(2) CH4 + 2O2 \(\xrightarrow{{{t}^{0}}}\) CO2 + 2H2O
(3) CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
(4) CaCO3 \(\xrightarrow{{{t}^{0}}}\) CaO + CO2
(5) CaO + 2HCl → CaCl2 + H2O
Câu 8
a) Gọi công thức phân tử của X là CxHyOz
\({{C}_{x}}{{H}_{y}}{{O}_{z}}+(x+\frac{y}{4}-\frac{z}{2}){{O}_{2}}\xrightarrow{{{t}^{0}}}xC{{O}_{2}}+\frac{y}{2}{{H}_{2}}O\)
Theo PTHH ⟹
Vậy CTPT của X là C2H6O.
b) CTCT có thể có của X là
CH3 – CH2 – OH ; CH3 – O – CH3.
Câu 9
a) PTHH
C2H4 + Br2 → C2H4Br2
2C6H6 + 15O2 \(\xrightarrow{{{t}^{0}}}\) 12CO2 + 6H2O
CH4 + 2O2 \(\xrightarrow{{{t}^{0}}}\) CO2 + 2H2O
b)
Gọi số mol benzen, metan và etilen trong X lần lượt là x, y và z (mol).
* X + Br2 ⟹ Etilen phản ứng với dung dịch brom và bị giữ lại trong bình dựng dung dịch brom.
⟹ mbình Br2 tăng = metilen = 0,42 g.
⟹ 28z = 0,42 ⟹ z = 0,015 (mol).
* Khí Y gồm C6H6 x (mol) và CH4 y (mol)
+ nY = x + y = 0,055 (1)
+ Đốt cháy Y trong không khí.
\({{n}_{kk}}=V/22,4=1,375(mol)\Rightarrow {{n}_{{{O}_{2}}}}={{n}_{kk}}.20%=0,275(mol)\)
Theo PTHH (đốt cháy Y)
⟹ \({{n}_{{{O}_{2}}}}=7,5.{{n}_{{{C}_{6}}{{H}_{6}}}}+2{{n}_{C{{H}_{4}}}}=7,5x+2y=0,275\) (2)
Từ (1)(2) ⟹ x = 0,03 và y = 0,025.
Ta có tỉ lệ phần trăm về thể tích là tỉ lệ phần trăm về số mol
Vậy thành phần phần trăm về thể tích của mỗi khí trong X là
Loigiaihay.com
- Đề số 5 - Đề kiểm tra giữa kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 3 - Đề kiểm tra giữa học kì II - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 2 - Đề kiểm tra giữa học kì II - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 1 - Đề kiểm tra giữa học kì II - Hóa học 9 có đáp án và lời giải chi tiết
Các bài khác cùng chuyên mục
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu





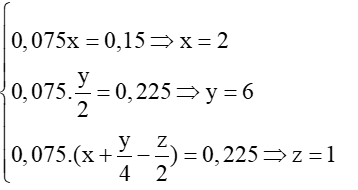
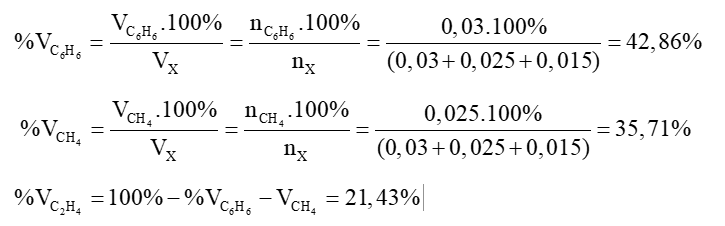








Danh sách bình luận