 Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
Đề số 4 - Đề kiểm tra học kì 2 – Hóa học 9
Đáp án và lời giải chi tiết Đề số 4 - Đề kiểm tra học kì 2 (Đề thi học kì 2) – Hóa học 9
Đề bài
I. TRẮC NGHIỆM : (3,0 điểm)
Chọn phương án đúng trong mỗi câu sau:
Câu 1: Dãy các chất nào sau đây đều tác dụng với dung dịch axit axetic
A. Na, CuO, BaCl2, KOH
B. Mg, KNO3 ,Cu, KOH
C. Zn, NaOH, CaCO3, MgO.
D. Na2SO4, Ag, Cu(OH)2, MgCl2.
Câu 2: Trong các chất có công thức hóa học sau. Chất nào là Este của chất béo:
A. CH3COOC2H5.
B. CH3COONa.
C. C17H35COOH.
D. (C17H35COO)3C3H5.
Câu 3: Pha 4 lít rượu etylic 500 với 6 lít nước ta được
A. Rượu 50. B. Rượu 500
C. Rượu 100. D. Rượu 150
Câu 4: Chất nào sau đây vừa tham gia phản ứng thế, vừa tham gia phản ứng công:
A. Metan B. Benzen.
C. Etilen. D. Axetilen.
Câu 5: Cho m gam rượu etylic tác dụng hết với kim loại Na. Thể tích khí H2 thu được (đktc) 1,12 lít, thì khối lượng rượu etylic đã dùng là:
A. 10 g. B. 9,2 g.
C. 4,6 g. D. 2,3 g
Câu 6: Đốt cháy hoàn toàn một hidrocacbon X thu được 6,72 lít khí CO2 ở đktc và 5,4 g H2O. Công thức hóa học của X là:
A. C2H4. B. C2H2.
C. C2H6. D. C6H6
II. TỰ LUẬN : ( 7,0 điểm)
Câu 1: Trình bày tính chất hóa học của etylen? Viết các PTHH minh họa?
Câu 2: Bằng phương pháp hóa học, hãy nhận biết các chất lngr sau: Rượu etylic, nước cất, axit axetic đựng trong các lọ mất nhãn. Viết PTHH
Câu 3: Cho 9,2g rượu etylic tác dụng hết với Na
a. Tính thể tích khí H2 thu được ở đktc ?
b.Tính thể tích rượu etylic đã dùng ? Biết Dr = 0,8 g/ml
c. Tính thể tích không khí ( chứa 20% thể tích O2) cần để đốt cháy hết rượu trên ?
d. Nếu pha rượu trên với 34,5 ml nước thì thu được rượu bao nhiêu độ?
Lời giải chi tiết
Hướng dẫn giải chi tiết
I. Trắc nghiệm
Câu 1:
Phương pháp:
Ghi nhớ tính chất hóa học của CH3COOH
Hướng dẫn giải:
A. Loại BaCl2
B. Loại Cu vì Cu là kim loại đứng sau H nên không có phản ứng với axit
C. Đúng
D. Loại Ag vì Ag là kim loại đứng sau H nên không có phản ứng với axit
Đáp án C
Câu 2:
Este của chất béo là este tạo bởi các axit béo ( từ 12 Cacbon trở nên) với glixerol ( C3H5(OH)3)
=> este có dạng: (RCOO)3C3H5.
=> (C17H35COO)3C3H5 thỏa mãn
Đáp án D
Câu 3:
Phương pháp:
Công thức tính độ rượu: \({{D}^{0}}=\frac{Vr}{V\,hh\,r}{{.100}^{0}}\)
Hướng dẫn giải:
Thể tích rượu C2H5OH có trong 4 lít rượu 500C là:
\({{D}^{0}}=\frac{Vr}{V\,hh\,r}{{.100}^{0}}=>{{V}_{{{C}_{2}}{{H}_{5}}OH}}=\frac{{{50}^{0}}.4}{{{100}^{0}}}=2\,(lit)\)
Sau khi pha thêm 6 lít nước vào
=> Vhh rượu = 4 + 6 = 10 (lít)
\(=>{{D}^{0}}=\frac{Vr}{V\,hh\,r}{{.100}^{0}}=\frac{2}{10}{{.100}^{0}}={{20}^{0}}\)
Đáp án B
Câu 4:
Hướng dẫn giải:
Chất vừa tham gia phản ứng thế, vừa tham gia phản ứng cộng là benzen
VD: Phản ứng thế:
C6H6 + Br2 \(\xrightarrow[{}]{Fe,{{t}^{0}}}\)C6H5Br + HBr
Phản ứng cộng
C6H6 + 3H2 → C6H12
C6H6 + 3Cl2 → C6H6Cl6
Đáp án B
Câu 5:
Phương pháp:
Đổi số mol H2
Viết PTHH xảy ra:
C2H5OH + Na → C2H5ONa + ½ H2↑
Tính số mol C2H5OH theo số mol của H2
Hướng dẫn giải:
nH2 = 1,12: 22,4 = 0,05 (mol)
PTHH: C2H5OH + Na → C2H5ONa + ½ H2↑
0,1 ← 0,05 (mol)
=> mC2H5OH = 0,1.46 = 4,6 (g)
Đáp án C
Câu 6:
Phương pháp:
Gọi công thức của hidrocacbon X là: CxHy
Đổi số mol nCO2 = VCO2: 22,4 = ? (mol)
=> nC = nCO2 = ? (mol)
Đổi số mol nH2O = mH2O: 18 = ? (mol)
=> nH = 2nH2O =?(mol)
=> x : y = nC : nH
=> Công thức đơn giản nhất của hidrocacbon, từ đó suy ra CTPT của H-C
Hướng dẫn giải:
Gọi công thức của hidrocacbon X là: CxHy
nCO2 = 6,72: 22,4 = 0,3 (mol)
=> nC = nCO2 = 0,3 (mol)
nH2O = 5,4: 18 = 0,3 (mol)
=> nH = 2nH2O = 2.0,3 =0, 6 (mol)
=> x : y = nC : nH
= 0,3 : 0,6
= 1: 2
=> Công thức đơn giản nhất của hidrocacbon là: (CH2)n
Khi n = 2 => CTPT là C2H4
=> thấy đáp án A thỏa mãn
Khi n = 6 => CTPT là C6H12
Đáp án A
II. Tự luận
Câu 1:
Phương pháp:
Kể tính chất hóa học của C2H4 sau đó viết PTHH minh họa xảy ra
+ phản ứng cộng
+ phản ứng trùng hợp
+ phản ứng cháy
Hướng dẫn giải:
Tính chất hóa học của C2H4
+ Phản ứng cộng: ( + H2, dd Br2)
C2H4 + Br2 → C2H4Br2
C2H4 + H2 \(\xrightarrow{Ni,{{t}^{0}}}\)C2H6
+ Phản ứng trùng hợp
nCH2=CH2 \(\xrightarrow{{{t}^{0}},p,xt}\) (-CH2-CH2-)n
+ phản ứng cháy
C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\)2CO2 + 2H2O
Câu 2:
Phương pháp:
Dùng quỳ tím để nhận biết các chất trên
Hướng dẫn giải:
Phân biệt: C2H5OH, H2O, CH3COOH
Bước 1: Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thư stuwj tương ứng
Bước 2: Cho quỳ tím vào từng ống nghiệm trên
+ quỳ tím chuyển sang màu đỏ: CH3COOH
+ quỳ tím không chuyển màu là: C2H5OH và H2O
Bước 3: 2 chất còn lại là C2H5OH và H2O ta đem đốt
+ Chất nào cháy là C2H5OH
C2H5OH + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 3H2O
+ Chất còn lại không cháy là H2O
Câu 3:
Phương pháp:
Đổi số mol của nC2H5OH = mC2H5OH : 46 = ? (mol)
a) Viết PTHH xảy ra:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Tính theo PTHH số mol của H2 theo số mol của C2H5OH đã biết
b) Ghi nhớ công thức chuyển đổi giữa các đại lượng:
c) Viết PTHH xảy ra: C2H5OH + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 3H2O
Tính theo PTHH: nO2 = 3nC2H5OH = ? (mol)
=> VO2 (đktc) = nO2 . 22,4 = ? (lít)
Vì O2 chiếm 20% thể tích không khí
=> \(Vkk=\frac{{{V}_{{{O}_{2}}}}.100%}{20%}=?\,(lit)\)
d) Thể tích hỗn hợp sau khi pha là:
Vhh = Vr + Vnước = ? (ml)
\(Dr=\frac{Vr}{Vdd\,r}{{.100}^{0}}=?\)
Hướng dẫn giải:
nC2H5OH = 9,2 : 46 = 0,2 (mol)
a) PTHH: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
Theo PTHH: nH2 = ½ nC2H5OH = ½. 0,2 = 0,1 (mol)
=> VH2 (đktc) = 0,1.22,4 = 2,24 (lít)
b)
1 ml C2H5OH có mr = Dr. Vr = 0,8× 1= 0,8 (g)
x (ml) C2H5OH có mr = 9,2 (g)
=> \(Vr=\frac{9,2\times 1}{0,8}=11,5\,(ml)\)
c) PTHH: C2H5OH + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 3H2O
Theo PTHH: nO2 = 3nC2H5OH = 3. 0,2 = 0,6 (mol)
=> VO2 (đktc) = 0,6. 22,4 = 13,44 (lít)
Vì O2 chiếm 20% thể tích không khí =>
\(Vkk=\frac{{{V}_{{{O}_{2}}}}.100%}{20%}=\frac{13,44.100%}{20%}=67,2\,(lit)\)
d)
Thể tích hỗn hợp sau khi pha là:
Vhh = Vr + Vnước = 11,5 + 34,5= 46 (ml)
\(Dr=\frac{Vr}{Vdd\,r}{{.100}^{0}}=\frac{11,5}{46}{{.100}^{0}}={{25}^{0}}\)
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu




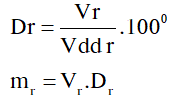








Danh sách bình luận