 Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
Đề số 3 - Đề kiểm tra học kì 2 – Hóa học 9
Đáp án và lời giải chi tiết Đề số 3 - Đề kiểm tra học kì 2 (Đề thi học kì 2) – Hóa học 9
Đề bài
I. TRẮC NGHIỆM: (2 điểm)
Hãy khoanh tròn một trong các chữ cái A,B C hoặc D ở các câu sau đây, nếu đúng.
Câu 1 Phát biểu không đúng là:
A. Clo là phi kim hoạt động hóa học mạnh hơn lưu huỳnh
B. Phản ứng giữa dung dịch NaOH với dung dịch NaHCO3 là phản ứng trung hòa.
C. Natri tiếp xúc với giấy lọc ẩm, giấy lọc bốc cháy, nhôm tiếp xúc giấy lọc không bốc cháy
D. Tất cả các muối cacbonat và muối hidrocacbonat đều bị phân hủy bởi nhiệt.
Câu 2 Chất tác dụng được với: Na, Na2O, NaOH, Na2CO3, NaHCO3 là
A. glucozơ. B. rượu etylic.
C. axit axetic. D. etyl axetat.
Câu 3 Cho các chất: metan, etilen, axetilen,benzen, rượu etylic, axit axetic. Số chất có liên kết đôi là
A. 1. B. 3.
C. 2. D. 4
Câu 4 Chất X thế được với Cl2 (ánh sáng). Chất Y thế được (bột sắt, nhiệt độ). X, Y lần lượt là
A. Benzen, etilen. B. Axetilen, etilen.
C. Axetilen, metan. D. Metan, benzen.
II. TỰ LUẬN
Câu 1 Viết phương trình hóa học theo dãy chuyển đổi hóa học sau (ghi rõ điều kiện phản ứng - nếu có):
Câu 2 Lên men hoàn toàn 690 ml rượu etylic 80 thành giấm. Tính khối lượng axit axetic có trong giấm. Biết khối lượng riêng của rượu etylic tinh khiết là 0,8 g/ml.
Câu 3
1. Đốt cháy hoàn toàn 68,4 gam một hỗn hợp chất hữu cơ thu được 2,4 mol CO2 và 2,2 mol H2O.
Lập công thức hóa học của hợp chất này, biết phân tử khối của hợp chất 342đvC
2. Từ tinh bột có thể sản xuất rượu etylic theo sơ đồ:
-(C6H10O5)-n → nC6H12O6 → 2nC2H5OH + 2nCO2
Muốn điều chế 920 kg rượu etylic, cần một khối lượng tinh bột là bao nhiêu. Biết hiệu suất của quá trình 50%.
Lời giải chi tiết
ĐÁP ÁN
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Hướng dẫn giải:
A. đúng
B. đúng; NaOH + NaHCO3 → Na2CO3 + H2O
C. đúng, vì giấy lọc có nước, mà Na thì phản ứng mãnh liệt với nước, còn Al thì không phản ứng được với nước, do vậy giấy lọc khi tiếp xúc với Na thì cháy, còn tiếp xúc với Al thì không cháy
D. Sai vì các muối Li2CO3; Na2CO3, K2CO3 không bị nhiệt phân hủy
Đáp án D
Câu 2:
Phương pháp:
Dựa vào tính chất hóa học của các chất đã cho trong đáp án để loại trừ và lựa chọn được đáp án phù hợp
Hướng dẫn giải:
Chất tác dụng được với tất cả Na, Na2O, NaOH, Na2CO3, NaHCO3 là axit axetic (CH3COOH)
CH3COOH + Na → CH3COONa + 1/2H2↑
2CH3COOH + Na2O → 2CH3COONa + H2O
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2↑
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2↑
Đáp án C
Câu 3:
Phương pháp:
Dựa vào công thức cấu tạo của các chất đã được học
Hướng dẫn giải:
Công thức hóa học của metan ; etilen, axetilen,benzen, rượu etylic, axit axetic lần lượt của các chất
metan: CH4 chỉ toàn liên kết đơn
etilen: CH2 = CH2 => chứa 1 liên kết đôi
axetilen: CH≡CH => chứa 1 liên kết ba
benzen: 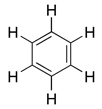
rượu etylic: CH3-CH2-OH =>chỉ chứa liên kết đơn
axit axetic: 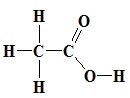
Vậy có 3 chất có liên kết đôi trong phân tử
Đáp án B
Câu 4:
Hướng dẫn giải:
Chất X là metan (CH4) ; chất Y là benzen (C6H6)
CH4 + Cl2 \(\xrightarrow{{{t}^{0}}}\) CH3Cl + HCl
C6H6 + Cl2 \(\xrightarrow{bot\,Fe,\,{{t}^{0}}}\) C6H5Cl + HCl
Đáp án D
II. TỰ LUẬN: (8,0đ)
Câu 1:
Phương pháp:
Viết các phương trình hóa học xảy ra, cân bằng phản ứng
Hướng dẫn giải:
(1) C2H4 + H2O \(\xrightarrow{{{t}^{0}}}\) C2H5OH
(2) C2H5OH + CH3COOH \(\underset{{{H}_{2}}S{{O}_{4}}}{\overset{{{t}^{0}}}{\longleftrightarrow}}\)CH3COOC2H5 + H2O
(3) CH3COOC2H5 + NaOH \(\xrightarrow{{{t}^{0}}}\) CH3COONa + C2H5OH
(4) 2C2H5OH + 2Na → 2C2H5ONa + H2
Câu 2
Phương pháp:
Tính thể tích rượu theo cống thức \({{V}_{r}}=\frac{{{V}_{dd}}}{100}.Dr\)
Từ đó tính được khối lượng rượu theo công thức: mr = Vr. dr
Sau đó tính được mol rượu: nr = mr : Mr
Viết PTHH xảy ra, sau đó tính toán khối lượng axit theo phương trình hóa học.
Hướng dẫn giải:
Thể tích rượu etylic tinh khiết: (690×8) :100 = 55,2 ml
Khối lượng rượu etylic tinh khiết: 55,2 × 0,8 = 44,16 g
Số mol rượu etylic tinh khiết: 44,16 : 46 = 0,96 mol
C2H5OH + O2 \(\xrightarrow{men\,giam}\) CH3COOH + H2O
0,96 0,96
Khối lượng axit axetic thu được: 0,96 × 60 = 57,6 g
Câu 3
Phương pháp:
1. Đặt công thức của hỗn hợp là: CxHyOz (x,y, z € N*)
Ta có: x : y : z = nC : nH : nO
Với nC = nCO2; nH = 2nH2O ; nO
tìm dựa vào khối lượng cho của hỗn hợp (có thể có hoặc không có oxi trong hợp chất)
biết phân tử khối của hợp chất 342đvC suy ra được công thức phân tử
2. Đổi số mol rượu, sau đó dựa vào sơ đồ tính được khối lượng lí thuyết tinh bột cần lấy
Vì %H = 50%
=> Khối lượng tinh bột thực tế cần lấy = mtb lí thuyết ×100% :%H =?
Hướng dẫn giải:
1.
nC = nCO2 = 2,4 (mol) => mC = 2,4×12 = 28,8 (g)
nH = 2nH2O = 2×2,2 = 4,4 (mol) => mH = 4,4×1 = 4,4 (g)
Ta thấy mC + mH = 28,8 + 4,4 = 33,2 (g) < 68,4 (g)
=> trong hỗn hợp có oxi
mO = mhh - (mC + mO) = 68,4 - 33,2 = 35,2 (g)
=> nO = 35,2 : 16 = 2,2 (mol)
Đặt công thức của hỗn hợp là: CxHyOz (x,y, z € N*)
Ta có: x : y : z = nC : nH : nO
= 2,4 : 4,4: 2,2
= 12:22 :11
Vậy công thức đơn giản nhất là: C12H22O11
Vì phân tử khối của hợp chất là 342 đvC
=> (C12H22O11)n = 342
=> (12.12 +1.22 + 16.11).n = 342
=> 342n = 342
=> n = 1
Vậy công thức phân tử của hợp chất hữu cơ là C12H22O11
2.
Số mol của C2H5OH là:
-(C6H10O5)-n → nC6H12O6 → 2nC2H5OH + 2nCO2
10/n ← 20 (kmol)
Theo sơ đồ: n(C6H10O5)n =
Khối lượng tinh bột cần dùng theo lí thuyết là:
mtinh bột lí thuyết = ntb. Mtb =
Vì hiệu suất phản ứng là 50% nên lượng tinh bột cần lấy thực tế là:
mtinh bột thực tế = mtinh bột lí thuyết ×100% :%H
= 1620 ×100% :50% = 3240 (kg)
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu












Danh sách bình luận