 Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 9
Đề số 1 - Đề kiểm tra học kì 2 – Hóa học 9
Đáp án và lời giải chi tiết Đề số 1 - Đề kiểm tra học kì 2 (Đề thi học kì 2) – Hóa học 9
Đề bài
A. PHẦN TRẮC NGHIỆM: (3 điểm) Khoanh tròn một trong các chữ cái A, B, C hoặc D trước kết quả đúng nhất
Câu 1 Trong các hợp chất sau, hợp chất nào là hợp chất hữu cơ
A. (NH4)2CO3 B. NaHCO3
C. CO D. C2H6O
Câu 2 Thành phần chính của sợi bông gỗ nứa là
A. tinh bột B. xenlulozơ
C. glucozơ D. saccarozơ
Câu 3 Iot tác dụng với chất nào sau đây tạo hợp chất màu xanh
A. tinh bột B. xenlulozơ
C. glucozơ D. saccarozơ
Câu 4 Cồn trong y tế để xác trùng vết thương là
A. 960 B. 700
C. 450 D. 400
Câu 5 Chất làm mất màu dung dịch brom là
A. C2H2 B. CH4
C. C2H5OH D. CH3COOH
Câu 6 Chất tác dụng được với axit axetic
A. Fe B. Cu
C. Au D. Ag
Câu 7 Chất nào sau đây dùng để điều chế nhựa PE?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 8 Hidrocacbon nào sau đây là chất lỏng ở điều kiện thường?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 9 Cho các chất: K, NaOH, Cu, NaHCO3. Số chất tác dụng được với rượu etylic là
A. 1 B. 2
C. 3 D. 4
Câu 10 Khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen?
A. 15,6 g B. 7,8 g
C. 7,75 g D. 5,15 g
Câu 11 Đốt cháy chất nào sau đây thu được số mol CO2 gấp đôi số mol H2O?
A. C2H2 B. CH4
C. C2H4 D. C6H6
Câu 12 Biết 0,336 lít khí axetilen (đktc) làm mất màu tối đa V ml dung dịch brom 0,2M. Giá trị của V là?
A. 75 B. 150
C. 200 D. 300
B. PHẦN TỰ LUẬN
Bài 1 Viết phương trình hóa học thực hiện chuỗi biến hóa sau (ghi điều kiện nếu có)
Bài 2 Bằng phương pháp hóa học hãy nhận biết các chất sau: CH4,C2H4, CO2. Viết phương trình (nếu có)
Bài 3 Cho 27,2 gam hỗn hợp A gồm ancol etylic và axit axetic tác dụng với natri dư thu được 5,6 lít khí H2 (đktc)
a) Viết phương trình hóa học của phản ứng
b) Tính khối lượng từng chất trong hỗn hợp A
c) Nếu hỗn hợp A trên làm thí nghiệm, thêm tiếp axit sunfuric đặc và đun nóng. Tính hiệu suất của phản ứng biết sau phản ứng thu được 14,08 gam etyl axetat.
Lời giải chi tiết
ĐÁP ÁN
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Phương pháp: Dựa vào định nghĩa về hợp chất hữu cơ: hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2,H2CO3 các muối cacbonat kim loại...)
Hướng dẫn giải: C2H6O là hợp chất hữu cơ
Đáp án D
Câu 2:
Phương pháp: Dựa vào trạng thái tự nhiên của các chất để chọn đáp án phù hợp
Hướng dẫn giải: Thành phần chính của sợi bông gỗ nứa là xenlulozơ
Đáp án B
Câu 3:
Hướng dẫn giải: Iot tạo hợp chất màu xanh tím với dung dịch hồ tin bột
Đáp án A
Câu 4:
Phương pháp: Dựa vào kiến thức hiểu biết thực tế về cồn y tế
Hướng dẫn giải: Cồn trong y tế để xác trùng vết thương có nồng độ etylic từ 700 đến 750
Đáp án B
Câu 5:
Phương pháp: Chất có nối đôi hoặc nối ba kém bền sẽ làm mất màu dung dịch nước brom
Hướng dẫn giải: C2H2 có phản ứng với dd Br2 nên làm mất màu dung dịch Br2
Đáp án A
Câu 6:
Phương pháp: Các kim loại đứng trước H trong dãy điện hóa thì có phản ứng với dung dịch CH3COOH
Hướng dẫn giải:
Chất tác dụng được với dd CH3COOH là Fe
2CH3COOH + Fe → (CH3COO)2Fe + H2↑
Đáp án A
Câu 7:
Hướng dẫn giải:
PE là polime etilen → được điều chế tử etilen C2H4
CH2=CH2 \(\xrightarrow{{{t}^{0}},p,xt}\) (-CH2-CH2-)n (PE)
Đáp án C
Câu 8:
Phương pháp: Các hidroncacbon có từ 1 đến 4 cacbon ở thể khí, từ lớn hơn 4 cacbon trở lên ở thể lỏng hoặc rắn ở điều kiện thường.
Hướng dẫn giải:
C2H2, CH4,C2H2 đều là các hidrocacbon ở thể khí ở điều kiện thường
C6H6 là chất lỏng ở điều kiện thường
Đáp án D
Câu 9:
Phương pháp: Dựa vào tính chất hóa học của C2H5OH
Hướng dẫn giải:
Có duy nhất K tác dụng được với rượu etylic → có 1 chất
2K + 2C2H5OH → 2C2H5OK + H2
Đáp án A
Câu 10:
Phương pháp: Tính toán mol C6H6 theo mol C6H5Br dựa vào PTHH:
C6H6 + Br2 \(\xrightarrow{bot\,Fe}\) C6H5Br + HBr
Hướng dẫn giải:
\({{n}_{{{C}_{6}}{{H}_{5}}Br}}=\frac{15,7}{12\times 6+5+80}=0,1\,(mol)\)
PTHH: C6H6 + Br2 \(\xrightarrow{bot\,Fe}\) C6H5Br + HBr
0,1 ← 0,1 (mol)
→ mC6H6 = 0,1.78 = 7,8 (g)
Đáp án B
Câu 11:
Phương pháp: Giả sử đều đốt cháy 1 mol chất
Viết các phản ứng cháy của các chất ra, sau đó chọn chất có số mol CO2 gấp 2 lần mol H2O
Hướng dẫn giải:
Giả sử đều đốt cháy 1 mol chất
C2H2 + 2,5O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + H2O
CH4 + 2O2 \(\xrightarrow{{{t}^{0}}}\) CO2 + 2H2O
C2H4 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 + 2H2O
C6H6 + 7,5O2 \(\xrightarrow{{{t}^{0}}}\) 6CO2 + 3H2O
Vậy đốt C2H2 cho số mol CO2 gấp 2 lần mol H2O
Đáp án A
Câu 12:
Phương pháp: Tính toán theo PTHH: C2H2 + 2Br2 → C2H2Br4
Hướng dẫn giải:
nC2H2(đktc) = 0,336 :22,4 = 0,015 (mol)
PTHH: C2H2 + 2Br2 → C2H2Br4
0,015 → 0,3 (mol)
nBr2 = 2nC2H2 = 2.0,015 = 0,03 (mol)
→ V = nBr2 : CM Br2 = 0,03 : 0,2 = 0,15 (lít) = 150 (ml)
Đáp án B
Câu 13:
Phương pháp: Dựa vào phần tính chất hóa học về rượu etylic, axit axetic để hoàn thành phương trình hóa học.
Hướng dẫn giải:
Câu 14:
Phương pháp:
Dựa vào phần tính chất hóa học khác nhau của 3 khí để chọn thuốc thử nhận biết, chú ý tính chất hóa học khác biệt là chất này có mà chất kia không có và khi cho thuốc thử vào thì phải quan sát được hiện tượng rõ ràng như sự thay đổi về màu sắc dung dịch, có kết tủa hay không,...
Hướng dẫn giải:
Cho các khí lội qua dung dịch nước vôi trong dư, khí nào làm đục nước vôi trong thì đó là khí CO2, các khí còn lại không có hiện tượng là CH4 và C2H4
- Cho 2 khí còn lại này lội qua dung dịch nước Br2 dư, khí nào làm nhạt màu dung dịch nước Br2 thì đó là C2H4, khí còn lại không có hiện tượng gì là CH4
PTHH xảy ra:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
C2H4 + Br2 → C2H4Br2
(màu nâu đỏ) (dd không màu)
Câu 15:
Phương pháp:
a) ancol etylic + Na → muối + H2
axit axetic + Na → muối + H2
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Lập hệ hai phương trình với số mol H2 và khối lượng hỗn hợp A → x, y =?
c) acol etylic + axit axetic \(\underset{{}}{\overset{{{H}_{2}}S{{O}_{4}}\,dac,{{t}^{0}}}{\longleftrightarrow}}\) este + H2O
xác định xem nếu H=100% thì ancol etylic hay axit axetic phản ứng hết. Từ đó tính toán hiệu suất phản ứng theo chất phản ứng hết.
Với lượng phản ứng thì tính theo số mol este thu được.
Hướng dẫn giải:
nH2(đktc) = 5,6/22,4 = 0,25 (mol)
a) PTHH xảy ra:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
x → 0,5x (mol)
2CH3COOH + 2Na → 2CH3COONa + H2
y → 0,5y (mol)
b) Đặt số mol C2H5OH và CH3COOH ban đầu lần lượt là x và y (mol)
Ta có hệ phương trình:
→ Khối lượng của C2H5OH là: 0,2× 46 = 9,2 (g)
→ Khối lượng của CH3COOH là: 0,3×60 = 18 (g)
c) số mol của CH3COOC2H5 thu được là:
PTHH:
CH3COOH + C2H5OH \(\underset{{}}{\overset{{{H}_{2}}S{{O}_{4}}\,dac,{{t}^{0}}}{\longleftrightarrow}}\) CH3COOC2H5 + H2O
Theo PT (mol): 1 : 1
Theo ĐB (mol): 0,2 : 0,3
Ta có: \(\frac{0,2}{1}<\frac{0,3}{1}\).
Do vậy nếu H= 100% thì C2H5OH phản ứng hết, vậy hiệu suất tính theo số mol của C2H5OH.
Theo PTHH (3):
nC2H5OH pư = nCH3COOC2H5 = 0,16 (mol)
Hiệu suất của phản ứng trên là:
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu




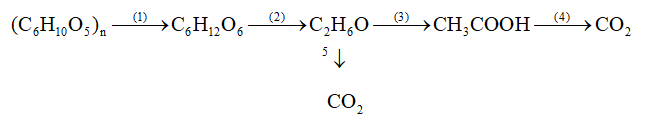
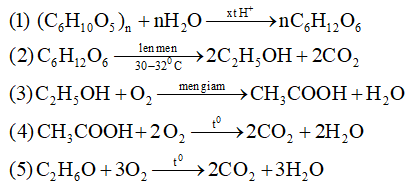
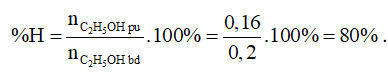








Danh sách bình luận