 Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Bài 18. Tính chất của kim loại. Dãy điện hoá của kim loại
Bài 18. Tính chất của kim loại. Dãy điện hoá của kim loại
Lý thuyết tính chất của kim loại, dãy điện hoá của kim loại
- Tính chất vật lí chung: có ánh kim, dẻo, dẫn điện và dẫn nhiệt tốt.
I. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
1. Tính chất vật lí chung
a) Tính dẻo
=> Kim loại có tính dẻo nhất là Au
b) Tính dẫn điện
=> Khả năng dẫn điện của một số kim loại Ag > Cu > Au > Al > Fe
c) Tính dẫn nhiệt
d) Tính ánh kim
=> Tính chất vật lí chung của kim loại như nói ở trên gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
2. Tính chất vật lí riêng
Một số tính chất vật lý riêng của kim loại:
a) Tính cứng
=> Kim loại mềm nhất là Cs, kim loại cứng nhất là Cr
b) Nhiệt độ nóng chảy
=> Kim loại dễ nóng chảy nhất là Hg (-39 độ C), khó nóng chảy nhất là W
c) Khối lượng riêng
- Kim loại có khối lượng riêng D < 5 gam/cm3 là kim loại nhẹ (Na, Li, Mg, Al,…)
- Kim loại có khối lượng riêng D > 5 gam/cm3 là kim loại nặng.( Cr, Fe, Zn, Pb, Ag, Hg,…)
II. TÍNH CHẤT HÓA HỌC CHUNG CỦA KIM LOẠI
Tính chất điển hình của kim loại là tính khử: M → Mn+ + ne
1. Tác dụng với phi kim
a) Tác dụng với clo
Hầu hết các kim loại đều có thể khử trực tiếp clo → muối clorua
\(\overset{o}{\mathop{2Fe}}\,\,\,\,+\,\,\,3\overset{o}{\mathop{C{{l}_{2}}}}\,\,\,\,\xrightarrow{{{t}^{o}}}\,\,\,2\overset{+3}{\mathop{Fe}}\,\overset{-1}{\mathop{C{{l}_{3}}}}\,\)
b) Tác dụng với oxi
\(\overset{o}{\mathop{4Al}}\,\,\,\,+\,\,\,3\overset{o}{\mathop{{{O}_{2}}}}\,\,\,\,\xrightarrow{{{t}^{o}}}\,\,\,2\overset{+3}{\mathop{A{{l}_{2}}}}\,\overset{-1}{\mathop{{{O}_{3}}}}\,\)
c) Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh từ xuống . Phản ứng cần đun nóng (trừ Hg). Ví dụ:
\(\overset{o}{\mathop{Hg}}\,\,\,\,+\,\,\,\overset{o}{\mathop{S}}\,\,\,\,\xrightarrow{{{t}^{o}}\,th\ddot{o}\hat{o}ng}\,\,\,\overset{+2}{\mathop{Hg}}\,\overset{-2}{\mathop{S}}\,\)
2. Tác dụng với dung dịch axit
a) Với dung dịch HCl, H2SO4 loãng
Kim loại đứng trước H trong dãy hoạt động hóa học có thể tác dụng được với axit để sinh ra khí H2 bay lên.
\(\overset{o}{\mathop{Fe}}\,\,\,\,+\,\,\,2\,\overset{+1}{\mathop{H}}\,Cl\to \,\,\,\overset{+2}{\mathop{Fe}}\,\overset{-1}{\mathop{C{{l}_{2}}}}\,\,\,+\,\,\overset{o}{\mathop{{{H}_{2}}}}\,\)
b) Với dung dịch HNO3, H2SO4 đặc
KL + (H2SO4 đ, HNO3) → muối + sản phẩm khử (SO2, NO, NO2, H2S ….) + H2O
\(3\overset{o}{\mathop{Cu}}\,\,\,+\,\,8H\overset{+5}{\mathop{N}}\,{{O}_{3}}\,\,\xrightarrow{{{t}^{o}}}\,\,3\overset{+2}{\mathop{Cu}}\,{{(N{{O}_{3}})}_{2}}\,\,+\,\,2\overset{+2}{\mathop{N}}\,O\,\,+\,\,4{{H}_{2}}O\)
\(\overset{o}{\mathop{Cu}}\,\,\,+\,\,2{{H}_{2}}\overset{+5}{\mathop{S}}\,{{O}_{4}}\,\,\xrightarrow{{{t}^{o}}}\,\,\overset{+2}{\mathop{Cu}}\,S{{O}_{4}}\,\,+\,\,\overset{+2}{\mathop{S}}\,{{O}_{2}}\,\,+\,\,2{{H}_{2}}O\)
● Chú ý : HNO3, H2SO4 đặc, nguội làm thụ động hoá Al, Fe, Cr, ...
KL sẽ lên số OXH cao nhất khi tác dụng với dung dịch HNO3, H2SO4 đặc.
3. Tác dụng với nước
\(\overset{o}{\mathop{Na}}\,\,\,\,+\,\,\,2\,\overset{+1}{\mathop{{{H}_{2}}}}\,O\,\,\to \,\,\,\overset{+1}{\mathop{2Na}}\,OH\,\,+\,\,\overset{o}{\mathop{{{H}_{2}}}}\,\)
4. Tác dụng với dung dịch muối
- Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
- Với các kim loại không tan trong nước, kim loại hoạt động đẩy được kim loại kém hoạt động ra khỏi dung dịch muối của chúng theo quy tắc α.
\(\overset{o}{\mathop{Fe}}\,\,\,\,+\,\,\,\,\overset{+2}{\mathop{Cu}}\,S{{O}_{4}}\,\,\to \,\,\,\overset{+2}{\mathop{Fe}}\,S{{O}_{4}}\,\,+\,\,\overset{o}{\mathop{Cu}}\,\)
5. Tác dụng với dung dịch kiềm
Các kim loại mà hiđroxit của chúng có tính lưỡng tính như Al, Zn, Be, Sn, Pb... tác dụng được với dung dịch kiềm (đặc).
2Al + 6H2O + 2NaOH → 2Na[Al(OH)4] + 3H2
6. Tác dụng với oxit kim loại
Các kim loại mạnh khử được các oxit kim loại yếu hơn ở nhiệt độ cao thành kim loại
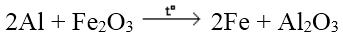
III. DÃY ĐIỆN HÓA CỦA KIM LOẠI
- Các kim loại trong dãy điện hoá được sắp xếp theo chiều tính khử của kim loại giảm dần và tính oxi hoá của ion kim loại tăng dần.
- Dãy điện hoá cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hoá - khử: chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.

Sơ đồ tư duy: Tính chất của kim loại, dãy điện hoá của kim loại

Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết












Danh sách bình luận