Đề kiểm tra 15 phút - Đề số 2 - Chương 6 – Hóa học 12
Đề kiểm tra 15 phút - Đề số 2 - Chương 6 – Hóa học 12
Đề bài
Câu 1. Cho vị trí một số nguyên tố trong bảng tuần hoàn như sau:
|
Nhóm Chu kỳ |
IA |
IIA |
IIIA |
|
I |
|
|
|
|
II |
X |
Z |
|
|
III |
Y |
|
T |
Phát biểu nào sau đây đúng?
A. X, Z là các kim loại kiềm thổ.
B. Độ cứng: Y > Z > T.
C. Tính khử X > Z
D. Khối lượng riêng của Y lớn nhất.
Câu 2. Chất nào sau đây phản ứng được với tất cả các kim loại kiềm thổ ở nhiệt độ thường?
A. \({O_2}\)
B. HCl/ dung dịch.
C. \({H_2}O\)
D. \(CuS{O_4}/\) dung dịch.
Câu 3. Nước cứng không gây ra tác hại nào dưới đây?
A. Gây ngộ độc nước uống.
B. Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo.
C. Làm giảm mùi vị thực phẩm đun nâu, đồ uống pha chế.
D. Gây hao tốn nhiên liệu khi đun nấu, làm giảm lưu lượng ống dẫn.
Câu 4. Cho X vào dung dịch \(HN{O_3}\) loãng thấy X tan một phần nhưng không sinh ra khí. X là kim loại nào trong số các kim loại sau đây?
A. Ba.
B. Na.
C. Mg.
D. Fe.
Câu 5. Hóa chất nào sau đây có thể dùng đồng thời làm mềm nước cứng tạm thời và nước cứng vĩnh cửu?
A. \(Ca{(OH)_2}\)
B. \(N{a_2}C{O_3}\)
C. \(C{a_3}{(P{O_4})_2}\)
D. HCl.
Câu 6. Phản ứng nào dùng để giải thích hiện tượng tạo thạch nhũ trong các hang động tự nhiên?
\(\begin{array}{l}A.\,C{O_2} + Ca{(OH)_2} \to CaC{O_3} + {H_2}O\\B.\,CaO + C{O_2} \to CaC{O_3}\\C.\,Ca{(HC{O_3})_2} \to CaC{O_3} + C{O_2} + {H_2}O\\D.\,CaC{O_3} + C{O_2} + {H_2}O \to Ca{(HC{O_3})_2}\end{array}\)
Câu 7. Trong dãy biến hóa sau: \(BaO \to Y \to Ba{(OH)_2} \to Y \to BaS{O_4}\) Y là
\(\begin{array}{l}A.\,BaC{O_3}.\\C.\,Ba{(N{O_3})_2}.\end{array}\) \(\begin{array}{l}B.\,BaC{l_2}.\\D.\,Ba{(HC{O_3})_2}.\end{array}\)
Câu 8. Có 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion. Các loại ion trong cả 4 dung dịch gồm: \(M{g^{2 + }};B{a^{2 + }};C{a^{2 + }};{K^ + };SO_4^{2 - };NO_3^{2 - };C{l^ - }\). Bốn dung dịch đó là
\(\begin{array}{l}A.\,{K_2}S{O_4},Mg{(N{O_3})_2},CaC{O_3},BaC{l_2}\\B.\,CaC{l_2},BaS{O_4},Mg{(N{O_3})_2},{K_2}C{O_3}.\\C.\,BaC{O_3},MgS{O_4},KCl,Ca{(N{O_3})_2}.\\D.\,MgS{O_4},BaC{l_2},{K_2}C{O_3},Ca{(N{O_3})_2}.\end{array}\)
Câu 9. Hòa tan hoàn toàn 11,2 gam CaO vào nước được dung dịch A. Sục V lít \(C{O_2}\) (đktc) vào A được 2,5 gam kết tủa. Giá trị của V là
A. 0,56 hoặc 8,4.
B. 8,4 hoặc 8,96.
C. 8,96 hoặc 0,56.
D. 0,56.
Câu 10. Cho 8,8 gam một hỗn hợp gồm 2 kim loại ở 2 chu kì liên tiếp thuộc nhóm IIA tác dụng với dung dịch HCl dư cho 6,72 lít khí hiro (đktc). Hai kim loại đó là
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca
D. Sr và Ba.
Lời giải chi tiết
Câu 1. Chọn C.
Kim loại kiềm thổ có tính khử yếu hơn kim loại kiềm cùng chu kỳ.
Kim loại kiềm thuộc nhóm IA, kim loại kiềm thổ thuộc nhóm IIA.
Khối lượng riêng của kim loại kiềm thổ đều nhỏ hơn Al (trừ Ba).
Các kim loại kiềm thổ đều mềm nhưng vẫn có độ cứng cao hơn kim loại kiềm.
Câu 2. Chọn B
\(M + 2HCl \to MC{l_2} + {H_2}\)
Ở nhiệt độ thường:
\({O_2}\) không phản ứng với Be, phản ứng chậm với các kim loại còn lại.
\({H_2}O\) không phản ứng với Be, phản ứng chậm với Mg.
Ca, Ba, Sr phản ứng với \({H_2}O\) trong dung dịch \(CuS{O_4}.\)
Câu 3. Chọn A.
Nước cứng dễ tạo kết tủa khi đun nóng hoặc khi kết hợp với các chất khác làm gây cặn bám ở đáy dụng cụ đun nấu gây tốn nhiên liệu, bám vào thành ống dẫn, phản ứng với các chất trong thực phẩm,
Câu 4. Chọn C
X tan một phần \( \to \) X dư, X là Mg.
\(4Mg + 10HN{O_3} \to Mg{(N{O_3})_2}\)\(\, + N{H_4}N{O_3} + 3{H_2}O\)
Fe là kim loại hoạt động trung bình không sinh ra \(N{H_4}N{O_3}.\)
Câu 5. Chọn B
\(CO_3^{2 - } + C{a^{2 + }};M{g^{2 + }} \to CaC{O_3};MgC{O_3}\)
\(Ca{(OH)_2}\) chỉ làm mềm nước cứng tạm thời
Dùng HCl: chỉ có ion \(HCO_3^ - \) phản ứng \( \to \) không làm thay đổi tính cứng.
\(C{a_3}(P{O_4}){ _2}\) không tan, không phản ứng.
Câu 6. Chọn C.
Nước tự nhiên thường chứa \(Ca{(HC{O_3})_2}\) hay còn gọi là nước có tính cứng tạm thời, muốn phân hủy chậm trong tự nhiên sinh ra kết tủa \(CaC{O_3}\) là thành phần chính của thạch nhũ.
Câu 7. Chọn B.
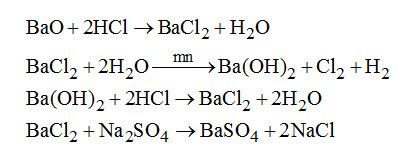
Câu 8. Chọn D.
Các ion không cùng tồn tại nếu kết hợp thành các chất không tan.
Các chất không tan: \(CaC{O_3},BaS{O_4},BaC{O_3}.\)
Câu 9. Chọn A.
Chia 2 trường hợp:
+ \(Ca{(OH)_2}\) dư: \({n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,025\,mol\)
+ \(C{O_2}\) dư so với \(Ca{(OH)_2}\) hòa tan bớt kết tủa còn 0,025 mol.
\( \Rightarrow C{O_2}\) tạo 2 muối \(CaC{O_3}\) và \(Ca{(HC{O_3})_2}\)
\({n_{C{O_2}}} = {n_{CaC{O_3}}} + 2.{n_{Ca{{(HC{O_3})}_2}}} \)\(\,= 0,025 + 2.(0,2 - 0,025) = 0,375\,mol.\)
Câu 10. Chọn C.
\(\begin{array}{l}\overline M + 2HCl \to {H_2} + \overline M C{l_2}\\0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\,\,\,\,mol\\\overline M = 29 \to Mg,Ca\end{array}\)
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết













Danh sách bình luận