 Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
Đề số 3 - Đề kiểm tra học kì 2 - Hóa học 12
Đáp án và lời giải chi tiết Đề số 3 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 12
Đề bài
Câu 1 : Cho dung dịch NaOH đến dư vào dung dịch FeCl2 thấy xuất hiện kết tủa
A. trắng xanh, sau đó chuyển nâu đỏ.
B. keo trắng, sau đó tan dần.
C. keo trắng không tan.
D. nâu đỏ.
Câu 2 : Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta gắn vào mặt ngoài của ống thép những khối kim loại bằng
A. Ag B. Cu
C. Pb D. Zn
Câu 3: Cho từ từ tới dư dung dịch chất X vào dung dịch AlCl3 thu được kết tủa keo trắng. Chất X là
A. HCl. B. NH3.
C. NaOH. D. KOH.
Câu 4: Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp
A. điện phân nóng chảy.
B. điện phân dung dịch.
C. nhiệt luyện.
D. thủy luyện.
Câu 5 : Ngâm một lá kẽm trong 100 ml dung dịch AgNO3 0,2M. Khi phản ứng kết thúc, khối lượng lá kẽm tăng thêm
A. 0,65 gam. B. 0,86 gam.
C. 1,51 gam. D. 2,16 gam.
Câu 6 : Khử hoàn toàn m gam Fe3O4 bằng CO dư ở nhiệt độ cao. Dẫn toàn bộ khí sinh ra vào dung dịch Ca(OH)2 dư, thu được 6 gam kết tủa . Giá trị của m là
A. 9,28. B. 4,64.
C. 3,48. D. 13,92.
Câu 7 : Để điều chế được 5,2 gam crom từ Cr2O3 bằng phương pháp nhiệt nhôm (giả sử hiệu suất phản ứng 100%) thì khối lượng bột nhôm cần lấy là
A. 5,4 gam. B. 1,8 gam.
C. 2,7 gam. D. 3,6 gam.
Câu 8 : Phản ứng nào sau đây không đúng?
A. Cu + 2FeCl3 → CuCl2 + 2FeCl2
B. 2Fe + 3Cl2 2FeCl3
C. Mg + FeCl2 → MgCl2 + Fe
D. Fe + 2S FeS2
Câu 9 : Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A. Ba B. Be
C. Na D. K
Câu 10 : Chất tác dụng với dung dịch HNO3 loãng có thể giải phóng khí NO là
A. Fe2O3. B. CaCO3.
C. CuO. D. Fe(OH)2.
Câu 11 : Chất có thể dùng để làm mềm nước có tính cứng toàn phần là
A. Na3PO4. B. CaCl2.
C. HCl. D. NaHSO4.
Câu 12 : Cấu hình electron lớp ngoài cùng của nguyên tử kim loại Mg (Z = 12) là
A. 2s22p4. B. 4s2.
C. 3s23p1. D. 3s2.
Câu 13 : Phản ứng của cặp chất nào sau đây sản phẩm có muối Fe (II)?
A. Fe3O4 + HCl.
B. FeO + HNO3.
C. Fe(OH)3 + H2SO4.
D. FeCO3 + HNO3.
Câu 14 : Chất không có tính lưỡng tính là
A. Al(OH)3. B. Al2O3.
C. NaHCO3. D. AlCl3.
Câu 15 : Dãy các kim loại được xếp theo chiều tính khử tăng dần là
A. Mg, Fe, Al. B. Fe, Al, Mg.
C. Al, Mg, Fe. D. Fe, Mg, Al.
Câu 16 : Kim loại Ni đều phản ứng được với các dung dịch nào sau đây?
A. MgSO4, CuSO4.
B. AgNO3, NaCl.
C. NaCl, AlCl3.
D. CuSO4, AgNO3.
Câu 17: Dung dịch chất nào sau đây làm quỳ tím hóa xanh?
A. AlCl3. B. Ca(NO3)2.
C. K2CO3. D. Na2SO4.
Câu 18: Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch HNO3 loãng dư, thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 1,12. B. 3,36.
C. 2,24. D. 4,48
Câu 19: Chất nào sau đây không tạo kết tủa khi tác dụng với dung dịch Ca(HCO3)2?
A. NaOH. B. HCl.
C. Ca(OH)2. D. Na2CO3.
Câu 20: Dung dịch NaOH không tác dụng với
A. AlCl3. B. NaHCO3.
C. FeO. D. Al2O3.
Câu 21: Nung hỗn hợp gồm Mg(OH)2 và Fe(OH)2 ngoài không khí cho đến khi khối lượng không đổi thu được chất rắn có thành phần là
A. Mg và FeO.
B. MgO và FeO.
C. MgO và Fe2O3.
D. Mg và Fe.
Câu 22 : Hòa tan hoàn toàn 18 gam hỗn hợp gồm Al và Al2O3 trong dung dịch NaOH giải phóng 3,36 lít khí H2 (đktc). Khối lượng của Al2O3 trong hỗn hợp là
A. 15,30 gam. B. 13,95 gam.
C. 11,93 gam. D. 10,20 gam.
Câu 23 : Phát biểu nào sau đây sai?
A. Quặng hematit có thành phần chính là Fe3O4.
B. Nguyên tắc sản xuất gang là khử quặng sắt oxit bằng than cốc trong lò cao.
C. Thành phần % khối lượng cacbon trong gang là từ 2 – 5%.
D. Thép không gỉ có chứa Cr và Ni.
Câu 24 : Dãy gồm các chất vừa có tính khử vừa có tính oxi hoá là
A. Fe, Fe3O4. B. FeO, FeCl2.
C. Fe, Fe(OH)2. D. FeSO4, Fe2(SO4)3.
Câu 25 : Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol FeCl3 và z mol HCl, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
A. x = y – 2z. B. 2x = y + z.
C. 2x = y + 2z. D. y = 2x.
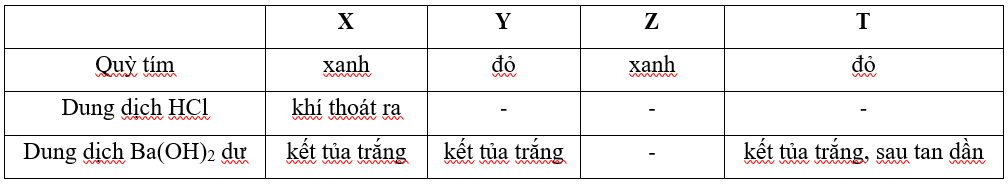
Câu 26 : Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: Ba(HCO3)2, NaOH, AlCl3, KHSO4. Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau: (dấu - là không có hiện tượng).
Nhận xét nào sau đây đúng?
A. X là KHSO4. B. Y là AlCl3.
C. Z là NaOH. D. T là Ba(HCO3)2.
Câu 27 : Nhỏ từ từ 150 ml dung dịch hỗn hợp gồm K2CO3 0,1M và NaHCO3 0,2M vào 200 ml dung dịch HCl 0,2M và khuấy đều. Sau các phản ứng, thu được V(ml) khí CO2 (đktc). Giá trị của V là
A. 336. B. 560.
C. 448. D. 672.
Câu 28 : Cho sơ đồ phản ứng :
Hai chất X, Y lần lượt là
A. MgCl2, Cl2. B. HCl, FeCl2
C. FeCl3, Cl2. D. Cl2, HCl.
Câu 29 : Đốt nóng hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí đến phản ứng hoàn toàn thu được hỗn hợp X. Cho X tác dụng với dung dịch NaOH dư thấy có khí thoát ra. Hỗn hợp X gồm
A. Al, Fe, Fe3O4, Al2O3.
B. Al, Fe, Fe2O3, Al2O3.
C. Al, Fe, Al2O3.
D. Fe, Fe3O4, Al2O3.
Câu 30 : Phát biểu nào sau đây sai?
A. Hợp chất KAl(SO4)2.12H2O dùng làm trong nước được gọi là phèn chua.
B. Ruby và saphia có thành phần hóa học chủ yếu là Al2O3.
C. Nước cứng là nước có chứa các cation Ca2+ và Mg2+.
D. Thạch cao nung dùng để đúc tượng, bó bột... có công thức là CaSO4.H2O.
Câu 31 : Điện phân dung dịch chứa hỗn hợp gồm HCl, FeCl3, CuCl2. Thứ tự điện phân ở catot là
A. Fe3+, Cu2+, H+, Fe2+, H2O
B. Cu2+, H+, Fe3+, H2O
C. Fe3+, Cu2+, H+, H2O
D. Fe3+, Fe2+, Cu2+, H+, H2O
Câu 32 : Cho hỗn hợp gồm Na và Al vào nước (dư). Sau khi phản ứng xảy ra hoàn toàn, thu được khí H2, chất rắn X và dung dịch Y. Y chứa chất nào sau đây?
A. NaOH. B. NaAlO2.
C. Al(OH)3. D. NaOH và NaAlO2.
Câu 33 : Cho 8,4 gam hỗn hợp hai kim loại kiềm thổ liên tiếp X và Y (MX < MY) tác dụng hết với dung dịch HCl thu được 5,6 lít H2 (đktc). Nhận xét nào sau đây về X và Y không đúng?
A. X có kiểu mạng lục phương.
B. X(OH)2 không tan trong H2O.
C. Ở nhiệt độ thường Y tác dụng với H2O.
D. Thành phần % khối lượng của Y trong hỗn hợp là 28,6%.
Câu 34 : Hoà tan hoàn toàn FeO vào dung dịch H2SO4 loãng dư thu được dung dịch X. Phát biểu sai khi nói về dung dịch X là
A. tác dụng được với dung dịch NaNO3.
B. làm mất màu thuốc tím.
C. tạo kết tủa với dung dịch NaOH dư.
D. có thể hòa tan Cu.
Câu 35 : Cho hình vẽ mô tả thí nghiệm điều chế kim loại bằng phương pháp nhiệt luyện:
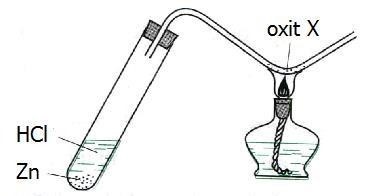
Trong hình vẽ này, oxit X là :
A. CuO. B. Na2O.
C. MgO. D. Al2O3.
Câu 36 : Cho hỗn hợp gồm Mg và Al (tỉ lệ mol 1:1) tan vừa đủ trong dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với giá trị nào sau đây?
A. 50,0. B. 48,6.
C. 35,4. D. 47,3.
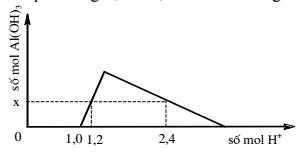
Câu 37 : Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
Tổng giá trị a + b là
A. 1,5. B. 0,5.
C. 0,7. D. 1,7.
Câu 38 : Cho H2 dư qua m gam hỗn hợp chất rắn X gồm Fe, CuO, Fe3O4 nung nóng, phản ứng kết thúc thấy khối lượng chất rắn giảm 0,48 gam. Nếu hòa tan hoàn toàn m gam X vào V(ml) dung dịch HNO3 0,5M vừa đủ thì thu được tối đa 1,344 lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 480. B. 720.
C. 600. D. 500.
Câu 39 : Cho các phát biểu về ứng dụng hóa học và giải pháp thực tế sau:
(a) Khi nhiệt kế bị vỡ có thể dùng bột lưu huỳnh gom thủy ngân bị rơi vãi.
(b) Bảo quản kim loại kiềm cần ngâm chúng trong dầu hỏa
(c) Dùng hỗn hợp tecmit (Al và Fe2O3) điều chế một lượng nhỏ sắt để hàn đường ray.
(d) Ở điều kiện thường có thể dùng bình bằng sắt chuyên chở axit H2SO4 đặc
(e) Ngâm đinh sắt vào dung dịch muối Fe2+ để dung dịch không chuyển thành Fe3+.
Số phát biểu đúng là
A. 2. B. 5.
C. 4. D. 3.
Câu 40 : Cho 30 gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch HCl, sau phản ứng hoàn toàn thu được dung dịch Y chứa hai chất tan và còn lại 6,32 gam chất rắn. Cho dung dịch AgNO3 dư vào dung dịch Y thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 25,9. B. 91,8.
C. 86,2. D. 117,8.
Lời giải chi tiết
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Phương pháp: Tính chất hóa học các hợp chất của sắt
Hướng dẫn giải:
- Ban đầu tạo Fe(OH)2 có màu trắng xanh:
FeCl2 + 2NaOH → Fe(OH)2 (trắng xanh) + 2NaCl
- Sau đó Fe(OH)2 bị O2 (trong dung dịch và không khí) oxi hóa thành Fe(OH)3 có màu nâu đỏ:
Fe(OH)2 + ¼ O2 + ½ H2O → Fe(OH)3 (nâu đỏ)
Vậy hiện tượng là tạo kết tủa trắng xanh, sau đó chuyển nâu đỏ.
Đáp án A
Câu 2:
Phương pháp: Ăn mòn điện hóa
(*) Định nghĩa:
- Là sự oxi hoá kim loại có phát sinh dòng điện.
(*) Điều kiện để xảy ra ăn mòn điện hóa:
- Bản chất hai điện cực phải khác nhau.(KL-KL, KL-PK,…)
- Hai điện cực phải cùng tiếp xúc với môi trường chất điện ly.
- Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn)
Chú ý: Trong một pin điện hóa thì KL nào có tính khử mạnh hơn sẽ bị ăn mòn trước.
Hướng dẫn giải:
(*) Ứng dụng pin điện:
Khi gắn tấm kẽm lên ống thép tức là ta tạo ra 1 pin điện Zn-Fe trong đó Zn là cực âm là Zn và cực dương là Fe (trong thép). Trong pin điện này, cực âm diễn ra quá trình oxi hóa Zn: Zn0 → Zn+2 + 2e
=> Zn sẽ bị oxi hóa trước Fe nên ông thép được bảo vệ.
Đáp án D
Câu 3:
Phương pháp: Tính chất hóa học hợp chất của Al
Hướng dẫn giải:
X (dư) + AlCl3 → Al(OH)3
=> X không thể là dung dịch bazo mạnh (dung dịch hidroxit của kiềm, kiềm thổ) vì sẽ hòa tan kết tủa
=> X là dung dịch bazo yếu (NH3)
PTHH: 3NH3 + AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl
Đáp án B
Câu 4:
Phương pháp: Dựa vào phương pháp điều chế kim loại trong công nghiệp.
Hướng dẫn giải:
Các kim loại kiềm và kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogen.
Đáp án A
Câu 5:
Phương pháp: Bài toán tăng giảm khối lượng : mThanh KL tăng = mKL tạo ra – mKL phản ứng
Hướng dẫn giải:
nAgNO3 = 0,1.0,2 = 0,02 mol
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Mol 0,01 ¬ 0,02 → 0,02
=> mThanh KL tăng = mAg – mZn = 108.0,02 – 65.0,01 = 1,51g
Đáp án C
Câu 6:
Phương pháp: Tính toán theo phương trình phản ứng
Hướng dẫn giải:
- Khi dẫn CO2 vào dd Ca(OH)2 dư: CO2 + Ca(OH)2 → CaCO3 + H2O
=> nCO2 = nCaCO3 = 6 : 100 = 0,06 mol
BTNT "C" => nCO pư = nCO2 = 0,06 mol
- Phản ứng khử oxit bằng CO có thể hiểu đơn giản là:
CO + [O] → CO2
=> nO(oxit) = nCO pư = 0,06 mol
=> nFe3O4 = 1/4.nO(oxit) = 0,015 mol
=> mFe3O4 = 0,015.232 = 3,48g
Đáp án C
Câu 7:
Phương pháp: Viết và tính toán theo PTHH.
Hướng dẫn giải:
PTHH: Cr2O3 + 2Al → Al2O3 + 2Cr
=> nAl = nCr = 5,2 : 52 = 0,1 mol
=> mAl = 27.0,1 = 2,7g
Đáp án C
Câu 8:
Phương pháp: Tính chất hóa học của sắt và các hợp chất của sắt.
Hướng dẫn giải:
Phản ứng D không đúng. PTHH đúng là: Fe + S FeS
Đáp án D
Câu 9:
Phương pháp: Tính chất hóa học của kim loại
Hướng dẫn giải:
Kim loại kiềm, kiềm thổ (trừ Be, Mg) có thể phản ứng với nước ở điều kiện thường.
Vậy Be không phản ứng được với nước ở điều kiện thường.
Đáp án B
Câu 10:
Phương pháp: Tính chất hóa học của các chất vô cơ
Hướng dẫn giải:
Một chất tác dụng với HNO3 sinh ra NO => Phản ứng oxi hóa - khử
Chỉ có phản ứng giữa Fe(OH)2 và HNO3 là phản ứng oxi hóa - khử.
PTHH:
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
Đáp án D
Câu 11:
Phương pháp:
(*) Phương pháp làm mềm nước cứng :
- Với nước cứng tạm thời:
+ Đun sôi.
+ Thêm Ca(OH)2 vừa đủ.
+ Thêm các dung dịch kiềm khác, dung dịch muối CO32-, dung dịch PO43-.
- Với nước cứng vĩnh cửu:
Thêm các dung dịch muối CO32-, dung dịch PO43-.
Hướng dẫn giải:
Chất thỏa mãn là Na3PO4
Đáp án A
Câu 12:
Phương pháp: Dựa vào cách viết cấu hình electron nguyên tử
Hướng dẫn giải:
12Mg: 1s22s22p63s2
Đáp án D
Câu 13:
Phương pháp: Tính chất hóa học của Fe và hợp chất của Fe
Chú ý: Khi tác dụng với các chất có tính oxi hóa mạnh thì Fe sẽ lên mức oxi hóa cao nhất +3.
Hướng dẫn giải:
A. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
B. FeO + HNO3 → Fe3+ + sản phẩm khử
C. 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
D. FeCO3 + HNO3 → Fe3+ + sản phẩm khử
Đáp án A
Câu 14:
Phương pháp: Chất lưỡng tính vừa có thể cho proton và nhận proton (H+)
Hướng dẫn giải:
AlCl3 không thể nhận proton (H+) nên không phải là chât lưỡng tính
Đáp án D
Câu 15:
Phương pháp: Dựa vào dãy điện hóa kim loại
Hướng dẫn giải:
Tính khử: Fe < Al < Mg
Đáp án B
Câu 16:
Phương pháp: Dãy điện hóa của kim loại
Hướng dẫn giải:
Các kim loại có tính khử mạnh hơn sẽ đẩy được kim loại yếu hơn ra khỏi muối của nó
A. Sai vì Ni không đẩy được Mg ra khỏi MgSO4
B. Sai vì Ni không đẩy được Na ra khỏi NaCl
C. Sai vì Ni không đẩy được Na ra khỏi NaCl, không đẩy được Al ra khỏi AlCl3
D. Đúng vì Ni đều phản ứng được với CuSO4, AgNO3
PTHH:
Ni + CuSO4 → NiSO4 + Cu
Ni + 2AgNO3 → Ni(NO3)2 + 2Ag
Đáp án D
Câu 17:
Phương pháp:
Cách xác định nhanh môi trường của dung dịch muối:
- Muối tạo bởi bazo yếu và axit mạnh
=> MT axit => Làm quỳ hóa đỏ
- Muối tạo bởi bazo mạnh và axit yếu
=> MT bazo => Làm quỳ hóa xanh
- Muối tạo bởi bazo mạnh và axit mạnh
=> MT trung tính => Không làm quỳ tím chuyển màu
Hướng dẫn giải:
Quỳ hóa xanh: K2CO3 (do tạo bởi bazo mạnh KOH và axit yếu H2CO3)
Quỳ hóa đỏ: AlCl3 (do tạo bởi bazo yếu Al(OH)3 và axit mạnh HCl)
Quỳ tím không đổi màu: Ca(NO3)2 ; Na2SO4 (do tạo bởi các bazo mạnh Ca(OH)2, NaOH và axit mạnh HNO3, H2SO4)
Đáp án C
Câu 18:
Phương pháp: Bảo toàn electron
Hướng dẫn giải:
Fe → Fe+3 + 3e
N+5 + 3e → N+2
Bảo toàn e: nFe = nNO = 8,4 : 56 = 0,15 mol
=> VNO = 0,15.22,4 = 3,36 lít
Đáp án B
Câu 19:
Phương pháp: Tính chất hóa học của muối canxi
Hướng dẫn giải:
PTHH:
- Phương án A:
Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O
hoặc Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
- Phương án B:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Phương án C:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- Phương án D:
Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3
Vậy HCl không tạo ra kết tủa khi tác dụng với dung dịch Ca(HCO3)2
Đáp án B
Câu 20:
Phương pháp: Dựa vào điều kiện của phản ứng trao đổi.
Phản ứng trao đổi chỉ xảy ra khi phản ứng sinh ra ít nhất 1 trong 3 loại chất sau:
- Chất kết tủa
- Chất khí
- Chất điện li yếu
Hướng dẫn giải:
NaOH không phản ứng được với FeO.
Các PTHH xảy ra:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
NaHCO3 + NaOH → Na2CO3 + H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Đáp án C
Câu 21:
Hướng dẫn giải:
Mg(OH)2 MgO + H2O
2Fe(OH)2 + ½ O2 Fe2O3 + 2H2O
Vậy chất rắn gồm: MgO, Fe2O3
Đáp án C
Câu 22:
Phương pháp: Tính toán theo phương trình phản ứng:
Al + NaOH + H2O → NaAlO2 + 1,5H2
Từ lượng khí H2 tính được lượng Al => lượng Al2O3
Hướng dẫn giải:
nH2 = 3,36 : 22,4 = 0,15 mol
Al + NaOH + H2O → NaAlO2 + 1,5H2
Mol 0,1 ¬ 0,15
=> mAl2O3 = 18 – mAl = 18 – 0,1.27 = 15,3g
Đáp án A
Câu 23:
Phương pháp: Lý thuyết về sắt và hợp kim của sắt
Hướng dẫn giải:
A sai vì quặng hematit có thành phần chính là là Fe2O3.
B, C, D là các phát biểu đúng
Đáp án A
Câu 24:
Phương pháp: Chất vừa có tính khử vừa có tính oxi hoá là chất vừa có thể nhận e và cho e (đang ở trạng thái có số oxi hóa trung gian)
Hướng dẫn giải:
Fe có số oxi hóa cao nhất là +3, thấp nhất là 0 => Các hợp chất sắt II vừa có tính khử vừa có tính oxi hoá
Vậy FeO và FeCl2 vừa có tính khử và tính oxi hóa.
Đáp án B
Câu 25:
Phương pháp: Tính chất hóa học các hợp chất của sắt
Hướng dẫn giải:
Dung dịch sau phản ứng chỉ thu được 1 chất tan duy nhất chính là FeCl2 vì :
Cách 1:Tìm mối liên hệ theo PTHH
Fe + 2HCl → FeCl2 + H2
Fe + 2FeCl3 → 3FeCl2
=> 2 phản ứng trên phải xảy ra hoàn toàn.
nFe = ½ nHCl + ½ nFeCl3 => 2x = y + z
Cách 2: Tìm mối liên hệ dựa vào bảo toàn electron
Bảo toàn e ta có: n e nhường = n e nhận
=> 2nFe = nFe3+ + nH+ => 2x = y + z
Đáp án B
Câu 26:
Hướng dẫn giải:
- Chỉ có X có phản ứng với HCl tạo khí => X là Ba(HCO3)2
Ba(HCO3)2 + 2HCl → BaCl2 + 2CO2 + 2H2O
=> Loại A và D
- Z làm quì tím hóa xanh nhưng không phản ứng được với HCl tạo khí => Z là NaOH
NaOH + HCl → NaCl + H2O
Đáp án C
Câu 27:
Phương pháp: Muối Cacbonat, Hidrocacbonat + H+
- TH1 : Nếu Cho từ từ Muối (CO32- : x mol và HCO3- : y mol) vào dung dịch Axit
=> Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời theo cùng tỉ lệ mol ban đầu.
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ → CO2 + H2O
=> nCO3 pứ : nHCO3 pứ = x : y
Hướng dẫn giải:
nK2CO3 = nCO3 2- = 0,15.0,1 = 0,015 mol
nNaHCO3 = nHCO3- = 0,15.0,2 = 0,03 mol
Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ → CO2 + H2O
=> nCO3 pứ : nHCO3 pứ = 0,015 : 0,03 = 1 : 2 = x : 2x
nHCl = 0,2.0,2 = 0,04 mol = 2.x + 1.2x = 4x
=> x = 0,01 mol
=> nCO2 = x + 2x = 3x = 0,03 mol
=> VCO2 = 0,03.22,4 = 0,672 lít = 672 ml
Đáp án D
Câu 28:
Phương pháp: Tính chất hóa học của Fe
Hướng dẫn giải:
A loại vì MgCl2 không phản ứng với Fe
B loại vì Fe không phản ứng được với FeCl2
C thỏa mãn.
PTHH: Fe + 2FeCl3 →3FeCl2; Fe + 1,5Cl2 → FeCl3
D loại vì Fe + 2HCl → FeCl2 + H2
=> Vậy cặp chất thỏa mãn là: X (FeCl3) và Y (Cl2)
Đáp án C
Câu 29:
Phương pháp: X tác dụng với NaOH dư thấy có khí thoát ra chứng tỏ X có chứa Al => Al dư, Fe3O4 phản ứng hết
Từ đó suy ra thành phần của X.
Hướng dẫn giải:
- Hỗn hợp X + NaOH tạo khí
=> có Al dư sau phản ứng
Al + NaOH + H2O → NaAlO2 + 1,5H2
- Phản ứng ban đầu :
Al + Fe3O4 → Al2O3 + 9Fe (Fe3O4 hết)
=> Hỗn hợp sau phản ứng có : Al, Fe, Al2O3
Đáp án C
Câu 30:
Phương pháp: Lý thuyết về các chất vô cơ
Hướng dẫn giải: Nước cứng là nước chứa nhiều Ca2+ ; Mg2+ (Nếu chứa ít Ca2+ ; Mg2+ thì chưa gọi là nước cứng)
Đáp án C
Câu 31:
Phương pháp: Trong quá trình điện phân, ở catot những ion nào có tính oxi hóa mạnh hơn bị khử trước.
Hướng dẫn giải:
Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O (Fe2+ do Fe3+ bị điện phân sinh ra)
=> Thứ tự điện phân ở catot là: Fe3+ > Cu2+ > H+ > Fe2+ > H2O
Đáp án A
Câu 32:
Phương pháp: Tính chất hóa học của Al
Hướng dẫn giải:
- Vì sau phản ứng có chất rắn Y nê Al dư
Na + H2O → NaOH + ½ H2
NaOH + Al + H2O → NaAlO2 + 1,5H2
Dung dịch sau phản ứng chỉ có NaAlO2
Đáp án B
Câu 33:
Phương pháp: Phương pháp trung bình :
Qui 2 kim loại kiềm thổ thành kim loại M (hóa trị II)
=> Tính toán theo 1 phương trình phản ứng
=> M trung bình của 2 kim loại
=> Tìm được tên của 2 kim loại
Hướng dẫn giải:
- Qui 2 kim loại kiềm thổ thành kim loại M (hóa trị II)
M + 2HCl → MCl2 + H2
Mol 0,25 ¬ 0,25
=> Mtb = 8,4 : 0,25 = 33,6 g/mol
=> 2 kim loại kiềm thổ liên tiếp là Mg(X) và Ca(Y)
Gọi số mol Mg và Ca lần lượt là x và y
=> nKL = x + y = 0,25 mol
Và mKL = 24x + 40y = 8,4
=> x = 0,1 ; y = 0,15 mol
=> %mY = 0,15.40 : 8,4 = 71,4%
A đúng vì Mg có kiểu mạng tinh thể lục phương
B đúng vì Mg(OH)2 không tan trong nước
C đúng vì Ca phản ứng được với nước ở nhiệt độ thường
D sai vì thành phần của Ca (Y) trong hỗn hợp ban đầu là 71,4%
Đáp án D
Câu 34:
Phương pháp: Dựa vào dữ kiện H2SO4 loãng dư suy ra thành phần của dung dịch sau phản ứng.
Hướng dẫn giải:
Phản ứng: FeO + H2SO4 → FeSO4 + H2O
Do H2SO4 dư nên dung dịch sau phản ứng có chứa: FeSO4, H2SO4
=> Dung dịch này không thể hòa tan Cu.
Đáp án D
Câu 35:
Phương pháp: Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của KL đứng sau Al trong dãy điện hóa.
Hướng dẫn giải:
- Khi cho Zn phản ứng với HCl sinh ra H2:
Zn + 2HCl → ZnCl2 + H2
- H2 sinh ra chỉ khử được CuO
Đáp án A
Câu 36:
Phương pháp:
- Biện luận các chất khí trong hỗn hợp khí sản phẩm => số mol các khí
=> Biện luận chất nào dư, chất nào hết sau phản ứng
=> Các chất trong dung dịch X (Chú ý kiểm tra xem có NH4+ trong dung dịch hay không)
- Dựa vào định luật bảo toàn điện tích để tích số mol các ion trong dung dịch
=> Khối lượng chất tan trong X
Hướng dẫn giải:
Vì hỗn hợp khí thu được có dY/H2 = 12,2
=> Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4)
=> khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn nguyên tố N:
nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron:
3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2
= 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa:
0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích:
nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
m= 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g
(Gần nhất với giá trị 47,3g)
Đáp án D
Câu 37:
Phương pháp: Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau:
[Al(OH)4]- + H+→ Al(OH)3 + H2O (1)
Al(OH)3 + 3H+→ Al3+ + 3H2O (2)
*Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì:
+ Nếu b/a 1 thì: nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Hướng dẫn giải:
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
- Tại: nH+ = 1,0 mol => bắt đầu có kết tủa
=> Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a
- Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa
=> nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol
- Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa
=> nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ)
=> 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol
=> (a + b) = 1,5 mol
Đáp án A
Câu 38:
Phương pháp:
Bài toán hỗn hợp kim loại, oxit tan hết trong HNO3
- Qui hỗn hợp về dạng: KL, O
=> Công thức giải nhanh:
ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO
nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO
Hướng dẫn giải:
- Quy hỗn hợp X về: Fe, Cu, O
- Khi X + H2 nghĩa là: [O] + H2 → H2O
=> mrắn giảm = mO pứ = 0,48g
=> nO(X) = 0,48 : 16 = 0,03 mol
- Khi X + HNO3: nNO = 1,344 : 22,4 = 0,06 mol
=> Ta có: nHNO3 = 4nNO + 2nO = 4.0,06 + 2.0,03 = 0,3 mol
=> VHNO3 = 0,3 : 0,5 = 0,6 lít = 600 ml
Đáp án C
Câu 39:
Phương pháp: Tính chất hóa học của các chất vô cơ
Hướng dẫn giải:
(a) Đúng. Nhờ phản ứng : Hg + S → HgS↓ (dễ thu gom)
(b) Đúng
(c) Đúng
(d) Đúng. Vì Fe thụ động trong H2SO4 đặc nguội => không có phản ứng
(e) Đúng. Vì dưới tác dụng của Oxi không khí, Fe2+ sẽ chuyển thành Fe3+ nhưng khi có Fe thì sẽ xảy ra phản ứng: Fe + 2Fe3+ → 3Fe2+
Đáp án B
Câu 40:
Phương pháp: Biện luận các chất có trong dung dịch và chất rắn sau phản ứng
=> Tìm xem trong X chất nào dư, chất nào hết
=> Tính được số mol các chất phản ứng
Chú ý khi cho muối sắt vào dung dịch AgNO3 có phản ứng: Fe2+ + Ag+ → Fe3+ + Ag↓
Hướng dẫn giải:
X + HCl: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Mol x → x → 2x
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Mol x ¬ 2x → x → 2x
Vì sau phản ứng có 2 muối trong dung dịch => Chỉ có Cu2+ và Fe2+
Chất rắn sau phản ứng chỉ gồm Cu dư.
mchất phản ứng = 232.x + 64.x = mX – mCu dư = 30 – 6,32
=> x = 0,08 mol
=> Trong dung dịch có: 0,08mol CuCl2 và 0,24 mol FeCl2
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Fe3+ + Ag
=> Chất kết tủa gồm: 0,24 mol Ag và 0,64 mol AgCl
=> m = 117,76g (Gần nhất với giá trị 117,8g)
Đáp án D
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết














Danh sách bình luận