 Đề thi hóa 11, đề kiểm tra hóa 11 kết nối tri thức có đáp án và lời giải chi tiết
Đề thi hóa 11, đề kiểm tra hóa 11 kết nối tri thức có đáp án và lời giải chi tiết
 Đề thi học kì 2 Hóa 11 - Kết nối tri thức
Đề thi học kì 2 Hóa 11 - Kết nối tri thức Đề cương ôn tập học kì 2 Hóa 11
Tải vềChủ đề 4: Hydrocarbon Khái niệm, đồng phân, danh pháp,
A. NỘI DUNG ÔN TẬP
Chủ đề 4: Hydrocarbon
Khái niệm, đồng phân, danh pháp, tính chất vật lí, tính chất hóa học và ứng dụng, điều chế của:
Chủ đề 5: Dẫn xuất halogen – Alcohol – Phenol
Khái niệm, đồng phân, danh pháp, tính chất vật lí, tính chất hóa học và ứng dụng, điều chế của:
Chủ đề 6: Hợp chất carbonyl – Carboxylic acid
Khái niệm, đồng phân, danh pháp, tính chất vật lí, tính chất hóa học và ứng dụng, điều chế của:
B. BÀI TẬP
Đề bài
I. Phần trắc nghiệm
Câu 1: Alkane là những hydrocarbon no, mạch hở, có công thức chung là
A. CnH2n+2 (n ≥1). B. CnH2n (n ≥2). C. CnH2n-2 (n ≥2). D. CnH2n-6 (n ≥6).
Câu 2: Alkane (CH3)2CH–CH3 có tên theo danh pháp thay thế là
A. 2-methylpropane. B. isobutane.
C. butane. D. 2-methylbutane.
Câu 3: Ở điều kiện thường hydrocarbon nào sau đây ở thể lỏng?
A. C4H10. B. C2H6. C. C3H8. D. C5H12.
Câu 4: Trong các chất dưới đây, chất nào có nhiệt độ sôi thấp nhất?
A. Butane. B. Ethane. C. Methane. D. Propane.
Câu 5: Phản ứng đặc trưng của hydrocarbon no là
A. Phản ứng tách. B. Phản ứng thế.
C. Phản ứng cộng. D. Phản ứng oxi hóa.
Câu 6: Cho isopentane tác dụng với Cl2 theo tỉ lệ số mol 1: 1, số sản phẩm monochloro tối đa thu được là
A. 5. B. 4. C. 3. D. 2.
Câu 7: Cho phản ứng cracking sau:
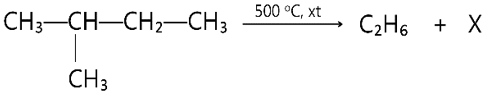
Công thức cấu tạo thu gọn của X là
A. CH3CH2CH3. B. CH3-CH=CH2.
C. CH3-CH=CH-CH3. D. CH3CH2CH2CH3.
Câu 8: Alkene sau có tên gọi là
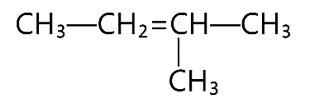
A. 2-methylbut-2-ene. B. 3-methylbut-2-ene.
C. 2-metybut-3-ene. D. 3-methylbut-3-ene.
Câu 9: Alkyne dưới đây có tên gọi là
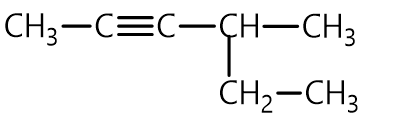
A. 4-ethylpent-2-yne. B. 2-ethylpent-3-yne.
C. 4-methylhex-2-yne. D. 3-methylhex-4-yne.
Câu 10: Nếu muốn phản ứng: CH≡CH + H2 dừng lại ở giai đoạn tạo thành ethylene thì cần sử dụng xúc tác nào dưới đây?
A. H2SO4 đặc. B. Lindlar. C. Ni/to. D. HCl loãng.
Câu 11: Cho phản ứng: 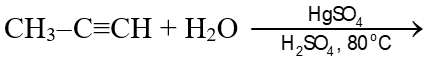
Sản phẩm chính của phản ứng trên là
A. CH3CH2-CH=O. B. CH3-CO-CH3.
C. CH2=C(CH3)-OH. D. HO-CH=CH-CH3.
Câu 12: Trùng hợp ethylene, sản phẩm thu được có cấu tạo là
A. 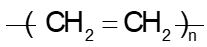
B. 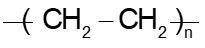
C. 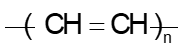
D. 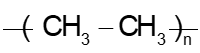
Câu 13: Cho các alkene: CH3-CH=CH-C2H5 (X); CH3-CH=CH-CH3 (Y); CH2=CH-C2H5 (Z);
CH3-CH=C(CH3)2 (T). Alkene nào có đồng phân hình học?
A. X, Y và Z. B. X và Y. C. Y, Z và T. D. T và Z.
Câu 14: Chất nào sau đây khi tác dụng với hỗn hợp HNO3 và H2SO4 đặc nóng tạo một sản phẩm mononitro hoá duy nhất?
A. Benzene. B. Toluene. C. o-xylene. D. Naphthalene.
Câu 15: Hợp chất thuộc loại dẫn xuất halogen của hydrocarbon là
A. C2H7N. B. C2H6O. C. CH4. D. C6H5Br.
Câu 16: Số đồng phân cấu tạo có cùng công thức phân tử C4H9Cl là
A. 3 B. 5 C. 4 D. 2
Câu 17: Alcohol là những hợp chất hữu cơ mà phân tử có chứa nhóm OH liên kết trực tiếp với
A. nguyên tử carbon. B. nguyên tử carbon không no.
C. nguyên tử carbon no. D. nguyên tử oxygen.
Câu 18: Tên gọi thông thường của dẫn xuất halogen có công thức CHCl3 là
A. methyl chloride. B. trichloromethane.
C. chloroform. D. propyl chloride.
Câu 19: Cho các dẫn xuất halogen sau: (1) C2H5F; (2) C2H5Cl; (3) C2H5Br; (4) C2H5I. Thứ tự giảm dần của nhiệt độ sôi là
A. (1) > (2) > (3) > (4). B. (1) > (4) > (2) > (3).
C. (4) > (3) > (2) > (1). D. (4) > (2) > (1) > (3).
Câu 20: Hai ancol nào sau đây cùng bậc?
A. Methanol và ethanol B. Propan-1-ol và propan-2-ol
C. Ethanol và propan-2-ol D. Propan-2-ol và 2-methylpropan-2-ol
Câu 21: Trong các chất sau, chất nào thuộc loại phenol?
A. 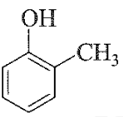 B.
B. 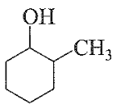
C. 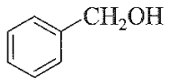 D.
D. 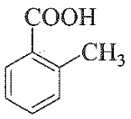
Câu 22: Phản ứng với chất/dung dịch nào sau đây của phenol chứng minh phenol có tính acid?
A. Na. B. Dung dịch NaOH.
C. Dung dịch bromine. D. HNO3 đặc/ H2SO4 đặc.
Câu 23: Cho các phát biểu:
(a) Do phân tử phân cực nên dẫn xuất halogen không tan trong dung môi hữu cơ như hydrocarbon, ether,..
(b) Nhiều dẫn xuất halogen có hoạt tính sinh học.
(c) Trong điều kiện thường, dẫn xuất halogen có thể ở dạng rắn, lỏng hay khí tùy thuộc vào khối lượng phân tử, bản chất và số lượng nguyên tử halogen.
(d) Nhiều dẫn xuất halogen được sử dụng trong tổng hợp các hợp chất hữu cơ.
(e) do liên kết C-X (X là F, Cl, Br, I) không phân cực nên dẫn xuất halogen dễ tham gia vào nhiều phản ứng hóa học
Số phát biểu đúng là
A. 3 B. 5 C. 4 D. 2
Câu 24: Số đồng phân carboxylic acid có công thức phân tử C4H8O2 là
A. 2. B. 3. C. 4. D. 5.
Câu 25: Ketone là hợp chất hữu cơ trong phân tử có
A. nhóm chức –CO- liên kết với hai gốc hydrocarbon.
B. nhóm chức –OH liên kết trực tiếp với nguyên tử carbon no.
C. nhóm chức –CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
D. nhóm chức –COO- liên kết với hai gốc hydrocarbon.
Câu 26: Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là
A. CnH2nO2 ( n ≥ 1). B. CnH2nO ( n ≥ 1).
C. CnH2n-2O( n ≥ 3). D. CnH2n+2O( n ≥ 1).
Câu 27: Tên thông thường của CH2=CH-CHO là
A. acetic aldehyde. B. acrylic aldehyde.
C. benzoic aldehyde. D. propionic aldehyde.
Câu 28: Cho hợp chất carbonyl có công thức cấu tạo sau
Tên theo danh pháp thay thế của hợp chất carbonyl đó là
A. 2-methylbutan -3-one. B. 3-methylbutan-2-one.
C. 3-methylbutan-2-ol. D. 1,1-dimethypropan-2-one
Câu 29: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu đỏ?
A. C2H5OH. B. C3H5(OH)3. C. CH3COOH. D. CH3CHO.
Câu 30: Cho lá zinc mỏng vào ống nghiệm đựng 2 mL dung dịch chất X, thấy lá kẽm tan dần và có khí thoát ra. Chất X là
A. glycerol. B. ethyl alcohol. C. saccarozơ. D. acetic acid.
Câu 31: Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
A. CnH2nO2 (n ≥ 1). B. CnH2n+2O2 (n ≥ 1).
C. CnH2n-1COOH (n ≥ 1). D. CnH2nO2 (n ≥ 2).
Câu 32: Số đồng phân carboxylic acid có công thức phân tử C4H8O2 là
A.2. B. 3. C. 4. D. 5.
Câu 33: Ketone là hợp chất hữu cơ trong phân tử có
A. nhóm chức –CO- liên kết với hai gốc hydrocarbon.
B. nhóm chức –OH liên kết trực tiếp với nguyên tử carbon no.
C. nhóm chức –CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
D. nhóm chức –COO- liên kết với hai gốc hydrocarbon.
Câu 34: Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là
A. CnH2nO2 ( n ≥ 1). B. CnH2nO ( n ≥ 1).
C. CnH2n-2O( n ≥ 3). D. CnH2n+2O( n ≥ 1).
Câu 35: Tên thông thường của CH2=CH-CHO là
A. acetic aldehyde. B. acrylic aldehyde.
C. benzoic aldehyde. D. propionic aldehyde.
Câu 36: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu đỏ?
A. C2H5OH. B. C3H5(OH)3. C. CH3COOH. D. CH3CHO.
Câu 37: Cho lá zinc mỏng vào ống nghiệm đựng 2 mL dung dịch chất X, thấy lá kẽm tan dần và có khí thoát ra. Chất X là
A. glycerol. B. ethyl alcohol. C. saccarozơ. D. acetic acid.
Câu 38: Cho 11,6 gam aldehyde đơn chức X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, đun nóng, thu được 43,2 gam Ag. Công thức của X là
A. C2H3CHO. B. HCHO. C. CH3CHO. D. C2H5CHO.
Câu 39: Cho các chất: NaHCO3; Na2CO3; CH3COONa; NaOH. Có bao nhiêu chất có thể phản ứng được với acetic acid?
A. 1. B. 2. C. 3. D. 4.
II. Tự luận
Câu 1: Dữ liệu thực nghiệm của hợp chất hữu cơ X như sau:
- Kết quả phân tích nguyên tố của (X) có 40% C; 6,67% H; còn lại là O về khối lượng
- Kết quả đo phổ khối lượng (MS) và phổ hồng ngoại (IR) của hợp chất (E) được cho như hìnhbên dưới:
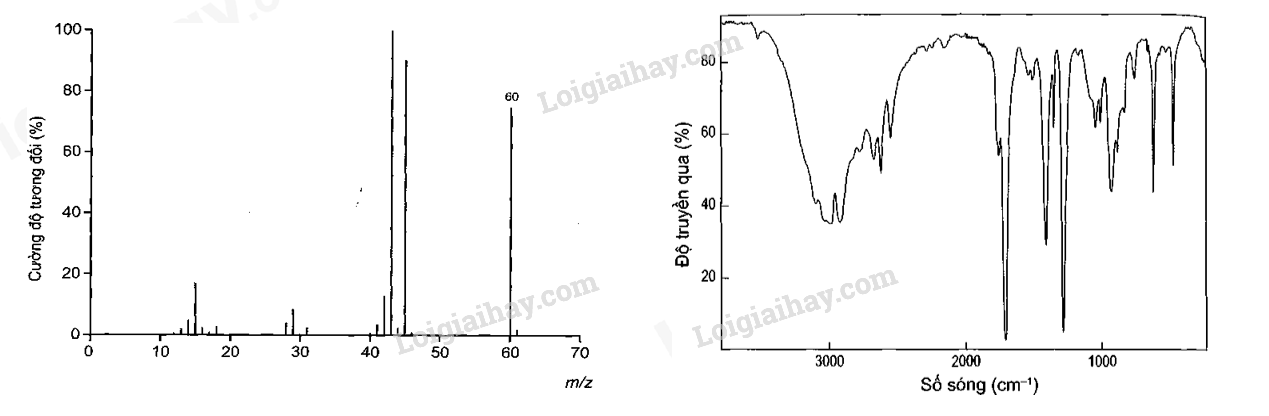 |
|
a. Công thức phân tử của X là C2H4O
b. X có nhóm chức – CHO
c. X có khả năng phản ứng với NaOH
d. Trong phân tử X có 2 liên kết pi.
Câu 2: Chỉ số octane (octane number) là đại lượng đặc trưng cho yếu tố đo lường khả năng chống kích nổ của một nhiên liệu khi nhiên liệu này bốc cháy với không khí bên trong xi lanh của động cơ đốt trong. Nếu chỉ số octane của một mẫu xăng thấp, xăng sẽ tự cháy mà không do bu-gi bật tia lửa điện đốt. Điều này làm cho hiệu suất động cơ giảm và sẽ hư hao các chi tiết máy. Người ta quy ước rằng chỉ số octane của 2,2,4 – trimethylpentane là 100 và của heptane là 0. Các hydrocarbon mạch vòng và mạch phân nhánh có chỉ số octane cao hơn hydrocarbon mạch không nhánh.
a. Chỉ số octane càng cao thì khả năng chịu nén của nhiên liệu trước khi phát nổ (đốt cháy) càng nhỏ, đồng thời giảm thiểu được ô nhiễm môi trường.
b. Ethanol có thể làm tăng chỉ số octane của xăng
c. Phản ứng reforming alkane được ứng dụng làm tăng chỉ số octane của xăng, dầu
d. Một mẫu xăng chỉ gồm 8 phần thể tích 2,2,4 – trimethylpentane và 2 phần thể tích heptane thì chỉ số octane của mẫu xăng này là 60.
Câu 3: Cho biết nhận định đúng, sai.
Cho các phát biểu:
a. Do phân tử phân cực nên dẫn xuất halogen không tan trong dung môi hữu cơ như hydrocarbon, ether,..
b. Nhiều dẫn xuất halogen có hoạt tính sinh học.
c. Trong điều kiện thường, dẫn xuất halogen có thể ở dạng rắn, lỏng hay khí tùy thuộc vào khối lượng phân tử, bản chất và số lượng nguyên tử halogen.
d. Nhiều dẫn xuất halogen được sử dụng trong tổng hợp các hợp chất hữu cơ.
Câu 4: Thí nghiệm được tiến hình như hình vẽ bên.
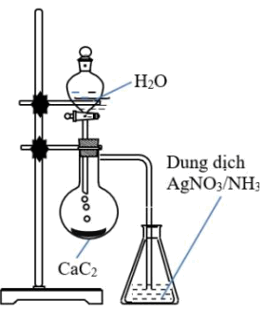
a. Hiện tượng trong bình đựng dung dịch AgNO3/NH3 có xuất hiện kết tủa trắng bạc
b. Thí nghiệm trên điều chế khí ethylene
c. Sản phẩm có phản ứng làm mất màu dung dịch nước bromine
d. CaC2 có tên gọi khác là đất đèn.
Câu 5: Một alcohol X có công thức phân tử là C2H6O2. Ở điều kiện thường, X là chất lỏng không màu, không mùi, tan tốt trong nước, có độ nhớt khá cao, có vị ngọt. Chất X được sử dụng rộng rãi làm chất chống đông và làm nguyên liệu trong sản xuất poly(ethylene terephtalate). Chất X có thể điều chế bằng cách oxi hóa trực tiếp ethylene bằng dung dịch potassium permangannate. Xác định công thức cấu tạo của X gọi tên X theo tên thay thế và tên thông thường.
Câu 6: Một mẫu khí gas X chứa hỗn hợp propane và butane. Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 594 kJ. Biết rằng, khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Tỉ lệ số mol của propane và butane trong X?
Câu 7: Acetone được điều chế bằng cách oxi hóa cumene nhờ oxygen, sau đó thủy phân trong dung dịch H2SO4 loãng. Để thu được 174 gam acetone thì lượng cumene cần dùng (giả sử hiệu suất quá trình điều chế đạt 70%) là bao nhiêu?
Câu 8: Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,… Acetic acid được tổng hợp từ nguồn khí than đá (giá thành rẻ) theo các phản ứng sau:
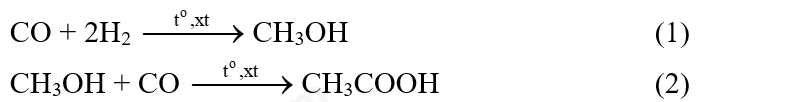
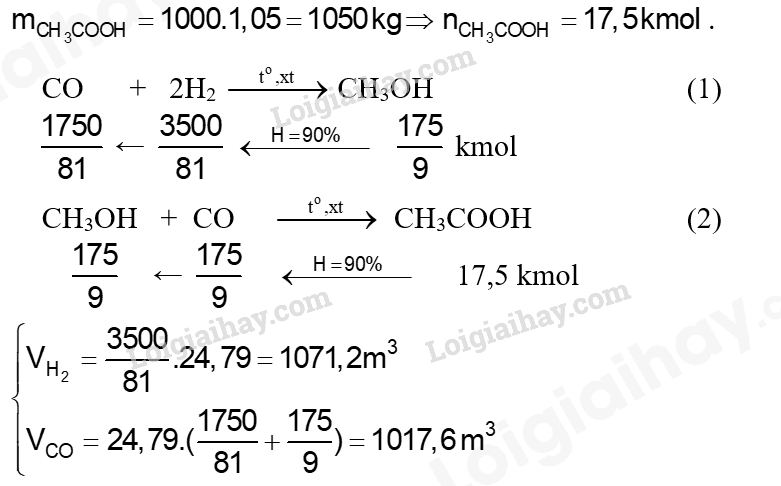
Giả sử hiệu suất của các phản ứng (1) và (2) đều đạt 90%. Để sản xuất 1000 lít acetic acid (D = 1,05 g mL-1), cần thể tích khí CO và H2 (ở điểu kiện chuẩn) lần lượt là bao nhiêu?
Câu 9: Cho các liên kết và giá trị năng lượng liên kết (Eb) của một số liên kết cộng hoá trị như sau:
|
Liên kết |
H-C |
H-O |
C-C |
C-O |
O=O |
C=O |
|
Eb (kJ/mol) |
413 |
467 |
347 |
358 |
498 |
745 |
(a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hơi ethanol.
(b) Khi đốt cháy cùng số mol ethanol và methanol, nhiệt năng của phản ứng nào tạo ra nhiều hơn?
Câu 10: Picric acid có nhiều ứng dụng trong y học (định lượng creatinine để chấn đoản và theo dõi tình trạng suy thận, khử trùng và làm khô da khi điều trị bỏng,…), trong quân sự (sản xuất đạn, thuốc nổ,…), trong phòng thí nghiệm (nhuộm mẫu, làm thuốc thử,…).
(a) Viết phương trình hóa học của phản ứng điều chế picric acid từ phenol.
(b) Giải thích vì sao trong phòng thí nghiệm thường bảo quản picric acid trong lọ dưới một lớp nước và trong quá trình làm việc với picric acid, tránh để acid tiếp xúc với kim loại?
Lời giải chi tiết
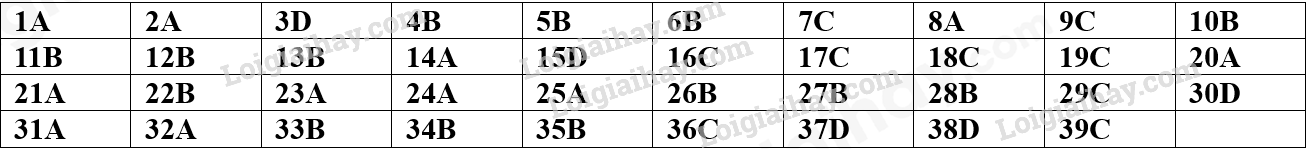
Phần trắc nghiệm
Phần tự luận
Câu 1: Dữ liệu thực nghiệm của hợp chất hữu cơ X như sau:
- Kết quả phân tích nguyên tố của (X) có 40% C; 6,67% H; còn lại là O về khối lượng
- Kết quả đo phổ khối lượng (MS) và phổ hồng ngoại (IR) của hợp chất (E) được cho như hìnhbên dưới:
 |
|
a. Công thức phân tử của X là C2H4O
b. X có nhóm chức – CHO
c. X có khả năng phản ứng với NaOH
d. Trong phân tử X có 2 liên kết pi.
Phương pháp giải
Dựa vào phổ IR của X từ đó tìm công thức của X
Lời giải chi tiết
%O = 100% - %C - %H = 100% - 40% - 6,67% = 53,33%
C : H : O = \(\frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% O}}{{16}} = \frac{{40\% }}{{12}}:\frac{{6,67\% }}{1}:\frac{{53,33\% }}{{16}} = 3,33:6,67:3,33 = 1:2:1\)
Công thức đơn giản nhất là (CH2O)n
Theo phổ MS: MX = 60 => M(CH2O)n = 60 => n = 2 => X: C2H4O2
Theo phổ IR: X có vùng tín hiệu đặc trưng ở 3000 – 2500 cm-1 và 1750 – 1680 cm-1. Đây là 2 vùng tín hiệu đặc trưng của nhóm – COOH.
a. Sai vì công thức phân tử X là C2H4O2
b. Sai vì X có nhóm chức – COOH
c. Đúng vì X là CH3COOH: acetic acid phản ứng với dung dịch NaOH
d. Sai, trong phân tử X có 1 liên kết pi ( C=O)
Câu 2: Chỉ số octane (octane number) là đại lượng đặc trưng cho yếu tố đo lường khả năng chống kích nổ của một nhiên liệu khi nhiên liệu này bốc cháy với không khí bên trong xi lanh của động cơ đốt trong. Nếu chỉ số octane của một mẫu xăng thấp, xăng sẽ tự cháy mà không do bu-gi bật tia lửa điện đốt. Điều này làm cho hiệu suất động cơ giảm và sẽ hư hao các chi tiết máy. Người ta quy ước rằng chỉ số octane của 2,2,4 – trimethylpentane là 100 và của heptane là 0. Các hydrocarbon mạch vòng và mạch phân nhánh có chỉ số octane cao hơn hydrocarbon mạch không nhánh.
a. Chỉ số octane càng cao thì khả năng chịu nén của nhiên liệu trước khi phát nổ (đốt cháy) càng nhỏ, đồng thời giảm thiểu được ô nhiễm môi trường.
b. Ethanol có thể làm tăng chỉ số octane của xăng
c. Phản ứng reforming alkane được ứng dụng làm tăng chỉ số octane của xăng, dầu
d. Một mẫu xăng chỉ gồm 8 phần thể tích 2,2,4 – trimethylpentane và 2 phần thể tích heptane thì chỉ số octane của mẫu xăng này là 60.
Phương pháp giải
Dựa vào kiến thức về alkane
Lời giải chi tiết
a. Sai vì chỉ số octane càng cao thì khả năng chịu nén của nhiên liệu trước khi phát nổ càng nhỏ
b. Đúng vì ethanol có chỉ số octane lớn hơn nhiều so với xăng
c. Đúng vì phản ứng reforming tạo ra các hydrocarbon mạch phân nhánh làm tăng chỉ số octane của xăng, dầu
d. Sai vì chỉ số octan của mẫu xăng này là 80.
Câu 3: Cho biết nhận định đúng, sai.
Cho các phát biểu:
a. Do phân tử phân cực nên dẫn xuất halogen không tan trong dung môi hữu cơ như hydrocarbon, ether,..
b. Nhiều dẫn xuất halogen có hoạt tính sinh học.
c. Trong điều kiện thường, dẫn xuất halogen có thể ở dạng rắn, lỏng hay khí tùy thuộc vào khối lượng phân tử, bản chất và số lượng nguyên tử halogen.
d. Nhiều dẫn xuất halogen được sử dụng trong tổng hợp các hợp chất hữu cơ.
Phương pháp giải
Dựa vào kiến thức về dẫn xuất halogen
Lời giải chi tiết
a. Sai, dẫn xuất halogen tan được trong dung môi hữu cơ
b. Đúng
c. Đúng
d. Đúng
Câu 4: Thí nghiệm được tiến hình như hình vẽ bên.

a. Hiện tượng trong bình đựng dung dịch AgNO3/NH3 có xuất hiện kết tủa trắng bạc
b. Thí nghiệm trên điều chế khí ethylene
c. Sản phẩm có phản ứng làm mất màu dung dịch nước bromine
d. CaC2 có tên gọi khác là đất đèn.
Phương pháp giải
CaC2 dùng để điều chế khí acetylene
Lời giải chi tiết
a. Sai, hiện tượng trong bình đựng dung dịch AgNO3/NH3 có xuất hiện kết tủa vàng nhạt.
b. Thí nghiệm trên điều chế khí acetylene
c. Đúng, acetylene có tham gia phản ứng cộng làm mất màu dung dịch nước bromine
d. Đúng
Câu 5: Một alcohol X có công thức phân tử là C2H6O2. Ở điều kiện thường, X là chất lỏng không màu, không mùi, tan tốt trong nước, có độ nhớt khá cao, có vị ngọt. Chất X được sử dụng rộng rãi làm chất chống đông và làm nguyên liệu trong sản xuất poly(ethylene terephtalate). Chất X có thể điều chế bằng cách oxi hóa trực tiếp ethylene bằng dung dịch potassium permangannate. Xác định công thức cấu tạo của X gọi tên X theo tên thay thế và tên thông thường.
Phương pháp giải
Dựa vào phản ứng của ethylene tác dụng với dung dịch potassium permangannate.
Lời giải chi tiết
Khi sục khí ethylene vào dung dịch KMnO4 tạo ethylene glicol.
X có công thức cấu tạo: C2H4(OH)2: ethane – 1,2 – diol.
Câu 6: Một mẫu khí gas X chứa hỗn hợp propane và butane. Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 594 kJ. Biết rằng, khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Tỉ lệ số mol của propane và butane trong X?
Phương pháp giải
Dựa vào lượng nhiệt tỏa ra của propane và butane
Lời giải chi tiết
Gọi số mol của propane và butane lần lượt là a và b
Khối lượng mẫu khí gas = m C3H8 + m C4H10 = a.44 + b.59 = 12 (1)
Lượng nhiệt tỏa ra khi đốt cháy mẫu khí gas là: a.2220 + b.2850 = 594 (2)
Từ (1) và (2): a = 0,075 mol và b = 0,15 mol
Vậy tỉ lệ giữa propane và butane = 0,075 : 0,15 = 1:2
Câu 7: Acetone được điều chế bằng cách oxi hóa cumene nhờ oxygen, sau đó thủy phân trong dung dịch H2SO4 loãng. Để thu được 174 gam acetone thì lượng cumene cần dùng (giả sử hiệu suất quá trình điều chế đạt 70%) là bao nhiêu?
Phương pháp giải
Dựa vào phản ứng oxi hóa cumene
Lời giải chi tiết
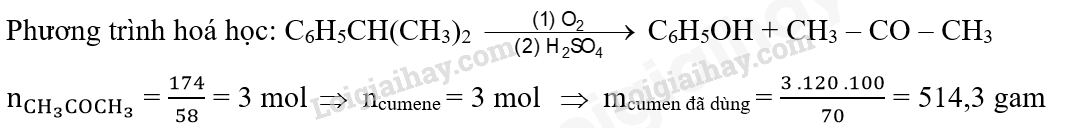
Câu 8: Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,… Acetic acid được tổng hợp từ nguồn khí than đá (giá thành rẻ) theo các phản ứng sau:
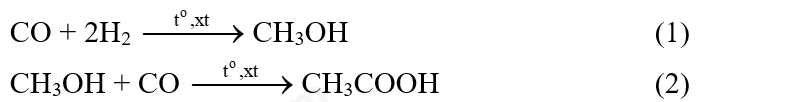
Giả sử hiệu suất của các phản ứng (1) và (2) đều đạt 90%. Để sản xuất 1000 lít acetic acid (D = 1,05 g mL-1), cần thể tích khí CO và H2 (ở điểu kiện chuẩn) lần lượt là bao nhiêu?
Lời giải chi tiết
Câu 9: Cho các liên kết và giá trị năng lượng liên kết (Eb) của một số liên kết cộng hoá trị như sau:
|
Liên kết |
H-C |
H-O |
C-C |
C-O |
O=O |
C=O |
|
Eb (kJ/mol) |
413 |
467 |
347 |
358 |
498 |
745 |
(a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hơi ethanol.
(b) Khi đốt cháy cùng số mol ethanol và methanol, nhiệt năng của phản ứng nào tạo ra nhiều hơn?
Lời giải chi tiết
(a) Phương trình hoá học của phản ứng đốt cháy hơi ethanol:
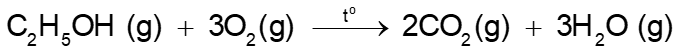
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết như sau
\({\Delta _r}H_{298}^o = \sum {{E_b}(cd) - } \sum {{E_b}(sp)} \)
\({\Delta _r}H_{298}^o = 5{E_b}{\rm{(}}C - H){\rm{ }} + {\rm{ }}{E_b}{\rm{(}}C - C){\rm{ }} + {\rm{ }}{E_b}{\rm{(}}C - O){\rm{ }} + {\rm{ }}{E_b}{\rm{(}}O - H) + 3{E_b}{\rm{(}}O = O) - 2.2{E_b}{\rm{(}}C = O) - 3.2{E_b}(O - H)\)
\({\Delta _r}H_{298}^o = 5.413 + 347 + 358 + 467 + 3.498 - 4.745 - 6.467 = - 1051{\rm{ }}(kJ)\)
b) Phương trình hoá học của phản ứng đốt cháy hơi methanol:
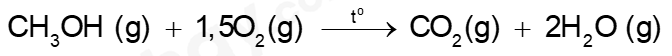
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết như sau:
\({\Delta _r}H_{298}^o = 3{E_b}{\rm{(}}C - H) + {E_b}{\rm{(}}C - O) + {E_b}{\rm{(}}O - H) + 1,5{E_b}{\rm{(}}O = O) - 2{E_b}{\rm{(}}C = O) - 4{E_b}(O - H)\)
\({\Delta _r}H_{298}^o = 3.413 + 358 + 467 + 1,5.498 - 2.745 - 4.467 = - 547{\rm{ }}(kJ)\)
Vậy khi đốt cháy cùng số mol methanol và ethanol thì ethanol giải phóng nhiệt năng lớn hơn.
Câu 10: Picric acid có nhiều ứng dụng trong y học (định lượng creatinine để chấn đoản và theo dõi tình trạng suy thận, khử trùng và làm khô da khi điều trị bỏng,…), trong quân sự (sản xuất đạn, thuốc nổ,…), trong phòng thí nghiệm (nhuộm mẫu, làm thuốc thử,…).
(a) Viết phương trình hóa học của phản ứng điều chế picric acid từ phenol.
(b) Giải thích vì sao trong phòng thí nghiệm thường bảo quản picric acid trong lọ dưới một lớp nước và trong quá trình làm việc với picric acid, tránh để acid tiếp xúc với kim loại?
Lời giải chi tiết
(a) 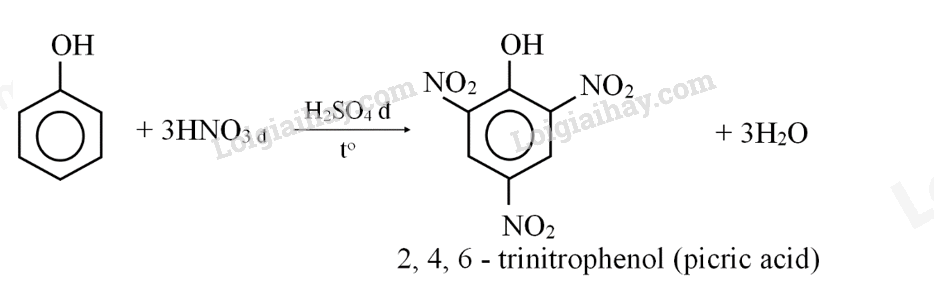
(b) Phân tử picric acid dễ cháy, nổ mạnh nên để an toàn, thường bảo quản picric acid trong lọ dưới một lớp nước. Mặt khác, picric acid có tính acid mạnh, phản ứng với kim loại tỏa nhiệt, tạo muối picrate cũng dễ gây cháy nổ.
- Đề thi học kì 2 Hóa 11 Kết nối tri thức - Đề số 1
- Đề thi học kì 2 Hóa 11 Kết nối tri thức - Đề số 2
- Đề thi học kì 2 Hóa 11 Kết nối tri thức - Đề số 3
- Đề thi học kì 2 Hóa 11 Kết nối tri thức - Đề số 4
- Đề thi học kì 2 Hóa 11 Kết nối tri thức - Đề số 5
>> Xem thêm
Luyện Bài Tập Trắc nghiệm Hóa lớp 11 - Kết nối tri thức - Xem ngay












Danh sách bình luận