 Đề thi hóa 11, đề kiểm tra hóa 11 kết nối tri thức có đáp án và lời giải chi tiết
Đề thi hóa 11, đề kiểm tra hóa 11 kết nối tri thức có đáp án và lời giải chi tiết
 Đề thi giữa kì 1 Hóa 11 - Kết nối tri thức
Đề thi giữa kì 1 Hóa 11 - Kết nối tri thức Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 6
Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là A. N2O. B. NO2. C. N2O5 D. NO.
Tổng hợp đề thi giữa kì 2 lớp 11 tất cả các môn - Kết nối tri thức
Toán - Văn - Anh - Lí - Hóa - Sinh
Đề thi
Câu 1: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
A. N2O. B. NO2. C. N2O5 D. NO.
Câu 2: X là chất khí không màu, mùi khai và gây xốc nếu hít phái, là nguyên liệu để sản xuất một loại phân bón. Khí X là
A. N2. B. NO2. C. NO. D. NH3.
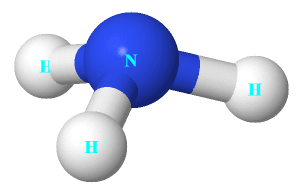
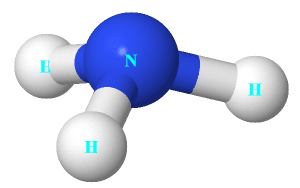
Câu 3: Cho cấu trúc của NH3 như hình bên.
Nhận định nào dưới đây đúng về NH3.
A. Nguyên tử nitrogen còn 1 electron chưa tham gia liên kết.
B. Liên kết giữa nguyên tử nitrogen và nguyên tử hydrogen là liên kết cho nhận.
C. Hình học phân tử của NH3 là hình chóp tam giác, với nguyên tử nitrogen nằm ở tâm hình chóp.
D. Nguyên tử nitrogen có khả năng tạo thêm liên kết với 1 nguyên tử hydrogen để tạo anion.
Câu 4: Tính base của NH3 do
A. trên nguyên tử nitrogen còn cặp electron chưa tham gia liên kết.
B. trong phân tử có 3 liên kết cộng hóa trị phân cực.
C. phân tử ammonia tan nhiều trong nước.
D. ammonia là chất khí ở điều kiện thường.
Câu 5: Cho 3,7185 lít N2 tác dụng với 6,1975 lít H2 thu được 7,437 lít hỗn hợp khí. Biết thể tích các khí đo ở điều kiện chuẩn. Hiệu suất của phản ứng là
A. 30%. B. 40%. C. 50%. D. 60%.
Câu 6: Số oxi hóa cao nhất của sulfur trong hợp chất là
A. +2. B. +3. C. +4. D. +6.
Câu 7: Phát biểu nào sau đây sai?
A. SO2 dùng làm chất tẩy trắng giấy và bột giấy.
B. SO2 dùng làm chất chống mốc lương thực , thực phẩm.
C. Trong phòng thí nghiệm, SO2 được điều chế bằng cách đốt quặng pyrite.
D. SO2 là chất trung gian để sản xuất sulfuric acid.
Câu 8: Nung nóng hỗn hợp gồm 3,6 gam Mg và 3,83 gam S trong điều kiện không có không khí, thu được chất rắn X. Cho chất rắn X tác dụng với dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Tỉ khối của Y so với khí hydrogen là
A. 16,2. B. 15,8. C. 11,2. D. 13,8.
Câu 9: Để giảm mưa acid cũng như các tác hại do mưa acid gây ra, các biên pháp có thể thực hiện là
(a) Tăng cường sử dụng các nhiên liệu hóa thạch.
(b) Xử lí nước thải trước khi đưa vào môi trường.
(c) Khử sulfur có trong nhiên liệu hóa thạch.
(d) Phát triển các nguồn năng lượng xanh.
(đ) Bón vôi vào đất bị acid hóa.
Số biện pháp đúng là
A. 4. B. 2. C. 3. D. 5.
Câu 10: Dung dịch H2SO4 (đặc) gây bỏng da khi tiếp xúc do
A. tính hóa nước của H2SO4 (đặc), quá trình này tỏa nhiệt và sự oxi hóa tế bào.
B. dung dịch H2SO4 (đặc) phản ứng với các hợp chất hữu cơ.
C. do tính acid của H2SO4.
D. do tính oxi hóa mạnh của H2SO4 đặc.
Câu 11: Điều nào sau đây đúng với phản ứng hóa học ở trạng thái cân bằng?
A. Chỉ có phản ứng thuận dừng lại. B. Chỉ có phản ứng nghịch dừng lại.
C. Cả phản ứng thuận và nghịch dừng lại. D. Tốc độ của phản ứng thuận và nghịch bằng nhau.
Câu 12: Xét cân bằng sau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào lượng SO2 thêm vào.
D. Không thay đổi.
Câu 13: Xét cân bằng hóa học: CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l) + H2O(l)
Trong bình có thể tích 500 mL hỗn hợp phản ứng ở trạng thái cân bằng chứa 0,235 mol CH3COOH, 0,0350 mol C2H5OH; 0,182 mol CH3COOC2H5 và 0,182 mol nước. Giá trị hằng số cân bằng KC của cân bằng trên là
A. 0,248. B. 4,027. C. 0,496. D. 2,105.
Câu 14: Xét hai cân bằng liên quan đến SO2(g) và các hằng số cân bằng tương ứng:
SO2(g) + 1/2O2(g) ⇌ SO3(g) Kc1 (1)
2SO3(g) ⇌ 2SO2(g) + O2(g) Kc2 (2)
Mối quan hệ giữa \({K_{{c_1}}}\)và \({K_{{c_2}}}\)là
A. \({K_{{c_2}}} = K_{{c_1}}^2\) . B. \(K_{{c_2}}^2 = {K_{{c_1}}}\). C. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^2}}\). D. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^{}}}\).
Câu 15: Cho các cân bằng sau trong bình kín (giữ nguyên nhiệt độ):
(I) 2HI(g) ⇌ H2 (g)+ I2(g)
(II) N2(g)+ 3H2 (g) ⇌ 2NH3(g)
(III) PCl5 (g) ⇌ PCl3(g)+ Cl2(g)
(IV) CaCO3(s) ⇌ CaO(s)+ CO2(g)
(V) SO2Cl2(g) ⇌ SO2(g)+ Cl2(g)
(VI) N2O4 (g) ⇌ 2NO2(g)
Khi tăng áp suất của hệ thì số cân bằng bị chuyển dịch theo chiều nghịch là
A. 2. B. 3. C. 4. D. 5.
Câu 16: Phosphorus(V) chloride bị phân hủy ở nhiệt độ cao thành phosphorus (III) chloride và chlorine theo phương trình: PCl5(g) ⇌ PCl3(g) + Cl2(g)
A. Đồ thị A. B. Đồ thị B. C. Đồ thị C. D. Đồ thị D.
Câu 17: Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu. B. anion (ion âm). C. cation (ion dương). D. chất.
Câu 18: Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm khử duy nhất). Kim loại M là
A. Cu. B. Zn. C. Mg. D. Fe.
Câu 19: Phương trình điện li viết đúng là
A. NaCl ⟶ Na2+ + Cl2-. B. Ca(OH)2 ⟶ Ca2+ + 2OH-.
C. C2H5OH ⟶ C2H5+ + OH-. D. CH3COOH ⟶ CH3COO- + H+.
Câu 20: Hỗn hợp X gồm N2 và H2 có tỉ khối so với He bằng 1,75. Cho 19,3362 lít hỗn hợp X qua xúc tác thích hợp, nung nóng, sau một thời gian thu được 17,47695 lít hỗn hợp khí Y. Biết thể tích khí đo ở đkc. Hiệu suất phản ứng tổng hợp ammonia là
A. 22%. B. 25%. C. 30%. D. 32%.
----- HẾT -----
Đáp án
|
1.D |
2.D |
3.C |
4.A |
5.D |
6.D |
7.C |
8.D |
9.A |
10.A |
|
11.D |
12.B |
13.B |
14.C |
15.C |
16.C |
17.A |
18.A |
19.B |
20.B |
Câu 1: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
A. N2O. B. NO2. C. N2O5 D. NO.
Phương pháp giải
Kiến thức về tính chất hóa học của đơn chất nitrogen.
Lời giải chi tiết
N2 + O2 2NO
Chọn D.
Câu 2: X là chất khí không màu, mùi khai và gây xốc nếu hít phải, là nguyên liệu để sản xuất một loại phân bón. Khí X là
A. N2. B. NO2. C. NO. D. NH3.
Phương pháp giải
Kiến thức về tính chất vật lí của ammonia.
Lời giải chi tiết
Chất khí không màu, mùi khai và gây xốc nếu hít phái, là nguyên liệu để sản xuất một loại phân bón là NH3.
Chọn D.
Câu 3: Cho cấu trúc của NH3 như hình bên.
Nhận định nào dưới đây đúng về NH3.
A. Nguyên tử nitrogen còn 1 electron chưa tham gia liên kết.
B. Liên kết giữa nguyên tử nitrogen và nguyên tử hydrogen là liên kết cho nhận.
C. Hình học phân tử của NH3 là hình chóp tam giác, với nguyên tử nitrogen nằm ở tâm hình chóp.
D. Nguyên tử nitrogen có khả năng tạo thêm liên kết với 1 nguyên tử hydrogen để tạo anion.
Phương pháp giải
Kiến thưc về cấu trúc của ammonia.
Lời giải chi tiết
A sai, vì guyên tử nitrogen còn 1 cặp electron chưa tham gia liên kết.
B sai, vì liên kết giữa nguyên tử nitrogen và nguyên tử hydrogen là liên kết công hóa trị.
C đúng.
D sai, vì nguyên tử nitrogen có khả năng tạo thêm liên kết với 1 nguyên tử hydrogen để tạo cation.
Chọn C.
Câu 4: Tính base của NH3 do
A. trên nguyên tử nitrogen còn cặp electron chưa tham gia liên kết.
B. trong phân tử có 3 liên kết cộng hóa trị phân cực.
C. phân tử ammonia tan nhiều trong nước.
D. ammonia là chất khí ở điều kiện thường.
Phương pháp giải
Kiến thức về ammonia.
Lời giải chi tiết
Tính base của NH3 do trên nguyên tử nitrogen còn cặp electron chưa tham gia liên kết.
Chọn A.
Câu 5: Cho 3,7185 lít N2 tác dụng với 6,1975 lít H2 thu được 7,437 lít hỗn hợp khí. Biết thể tích các khí đo ở điều kiện chuẩn. Hiệu suất của phản ứng là
A. 30%. B. 40%. C. 50%. D. 60%.
Phương pháp giải
Tính toán dựa vào phương trình phản ứng.
Lời giải chi tiết
N2 + 3H2 ⟶ 2NH3
Ban đầu: 0,15 0,25
Phản ứng: x ⟶ 3x ⟶ 2x
Sau: (0,15 – x) (0,25 – 3x) 2x
⟹ nsau = (0,15 – x) + (0,25 – 3x) + 2x = 0,3 ⟹ x = 0,05.
Do 0,15/1 > 0,25/3 nên hiệu suất tính theo H2.
⟹ H% = 0,15/0,25.100% = 60%.
Chọn D.
Câu 6: Số oxi hóa cao nhất của sulfur trong hợp chất là
A. +2. B. +3. C. +4. D. +6.
Phương pháp giải
Kiến thức về sulfur.
Lời giải chi tiết
Số oxi hóa cao nhất của sulfur trong hợp chất là +6.
Chọn D.
Câu 7: Phát biểu nào sau đây sai?
A. SO2 dùng làm chất tẩy trắng giấy và bột giấy.
B. SO2 dùng làm chất chống mốc lương thực , thực phẩm.
C. Trong phòng thí nghiệm, SO2 được điều chế bằng cách đốt quặng pyrite.
D. SO2 là chất trung gian để sản xuất sulfuric acid.
Phương pháp giải
Kiến thức về sulfur dioxide.
Lời giải chi tiết
C sai, vì trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối SO32- phản ứng với HCl hoặc H2SO4.
Chọn C.
Câu 8: Nung nóng hỗn hợp gồm 3,6 gam Mg và 3,83 gam S trong điều kiện không có không khí, thu được chất rắn X. Cho chất rắn X tác dụng với dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Tỉ khối của Y so với khí hydrogen là
A. 16,2. B. 15,8. C. 11,2. D. 13,8.
Phương pháp giải
Định luật bảo toàn electron, công thức tính tỉ khối hỗn hợp chất khí.
Lời giải chi tiết
Sơ đồ:
\(\left. {\begin{array}{*{20}{l}}{Mg:0,15mol}\\{S:0,12mol}\end{array}} \right\} + HCl \to \left\{ {\begin{array}{*{20}{l}}{M{g^{2 + }}:0,15mol}\\{{S^{2 - }}:0,12mol}\\{{H_2}}\end{array}} \right.\)
BTe: 2.nMg = 2.nS + 2.nH2 ⟹ nH2 = 0,03 (mol)
Trong hỗn hợp Y gồm: 0,12 (mol) H2S; 0,03 (mol) H2
⟹ \(\bar M = \frac{{0,12.34 + 0,03.2}}{{0,12 + 0,03}} = 27,6\)
dY/H2 = 27,6/2 = 13,8
Chọn D.
Câu 9: Để giảm mưa acid cũng như các tác hại do mưa acid gây ra, các biên pháp có thể thực hiện là
(a) Tăng cường sử dụng các nhiên liệu hóa thạch.
(b) Xử lí nước thải trước khi đưa vào môi trường.
(c) Khử sulfur có trong nhiên liệu hóa thạch.
(d) Phát triển các nguồn năng lượng xanh.
(đ) Bón vôi vào đất bị acid hóa.
Số biện pháp đúng là
A. 4. B. 2. C. 3. D. 5.
Phương pháp giải
Lý thuyết về SO2 và các vấn đề về kinh tế, môi trường, xã hội.
Lời giải chi tiế
(a) sai, vì trong nhiên liệu hóa thạch có lẫn tạp chất là sulfur, khi tăng cường sử dụng sẽ tăng phát thải khí SO2 ra môi trường.
(b) đúng.
(c) đúng.
(d) đúng.
(đ) đúng.
⟹ Có 4 biện pháp đúng.
Chọn A.
Câu 10: Dung dịch H2SO4 (đặc) gây bỏng da khi tiếp xúc do
A. tính hóa nước của H2SO4 (đặc), quá trình này tỏa nhiệt và sự oxi hóa tế bào.
B. dung dịch H2SO4 (đặc) phản ứng với các hợp chất hữu cơ.
C. do tính acid của H2SO4.
D. do tính oxi hóa mạnh của H2SO4 đặc.
Phương pháp giải
Lý thuyết về tính chất hóa học của H2SO4 đặc.
Lời giải chi tiết
Dung dịch H2SO4 (đặc) gây bỏng da khi tiếp xúc do tính hóa nước của H2SO4 (đặc), quá trình này tỏa nhiệt và sự oxi hóa tế bào.
Chọn A.
Câu 11: Điều nào sau đây đúng với phản ứng hóa học ở trạng thái cân bằng?
A. Chỉ có phản ứng thuận dừng lại. B. Chỉ có phản ứng nghịch dừng lại.
C. Cả phản ứng thuận và nghịch dừng lại. D. Tốc độ của phản ứng thuận và nghịch bằng nhau.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Phát biểu đúng là tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch ở trạng thái cân bằng.
Chọn D.
Câu 12: Xét cân bằng sau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào lượng SO2 thêm vào.
D. Không thay đổi.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Tăng nồng độ SO2(g), cân bằng chuyển dịch theo chiều giảm nồng độ SO2 ⟶ chiều thuận.
Chọn B.
Câu 13: Xét cân bằng hóa học: CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l) + H2O(l)
Trong bình có thể tích 500 mL hỗn hợp phản ứng ở trạng thái cân bằng chứa 0,235 mol CH3COOH, 0,0350 mol C2H5OH; 0,182 mol CH3COOC2H5 và 0,182 mol nước. Giá trị hằng số cân bằng KC của cân bằng trên là
A. 0,248. B. 4,027. C. 0,496. D. 2,105.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
\({K_C} = \frac{{[C{H_3}COO{C_2}{H_5}].[{H_2}O]}}{{[C{H_3}COOH].[{C_2}{H_5}OH]}} = \frac{{\left( {\frac{{0,182}}{{0,5}}} \right).\left( {\frac{{0,182}}{{0,5}}} \right)}}{{\left( {\frac{{0,235}}{{0,5}}} \right).\left( {\frac{{0,035}}{{0,5}}} \right)}} = 4,027\)
Chọn B.
Câu 14: Xét hai cân bằng liên quan đến SO2(g) và các hằng số cân bằng tương ứng:
SO2(g) + 1/2O2(g) ⇌ SO3(g) Kc1 (1)
2SO3(g) ⇌ 2SO2(g) + O2(g) Kc2 (2)
Mối quan hệ giữa \({K_{{c_1}}}\)và \({K_{{c_2}}}\)là
A. \({K_{{c_2}}} = K_{{c_1}}^2\) . B. \(K_{{c_2}}^2 = {K_{{c_1}}}\). C. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^2}}\). D. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^{}}}\).
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Phản ứng (1) ngược chiều và có hệ số bằng ½ so với phản ứng (2).
\({K_{{C_1}}} = \frac{{[S{O_3}]}}{{[S{O_2}].[{O_2}]}} \Rightarrow \frac{1}{{{K_{{C_1}}}}} = \frac{{[S{O_2}].[{O_2}]}}{{[S{O_3}]}} \Rightarrow \frac{1}{{K_{{C_1}}^2}} = \frac{{{{[S{O_2}]}^2}.[{O_2}]}}{{{{[S{O_3}]}^2}}} = {K_{{C_2}}}\)
Chọn C.
Câu 15: Cho các cân bằng sau trong bình kín (giữ nguyên nhiệt độ):
(I) 2HI(g) ⇌ H2 (g)+ I2(g)
(II) N2(g)+ 3H2 (g) ⇌ 2NH3(g)
(III) PCl5 (g) ⇌ PCl3(g)+ Cl2(g)
(IV) CaCO3(s) ⇌ CaO(s)+ CO2(g)
(V) SO2Cl2(g) ⇌ SO2(g)+ Cl2(g)
(VI) N2O4 (g) ⇌ 2NO2(g)
Khi tăng áp suất của hệ thì số cân bằng bị chuyển dịch theo chiều nghịch là
A. 2. B. 3. C. 4. D. 5.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Khi tăng áp suất thì (I) không chuyển dịch; (II) bị chuyển dịch theo chiều thuận; (III), (IV), (V), (VI) bị chuyển dịch theo chiều nghịch.
Chọn C.
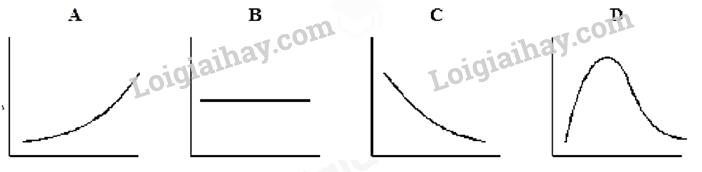
Câu 16: Phosphorus(V) chloride bị phân hủy ở nhiệt độ cao thành phosphorus (III) chloride và chlorine theo phương trình: PCl5(g) ⇌ PCl3(g) + Cl2(g)
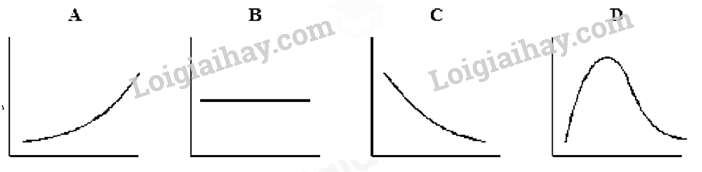
A. Đồ thị A. B. Đồ thị B. C. Đồ thị C. D. Đồ thị D.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Cách giải:
Đồ thị C
Khi tăng áp suất cân bằng chuyển dịch theo chiều nghịch nên lượng chlorine thu được sẽ giảm.
Chọn C.
Câu 17: Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu. B. anion (ion âm). C. cation (ion dương). D. chất.
Phương pháp giải
Dựa vào lý thuyết về acid, base, muối.
Lời giải chi tiết
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các ion trái dấu.
Chọn A.
Câu 18: Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm khử duy nhất). Kim loại M là
A. Cu. B. Zn. C. Mg. D. Fe.
Phương pháp giải
Các quá trình nhường nhận e:
M → Mn+ + ne
N+5 + 3e → N+2
Áp dụng bảo toàn electron ⟹ Mối quan hệ giữa M và n.
Biện luận với n = 1; 2; 3 để chọn ra M thỏa mãn ⟹ Tên kim loại.
Lời giải chi tiết
nNO = 0,2 mol
Các quá trình nhường nhận e:
M - ne → Mn+ N+5 + 3e → N+2
Bảo toàn electron: n.nM = 3nNO ⟹ \(\frac{{19,2}}{M}.n = 3.0,2\) ⟹ M = 32n
Biện luận với n = 1; 2; 3 thấy với n = 2; M = 64 (Cu) thỏa mãn.
Chọn A.
Câu 19: Phương trình điện li viết đúng là
A. NaCl ⟶ Na2+ + Cl2-. B. Ca(OH)2 ⟶ Ca2+ + 2OH-.
C. C2H5OH ⟶ C2H5+ + OH-. D. CH3COOH ⟶ CH3COO- + H+.
Phương pháp giải
Dựa vào lý thuyết về sự điện li.
Lời giải chi tiết
A sai, sửa lại NaCl ⟶ Na+ + Cl-
B đúng.
C sai, vì C2H5OH không phải là chất điện li.
D sai, sửa lại CH3COOH ⇌ CH3COO- + H+
Chọn B.
Câu 20: Hỗn hợp X gồm N2 và H2 có tỉ khối so với He bằng 1,75. Cho 19,3362 lít hỗn hợp X qua xúc tác thích hợp, nung nóng, sau một thời gian thu được 17,47695 lít hỗn hợp khí Y. Biết thể tích khí đo ở đkc. Hiệu suất phản ứng tổng hợp ammonia là
A. 22%. B. 25%. C. 30%. D. 32%.
Phương pháp giải
- Dùng đường chéo hoặc đặt ẩn là số mol để tìm số mol N2 và H2 trong hỗn hợp X.
- Đặt nN2 pứ = a mol; nH2 pứ = 3a mol
Kết hợp với số mol hỗn hợp Y ⟹ a
- Ta thấy nN2/1 < nH2/3 ⟹ Tính hiệu suất theo N2.
Lời giải chi tiết
MX = 4.1,75 = 7 g/mol
nX = 19,3362:24,79 = 0,78 mol
nY = 17,47695:24,79 = 0,705 mol
Đặt nN2 = x mol; nH2 = y mol
nN2 + nH2 = nX ⟹ x + y = 0,78 (1)
mN2 + mH2 = mX ⟹ 28x + 2y = 7.0,78 = 5,46 (2)
Từ (1)(2) ⟹ x = 0,15; y = 0,63.
N2 + 3H2 ⇄ 2NH3
Ban đầu: 0,15 0,63 0 (mol)
Phản ứng: a 3a 2a (mol)
Còn lại: 0,15 – a 0,63 – 3a 2a (mol)
⟹ nY = 0,15 – a + 0,63 – 3a + 2a = 0,705
⟹ a = 0,0375 mol
Ta thấy nN2/1 < nH2/3 ⟹ Tính hiệu suất theo N2.
⟹ H% = (0,0375/0,15).100% = 25%.
Chọn B.
- Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 7
- Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 8
- Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 9
- Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 10
- Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 11
>> Xem thêm
Luyện Bài Tập Trắc nghiệm Hóa lớp 11 - Kết nối tri thức - Xem ngay












Danh sách bình luận