Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 5
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Đề bài
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
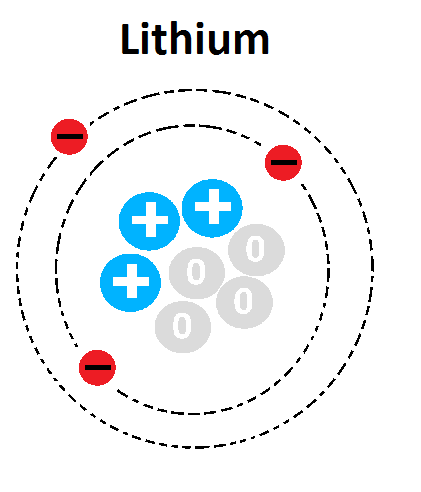
Mô hình cấu tạo nguyên tử X
-
A.
1.
-
B.
3.
-
C.
4.
-
D.
7.
Hình vẽ sau mô tả thí nghiệm tìm ra hạt A – là một trong những thành phần cấu tạo nên nguyên tử. Đó là
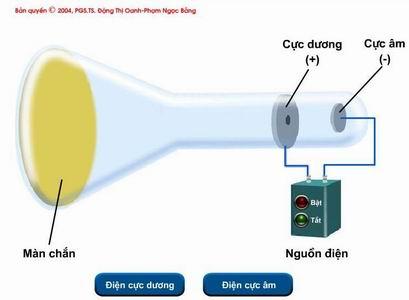
Thí nghiệm tìm ra hạt A
-
A.
Thí nghiệm tìm ra electron.
-
B.
Thí nghiệm tìm ra neutron.
-
C.
Thí nghiệm tìm ra proton.
-
D.
Thí nghiệm tìm ra hạt nhân.
Hạt nhân của nguyên tử nào có số hạt neutron là 28?
-
A.
\({}_{19}^{39}K\).
-
B.
\({}_{26}^{54}Fe\).
-
C.
\({}_{15}^{32}P\).
-
D.
\({}_{11}^{23}Na\).
Cho các phát biểu sau đây về các hạt cấu tạo nên nguyên tử
(i) Hạt nhân của tất cả các nguyên tử đều chứa neutron.
(ii) Có những nguyên tử chứa nhiều neutron hơn proton.
(iii) Các proton và neutron có cùng khối lượng.
(iv) Electron không có khối lượng.
Các phát biểu đúng là
-
A.
(ii).
-
B.
(i) và (ii).
-
C.
(ii) và (iii).
-
D.
(i) và (iv).
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
-
A.
2, 6, 8, 18
-
B.
2, 8, 18, 32
-
C.
2, 4, 6, 8
-
D.
2, 6, 10, 14
-
A.
Chỉ có 1
-
B.
Chỉ có 2
-
C.
Chỉ có 3
-
D.
Chỉ có 4
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?
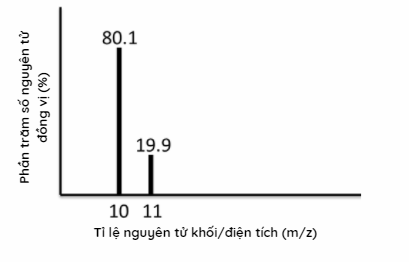
-
A.
10
-
B.
10,8
-
C.
10,2
-
D.
11
Nguyên tử M có cấu hình electron 1s2s22p4. Cấu hình electron theo ô orbital là
-
A.
-
B.
-
C.
-
D.
Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
-
A.
1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1.
-
B.
1s2 2s2 2p6 3s2 3p6 3d6 4s2.
-
C.
1s2 2s2 2p6 3s2 3p2 4s2 3d8.
-
D.
1s2 2s2 2p6 3s2 3p6 3d5 4s3
Trong cùng 1 nhóm A (trừ He), khi đi từ trên xuống dưới, nhìn chung:
-
A.
Bán kính nguyên tử tăng, năng lượng ion hóa giảm, độ âm điện tăng.
-
B.
Bán kính nguyên tử tăng, năng lượng ion hóa giảm, độ âm điện giảm
-
C.
Bán kính nguyên tử giảm, năng lượng ion hóa tăng, độ âm điện tăng
-
D.
Bán kính nguyên tử giảm, năng lượng ion hóa giảm, độ âm điện giảm
Nguyên tố M thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của M là:
-
A.
M2O.
-
B.
M2O3.
-
C.
M2O7.
-
D.
MO3.
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
-
A.
chu kì 4, nhóm IA.
-
B.
chu kì 3, nhóm VIIA.
-
C.
chu kì 3, nhóm VIIIA.
-
D.
chu kì 4, nhóm IIA.
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh quỳ tím. Oxide của Z phản ứng được với cả acid lẫn base. Cách phân loại X,Y,Z nào sau đây là đúng ?
-
A.
X là kim loại; Y vừa tác dụng acid vừa tác dụng base; Z là phi kim.
-
B.
X là phi kim; Y vừa tác dụng acid vừa tác dụng base; Z là kim loại.
-
C.
X là kim loại; Z vừa tác dụng acid vừa tác dụng base; Y là phi kim.
-
D.
X là phi kim; Z vừa tác dụng acid vừa tác dụng base; Y là kim loại.
Hợp chất khí với H của một nguyên tố ứng với công thức RH4. Oxide cao nhất của nó chứa 53,3% O. Nguyên tố R là:
-
A.
C
-
B.
N
-
C.
Si
-
D.
P
Cho các phát biểu sau:
(a) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số electron.
(b) Vỏ nguyên tử được chia thành 7 lớp, các electron trong cùng một lớp có năng lượng bằng nhau.
(c) Có 3 nguyên tố đều có cấu hình electron lớp ngoài cùng là 4s1.
(d) Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron.
(e) Trong bảng tuần hoàn, các nguyên tố s, p thuộc nhóm A, các nguyên tố d, f thuộc nhóm B.
Số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là:
-
A.
Liên kết ion.
-
B.
Liên kết cộng hóa trị.
-
C.
Liên kết cho - nhận.
-
D.
Không xác định được.
Cho các nguyên tố A (ns1), B (ns2), X (ns2np5) đều thuộc chu kì nhỏ, n ≠ 1. Chọn phát biểu không đúng trong các phát biểu dưới đây.
-
A.
Liên kết giữa A và X là liên kết ion.
-
B.
Liên kết giữa B và X là liên kết cộng hóa trị.
-
C.
A và B không liên kết với nhau.
-
D.
A và B là kim loại, X là phi kim.
Dãy các chất trong dãy nào sau đây chỉ có liên kết cộng hóa trị phân cực?
-
A.
HCl, KCl, HNO3, NO.
-
B.
NH3, KHSO4, SO2, SO3.
-
C.
N2, H2S, H2SO4, CO2.
-
D.
HCl, H2S, H3PO4, NO2.
Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion?
-
A.
H2S, NH3.
-
B.
BeCl2, BeS.
-
C.
MgO, Al2O3.
-
D.
MgCl2, AlCl3.
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxide cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
-
A.
Liên kết ion.
-
B.
Liên kết cộng hoá trị.
-
C.
Liên kết cho nhận
-
D.
Liên kết ion, liên kết cộng hoá trị.
Các chất trong phân tử chỉ có liên kết cộng hóa trị là:
-
A.
NaHS và K2S, Na2SO3, H2SO4, SO3
-
B.
Na2SO3, K2S, NaHS
-
C.
Na2SO3, K2S, H2S , NaHS
-
D.
H2S, H2SO3, H2SO4, SO3, SO2
Cho các phát biểu về các loại liên kết?
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết cộng hóa trị
Số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
-
A.
Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
-
B.
Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
-
C.
Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
-
D.
Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
-
A.
Chlorine.
-
B.
Sulfur.
-
C.
Oxygen.
-
D.
Hydrogen.
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
-
A.
Neon và argon.
-
B.
Helium và xenon.
-
C.
Helium và radon.
-
D.
Helium và krypton.
Lời giải và đáp án
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là

Mô hình cấu tạo nguyên tử X
-
A.
1.
-
B.
3.
-
C.
4.
-
D.
7.
Đáp án : B
Dựa vào mô hình cấu tạo nguyên tử X
Nguyên tử X có 3 electron => Z= E = P = 3
Đáp án B
Hình vẽ sau mô tả thí nghiệm tìm ra hạt A – là một trong những thành phần cấu tạo nên nguyên tử. Đó là

Thí nghiệm tìm ra hạt A
-
A.
Thí nghiệm tìm ra electron.
-
B.
Thí nghiệm tìm ra neutron.
-
C.
Thí nghiệm tìm ra proton.
-
D.
Thí nghiệm tìm ra hạt nhân.
Đáp án : A
Dựa vào hình ảnh thí nghiệm
Thí nghiệm tìm ra hạt electron
Đáp án A
Hạt nhân của nguyên tử nào có số hạt neutron là 28?
-
A.
\({}_{19}^{39}K\).
-
B.
\({}_{26}^{54}Fe\).
-
C.
\({}_{15}^{32}P\).
-
D.
\({}_{11}^{23}Na\).
Đáp án : B
Số N = A – P
Số N của Fe là 54 – 26 = 28
Đáp án B
Cho các phát biểu sau đây về các hạt cấu tạo nên nguyên tử
(i) Hạt nhân của tất cả các nguyên tử đều chứa neutron.
(ii) Có những nguyên tử chứa nhiều neutron hơn proton.
(iii) Các proton và neutron có cùng khối lượng.
(iv) Electron không có khối lượng.
Các phát biểu đúng là
-
A.
(ii).
-
B.
(i) và (ii).
-
C.
(ii) và (iii).
-
D.
(i) và (iv).
Đáp án : C
Dựa vào kiến thức về cấu tạo nguyên tử
(i) sai vì hạt nhân của hydrogen không chứa neutron
(ii) đúng
(iii) đúng
(iv) electron vẫn có khối lượng sấp sỉ bằng 0,00055amu
Đáp án C
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
-
A.
2, 6, 8, 18
-
B.
2, 8, 18, 32
-
C.
2, 4, 6, 8
-
D.
2, 6, 10, 14
Đáp án : D
Dựa vào số electron trong các phân lớp
Phân lớp s chứa tối đa 2 electron
Phân lớp p chứa tối đa 6 electron
Phân lớp d chứa tối đa 10 electron
Phân lớp f chứa tối đa 14 electron
Đáp án D
-
A.
Chỉ có 1
-
B.
Chỉ có 2
-
C.
Chỉ có 3
-
D.
Chỉ có 4
Đáp án : C
Dựa vào hình ảnh của các AO
Hình 3 chứa AOpx
Đáp án C
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?

-
A.
10
-
B.
10,8
-
C.
10,2
-
D.
11
Đáp án : C
Dựa vào phổ khối lượng của nguyên tố X
\({\bar M_X} = \frac{{80,1.10 + 11.19,9}}{{100}} = 10,2\)
Đáp án C
Nguyên tử M có cấu hình electron 1s2s22p4. Cấu hình electron theo ô orbital là
-
A.
-
B.
-
C.
-
D.
Đáp án : A
Dựa vào cấu hình electron theo ô orbital
Mỗi ô orbital chứa tối đa 2 electron, biểu diễn bằng 2 mũi tên ngược chiều nhau.
Các electron điền đủ vào các ô orbital
Đáp án A
Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
-
A.
1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1.
-
B.
1s2 2s2 2p6 3s2 3p6 3d6 4s2.
-
C.
1s2 2s2 2p6 3s2 3p2 4s2 3d8.
-
D.
1s2 2s2 2p6 3s2 3p6 3d5 4s3
Đáp án : B
Ion R3+ đã nhường 3 electron, có phân lớp cuối cùng là 3d5
Cấu hình của R là: 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Trong cùng 1 nhóm A (trừ He), khi đi từ trên xuống dưới, nhìn chung:
-
A.
Bán kính nguyên tử tăng, năng lượng ion hóa giảm, độ âm điện tăng.
-
B.
Bán kính nguyên tử tăng, năng lượng ion hóa giảm, độ âm điện giảm
-
C.
Bán kính nguyên tử giảm, năng lượng ion hóa tăng, độ âm điện tăng
-
D.
Bán kính nguyên tử giảm, năng lượng ion hóa giảm, độ âm điện giảm
Đáp án : B
Dựa vào xu hướng biến đổi trong bảng tuần hoàn trong cùng 1 nhóm A
Đáp án B
Nguyên tố M thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của M là:
-
A.
M2O.
-
B.
M2O3.
-
C.
M2O7.
-
D.
MO3.
Đáp án : C
Dựa vào vị trí của nguyên tố M
Nguyên tố M thuộc nhóm VIIA => có 7 electron lớp ngoài cùng
Công thức oxide cao nhất là M2O7
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
-
A.
chu kì 4, nhóm IA.
-
B.
chu kì 3, nhóm VIIA.
-
C.
chu kì 3, nhóm VIIIA.
-
D.
chu kì 4, nhóm IIA.
Đáp án : A
Cation R+ đã nhường đi 1 electron
Cấu hình của R là 1s22s22p63s23p64s1 => chu kì 4, nhóm IA
Đáp án A
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh quỳ tím. Oxide của Z phản ứng được với cả acid lẫn base. Cách phân loại X,Y,Z nào sau đây là đúng ?
-
A.
X là kim loại; Y vừa tác dụng acid vừa tác dụng base; Z là phi kim.
-
B.
X là phi kim; Y vừa tác dụng acid vừa tác dụng base; Z là kim loại.
-
C.
X là kim loại; Z vừa tác dụng acid vừa tác dụng base; Y là phi kim.
-
D.
X là phi kim; Z vừa tác dụng acid vừa tác dụng base; Y là kim loại.
Đáp án : D
Dựa vào dung dịch sau khi hòa tan các hợp chất của X, Y, Z vào nước
Oxide X hòa tan trong nước thu được dung dịch làm hồng quỳ tìm => Oxide X là oxide acid => X là phi kim
Oxide Y hòa tan trong nước thu được dung dịch làm xanh quỳ tím => oxide Y là oxide base tan => Y là kim loại
Oxide Z phản ứng được cả acid và base => Z phản ứng được với cả dung dịch acid và base
Đáp án D
Hợp chất khí với H của một nguyên tố ứng với công thức RH4. Oxide cao nhất của nó chứa 53,3% O. Nguyên tố R là:
-
A.
C
-
B.
N
-
C.
Si
-
D.
P
Đáp án : C
Vì công thức ứng với H của R là RH4 => Công thức oxide của R là RO2
\(\begin{array}{l}\% O = \frac{{16.2}}{{16.2 + R}}.100\% = 53,3\% \\ \to {M_R} = 28\end{array}\)
Đáp án C
Cho các phát biểu sau:
(a) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số electron.
(b) Vỏ nguyên tử được chia thành 7 lớp, các electron trong cùng một lớp có năng lượng bằng nhau.
(c) Có 3 nguyên tố đều có cấu hình electron lớp ngoài cùng là 4s1.
(d) Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron.
(e) Trong bảng tuần hoàn, các nguyên tố s, p thuộc nhóm A, các nguyên tố d, f thuộc nhóm B.
Số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : D
Dựa vào cấu tạo của nguyên tố hóa học
(a) đúng
(b) sai, vì vỏ nguyên tử của mỗi nguyên tố có số lớp khác nhau, nguyên tử có tối đa 7 lớp, các electron cùng lớp có năng lượng gần bằng nhau
(c) đúng vì có nguyên tố K, Cr, Cu
(d) đúng
(e) đúng
Đáp án D
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là:
-
A.
Liên kết ion.
-
B.
Liên kết cộng hóa trị.
-
C.
Liên kết cho - nhận.
-
D.
Không xác định được.
Đáp án : A
Xác định nguyên tử X và nguyên tử Y
Nguyên tử X có 11 electron p => cấu hình của X là: 1s22s22p63s23p5 => X có 17 electron (Cl)
Nguyên tử Y có 5 electron s => cấu hình của Y là: 1s22s22p63s1 => Y có 11 electron (Na)
Vậy liên kết giữa Na và Cl là liên kết ion
Đáp án A
Cho các nguyên tố A (ns1), B (ns2), X (ns2np5) đều thuộc chu kì nhỏ, n ≠ 1. Chọn phát biểu không đúng trong các phát biểu dưới đây.
-
A.
Liên kết giữa A và X là liên kết ion.
-
B.
Liên kết giữa B và X là liên kết cộng hóa trị.
-
C.
A và B không liên kết với nhau.
-
D.
A và B là kim loại, X là phi kim.
Đáp án : B
Dựa vào số electron lớp ngoài cùng của các nguyên tố
Nguyên tố A, B là kim loại, X là phi kim
Liên kết giữa A hoặc B và X là liên kết ion
A, B không liên kết với nhau
Đáp án B
Dãy các chất trong dãy nào sau đây chỉ có liên kết cộng hóa trị phân cực?
-
A.
HCl, KCl, HNO3, NO.
-
B.
NH3, KHSO4, SO2, SO3.
-
C.
N2, H2S, H2SO4, CO2.
-
D.
HCl, H2S, H3PO4, NO2.
Đáp án : D
Dựa vào hiệu độ âm điện của các hợp chất
Đáp án D
Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion?
-
A.
H2S, NH3.
-
B.
BeCl2, BeS.
-
C.
MgO, Al2O3.
-
D.
MgCl2, AlCl3.
Đáp án : C
Dựa vào hiệu độ âm điện của các hợp chất
Liên kết ion có hiệu độ âm điện >1,7
Đáp án C
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxide cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
-
A.
Liên kết ion.
-
B.
Liên kết cộng hoá trị.
-
C.
Liên kết cho nhận
-
D.
Liên kết ion, liên kết cộng hoá trị.
Đáp án : A
Dựa vào % khối lượng M, X trong hợp chất oxide
Công thức hợp chất oxide của M là: MO
\(\begin{array}{l}\% M = \frac{M}{{M + 16}}.100\% = 71,43\% \\ \to M = 40(Ca)\end{array}\)
Công thức hợp chất oxide của X là XO3
\(\begin{array}{l}\% X = \frac{X}{{X + 16.3}}.100\% = 40\% \\ \to X = 32(S)\end{array}\)
Liên kết giữa Ca và S là liên kết ion
Các chất trong phân tử chỉ có liên kết cộng hóa trị là:
-
A.
NaHS và K2S, Na2SO3, H2SO4, SO3
-
B.
Na2SO3, K2S, NaHS
-
C.
Na2SO3, K2S, H2S , NaHS
-
D.
H2S, H2SO3, H2SO4, SO3, SO2
Đáp án : D
Liên kết cộng hóa trị thường được hình thành giữa phi kim và phi kim
Đáp án D
Cho các phát biểu về các loại liên kết?
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết cộng hóa trị
Số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : B
Dựa vào kiến thức về liên kết hóa học
(a) đúng
(b) sai
(c) đúng
(d) sai
Đáp án B
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
-
A.
Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
-
B.
Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
-
C.
Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
-
D.
Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Đáp án : A
Đáp án A
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
-
A.
Chlorine.
-
B.
Sulfur.
-
C.
Oxygen.
-
D.
Hydrogen.
Đáp án : C
Dựa vào cấu hình electron của mỗi nguyên tử nguyên tố.
Cl: 1s2 2s2 2p6 3s2 3p5 ⟶ có xu hướng nhận 1e thành 1s2 2s2 2p6 3s2 3p6 (cấu hình electron Ar).
S: 1s2 2s2 2p6 3s2 3p4 ⟶ có xu hướng nhận 2e thành 1s2 2s2 2p6 3s2 3p6 (cấu hình electron Ar).
O: 1s2 2s2 2p4 ⟶ có xu hướng nhận 2e thành 1s2 2s2 2p6 (cấu hình electron Ne).
H: 1s1 ⟶ có xu hướng nhận 1e thành 1s2 (cấu hình electron He).
Chọn C.
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
-
A.
Neon và argon.
-
B.
Helium và xenon.
-
C.
Helium và radon.
-
D.
Helium và krypton.
Đáp án : D
Dựa vào cấu hình electron của mỗi nguyên tử nguyên tố.
H: 1s1 ⟶ có xu hướng nhận 1e thành 1s2 (cấu hình electron He).
Br: 1s2 2s2 2p6 3s2 3p6 3d104s2 4p5 ⟶ có xu hướng nhận 1e thành 1s2 2s2 2p6 3s2 3p6 3d104s2 4p6 (cấu hình electron Kr).
Chọn D.
Chu kì là
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Hạt mang điện trong hạt nhân nguyên tử là
Điện tích của hạt nhân do loại hạt nào quyết định?
Hạt mang điện trong nhân nguyên tử là:
Trình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận