Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề số 6
Cho phản ứng xảy ra trong pha khí sau
Đề bài
Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 \( \to \) 2HCl. Biểu thức tốc độ trung bình của phản ứng là:
-
A.
\(v = \frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{\Delta t}}\).
-
B.
\(v = \frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{HCl}}}}{{\Delta t}}\).
-
C.
\(v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{\Delta t}}\).
-
D.
\(v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{2\Delta t}}\).
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
-
A.
Nhiệt độ chất phản ứng.
-
B.
Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ....).
-
C.
Nồng độ chất phản ứng.
-
D.
Tỉ lệ mol của các chất trong phản ứng.
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
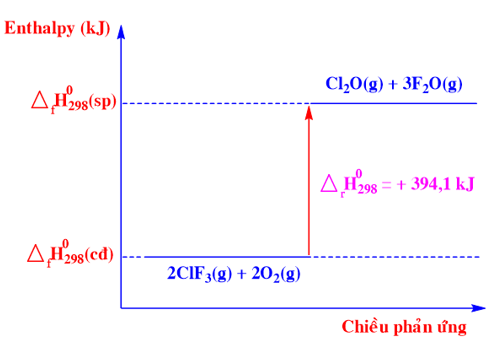
-
A.
Cl2O (g) + 3F2O (g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
-
B.
Cl2O (g) + 3F2O(g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
C.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
D.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Tốc độ phản ứng tăng lên khi
-
A.
giảm nhiệt độ
-
B.
tăng diện tích tiếp xúc giữa các chất phản ứng
-
C.
tăng lượng chất xúc tác
-
D.
giảm nồng độ các chất tham gia phản ứng
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
-
A.
Nhiệt độ.
-
B.
Nhiệt độ.
-
C.
Nồng độ.
-
D.
Áp suất.
-
A.
Kích thước các tinh thể KClO3.
-
B.
Áp suất.
-
C.
Chất xúc tác.
-
D.
Nhiệt độ.
Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau.
(1) Dùng nồi áp suất (3) Chặt nhỏ thịt cá.
(2) Cho thêm muối vào. (4) Nấu cùng nước lạnh.
Cách làm cho thịt cá nhanh chín hơn là
-
A.
1, 2, 3.
-
B.
1, 3, 4.
-
C.
2, 3, 4.
-
D.
1, 2, 4.
Không dùng chai, lọ thuỷ tinh mà thường dùng chai nhựa để chứa, đựng, bảo quản hydrohalic acid nào sau đây?
-
A.
HF.
-
B.
HCl.
-
C.
HBr.
-
D.
HI.
Hai chất nào sau đây được cho vào muối ăn để bổ sung iodine?
-
A.
I2, HI.
-
B.
HI, HIO3.
-
C.
KI, KIO3.
-
D.
I2, AlI3.
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
-
A.
ns2np2.
-
B.
ns2np3.
-
C.
ns2 np5.
-
D.
ns2np6.
Khi đun nóng, đơn chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là
-
A.
F2.
-
B.
I2.
-
C.
Cl2.
-
D.
Br2.
Trong hợp chất chlorine có các số oxi hóa nào sau đây?
-
A.
-2, 0, +4, +6.
-
B.
-1, 0, +1, +3, +5, +7.
-
C.
-1, +1, +3, +5, +7.
-
D.
-1, 0, +1, +2, +3, +5, +7.
Sục Cl2 vừa đủ vào dung dịch NaOH loãng, ở nhiệt độ thường thu được dịch X. Trong X chứa chất tan nào sau đây?
-
A.
NaCl.
-
B.
NaClO.
-
C.
NaCl, NaClO.
-
D.
NaCl, NaClO3
Khí HCl khi tan trong nước tạo thành dung dịch hydrochloric acid. Hydrochloric acid khi tiếp xúc với quỳ tím làm quỳ tím
-
A.
chuyển sang màu đỏ.
-
B.
chuyển sang màu xanh.
-
C.
không chuyển màu.
-
D.
không chuyển màu.
Oxide nào sau đây tác dụng với dung dịch HCl sinh ra hỗn hợp muối?
-
A.
Al2O3.
-
B.
Fe3O4.
-
C.
CaO.
-
D.
Na2O.
Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối?
-
A.
NaOH.
-
B.
HCl.
-
C.
AgNO3.
-
D.
KNO3.
Dãy các chất nào sau đây đều tác dụng với hydrochloric acid?
-
A.
Fe2O3, KMnO4, Cu, Fe, AgNO3.
-
B.
Fe2O3, KMnO4¸Fe, CuO, AgNO3.
-
C.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
-
D.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
Có các nhận xét sau về chlorine và hợp chất của chlorine
(1) Nước Javel có khả năng tẩy mầu và sát khuẩn.
(2) Cho giấy quì tím vào dung dịch nước chlorine thì quì tím chuyển màu hồng sau đó lại mất màu.
(3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
(4) Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Cho sơ đồ phản ứng sau (với x, y, z, t, m, n, p là các số nguyên tối giản của nhau):
xFeSO4 + yK2Cr2O7 + zH2SO4 \( \to \) tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
Hòa tan 25,02 gam FeSO4.7H2O trong dung dịch H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X tác dụng với lượng vừa đủ với V mL dung dịch K2Cr2O7 1,47% (D=1,25 g/mL). Cho các nhận định sau:
a) Giá trị \(\frac{x}{y} = 6.\)
b) Giá trị của V là 240.
c) Khối lượng K2Cr2O7 tham gia vừa đủ phản ứng là 4,41 gam.
d) Trong phản ứng trên, H2SO4 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò chất khử.
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình
“ S (s) + O2(g) → SO2(g)” và tỏa ra một lượng nhiệt là 296,9kJ.
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
Cho các phát biểu về các hydrogen halide HX như sau:
(a) Ở điều kiện thường, đều là chất khí.
(b) Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phú hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
(c) Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
(d) Năng lượng liên kết tăng dần từ HF đến HI.
Cho các ứng dụng sau:
(a) Muối iodized dùng để phòng bệnh bướu cổ do thiếu iodine.
(b) Chloramin-B được dùng phun khử khuẩn phòng dịch covid – 19.
(c) Nước Javel được dùng để tẩy màu và sát trùng.
(d) Muối là nguyên liệu sản xuất xút, chlorine, nước javel.
Lời giải và đáp án
Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 \( \to \) 2HCl. Biểu thức tốc độ trung bình của phản ứng là:
-
A.
\(v = \frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{\Delta t}}\).
-
B.
\(v = \frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{HCl}}}}{{\Delta t}}\).
-
C.
\(v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{\Delta t}}\).
-
D.
\(v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{2\Delta t}}\).
Đáp án : D
Dựa vào công thức tính tốc độ trung bình của phản ứng
\(v = \frac{{ - \Delta {C_{{H_2}}}}}{{\Delta t}} = \frac{{ - \Delta {C_{C{l_2}}}}}{{\Delta t}} = \frac{{\Delta {C_{HCl}}}}{{2\Delta t}}\)
Đáp án D
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
-
A.
Nhiệt độ chất phản ứng.
-
B.
Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ....).
-
C.
Nồng độ chất phản ứng.
-
D.
Tỉ lệ mol của các chất trong phản ứng.
Đáp án : D
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Tỉ lệ mol của các chất trong phản ứng không ảnh hưởng đến tốc độ phản ứng
Đáp án D
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:

-
A.
Cl2O (g) + 3F2O (g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
-
B.
Cl2O (g) + 3F2O(g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
C.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
D.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Đáp án : C
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Chất tham gia: ClF3(g) và O2(g)
Chất sản phẩm: Cl2O(g) và F2O(g)
Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0\) = +394,10 kJ
=>2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
Tốc độ phản ứng tăng lên khi
-
A.
giảm nhiệt độ
-
B.
tăng diện tích tiếp xúc giữa các chất phản ứng
-
C.
tăng lượng chất xúc tác
-
D.
giảm nồng độ các chất tham gia phản ứng
Đáp án : B
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Tốc độ phản ứng tăng lên khi tăng diện tích tiếp xúc giữa các chất phản ứng
Đáp án B
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
-
A.
Nhiệt độ.
-
B.
Nhiệt độ.
-
C.
Nồng độ.
-
D.
Áp suất.
Đáp án : B
Dựa vào các yếu tố làm ảnh hưởng đến tốc độ phản ứng
Chất xúc tác đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín để ủ rượu
Đáp án B
-
A.
Kích thước các tinh thể KClO3.
-
B.
Áp suất.
-
C.
Chất xúc tác.
-
D.
Nhiệt độ.
Đáp án : B
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
trong phản ứng có nhiệt độ, chất xúc tác, kích thước chất rắn.
=> Áp suất không ảnh hưởng đến phản ứng
Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau.
(1) Dùng nồi áp suất (3) Chặt nhỏ thịt cá.
(2) Cho thêm muối vào. (4) Nấu cùng nước lạnh.
Cách làm cho thịt cá nhanh chín hơn là
-
A.
1, 2, 3.
-
B.
1, 3, 4.
-
C.
2, 3, 4.
-
D.
1, 2, 4.
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Khi ninh (hầm) thịt cá, người ta sử dụng nồi áp suất, cho thêm muối vào, chặt nhỏ thịt cá
Đáp án A
Không dùng chai, lọ thuỷ tinh mà thường dùng chai nhựa để chứa, đựng, bảo quản hydrohalic acid nào sau đây?
-
A.
HF.
-
B.
HCl.
-
C.
HBr.
-
D.
HI.
Đáp án : A
Dựa vào tính chất hóa học của hydrohalic acid
Không dùng chai, lọ thủy tinh để bảo quản HF vì HF có phản ứng với thủy tinh
HF + SiO2 \( \to \)SiF4 + H2O
Đáp án A
Hai chất nào sau đây được cho vào muối ăn để bổ sung iodine?
-
A.
I2, HI.
-
B.
HI, HIO3.
-
C.
KI, KIO3.
-
D.
I2, AlI3.
Đáp án : C
Dựa vào ứng dụng của iodine
KI, KIO3 để sử dụng bổ sung iodine
Đáp án C
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
-
A.
ns2np2.
-
B.
ns2np3.
-
C.
ns2 np5.
-
D.
ns2np6.
Đáp án : C
Dựa vào cấu hình electron lớp ngoài của nguyên tố halogen
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là: ns2np5
Đáp án C
Khi đun nóng, đơn chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là
-
A.
F2.
-
B.
I2.
-
C.
Cl2.
-
D.
Br2.
Đáp án : B
Dựa vào tính chất vật lí của nguyên tố halogen
Khi đun nóng, đơn chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là I2
Đáp án B
Trong hợp chất chlorine có các số oxi hóa nào sau đây?
-
A.
-2, 0, +4, +6.
-
B.
-1, 0, +1, +3, +5, +7.
-
C.
-1, +1, +3, +5, +7.
-
D.
-1, 0, +1, +2, +3, +5, +7.
Đáp án : C
Dựa vào quy tắc xác định số oxi hóa của các chất
Trong hợp chất chlorine có các số oxi hóa là: -1, +1, +3, +5, +7.
Đáp án C
Sục Cl2 vừa đủ vào dung dịch NaOH loãng, ở nhiệt độ thường thu được dịch X. Trong X chứa chất tan nào sau đây?
-
A.
NaCl.
-
B.
NaClO.
-
C.
NaCl, NaClO.
-
D.
NaCl, NaClO3
Đáp án : C
Dựa vào tính chất hóa học của chlorine
Cl2 + 2NaOH \( \to \)NaCl + NaClO + H2O
Đáp án C
Khí HCl khi tan trong nước tạo thành dung dịch hydrochloric acid. Hydrochloric acid khi tiếp xúc với quỳ tím làm quỳ tím
-
A.
chuyển sang màu đỏ.
-
B.
chuyển sang màu xanh.
-
C.
không chuyển màu.
-
D.
không chuyển màu.
Đáp án : A
Các hydrohalic acid có tính chất acid
Khí HCl khi tan trong nước tạo thành dung dịch acid làm quỳ tím đổi sang màu đỏ
Đáp án A
Oxide nào sau đây tác dụng với dung dịch HCl sinh ra hỗn hợp muối?
-
A.
Al2O3.
-
B.
Fe3O4.
-
C.
CaO.
-
D.
Na2O.
Đáp án : B
Dựa vào tính chất hóa học của HCl
HCl phản ứng với Fe3O4 sinh ra hỗn hợp muối
8HCl + Fe3O4 \( \to \)FeCl2 + 2FeCl3 + 4H2O
Đáp án B
Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối?
-
A.
NaOH.
-
B.
HCl.
-
C.
AgNO3.
-
D.
KNO3.
Đáp án : C
Dựa vào tính chất hóa học của nguyên tố halogen
AgNO3 có thể phân biệt được các ion F-, Cl-, Br-, I- vì tạo ra các kết tủa khác nhau
AgCl: màu trắng; AgBr: màu vàng nhạt; AgI: màu vàng; AgF không tồn tại
Đáp án C
Dãy các chất nào sau đây đều tác dụng với hydrochloric acid?
-
A.
Fe2O3, KMnO4, Cu, Fe, AgNO3.
-
B.
Fe2O3, KMnO4¸Fe, CuO, AgNO3.
-
C.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
-
D.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
Đáp án : B
Dựa vào tính chất hóa học của HCl
HCl tác dụng với Fe2O3, KMnO4¸Fe, CuO, AgNO3.
Đáp án B
Có các nhận xét sau về chlorine và hợp chất của chlorine
(1) Nước Javel có khả năng tẩy mầu và sát khuẩn.
(2) Cho giấy quì tím vào dung dịch nước chlorine thì quì tím chuyển màu hồng sau đó lại mất màu.
(3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
(4) Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : B
Dựa vào tính chất và ứng dụng của chlorine
(1) đúng
(2) sai, quỳ tím chuyển thành màu đỏ
(3) đúng
(4) đúng
Đáp án B
Cho sơ đồ phản ứng sau (với x, y, z, t, m, n, p là các số nguyên tối giản của nhau):
xFeSO4 + yK2Cr2O7 + zH2SO4 \( \to \) tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
Hòa tan 25,02 gam FeSO4.7H2O trong dung dịch H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X tác dụng với lượng vừa đủ với V mL dung dịch K2Cr2O7 1,47% (D=1,25 g/mL). Cho các nhận định sau:
a) Giá trị \(\frac{x}{y} = 6.\)
b) Giá trị của V là 240.
c) Khối lượng K2Cr2O7 tham gia vừa đủ phản ứng là 4,41 gam.
d) Trong phản ứng trên, H2SO4 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò chất khử.
a) Giá trị \(\frac{x}{y} = 6.\)
b) Giá trị của V là 240.
c) Khối lượng K2Cr2O7 tham gia vừa đủ phản ứng là 4,41 gam.
d) Trong phản ứng trên, H2SO4 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò chất khử.
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x3}}\\C{r^{ + 6}} + 3{\rm{e}} \to C{r^{ + 3}}|x1\end{array}\)
6FeSO4 + K2Cr2O7 + 7H2SO4 \( \to \) Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
n FeSO4.7H2O = \(\frac{{25,02}}{{278}} = 0,09mol\)
theo phương trình => 6. n K2Cr2O7 = n FeSO4 => n K2Cr2O7 = 0,015 mol
V K2Cr2O7 = \(\frac{{0,015.294}}{{1,25}}:1,47\% = 240mL\)
=> (a) đúng
(b) đúng
(c) đúng, m K2Cr2O7 = 0,015.294 = 4,41g
(d) sai, H2SO4 đóng vai trò là môi trường
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình
“ S (s) + O2(g) → SO2(g)” và tỏa ra một lượng nhiệt là 296,9kJ.
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
a) sai, biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ
b) đúng
c) đúng
d) đúng
Cho các phát biểu về các hydrogen halide HX như sau:
(a) Ở điều kiện thường, đều là chất khí.
(b) Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phú hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
(c) Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
(d) Năng lượng liên kết tăng dần từ HF đến HI.
(a) Ở điều kiện thường, đều là chất khí.
(b) Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phú hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
(c) Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
(d) Năng lượng liên kết tăng dần từ HF đến HI.
a) đúng
b) đúng
c) đúng
d) sai, năng lượng liên kết giảm dần từ HF đến HI
Cho các ứng dụng sau:
(a) Muối iodized dùng để phòng bệnh bướu cổ do thiếu iodine.
(b) Chloramin-B được dùng phun khử khuẩn phòng dịch covid – 19.
(c) Nước Javel được dùng để tẩy màu và sát trùng.
(d) Muối là nguyên liệu sản xuất xút, chlorine, nước javel.
(a) Muối iodized dùng để phòng bệnh bướu cổ do thiếu iodine.
(b) Chloramin-B được dùng phun khử khuẩn phòng dịch covid – 19.
(c) Nước Javel được dùng để tẩy màu và sát trùng.
(d) Muối là nguyên liệu sản xuất xút, chlorine, nước javel.
a) đúng
b) đúng
c) đúng
d) đúng
Các biện pháp được sử dụng để làm tăng tốc độ phản ứng: dùng chất xúc tác manganese dioxide (MnO2); nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao.
\(\begin{array}{l}\bar v = - \frac{{\Delta {C_{B{r_2}}}}}{t} = - \frac{{(0,01 - a)}}{{50}} = {4.10^{ - 5}}\\ \to a = 0,012M\end{array}\)
Số ống nghiệm cho kết tủa với dung dịch AgNO3 là: 2
PTHH: HCl + AgNO3 \( \to \)AgCl\( \downarrow \) + HNO3
NaBr + AgNO3 \( \to \)AgBr \( \downarrow \)+ NaNO3
KIO3 + 5KI + 3H2SO4 → 3K2SO4 + 3I2 + 3H2O
0,1 mol ← 0,3 mol
\({m_{KI{O_{_3}}}} = 0,1.(39 + 127 + 16.3) = 21,4gam\)
\(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_2} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{02^x}.0,{01^y} = {8.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_2}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{02}^x}.0,{{01}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{8.10}^{ - 4}}}}\\ \to x = 2\end{array}\)
\(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_3} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{02^y} = {4.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_3}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{01}^x}.0,{{02}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{4.10}^{ - 4}}}}\\ \to y = 1\end{array}\)
Tổng x + y = 1 + 2 = 3
HCl đóng vai trò là chất khử khi tăng số oxi hóa
(a); (c) đóng vai trò là chất khử.
Dùng không khí nén thổi vào lò cao để đốt cháy
Phản ứng oxi hóa - khử là phản ứng có sự nhường và nhận
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:
Hoàn thành phương trình hóa học của các phản ứng sau và cho biết chất nào là chất oxi hóa, chất nào là chất khử.
Fe2O3 là thành phần chính của quặng hematite đỏ, dùng để luyện gang. Số oxi hóa của iron (sắt) trong Fe2O3 là
Trong phản ứng oxi hóa – khử, chất khử là chất A. nhường electron. B. nhận electron. C. nhận proton. D.nhường proton.
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
Khái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận