Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 7
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Đề bài
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1. Số hiệu nguyên tử của nguyên tố R là
-
A.
19 hoặc 24 hoặc 29.
-
B.
19.
-
C.
29.
-
D.
24.
Cấu hình electron nguyên tử nào sau đây của nguyên tố kim loại?
-
A.
1s2.
-
B.
1s22s22p6.
-
C.
1s22s22p5.
-
D.
1s22s22p63s2.
Cho các nguyên tố: 8X, 11R, 6Y. Bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự
-
A.
X < Y < R.
-
B.
Y < X< R.
-
C.
R < X< Y.
-
D.
R < Y< X.
Nguyên tử nguyên tố X có tổng số electron trên phân lớp p là 11. Hãy cho biết cấu hình electron lớp ngoài cùng của nguyên tử X và kiểu xen phủ các orbital trong nguyên tử để tạo ra phân tử X2?
-
A.
3s23p5, kiểu xen phủ trục p-p.
-
B.
3s23p5, kiểu xen phủ bên p-p.
-
C.
3s1, kiểu xen phủ s-s.
-
D.
3s23p5, kiểu xen phủ s-p.
Trong các hợp chất sau đây, hợp chất nào là hợp chất ion?
-
A.
H2O
-
B.
H2S
-
C.
KBr
-
D.
NH3
Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2np3. Trong hợp chất cao nhất với oxygen, X chiếm 43,662% về khối lượng. Phần trăm của X trong hợp chất với hydrogen là
-
A.
91,176%.
-
B.
17,648%.
-
C.
82,352%.
-
D.
8,824%.
Hạt nhân nguyên tử X có 26 proton và 30 neutron. Ký hiệu nguyên tử X là
-
A.
\(_{26}^{30}X\)
-
B.
\(_{30}^{56}X\)
-
C.
\(_{26}^{56}X\)
-
D.
\(_{56}^{26}X\)
Công thức Lewis của phân tử O2 là
-
A.
O = O
-
B.
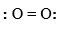
-
C.
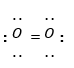
-
D.
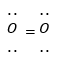
Cho độ âm điện các nguyên tố K(0,82); O(3,44); Cl(3,16); H(2,20); N(3,04). Hợp chất có liên kết cộng hóa trị phân cực mạnh nhất là
-
A.
KCl
-
B.
Cl2O7
-
C.
NH3
-
D.
H2O
Chất nào sau đây có cả liên kết ion, liên kết CHT phân cực và liên kết cho nhận?
-
A.
HNO3
-
B.
NaNO3
-
C.
NaOH
-
D.
K2CO3
Nguyên tố X thuộc nhóm A trong bảng tuần hoàn. Oxide cao nhất của X có công thức hóa học là XO3. Số electron lớp ngoài cùng của X là
-
A.
8
-
B.
6
-
C.
3
-
D.
2
X, Y, Z là 3 nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Biết oxide của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím, Y phản ứng với nước tạo thành một dung dịch làm xanh giấy quỳ tím, còn Z phản ứng được với cả dung dịch acid và dung dịch kiềm. Nếu xếp theo trật tự tăng dần độ âm điện thì trật tự đúng sẽ là
-
A.
Y<Z<X.
-
B.
Z<Y<X.
-
C.
X<Y<Z.
-
D.
X<Z<Y.
Chất nào sau đây đều có liên kết hydrogen giữa các phân tử?
-
A.
SiH4; CH4.
-
B.
H2O; HF.
-
C.
PH3; NH3.
-
D.
H2S; HCl.
Cho 9,0g hỗn hợp 2 kim loại A, B hòa tan hoàn toàn trong dung dịch HCl dư thu được 7,437 lít khí H2 (đkc). A, B thuộc 2 chu kì liên tiếp nhau và thuộc nhóm IIA. A, B là các nguyên tố
-
A.
Be, Ca.
-
B.
Ca, Sr.
-
C.
Be, Mg.
-
D.
Mg, Ca.
Cho các phát biểu sau
a. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
b. Trong phân tử C2H2 có một liên kết ba.
c. Mỗi cặp electron góp chung tạo nên hai liên kết cộng hóa trị.
d. Độ âm điện của một nguyên tử đặc trưng cho khả năng nhường electron của nguyên tử đó khi hình thành liên kết hóa học.
e. Liên kết giữa nguyên tử C và O phân cực nên phân tử CO2 phân cực.
Số phát biểu sai là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Cho cấu hình của nguyên tố X là 1s²2s²2p63s². Phát biểu đúng là
-
A.
X ở ô 12, chu kỳ 3, nhóm IIIA trong bảng tuần hoàn.
-
B.
X ở ô 12, chu kỳ 3, nhóm IIIB trong bảng tuần hoàn.
-
C.
X ở ô 12, chu kỳ 2, nhóm IIA trong bảng tuần hoàn.
-
D.
X ở ô 12, chu kỳ 3, nhóm IIA trong bảng tuần hoàn.
Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
-
A.
Tính kim loại và tính phi kim.
-
B.
Khối lượng nguyên tử.
-
C.
Tính acid - base của các hydroxygende.
-
D.
Cấu hình electron lớp ngoài cùng.
Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất? Cho biết nguyên tố này được sử dụng trong công nghệ hàn, sản xuất thép và methanol.
-
A.
B.
-
B.
N.
-
C.
O.
-
D.
Mg.
Nguyên tố X được sử dụng làm vật liệu máy bay, ô tô, tên lửa, tàu vũ trụ. Trong bảng tuần hoàn, X thuộc chu kì 3, nhóm IIIA.
a. X có tính kim loại mạnh hơn Mg(Z=12).
b. Oxide cao nhất của X có công thức hóa học X2O3.
c. Hợp chất hydroxide của X có công thức hóa học X(OH)3.
d. Hydroxide của X có tính base mạnh.
Khí CO2 có trong khí quyển và sự gia tăng hàm lượng CO2 là nguyên nhân chính gây ra hiệu ứng nhà kính. Cho độ âm điện của nguyên tử C là 2,55 và O là 3,44.
a. Phân tử CO2 là phân tử không phân cực.
b. Phân tử CO2 có 2 xen phủ s-p và 2 xen phủ p-p.
c. Trong phân tử CO2 có 2 liên kết σ và 2 kiên kết π.
d. Trong phân tử CO2 có 4 cặp e hóa trị riêng chưa tham gia liên kết.
Nguyên tố Y là kim loại cứng nhất, dùng trong dao cắt kính và ở ô số 24 của bảng tuần hoàn.
a. Y có 6 e hóa trị và là nguyên tố kim loại.
b. Y là nguyên tố d.
c. Y ở chu kì 4 của bảng tuần hoàn.
d. Ở trạng thái cơ bản, Y có 6 e ở phân lớp s.
Cho 5 nguyên tố A, X, Y, Z, T theo thứ tự thuộc 5 ô liên tiếp nhau trong bảng tuần hoàn các nguyên tố hóa học, có số hiệu nguyên tử tăng dần. Tổng số hạt mang điện trong 5 nguyên tử của 5 nguyên tố trên bằng 100.
a. Nguyên tố A là oxygen và T là nguyên tố Magnesium.
b. A, X, Y thuộc loại là nguyên tố p.
c. Z, T thuộc cùng một nhóm.
d. Z, T thuộc loại là nguyên tố phi kim.
Trong tự nhiên, bromine có 2 đồng vị là 79Br có hàm lượng 50,7% còn lại là 81Br. Nguyên tử khối trung bình của bromine là bao nhiêu?
Đáp án:
Cho các chất sau: NaCl, H2O, K2O, BaCl2, CaF2, HCl, NH4NO3. Có bao nhiêu chất chứa liên kết ion?
Đáp án:
Tổng số cặp electron dùng chung giữa các nguyên tử trong phân tử ethylene (C2H4) là bao nhiêu?
Đáp án:
Hợp chất khí với hydrogen của nguyên tố X có công thức XH4, được sử dụng làm tác nhân ghép nối để bám dính các sợi như sợi thủy tinh và sợi carbon. Oxide cao nhất của X chứa 53,3% oxygen về khối lượng, thường được dùng để sản xuất cửa sổ, lọ thủy tinh. Hãy cho biết giá trị nguyên tử khối trung bình của X là bao nhiêu?
Đáp án:
Lời giải và đáp án
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1. Số hiệu nguyên tử của nguyên tố R là
-
A.
19 hoặc 24 hoặc 29.
-
B.
19.
-
C.
29.
-
D.
24.
Đáp án : B
Dựa vào số electron lớp ngoài cùng nguyên tử R.
Vì nguyên tố R ở nhóm A mà R có phân lớp electron ngoài cùng là 4s1 nên cấu hình electron R là: 1s2 2s22p6 3s23p6 4s1.
Đáp án B
Cấu hình electron nguyên tử nào sau đây của nguyên tố kim loại?
-
A.
1s2.
-
B.
1s22s22p6.
-
C.
1s22s22p5.
-
D.
1s22s22p63s2.
Đáp án : D
Nguyên tố kim loại có số electron lớp ngoài cùng là 1,2,3.
1s22s22p63s2 có 2 electron lớp ngoài cùng nên thuộc nguyên tố kim loại
Đáp án D
Cho các nguyên tố: 8X, 11R, 6Y. Bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự
-
A.
X < Y < R.
-
B.
Y < X< R.
-
C.
R < X< Y.
-
D.
R < Y< X.
Đáp án : A
Dựa vào xu hướng biến đổi trong bảng tuần hoàn.
8X, 6Y thuộc cùng chu kì 2 nên bán kính 6Y > 8X
11R thuộc chu kì 3 nên bán kính 11R > 6Y
Sắp xếp bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự là: X < Y < R
Đáp án A
Nguyên tử nguyên tố X có tổng số electron trên phân lớp p là 11. Hãy cho biết cấu hình electron lớp ngoài cùng của nguyên tử X và kiểu xen phủ các orbital trong nguyên tử để tạo ra phân tử X2?
-
A.
3s23p5, kiểu xen phủ trục p-p.
-
B.
3s23p5, kiểu xen phủ bên p-p.
-
C.
3s1, kiểu xen phủ s-s.
-
D.
3s23p5, kiểu xen phủ s-p.
Đáp án : A
Dựa vào sự xen phủ orbital.
Vì nguyên tử nguyên tố X có tổng số electron trên phân lớp p là 11 nên cấu hình nguyên tử X là:
1s2 2s22p6 3s23p5
Vậy X là nguyên tử nguyên tố phi kim.
Cấu hình electron lớp ngoài cùng của nguyên tử X là 3s23p5, kiểu xen phủ trục p – p vì theo cách sắp xếp electron trong orbital nguyên tử X là:
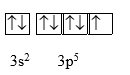
Đáp án A
Trong các hợp chất sau đây, hợp chất nào là hợp chất ion?
-
A.
H2O
-
B.
H2S
-
C.
KBr
-
D.
NH3
Đáp án : C
Dựa vào khái niệm liên kết ion.
KBr là hợp chất ion
Đáp án C
Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2np3. Trong hợp chất cao nhất với oxygen, X chiếm 43,662% về khối lượng. Phần trăm của X trong hợp chất với hydrogen là
-
A.
91,176%.
-
B.
17,648%.
-
C.
82,352%.
-
D.
8,824%.
Đáp án : A
Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử X.
Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2np3 nên X có 5 electron lớp ngoài cùng nên hóa trị cao nhất của X với oxygen là 5, hóa trị với hydrogen là 3.
Công thức oxide X là: X2O5
%X = \(\frac{{2.{M_X}}}{{2.{M_X} + 5.{M_O}}}.100 = 43,662\% \to {M_X} = 31\)→ X là phosphorus (P)
%P trpng PH3 là: \(\frac{{31}}{{31 + 3.1}}.100 = 91,17\% \)
Đáp án A
Hạt nhân nguyên tử X có 26 proton và 30 neutron. Ký hiệu nguyên tử X là
-
A.
\(_{26}^{30}X\)
-
B.
\(_{30}^{56}X\)
-
C.
\(_{26}^{56}X\)
-
D.
\(_{56}^{26}X\)
Đáp án : C
Dựa vào kí hiệu nguyên tử X.
Số khối X là: 26 + 30 = 56
Kí hiệu nguyên tử X là: \(_{26}^{56}X\)
Đáp án C
Công thức Lewis của phân tử O2 là
-
A.
O = O
-
B.
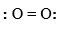
-
C.
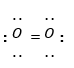
-
D.
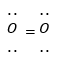
Đáp án : D
Dựa vào công thức Lewis: biểu diễn sự hình thành liên kết giữa các nguyên tử và số electron còn lại mỗi nguyên tử.
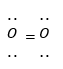
là công thức Lewis của phân tử O2
Đáp án D
Cho độ âm điện các nguyên tố K(0,82); O(3,44); Cl(3,16); H(2,20); N(3,04). Hợp chất có liên kết cộng hóa trị phân cực mạnh nhất là
-
A.
KCl
-
B.
Cl2O7
-
C.
NH3
-
D.
H2O
Đáp án : D
Dựa vào độ âm điện của các nguyên tố.
Tính hiệu độ âm điện của các nguyên tố ta thấy liên kết O – H có sự phân cực mạnh nhất do O có độ âm điện lớn nhất và H có độ âm điện nhỏ nhất.
Đáp án D
Chất nào sau đây có cả liên kết ion, liên kết CHT phân cực và liên kết cho nhận?
-
A.
HNO3
-
B.
NaNO3
-
C.
NaOH
-
D.
K2CO3
Đáp án : B
Dựa vào hiệu độ âm điện của nguyên tử.
NaNO3 có chứa liên kết ion Na và gốc – NO3; liên kết cộng hóa trị phân cực N – O và liên kết cho – nhận N → O
Đáp án B
Nguyên tố X thuộc nhóm A trong bảng tuần hoàn. Oxide cao nhất của X có công thức hóa học là XO3. Số electron lớp ngoài cùng của X là
-
A.
8
-
B.
6
-
C.
3
-
D.
2
Đáp án : B
Dựa vào công thức oxide của X.
Vì oxide cao nhất của X có công thức hóa học là XO3 nên X có hóa trị 6 nên số electron lớp ngoài cùng của X là 6.
Đáp án B
X, Y, Z là 3 nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Biết oxide của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím, Y phản ứng với nước tạo thành một dung dịch làm xanh giấy quỳ tím, còn Z phản ứng được với cả dung dịch acid và dung dịch kiềm. Nếu xếp theo trật tự tăng dần độ âm điện thì trật tự đúng sẽ là
-
A.
Y<Z<X.
-
B.
Z<Y<X.
-
C.
X<Y<Z.
-
D.
X<Z<Y.
Đáp án : A
Dựa vào xu hướng biến đổi trong bảng tuần hoàn.
X là phi kim do X tạo oxide acid do khi tan vào nước tạo thành dung dịch làm hồng quỳ tím
Y là kim loại IA hoặc IIA do Y tạo oxide base do khi tan vào nước tạo thành dung dịch làm xanh quỳ tím.
Z là kim loại IIIA.
Độ âm điện tăng dần là: Y < Z < X.
Đáp án A
Chất nào sau đây đều có liên kết hydrogen giữa các phân tử?
-
A.
SiH4; CH4.
-
B.
H2O; HF.
-
C.
PH3; NH3.
-
D.
H2S; HCl.
Đáp án : B
Dựa vào khái niệm liên kết hydrogen.
Liên kết hydrogen được hình thành từ những nguyên tố có độ âm điện lớn với hydrogen.
H2O và HF vì độ âm điện O và F lớn nhất trong bảng tuần hoàn
Đáp án B
Cho 9,0g hỗn hợp 2 kim loại A, B hòa tan hoàn toàn trong dung dịch HCl dư thu được 7,437 lít khí H2 (đkc). A, B thuộc 2 chu kì liên tiếp nhau và thuộc nhóm IIA. A, B là các nguyên tố
-
A.
Be, Ca.
-
B.
Ca, Sr.
-
C.
Be, Mg.
-
D.
Mg, Ca.
Đáp án : D
Dựa vào tính chất hóa học của kim loại.
Gọi M là kim loại trung bình của A và B.
n H2 = 7,437 : 24,79 = 0,3 mol
M + 2HCl → MCl2 + H2
0,3 ← 0,3
MM = 9 : 0,3 = 30
MA < MM < MB nên A là Mg và B là Ca do A, B thuộc 2 chu kì liên tiếp nhau.
Đáp án D
Cho các phát biểu sau
a. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
b. Trong phân tử C2H2 có một liên kết ba.
c. Mỗi cặp electron góp chung tạo nên hai liên kết cộng hóa trị.
d. Độ âm điện của một nguyên tử đặc trưng cho khả năng nhường electron của nguyên tử đó khi hình thành liên kết hóa học.
e. Liên kết giữa nguyên tử C và O phân cực nên phân tử CO2 phân cực.
Số phát biểu sai là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Đáp án : B
Dựa vào các loại liên kết.
a. đúng
b. đúng
c. sai, mỗi cặp electron góp chung tạo nên một liên kết cộng hóa trị.
d. sai, độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học
e. sai, phân tử CO2 không phân cực
Đáp án B
Cho cấu hình của nguyên tố X là 1s²2s²2p63s². Phát biểu đúng là
-
A.
X ở ô 12, chu kỳ 3, nhóm IIIA trong bảng tuần hoàn.
-
B.
X ở ô 12, chu kỳ 3, nhóm IIIB trong bảng tuần hoàn.
-
C.
X ở ô 12, chu kỳ 2, nhóm IIA trong bảng tuần hoàn.
-
D.
X ở ô 12, chu kỳ 3, nhóm IIA trong bảng tuần hoàn.
Đáp án : D
Dựa vào cấu hình của nguyên tố X.
X ở chu kì 12, chu kì 3, nhóm IIA.
Đáp án D
Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
-
A.
Tính kim loại và tính phi kim.
-
B.
Khối lượng nguyên tử.
-
C.
Tính acid - base của các hydroxygende.
-
D.
Cấu hình electron lớp ngoài cùng.
Đáp án : B
Dựa vào xu hướng biến đổi trong bảng tuần hoàn.
Khối lượng nguyên tử không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Đáp án B
Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất? Cho biết nguyên tố này được sử dụng trong công nghệ hàn, sản xuất thép và methanol.
-
A.
B.
-
B.
N.
-
C.
O.
-
D.
Mg.
Đáp án : C
Dựa vào độ âm điện của các nguyên tố.
Oxygen là nguyên tử nguyên tố có độ âm điện lớn nhất (sau flourine) và được sử dụng trong công nghệ hàn, sản xuất thép và methanol
Nguyên tố X được sử dụng làm vật liệu máy bay, ô tô, tên lửa, tàu vũ trụ. Trong bảng tuần hoàn, X thuộc chu kì 3, nhóm IIIA.
a. X có tính kim loại mạnh hơn Mg(Z=12).
b. Oxide cao nhất của X có công thức hóa học X2O3.
c. Hợp chất hydroxide của X có công thức hóa học X(OH)3.
d. Hydroxide của X có tính base mạnh.
a. X có tính kim loại mạnh hơn Mg(Z=12).
b. Oxide cao nhất của X có công thức hóa học X2O3.
c. Hợp chất hydroxide của X có công thức hóa học X(OH)3.
d. Hydroxide của X có tính base mạnh.
Dựa vào ứng dụng của một số nguyên tố.
X là kim loại Al
a. sai, Al có tính kim loại yếu hơn Mg (Z=12)
b. đúng
c. đúng
d. sai, hydroxide của X có tính lưỡng tính
Khí CO2 có trong khí quyển và sự gia tăng hàm lượng CO2 là nguyên nhân chính gây ra hiệu ứng nhà kính. Cho độ âm điện của nguyên tử C là 2,55 và O là 3,44.
a. Phân tử CO2 là phân tử không phân cực.
b. Phân tử CO2 có 2 xen phủ s-p và 2 xen phủ p-p.
c. Trong phân tử CO2 có 2 liên kết σ và 2 kiên kết π.
d. Trong phân tử CO2 có 4 cặp e hóa trị riêng chưa tham gia liên kết.
a. Phân tử CO2 là phân tử không phân cực.
b. Phân tử CO2 có 2 xen phủ s-p và 2 xen phủ p-p.
c. Trong phân tử CO2 có 2 liên kết σ và 2 kiên kết π.
d. Trong phân tử CO2 có 4 cặp e hóa trị riêng chưa tham gia liên kết.
Dựa vào liên kết trong nguyên tố.
a. đúng
b. sai, phân tử CO2 có 2 xen phủ p – p.
c. đúng
d. đúng
Nguyên tố Y là kim loại cứng nhất, dùng trong dao cắt kính và ở ô số 24 của bảng tuần hoàn.
a. Y có 6 e hóa trị và là nguyên tố kim loại.
b. Y là nguyên tố d.
c. Y ở chu kì 4 của bảng tuần hoàn.
d. Ở trạng thái cơ bản, Y có 6 e ở phân lớp s.
a. Y có 6 e hóa trị và là nguyên tố kim loại.
b. Y là nguyên tố d.
c. Y ở chu kì 4 của bảng tuần hoàn.
d. Ở trạng thái cơ bản, Y có 6 e ở phân lớp s.
Dựa vào vị trí của nguyên tố trong bảng tuần hoàn.
Y là nguyên tố Cr trong bảng tuần hoàn
a. đúng
b. đúng
c. đúng
d. sai, ở trạng thái cơ bản, Y có 7 electron ở phân lớp s.
Cho 5 nguyên tố A, X, Y, Z, T theo thứ tự thuộc 5 ô liên tiếp nhau trong bảng tuần hoàn các nguyên tố hóa học, có số hiệu nguyên tử tăng dần. Tổng số hạt mang điện trong 5 nguyên tử của 5 nguyên tố trên bằng 100.
a. Nguyên tố A là oxygen và T là nguyên tố Magnesium.
b. A, X, Y thuộc loại là nguyên tố p.
c. Z, T thuộc cùng một nhóm.
d. Z, T thuộc loại là nguyên tố phi kim.
a. Nguyên tố A là oxygen và T là nguyên tố Magnesium.
b. A, X, Y thuộc loại là nguyên tố p.
c. Z, T thuộc cùng một nhóm.
d. Z, T thuộc loại là nguyên tố phi kim.
Dựa vào vị trí của nguyên tố trong bảng tuần hoàn.
Gọi số hạt proton của A là Z
=> của X là Z+1; của Y là Z +2; của Z là Z + 3; của T là Z+4
Theo bài ra ta có: 10Z + 20 = 100 => Z = 8.
=> A là 8O ; X là 9F ; Y là 10Ne ; Z là 11Na ; T là 12Mg
A(Z=8): 1s22s22p4 => nguyên tố p ( có 6 electron lớp ngoài cùng nên thuộc loại nguyên tố phi kim)
X(Z= 9): 1s22s22p5 => nguyên tố p (có 7 electron lớp ngoài cùng nên thuộc loại nguyên tố phi kim).
Y(Z= 10): 1s22s22p6 => nguyên tố p (có 8 electron lớp ngoài cùng nên thuộc loại nguyên tố khí hiếm).
Z (Z=11): 1s22s22p63s1 => nguyên tố s (có 1 electron lớp ngoài cùng nên thuộc loại nguyên tố kim loại, thuộc nhóm IA).
T (Z=11): 1s22s22p63s2 => nguyên tố s (có 2 electron lớp ngoài cùng nên thuộc loại nguyên tố kim loại, thuộc nhóm IIA).
a. Nguyên tố A là oxygen và T là nguyên tố Magnesium. => Đúng
b. A, X, Y thuộc loại là nguyên tố p. => Đúng
c. Z, T thuộc cùng một nhóm => Sai
d. Z, T thuộc loại là nguyên tố phi kim. => Sai
Trong tự nhiên, bromine có 2 đồng vị là 79Br có hàm lượng 50,7% còn lại là 81Br. Nguyên tử khối trung bình của bromine là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào công thức tính nguyên tử khối trung bình.
MBr= \(\frac{{79.50,7 + 81.49,3}}{{100}} = 79,986\)
Cho các chất sau: NaCl, H2O, K2O, BaCl2, CaF2, HCl, NH4NO3. Có bao nhiêu chất chứa liên kết ion?
Đáp án:
Đáp án:
Dựa vào khái niệm liên kết ion.
NaCl, K2O, BaCl2, CaF2, NH4NO3 có chứa liên kết ion.
Đáp án 5
Tổng số cặp electron dùng chung giữa các nguyên tử trong phân tử ethylene (C2H4) là bao nhiêu?
Đáp án:
Đáp án:
Có 4 liên kết đơn C-H (4 cặp e) và 1 liên kết đôi C=C (2 cặp e)
Hợp chất khí với hydrogen của nguyên tố X có công thức XH4, được sử dụng làm tác nhân ghép nối để bám dính các sợi như sợi thủy tinh và sợi carbon. Oxide cao nhất của X chứa 53,3% oxygen về khối lượng, thường được dùng để sản xuất cửa sổ, lọ thủy tinh. Hãy cho biết giá trị nguyên tử khối trung bình của X là bao nhiêu?
Đáp án:
Đáp án:
Từ công thức XH4 → oxide XO2
%O: 53,3 = \(\frac{{16.2}}{{16.2 + X}}.100\) → X=28
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Chu kì là
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Hạt mang điện trong hạt nhân nguyên tử là
Điện tích của hạt nhân do loại hạt nào quyết định?
Hạt mang điện trong nhân nguyên tử là:
Trình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận