 Đề thi hóa 10, đề kiểm tra hóa 10 kết nối tri thức có đáp án và lời giải chi tiết
Đề thi hóa 10, đề kiểm tra hóa 10 kết nối tri thức có đáp án và lời giải chi tiết
 Đề thi học kì 2 Hóa 10 - Kết nối tri thức
Đề thi học kì 2 Hóa 10 - Kết nối tri thức Đề cương ôn tập học kì 2 Hóa 10
Tải vềKhái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
A. NỘI DUNG ÔN TẬP
Chủ đề 4: Phản ứng oxi hóa – khử
- Khái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
- Khái niệm về phản ứng oxi hóa – khử và ý nghĩa của phản ứng oxi hóa – khử
- Cân bằng được phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
- Ý nghĩa của phản ứng oxi hóa – khử trong cuộc sống
Chủ đề 5: Năng lượng hóa học
- Khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn
- Khái niệm enthalpy tạo thành và biến thiên enthalpy (nhiệt của phản ứng) của phản ứng hóa học.
-Ý nghĩa của dấu và giá trị
- Tính được của phản ứng hóa học dựa vào enthalpy tạo thành và theo năng lượng liên kết
- Công thức: \({\Delta _r}H_{298}^o\)= \(\sum {{\Delta _f}H_{298}^o(sp) - \sum {{\Delta _f}H_{298}^o(tg)} } \); \({\Delta _r}H_{298}^o\)= \(\sum {{E_{tg}} - \sum {{E_{{\rm{s}}p}}} } \)
Chủ đề 6: Tốc độ phản ứng hóa học
- Khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng
- Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ
- Các yếu tố ảnh hưởng đến tốc độ phản ứng: nhiệt độ, nồng độ, áp suất, diện tích bề mặt, chất xúc tác
- Ý nghĩa của hệ số nhiệt độ Van’t Hoff
- Giải thích một số vấn đề trong cuộc sống dựa vào tốc độ phản ứng hóa học
Chủ đề 7: Nguyên tố nhóm VIIA
- Trạng thái tự nhiên của các nguyên tố halogen
- Tính chất hóa học của đơn chất halogen
- Xu hướng biến đổi tính acid của dãy hydrohalic acid
- Nhận biết ion F-, Cl-, Br-, I- bằng dung dịch AgNO3
- Tính chất hóa học của các ion halide
- Ứng dụng của một số hydrogen halide.
B. BÀI TẬP
Đề bài
I. Trắc nghiệm
Câu 1: Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử. B. chất oxi hoá. C. acid. D. base.
Câu 2: Trong phản ứng oxi hoá – khử, chất nhận electron được gọi là
A. chất khử. B. chất oxi hoá. C. acid. D. base.
Câu 3: Cho quá trình Al → Al3+ + 3e, đây là quá trình
A. khử. B. oxi hóa. C. tự oxi hóa – khử. D. nhận proton.
Câu 4: Cho quá trình N+5 + 3e → N+2, đây là quá trình
A. khử. B. oxi hóa. C. tự oxi hóa – khử. D. nhận proton.
Câu 5: Phản ứng nào sau đây là phản ứng oxi hóa – khử?

Câu 6: Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O
Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng (a + b) bằng:
A. 8. B. 3. C. 11. D. 5.
Câu 7: Phản ứng tỏa nhiệt là gì?
A. Là phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. Là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. Là phản ứng giải phóng ion dưới dạng nhiệt.
D. Là phản ứng hấp thụ ion dưới dạng nhiệt.
Câu 8: Phản ứng thu nhiệt là gì?
A. Là phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. Là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. Là phản ứng giải phóng ion dưới dạng nhiệt.
D. Là phản ứng hấp thụ ion dưới dạng nhiệt.
Câu 9: Kí hiệu enthalpy tạo thành (nhiệt tạo thành) của chất hóa học ở điều kiện chuẩn là
A. \({\Delta _r}H_{298}^o\)
B. \({\Delta _f}H_{298}^o\)
C. \({\Delta _r}H\)
D. \({\Delta _f}H\)
Câu 10: Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là
A. \({\Delta _r}H_{298}^o\) B. \({\Delta _f}H_{298}^o\)
C. \({\Delta _r}H\) D. \({\Delta _f}H\)
Câu 11: Enthalpy tạo thành chuẩn của các đơn chất bền vững bằng
A. +1 kJ/mol. B. -1 kJ/mol. C. +2 kJ/mol. D. 0 kJ/mol.
Câu 12: Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25°C hay 298 K. B. Áp suất 1 bar và nhiệt độ 298 K.
C. Áp suất 1 bar và nhiệt độ 25°C. D. Áp suất 1 bar và nhiệt độ 25 K.
Câu 13: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng tôi vôi. B. Phản ứng đốt than và củi.
C. Phản ứng phân hủy đá vôi. D. Phản ứng đốt nhiên liệu.
Câu 14: Nhiệt lượng tỏa ra hay thu vào của một phản ứng ở một điều kiện xác định được gọi là gì?
A. Nhiệt lượng tỏa ra; B. Nhiệt lượng thu vào;
C. Biến thiên enthalpy; D. Biến thiên năng lượng.
Câu 15: Phản ứng nào sau đây là phản ứng toả nhiệt?
A. Phản ứng nhiệt phân muối KNO3. B. Phản ứng phân huỷ khí NH3.
C. Phản ứng oxi hoá glucose trong cơ thể. D. Phản ứng hoà tan NH4Cl trong nước.
Câu 16: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C (than chì)\( + {O_{2\,(g)}} \to 2C{O_{(g)}}\)
B. C (than chì) + \({O_{(g)}} \to C{O_{(g)}}\)
C. C (than chì)\( + \frac{1}{2}{O_{2\,(g)}} \to C{O_{(g)}}\)
D. C (than chì)\( + C{O_{2\,(g)}} \to 2C{O_{(g)}}\)
Câu 17: Quy ước về dấu của nhiệt phản ứng (\({\Delta _r}H_{298}^o\)) nào sau đây là đúng?
A. Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^o\)> 0.
B. Phản ứng thu nhiệt có \({\Delta _r}H_{298}^o\)< 0.
C. Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^o\)< 0.
D. Phản ứng thu nhiệt có \({\Delta _r}H_{298}^o\)= 0.
Câu 18: Cho phương trình nhiệt hóa học của phản ứng: 2H2(g) + O2(g) \( \to \) 2H2O(l) \({\Delta _r}H_{298}^o\)= -571,68kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu19: Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) \( \to \) 2NO(l) \({\Delta _r}H_{298}^o\)= +179,20kJ
Phản ứng trên là phản ứng
A. thu nhiệt. B. không có sự thay đổi năng lượng.
C. tỏa nhiệt. D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 20: Nung KNO3 lên 5500C xảy ra phản ứng:
KNO3(s) \( \to \)KNO2(s) + \(\frac{1}{2}{O_2}(g){\rm{ }}{\Delta _r}H_{298}^o?\) Phản ứng nhiệt phân KNO3 là phản ứng:
A. toả nhiệt, có \({\Delta _r}H_{298}^o\)< 0. B. thu nhiệt, có \({\Delta _r}H_{298}^o\)> 0.
C. toả nhiệt, có \({\Delta _r}H_{298}^o\)> 0. D. thu nhiệt, có \({\Delta _r}H_{298}^o\)< 0.
Câu 21: Nồng độ đối với chất tan trong dung dịch ở điều kiện chuẩn là?
A. 0,01 mol/L. B. 0,1 mol/L. C. 1 mol/L. D. 0,5 mol/L.
Câu 22: Nhiệt tạo thành chuẩn của khí oxygen trong phản ứng hóa học là?
A. 0 kJ/mol; B. 1 kJ/mol; C. 273 kJ/mol; D. 298 kJ/mol.
Câu 23: Phản ứng nung vôi thuộc phản ứng
A. tỏa nhiệt. B. trung hòa. C. thu nhiệt. D. oxi hóa khử.
Câu 24: Phản ứng toả nhiệt thì
A. ∆rH = 0. B. ∆rH < 0. C. ∆rH > 0. D. ∆rH ≥ 0.
Câu 25: Cho các chất sau, chất nào có enthalpy tạo thành chuẩn bằng 0?
A. CaCO3(s). B. SO2(g). C. Cl2(g). D. CH4(g)
Câu 26: Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) đối với chất khí được xác định trong điều kiện áp suất là A. 1 Pa. B. 1 atm. C. 760 mmHg. D. 1 bar.
Câu 27: Tốc độ phản ứng là:
A. độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 28: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây:
A. Thời gian xảy ra phản ứng B. Bề mặt tiếp xúc giữa các chất phản ứng
C. Nồng độ các chất tham gia phản ứng. D. Chất xúc tác
Câu 29: Tủ lạnh để bảo quản thức ăn là ứng dụng cho yếu tố ảnh hưởng tốc độ phản ứng nào?
A. Nhiệt độ; B. Nồng độ;
C. Chất xúc tác; D. Diện tích bề mặt tiếp xúc.
Câu 30: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. Nồng độ của các chất khí tăng lên. B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên. D. Nồng độ của các chất khí không thay đổi.
Câu 31: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. đốt trong lò kín B. xếp củi chặt khít C. thổi hơi nước D. thổi không khí khô
Câu 32: Cho phản ứng hoá học tổng hợp amonia: 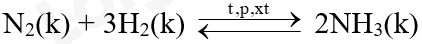
Khi tăng nồng độ của hydrogen lên 2 lần, tốc độ phản ứng thuận.
A. giảm đi 2 lần. B. tăng lên 2 lần. C. tăng lên 8 lần. D. tăng lên 6 lần
Câu 33: Cho phản ứng : Br2 + HCOOH ® 2HBr + CO2. Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol(lít.s)-1. Giá trị của a là:
A. 0,018. B. 0,016. C. 0,012. D. 0,014.
Câu 34: Hệ số nhiệt độ của tốc độ phản ứng có giá trị nào sau đây? Biết rằng khi giảm nhiệt độ của phản ứng xuống 80oC thì tốc độ phản ứng giảm đi 256 lần.
A. 4,0. B. 2,5. C. 3,0. D. 2,0.
Câu 35: Cho hệ cân bằng 2CO (g) + O2 (g) → 2CO2 (g) trong bình kín, nhiệt độ không đổi. Nếu giảm thể tích của hệ 3 lần, tốc độ phản ứng nghịch sẽ tăng lên
A. 3 lần. B. 6 lần. C. 9 lần. D. 12 lần.
Câu 36: Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là
A. 5. B. 7. C. 2. D. 8.
Câu 37: Tính chất hoá học đặc trưng của các đơn chất halogen là
A. tính khử. B. tính base. C. tính acid. D. tính oxi hoá.
Câu 38: Trong tự nhiên, nguyên tố fluorine tồn tại phổ biến nhất ở dạng hợp chất là
A. Na3AlF6. B. NaF. C. HF. D. CaF2.
Câu 39: Hydrohalic acid nào sau đây có tính acid mạnh nhất?
A. HI. B. HF. C. HCl. D. HBr.
Câu 40: Trong nhóm halogen, từ fluorine đến iodine, bán kính nguyên tử biến đổi như thế nào?
A. Giảm dần. B. Không đổi. C. Tăng dần. D. Tuần hoàn.
Câu 41 Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy biến đổi như thế nào?
A. Giảm dần. B. Tăng dần. C. Không đổi. D. Tuần hoàn.
Câu 42: Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là
A. F2. B. Cl2. C. Br2. D. I2.
Câu 43: Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây?
A. Nhường 1 electron. B. Nhận 1 electron. C. Nhường 7 electron. D. Góp chung 1 electron.
Câu 44: Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối?
A. NaOH. B. HCl. C. AgNO3. D. KNO3.
Câu 45: KBr thể hiện tính khử khi đun nóng với dung dịch nào sau đây?
A. AgNO3. B. H2SO4 đặc. C. HCl. D. H2SO4 loãng.
II. Tự luận
Câu 1: Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng 10-4–10-3mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
a. X là hydrochloric acid.
b. Khi nồng độ của X trong dạ dày vượt mức 0,001 mol/L sẽ dẫn tới tình trạng thừa acid.
c. Người ta thường dùng NaHCO3 để làm giảm cơn đau dạ dày.
d. X là hydrogen chloride.
Câu 2: Cho sơ đồ phản ứng sau (với x, y, z, t, m, n, p là các số nguyên tối giản của nhau):
xFeSO4 + yK2Cr2O7 + zH2SO4 \( \to \) tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
Hòa tan 25,02 gam FeSO4.7H2O trong dung dịch H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X tác dụng với lượng vừa đủ với V mL dung dịch K2Cr2O7 1,47% (D=1,25 g/mL). Cho các nhận định sau:
a) Giá trị \(\frac{x}{y} = 6.\)
b) Giá trị của V là 240.
c) Khối lượng K2Cr2O7 tham gia vừa đủ phản ứng là 4,41 gam.
d) Trong phản ứng trên, H2SO4 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò chất khử.
Câu 3: Thực hiện phản ứng: 2ICl + H2\( \to \)I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
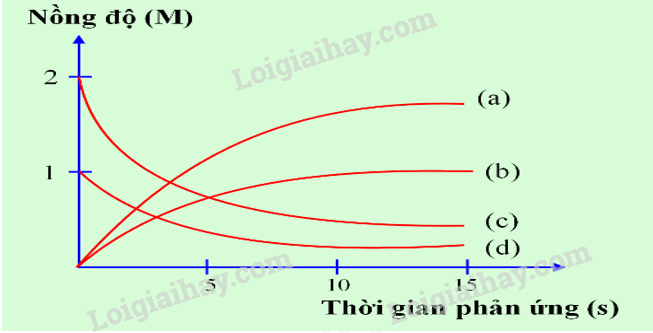
a. Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi I2.
b. Trong quá trình phản ứng nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
c. Đường (b) nồng độ I2 thay đổi theo thời gian: nồng độ tăng dần.
d. Đường (c) nồng độ ICl thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi H2.
Câu trả lời ngắn
Câu 1: Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
(1) NH3 + O2 \( \to \) NO + H2O (2) SO2 + Br2 + H2O \( \to \) H2SO4 + HBr
Câu 2: Tính biến thiên enthalpy của các phản ứng sau:
1. CaCO3(s) \( \to \)CaO(s) + CO2(g)
Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là –1207, –635 và –393,5.
2. CO(g) + H2O(g) \( \to \)CO2(g) + H2(g)
Biết nhiệt tạo thành (kJ/mol) của CO(g), H2O(g) và CO2 lần lượt là –110,5; –241,8 và –393,5.
Câu 3: Ở 225 ℃, khí NO2 và O2 có phản ứng sau: 2NO(g) + O2 (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NO2 (g)
a. Viết biểu thức tốc độ phản ứng.
b. Cho biết tốc độ phản ứng sẽ thay đổi như thế nào nếu:
- Tăng nồng độ NO lên 2 lần. - Giảm nồng độ O2 đi 3 lần. - Tăng nồng độ NO2 lên 2 lần.
Câu 4: Khi nhiệt độ phòng là 25 oC, cho 10g đá vôi (dạng viên) vào cốc đựng 100 gam dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút. Lặp lại thí nghiệm khi nhiệt độ phòng là 35 oC. Kết quả thí nghiệm được ghi lại trong bảng sau:
|
STT |
Nhiệt độ (oC) |
Khối lượng cốc (g) |
|
|
Thời điểm đầu |
Sau 1 phút |
||
|
1 |
25 |
235,40 |
235,13 |
|
2 |
35 |
235,78 |
235,21 |
a. Tính hệ số nhiệt độ của phản ứng.
b. Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 gam. Thực hiện thí nghiệm ở 45oC. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu? (Bỏ qua khối lượng nước bay hơi).
Câu 5: Dẫn khí chlorine (dư) vào 200 gam dung dịch potassium bromide. Sau khi phản ứng hoàn toàn khối lượng muối tạo thành nhỏ hơn khối lượng muối ban đầu là 4,45 gam. Tính nồng độ phần trăm potassium bromide trong dung dịch ban đầu.
Tiêu chuẩn quốc gia GB 14880 – 1994 quy định hàm lượng iodine có trong muối iodine là từ 20 – 60 mg/kg. Để kiểm tra hàm lượng potassium iodide trong muối ăn có đạt tiêu chuẩn hay không có thể sử dụng phản ứng sau: KIO3 + KI + H2SO4 → K2SO4 + I2 + H2O.
Nếu cần tạo ra 0,3 mol iodine thì khối lượng muối KIO3 cần dùng là bao nhiêu gam? (Cho biết NTK: K=39, I=127, O=16) (Làm tròn kết quả đến hàng phần mười)
Câu 6: Cần bao nhiêu gam KMnO4 tác dụng hết với dung dịch axit HCl để điều chế đủ khí chlorine tác dụng với iron tạo ra 16,25 gam FeCl3?
Lời giải chi tiết
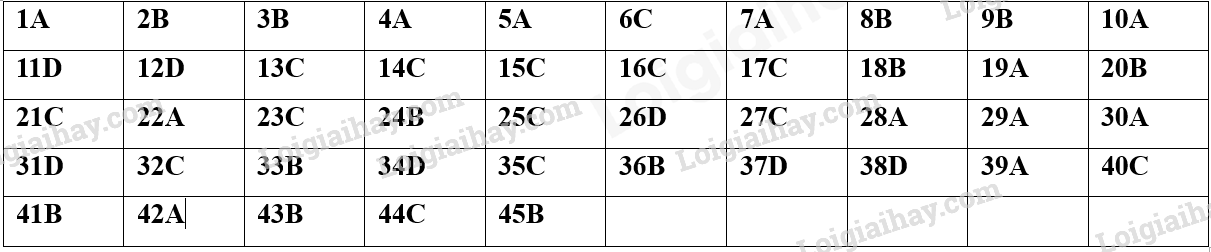
I. Phần trắc nghiệm
II. Phần tự luận
Câu 1: Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng 10-4–10-3mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
a. X là hydrochloric acid.
b. Khi nồng độ của X trong dạ dày vượt mức 0,001 mol/L sẽ dẫn tới tình trạng thừa acid.
c. Người ta thường dùng NaHCO3 để làm giảm cơn đau dạ dày.
d. X là hydrogen chloride.
Lời giải chi tiết
a) đúng
b) đúng
c) đúng
d) đúng
Câu 2: Cho sơ đồ phản ứng sau (với x, y, z, t, m, n, p là các số nguyên tối giản của nhau):
xFeSO4 + yK2Cr2O7 + zH2SO4 \( \to \) tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
Hòa tan 25,02 gam FeSO4.7H2O trong dung dịch H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X tác dụng với lượng vừa đủ với V mL dung dịch K2Cr2O7 1,47% (D=1,25 g/mL). Cho các nhận định sau:
a) Giá trị \(\frac{x}{y} = 6.\)
b) Giá trị của V là 240.
c) Khối lượng K2Cr2O7 tham gia vừa đủ phản ứng là 4,41 gam.
d) Trong phản ứng trên, H2SO4 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò chất khử.
Lời giải chi tiết
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x3}}\\C{r^{ + 6}} + 3{\rm{e}} \to C{r^{ + 3}}|x1\end{array}\)
6FeSO4 + K2Cr2O7 + 7H2SO4 \( \to \) Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
n FeSO4.7H2O = \(\frac{{25,02}}{{278}} = 0,09mol\)
theo phương trình => 6. n K2Cr2O7 = n FeSO4 => n K2Cr2O7 = 0,015 mol
V K2Cr2O7 = \(\frac{{0,015.294}}{{1,25}}:1,47\% = 240mL\)
=> (a) đúng
(b) đúng
(c) đúng, m K2Cr2O7 = 0,015.294 = 4,41g
(d) sai, H2SO4 đóng vai trò là môi trường
Câu 3: Thực hiện phản ứng: 2ICl + H2\( \to \)I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:

a. Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi I2.
b. Trong quá trình phản ứng nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
c. Đường (b) nồng độ I2 thay đổi theo thời gian: nồng độ tăng dần.
d. Đường (c) nồng độ ICl thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi H2.
Lời giải chi tiết
a) đúng
b) sai, ICl và H2 là chất tham gia nên quá trình phản ứng nồng độ sẽ giảm dần
c) đúng
d) đúng
Câu trả lời ngắn
Câu 1: Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
(1) NH3 + O2 \( \to \) NO + H2O (2) SO2 + Br2 + H2O \( \to \) H2SO4 + HBr
Lời giải chi tiết
(1)
\(\begin{array}{l}{N^{ - 3}} \to {N^{ + 2}} + 5{\rm{e|x4}}\\2{O^o} + 4e \to 2{O^{ - 2}}|x5\\4N{H_3} + 5{O_2} \to 4NO + 6{H_2}{\rm{O}}\end{array}\)
(2)
\(\begin{array}{l}{S^{ + 4}} \to {S^{ + 6}} + 2e|x1\\2B{r^o} + 2{\rm{e}} \to 2B{r^{ - 1}}|x1\\S{O_2} + B{r_2} + 2{H_2}{\rm{O}} \to {H_2}{\rm{S}}{O_4} + 2HBr\end{array}\)
Câu 2: Tính biến thiên enthalpy của các phản ứng sau:
1. CaCO3(s) \( \to \)CaO(s) + CO2(g)
Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là –1207, –635 và –393,5.
Phương pháp giải
Dựa vào công thức tính biến thiên enthalpy của phản ứng
Lời giải chi tiết
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(CaO) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) = - 635 + ( - 393,5) - ( - 1207) = 178,5kJ\)
2. CO(g) + H2O(g) \( \to \)CO2(g) + H2(g)
Biết nhiệt tạo thành (kJ/mol) của CO(g), H2O(g) và CO2 lần lượt là –110,5; –241,8 và –393,5.
Lời giải chi tiết
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o({H_2}) - {\Delta _f}H_{298}^o(CO) - {\Delta _f}H_{298}^o({H_2}{\rm{O}})\\ = - 293,5 + 0 - ( - 110,5) - ( - 241,8)\\ = 58,8kJ\end{array}\)
Câu 3: Ở 225 ℃, khí NO2 và O2 có phản ứng sau: 2NO(g) + O2 (g) ⇄ 2NO2 (g)
a. Viết biểu thức tốc độ phản ứng.
b. Cho biết tốc độ phản ứng sẽ thay đổi như thế nào nếu:
- Tăng nồng độ NO lên 2 lần. - Giảm nồng độ O2 đi 3 lần. - Tăng nồng độ NO2 lên 2 lần.
Phương pháp giải
Dựa vào biểu thức tốc độ phản ứng theo hằng số k và nồng độ các chất tham gia
Lời giải chi tiết
v= k.[NO]2.[O2]1.
b.
- Khi tăng nồng độ NO lên 2 lần thì tốc độ phản ứng tăng 4 lần
- Khi giảm nồng độ O2 3 lần thì tốc độ phản ứng giảm 3 lần
- Khi tăng nồng độ NO2 lên 2 lần thì tốc độ phản ứng không đổi.
Câu 4: Khi nhiệt độ phòng là 25 oC, cho 10g đá vôi (dạng viên) vào cốc đựng 100 gam dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút. Lặp lại thí nghiệm khi nhiệt độ phòng là 35 oC. Kết quả thí nghiệm được ghi lại trong bảng sau:
|
STT |
Nhiệt độ (oC) |
Khối lượng cốc (g) |
|
|
Thời điểm đầu |
Sau 1 phút |
||
|
1 |
25 |
235,40 |
235,13 |
|
2 |
35 |
235,78 |
235,21 |
a. Tính hệ số nhiệt độ của phản ứng.
b. Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 gam. Thực hiện thí nghiệm ở 45oC. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu? (Bỏ qua khối lượng nước bay hơi).
Lời giải chi tiết
Tốc độ phản ứng ở nhiệt độ 25oC= \(\frac{{235,40 - 235,13}}{1} = 0,27g/phut\)
Tốc độ phản ứng ở nhiệt độ 35oC = \(\frac{{235,78 - 235,21}}{1} = 0,57g/phut\)
a. Hệ số nhiệt độ phản ứng : \(\gamma = \frac{{0,57}}{{0,27}} = 2,11\)
b. Tốc độ phản ứng ở 45oC là: \(\gamma .{v_{{{35}^o}}}\)= 2,11.0,57 = 1,203 g/phút
Khối lượng cốc là: 1,20 = \(\frac{{235,40 - x}}{1}\)=> x = 234,20g
Câu 5: Dẫn khí chlorine (dư) vào 200 gam dung dịch potassium bromide. Sau khi phản ứng hoàn toàn khối lượng muối tạo thành nhỏ hơn khối lượng muối ban đầu là 4,45 gam. Tính nồng độ phần trăm potassium bromide trong dung dịch ban đầu.
Tiêu chuẩn quốc gia GB 14880 – 1994 quy định hàm lượng iodine có trong muối iodine là từ 20 – 60 mg/kg. Để kiểm tra hàm lượng potassium iodide trong muối ăn có đạt tiêu chuẩn hay không có thể sử dụng phản ứng sau: KIO3 + KI + H2SO4 → K2SO4 + I2 + H2O.
Nếu cần tạo ra 0,3 mol iodine thì khối lượng muối KIO3 cần dùng là bao nhiêu gam? (Cho biết NTK: K=39, I=127, O=16) (Làm tròn kết quả đến hàng phần mười)
Lời giải chi tiết
KIO3 + 5KI + 3H2SO4 → 3K2SO4 + 3I2 + 3H2O
0,1 mol ← 0,3 mol
\({m_{KI{O_{_3}}}} = 0,1.(39 + 127 + 16.3) = 21,4gam\)
Câu 6: Cần bao nhiêu gam KMnO4 tác dụng hết với dung dịch acid HCl để điều chế đủ khí chlorine tác dụng với iron tạo ra 16,25 gam FeCl3?
Lời giải chi tiết
n FeCl3 = \(\frac{{16,25}}{{162,5}} = 0,1mol\)
\(2KMn{O_4} + 16HCl \to 2KCl + MnC{l_2} + 5C{l_2} + 8{H_2}{\rm{O}}\)
0,06 0,15
2Fe + 3Cl2 --> 2FeCl3
0,15 0,1
m KMnO4 = 0,06 .158 = 9,48g
- Đề thi học kì 2 Hóa học 10 Kết nối tri thức - Đề 1
- Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề 2
- Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề 3
- Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề 4
- Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề 5
>> Xem thêm
Luyện Bài Tập Trắc nghiệm Hóa 10 - Kết nối tri thức - Xem ngay












Danh sách bình luận