Đề thi giữa kì 1 Hóa 10 Kết nối tri thức - Đề số 12
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
Đề bài
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
-
A.
f
-
B.
d
-
C.
s
-
D.
p
Theo mô hình nguyên tử hiện đại
-
A.
các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
-
B.
orbital nguyên tử kà khu vực không gian xung quanh hạt nhân.
-
C.
các electron chuyển động trên những quỹ đạo tròn hay bầu dục xung quanh hạt nhân.
-
D.
các electron chuyển động rất nhanh cách xa hạt nhân.
Nguyên tử nguyên tố X có tổng số hạt là 28; trong đó hạt mang điện ở hạt nhân ít hơn hạt
không mang điện là 1 hạt. Cho các phát biểu sau:
(a) Nguyên tử X có 5 electron ở lớp ngoài cùng.
(b) Nguyên tử X có 3 electron độc thân.
(c) Tổng số electron trên phân lớp s là 4.
(d) Nguyên tố X là phi kim
Số phát biểu đúng là
-
A.
3
-
B.
2
-
C.
1
-
D.
4
Tổng số electron trong ion \(AB_4^{3 - }\)là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số proton của nguyên tử A, B lần lượt là
-
A.
16 và 7
-
B.
7 và 16
-
C.
15 và 8
-
D.
8 và 15.
Cấu hình electron nguyên tử của X là 1s22s22p63s23p3. Phát biểu nào sau đây sai?
-
A.
Lớp L có 8 electron.
-
B.
Lớp M có 5 electron.
-
C.
Lớp K có 2 electron
-
D.
Lớp ngoài cùng có 3 electron.
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
-
A.
0
-
B.
1
-
C.
2
-
D.
5
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s22s22p63s2 Z: 1s22s22p63s23p63d54s2
Y: 1s22s22p63s23p5 R: 1s22s22p6
Các nguyên tố kim loại là
-
A.
X, Y, Z
-
B.
X, Z
-
C.
X, Z, R
-
D.
X, Y, R.
Đồng có hai đồng vị bền trong tự nhiên là và . Nguyên tử khối trung bình của đồng là 63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
-
A.
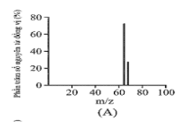
-
B.
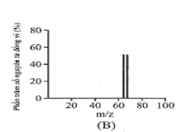
-
C.
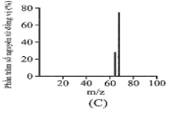
-
D.
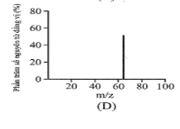
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số hạt mang điện trong hai hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là
-
A.
chu kì 3 và các nhóm IA và IIA
-
B.
chu kì 2 và các nhóm IA và IIA.
-
C.
chu kì 3 và các nhóm IIIA và IVA
-
D.
chu kì 3 và các nhóm IIA và IIIA.
Hòa tan 0,03 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IA (MX < MY) vào H2O thì thu được 0,02479 lít khí H2 (đkc). X và Y lần lượt là
-
A.
Li và Na
-
B.
K và Rb
-
C.
Na và K
-
D.
Rb và Cs.
Phát biểu nào sau đây sai?
-
A.
Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
-
B.
Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
-
C.
Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng
-
D.
Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
X được dùng làm chất bản dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử X là:
-
A.
1s22s22p5.
-
B.
1s22s22p6.
-
C.
1s22s22p63s23p2.
-
D.
1s22s22p63s1.
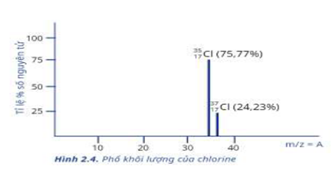
Trong tự nhiên chlorine có hai đồng vị bền: \(_{17}^{37}Cl\) chiếm 24,23% tổng số nguyên tử, còn lại là \(_{17}^{35}Cl\). Thành phần % theo khối lượng của đồng vị \(^{37}Cl\) trong HClO4 là
-
A.
8,43%
-
B.
8,79%
-
C.
8,92%
-
D.
8,56%
. Cho các phát biểu sau:
(1) Chỉ có nguyên tử magnesium mới có tỉ lệ số proton và neutron là 1:1
(2) Nguyên tử aluminum có 3 lớp electron.
(3) Nguyên tử khối là khối lượng tương đối của nguyên tử.
(4) Hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)khác nhau về số electron.
(5) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ nguyên tử.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Gali (Z=31) được Boisbaudran phát hiện năm 1875, ông gọi là nguyên tố “gallia” theo tên cổ xưa của nước Pháp, quê hương ông. Ga có 2 đồng vị với số neutron lần lượt là 38 và 40, có nguyên tử khối trung bình là 69,798. Phần trăm số nguyên tử của đồng vị Ga có số khối nhỏ là
-
A.
39,9%
-
B.
60,1%
-
C.
59,4%
-
D.
40,6%
Trong 5 nguyên tử \(_{17}^{35}X,_{16}^{34}Y,_8^{16}Z,_{34}^{80}T,_8^{17}R\)cặp nguyên tử nào là đồng vị của nhau?
-
A.
X và R
-
B.
Y và Z
-
C.
Y và T
-
D.
Z và R
Nguyên tố R có Z = 25, vị trí của R trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm VIIA
-
B.
chu kì 4, nhóm VB
-
C.
chu kì 4, nhóm IIA
-
D.
chu kì 4, nhóm VIIB.
Electron thuộc lớp nào liên kết chặt chẽ với hạt nhân nhất?
-
A.
Lớp N
-
B.
Lớp L
-
C.
Lớp M
-
D.
Lớp K
X và Y (ZX < ZY) là hai kim loại thuộc cùng nhóm A, ở hai chu kì liên tiếp. Biết ZX + ZY = 32.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Cho 3 nguyên tố: \(_8^{16}X,_6^{16}Y,_9^{18}Z,_9^{19}T\)
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
Cho kí hiệu nguyên tố: \(_{24}^{52}X\)
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d44s2
X là kim loại.
Chọn phát biểu đúng, sai
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns2np6.
Lời giải và đáp án
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
-
A.
f
-
B.
d
-
C.
s
-
D.
p
Đáp án : C
Dựa vào lớp và phân lớp.
Các nguyên tố nhóm IIA thuộc khối các nguyên tố s trong bảng tuần hoàn.
Đáp án C
Theo mô hình nguyên tử hiện đại
-
A.
các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
-
B.
orbital nguyên tử kà khu vực không gian xung quanh hạt nhân.
-
C.
các electron chuyển động trên những quỹ đạo tròn hay bầu dục xung quanh hạt nhân.
-
D.
các electron chuyển động rất nhanh cách xa hạt nhân.
Đáp án : A
Dựa vào mô hình nguyên tử của Ruther – Bohr.
Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
Đáp án A
Nguyên tử nguyên tố X có tổng số hạt là 28; trong đó hạt mang điện ở hạt nhân ít hơn hạt
không mang điện là 1 hạt. Cho các phát biểu sau:
(a) Nguyên tử X có 5 electron ở lớp ngoài cùng.
(b) Nguyên tử X có 3 electron độc thân.
(c) Tổng số electron trên phân lớp s là 4.
(d) Nguyên tố X là phi kim
Số phát biểu đúng là
-
A.
3
-
B.
2
-
C.
1
-
D.
4
Đáp án : B
Dựa vào cấu hình electron X.
Ta có: P + N + E = 28
N – P = 1
\( \to \)P = E = 9; N = 10.
Cấu hình electron của X là: 1s22s22p5
a. sai, nguyên tử X có 7 electron ở lớp ngoài cùng.
b. sai, nguyên tử X có 1 electron độc thân.
c. đúng
d. đúng
Đáp án B
Tổng số electron trong ion \(AB_4^{3 - }\)là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số proton của nguyên tử A, B lần lượt là
-
A.
16 và 7
-
B.
7 và 16
-
C.
15 và 8
-
D.
8 và 15.
Đáp án : C
Dựa vào thành phần nguyên tử.
Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22:
2PA – PB = 22
Tổng số electron trong ion \(AB_4^{3 - }\)là: EA + 4.EB + 3 = 50
Và P = E
Giải hệ phương trình: \(\left\{ \begin{array}{l}2{P_A} - {P_B} = 22\\{E_{\rm{A}}} + 4{{\rm{E}}_B} + 3 = 50\\P = E\end{array} \right. \to \left\{ \begin{array}{l}{P_A} = 15\\{P_B} = 8\end{array} \right.\)
Đáp án C
Cấu hình electron nguyên tử của X là 1s22s22p63s23p3. Phát biểu nào sau đây sai?
-
A.
Lớp L có 8 electron.
-
B.
Lớp M có 5 electron.
-
C.
Lớp K có 2 electron
-
D.
Lớp ngoài cùng có 3 electron.
Đáp án : D
Dựa vào cấu hình electron nguyên tử của X.
Lớp K có 2 electron
Lớp L có 8 electron
Lớp M có 5 electron
Đáp án D
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
-
A.
0
-
B.
1
-
C.
2
-
D.
5
Đáp án : B
Dựa vào orbital nguyên tử.
5 electron được điều vào 3AO thì số lượng electron độc thân là 1.
Đáp án B
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s22s22p63s2 Z: 1s22s22p63s23p63d54s2
Y: 1s22s22p63s23p5 R: 1s22s22p6
Các nguyên tố kim loại là
-
A.
X, Y, Z
-
B.
X, Z
-
C.
X, Z, R
-
D.
X, Y, R.
Đáp án : B
Số electron hóa trị 1,2,3 thường là kim loại.
X, Z có 2 electron hóa trị nên là kim loại.
Đáp án B
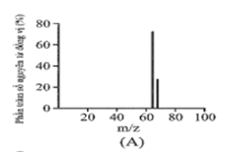
Đồng có hai đồng vị bền trong tự nhiên là và . Nguyên tử khối trung bình của đồng là 63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
-
A.

-
B.

-
C.

-
D.

Đáp án : A
Dựa vào phổ khối.
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số hạt mang điện trong hai hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là
-
A.
chu kì 3 và các nhóm IA và IIA
-
B.
chu kì 2 và các nhóm IA và IIA.
-
C.
chu kì 3 và các nhóm IIIA và IVA
-
D.
chu kì 3 và các nhóm IIA và IIIA.
Đáp án : D
Dựa vào cấu tạo bảng tuần hoàn.
Vì X và Y đứng kế tiếp nhau trong một chu kì nên: ZY – ZX = 1
Tổng số hạt mang điện trong hai hạt nhân là: PX + PY = 25
Giải hệ phương trình \(\left\{ \begin{array}{l}{P_{\rm{X}}} + {P_Y} = 25\\ - {P_{\rm{X}}} + {P_Y} = 1\end{array} \right. \to \left\{ \begin{array}{l}{P_{\rm{X}}} = 12\\{P_Y} = 13\end{array} \right.\)
X và Y thuộc chu kì 3 và các nhóm IIA và IIIA.
Đáp án D
Hòa tan 0,03 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IA (MX < MY) vào H2O thì thu được 0,02479 lít khí H2 (đkc). X và Y lần lượt là
-
A.
Li và Na
-
B.
K và Rb
-
C.
Na và K
-
D.
Rb và Cs.
Đáp án : A
Dựa vào tính chất hóa học của nhóm IA.
Gọi R là nguyên tố tổng quát.
n H2 = 0,02479 : 24,79 = 0,001 mol
R + H2O \( \to \)ROH + ½ H2
0,002 \( \leftarrow \) 0,001
\({\bar M_R} = \frac{{0,03}}{{0,002}} = 15\)
MX < \({\bar M_R}\)< MY \( \to \)X là Li, Y là Na
Đáp án A
Phát biểu nào sau đây sai?
-
A.
Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
-
B.
Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
-
C.
Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng
-
D.
Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
Đáp án : A
Dựa vào cấu tạo của bảng tuần hoàn.
A sai, vì He thuộc nhóm VIIIA nhưng có 2 electron lớp ngoài cùng.
Đáp án A
X được dùng làm chất bản dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử X là:
-
A.
1s22s22p5.
-
B.
1s22s22p6.
-
C.
1s22s22p63s23p2.
-
D.
1s22s22p63s1.
Đáp án : C
Dựa vào cấu hình electron của X.
Cấu hình của nguyên tử X là: 1s22s22p63s23p2.
Đáp án C
Trong tự nhiên chlorine có hai đồng vị bền: \(_{17}^{37}Cl\) chiếm 24,23% tổng số nguyên tử, còn lại là \(_{17}^{35}Cl\). Thành phần % theo khối lượng của đồng vị \(^{37}Cl\) trong HClO4 là
-
A.
8,43%
-
B.
8,79%
-
C.
8,92%
-
D.
8,56%
Đáp án : C
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Cl}} = \frac{{37.24,23\% + 35.(100 - 24,23)}}{{100}} = 35,4846\)
%\(^{37}Cl\) trong HClO4 là: \(\frac{{37.24,23\% }}{{1 + 35,4846 + 16.4}}.100 = 8,92\% \)
. Cho các phát biểu sau:
(1) Chỉ có nguyên tử magnesium mới có tỉ lệ số proton và neutron là 1:1
(2) Nguyên tử aluminum có 3 lớp electron.
(3) Nguyên tử khối là khối lượng tương đối của nguyên tử.
(4) Hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)khác nhau về số electron.
(5) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ nguyên tử.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : A
Dựa vào thành phần nguyên tử.
(1) sai, calcium có tỉ lệ số proton và neutron là 1:1
(2) đúng
(3) đúng
(4) sai, hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)có cùng số electron.
(5) sai, khối lượng nguyên tử tập trung ở hạt nhân.
Đáp án A
Gali (Z=31) được Boisbaudran phát hiện năm 1875, ông gọi là nguyên tố “gallia” theo tên cổ xưa của nước Pháp, quê hương ông. Ga có 2 đồng vị với số neutron lần lượt là 38 và 40, có nguyên tử khối trung bình là 69,798. Phần trăm số nguyên tử của đồng vị Ga có số khối nhỏ là
-
A.
39,9%
-
B.
60,1%
-
C.
59,4%
-
D.
40,6%
Đáp án : B
Dựa vào công thức tính nguyên tử khối trung bình.
Gọi % đồng vị của 69Ga và 71Ga lần lượt là a và 100 – a.
\({\bar A_{Ga}} = \frac{{69.a + 71.(100 - a)}}{{100}} = 69,798 \to a = 60,1\% \)
Đáp án B
Trong 5 nguyên tử \(_{17}^{35}X,_{16}^{34}Y,_8^{16}Z,_{34}^{80}T,_8^{17}R\)cặp nguyên tử nào là đồng vị của nhau?
-
A.
X và R
-
B.
Y và Z
-
C.
Y và T
-
D.
Z và R
Đáp án : D
Đồng vị là các nguyên tố có cùng số proton khác nhau số khối.
Z và R có cùng số proton khác nhau về số khối.
Đáp án D
Nguyên tố R có Z = 25, vị trí của R trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm VIIA
-
B.
chu kì 4, nhóm VB
-
C.
chu kì 4, nhóm IIA
-
D.
chu kì 4, nhóm VIIB.
Đáp án : D
Dựa vào cấu tạo của bảng tuần hoàn.
Cấu hình electron R là: 1s22s22p63s23p63d54s2
R thuộc chu kì 4, nhóm VIIB.
Đáp án D
Electron thuộc lớp nào liên kết chặt chẽ với hạt nhân nhất?
-
A.
Lớp N
-
B.
Lớp L
-
C.
Lớp M
-
D.
Lớp K
Đáp án : D
Các lớp càng gần hạt nhân càng liên kết chặt chẽ.
Lớp K gần hạt nhân nhất nên liên kết chặt chẽ nhất.
Đáp án D
X và Y (ZX < ZY) là hai kim loại thuộc cùng nhóm A, ở hai chu kì liên tiếp. Biết ZX + ZY = 32.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Xác định ZX; ZY.
Ta có: \(\left\{ \begin{array}{l}{Z_Y} - {Z_X} = 1\\{Z_{\rm{X}}} + {Z_Y} = 32\end{array} \right.(L)\) hoặc \(\left\{ \begin{array}{l}{Z_Y} - {Z_X} = 8\\{Z_{\rm{X}}} + {Z_Y} = 32\end{array} \right. \to \left\{ \begin{array}{l}{Z_Y} = 20\\{Z_X} = 12\end{array} \right.(TM)\)
a. đúng
b. sai, tính kim loại của Y mạnh hơn X.
c. đúng
d. đúng
Cho 3 nguyên tố: \(_8^{16}X,_6^{16}Y,_9^{18}Z,_9^{19}T\)
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
Dựa vào nguyên tố hóa học.
a. Sai, vì X và Y không thuộc cùng nguyên tố hóa học.
b. đúng
c. đúng, X, Y, Z là nguyên tố hóa học
d. đúng
Cho kí hiệu nguyên tố: \(_{24}^{52}X\)
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d44s2
X là kim loại.
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d44s2
X là kim loại.
Dựa vào kí hiệu nguyên tố hóa học.
a. đúng, tổng số hạt mang điện của X là 48, hạt không mang điện là 28.
b. đúng
c. sai, cấu hình electron của X là [Ar]3d54s1
d. đúng
Chọn phát biểu đúng, sai
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns2np6.
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns2np6.
Dựa vào lớp và phân lớp.
a. sai, vì He có 2 electron lớp ngoài cùng nhưng thuộc khí hiếm.
b. đúng
c. sai, lớp K có mức năng lượng thấp nhất.
d. sai, He có cấu hình 1s22s2
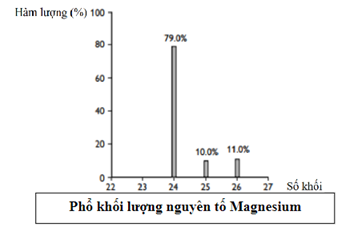
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Mg}} = \frac{{24.79 + 25.10 + 26.11}}{{100}} = 24,32\)
Số mol của 25Mg = \(\frac{{5,{{418.10}^{22}}}}{{6,{{02.10}^{23}}}} = 0,09mol\)
Số mol của MgCO3 = 0,09:10% = 0,9 mol
Khối lượng MgCO3 = 0,9.84,32 = 75,888 \( \approx \)76
\({\bar A_{Cl}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,4846\)
n NaCl = 0,1.0,2 = 0,02 mol
m NaCl = 0,02.(58 + 35,4846) = 1,88g
Đáp án 1,88
Theo dữ kiện đề bài ta có:
2(2ZM + NM) + 2ZO + NO =140 => 4ZM + 2NM + 2.8 + 8 = 140 (1)
=>4ZM + 2.8 – (2NM + 8) = 44 (2)
Giải hệ (1) và (2) => ZM = 19 (K), NM = 20.
Công thức M2O: K2O
dđĩa =7,8 µm; dHe = 0,62 Å = 0,62.10-4 µm
=>Số nguyên tử He) sắp xếp thẳng hàng và khít nhau = \(\frac{{7,8}}{{0,{{62.10}^{ - 4}}}}\)≈ 125806 nguyên tử.
Nếu hình dung nguyên tử như một khối cầu
I. Trắc nghiệm
I. Trắc nghiệm
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
Câu 1: Nhận định nào sau đây là không đúng ? A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, neutron.
Trong nguyên tử, hạt mang điện là A. proton và neutron. B. proton và electron. C. electron. D. electron và neutron
Hình ảnh dưới đây mô tả thí nghiệm chứng minh nguyên tử có cấu tạo rỗng. Hiện tượng nào chứng tỏ điều đó?
Nhóm A bao gồm các nguyên tố: A. Nguyên tố s. B. Nguyên tố p. C. Nguyên tố d và nguyên tố f. D. Nguyên tố s và nguyên tố p.
Câu 1. Số thứ tự ô nguyên tố không cho biết: A. số proton trong hạt nhân. B. số neutron trong hạt nhân. C. số hiệu nguyên tử. D. số electron ở lớp vỏ.
Nhận định nào sau đây đúng khi nói về 3 nguyên tử. Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số elctron độc thân của M là:
Chu kì là dãy nguyên tố mà nguyên tử của chúng có cùng: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p6. Số hiệu nguyên tử của X là: Nguyên tử R có phân mức năng lượng cao nhất (ở trạng thái cơ bản) là 2p4. Tổng số hạt mang điện trong nguyên tử R là
Ở trạng thái cơ bản cấu hình electron nguyên tử nào sau đây là của phi kim? Có bao nhiêu electron tối đa ở lớp thứ 3 (lớp M) ? Số electron tối đa trong phân lớp d là
Ion (cation hoặc anion) hình thành khi nguyên tử nhường hoặc nhận electron. Anion Y2- có cấu hình e phân lớp ngoài cùng là 2p6. Số hiệu nguyên tử của Y là Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là
Số electron lớp ngoài cùng có trong nguyên tử silicon (Z = 14) là Số elctron tối đa trong lớp M là Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận