Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 9
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Đề bài
Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong cafe và trà được biểu diễn ở hình dưới
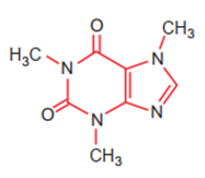
Nguyên tố N tạo nên cafein, có vị trí trong bảng tuần hoàn là
-
A.
ô số 6, chu kì 3, nhóm IIA.
-
B.
ô số 4, chu kì 2, nhóm VIA
-
C.
ô số 5, chu kì 4, nhóm IVA.
-
D.
ô số 7, chu kì 2, nhóm VA.
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường nhưng vật chất siêu lỏng này không có ma sát bò trên thành cốc và tự chảy ra ngoài.

Vị trí của helium trong bảng tuần hoàn hóa học thuộc
-
A.
nhóm VA, chu kỳ 4.
-
B.
nhóm IVA, chu kỳ 3.
-
C.
nhóm VIIIA, chu kỳ 1.
-
D.
nhóm VIIA, chu kỳ 2.
-
A.
1 electron.
-
B.
3 electron.
-
C.
4 electron.
-
D.
2 electron.
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
-
A.
một hay nhiều cặp electron dùng chung.
-
B.
sự cho-nhận electron.
-
C.
một electron chung.
-
D.
một cặp electron góp chung.
Cho các chất N2, H2, NH3, NaCl, HCl, H2O, số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
-
A.
3
-
B.
2
-
C.
5
-
D.
4
Liên kết hydrogen là loại liên kết hoá học được hình thành giữa các nguyên tử nào sau đây?
-
A.
Phi kim và hydrogen trong hai phân tử khác nhau.
-
B.
F,O,N,… có độ âm điện lớn, đồng thời có cặp electron hoá trị chưa liên kết và nguyên tử hydrogen linh động.
-
C.
Phi kim có độ âm điện lớn và nguyên tử hydrogen.
-
D.
Phi kim và hydrogen trong cùng một phân tử.
Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
-
A.
X có số thứ tự 17, chu kỳ 4, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
-
B.
X có số thứ tự 17, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
-
C.
X có số thứ tự 18, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 3, nhóm IIA
-
D.
X có số thứ tự 18, chu kỳ 3, nhóm VIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
-
A.
Kim loại X không khử được ion Cu2+ trong dung dịch.
-
B.
Hợp chất với oxygen của X có dạng X2O7.
-
C.
Trong nguyên tử nguyên tố X có 25 proton.
-
D.
Ở nhiệt độ thường X không khử được H2O.
Cation R3+ có cấu hình electron lớp ngoài cùng là 2p6. Công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của R và tính acid – base của chúng là
-
A.
R2O3, R(OH)3 (đều lưỡng tính)
-
B.
RO3 (acidic oxide), H2RO4 (acid)
-
C.
RO2 (acidic oxide), H2RO3 (acid)
-
D.
RO (basic oxide), R(OH)2 (base).
Nguyên tố phổ biến nhất trong vỏ trái đất là
-
A.
iron.
-
B.
silicon.
-
C.
aluminium.
-
D.
oxygen.
Liên kết ion được tạo thành giữa hai nguyên tử bằng
-
A.
một hay nhiều cặp electron dùng chung.
-
B.
một hay nhiều cặp electron dùng chung nhưng chỉ do một nguyên tử đóng góp.
-
C.
lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
-
D.
một hay nhiều cặp electron dùng chung và cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Nguyên tố X thuộc nhóm VIA của bảng tuần hoàn các nguyên tố hóa học. Công thức hợp chất khí với H của X là
-
A.
H4X.
-
B.
H3X.
-
C.
H2X.
-
D.
HX.
Hai ion X+ và Y- đều có cấu hình electron của khí hiếm Ar (Z=18). Cho các phát biểu sau:
(1) Số hạt mang điện của X nhiều hơn số hạt mang điên của Y là 4.
(2) Bán kính ion Y- lớn hơn bán kính ion X+.
(3) X ở chu kì 3, còn Y ở chu kì 4 trong bảng hệ thống tuần hoàn.
(4) Độ âm điện của X nhỏ hơn độ âm điện của Y.
(5) X thuộc loại nguyên tố p.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
-
A.
Quy tắc của Hund.
-
B.
Không vi phạm nguyên lí, quy tắc nào.
-
C.
Nguyên lí Pauli.
-
D.
Quy tắc Klechkovski.
Cho công thức hợp chất A như sau: HC≡C – CH2 = CH2. Số liên kết 𝛔 trong hợp chất A là
-
A.
5
-
B.
4
-
C.
6
-
D.
7
Tỉ lệ phần trăm số nguyên tử các đồng vị của Neon (Ne) được xác định theo phổ khối lượng sau:
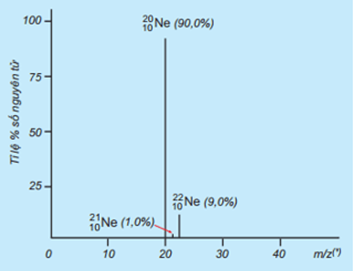
Giá trị nguyên tử khối trung bình của Ne là
-
A.
19,19.
-
B.
20,20.
-
C.
19,20.
-
D.
20,19.
Nguyên tố Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Cho biết chlorine là phi kim tại vì
-
A.
lớp ngoài cùng có 2 electron.
-
B.
lớp ngoài cùng có 7 electron.
-
C.
lớp ngoài cùng có 5 electron.
-
D.
lớp ngoài cùng có 6 electron.
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
-
A.
N2, HI, Cl2, CH4.
-
B.
N2, Cl2, H2, HCl.
-
C.
Cl2, O2, N2, F2.
-
D.
N2, CO2, Cl2, H2.
X,Y là hai nguyên tố thuộc nhóm A trong cùng một chu kì của bảng tuần hoàn. Oxide cao nhất của X,Y có dạng XO, YO3. Cho các phát biểu sau :
(a) X,Y thuộc 2 nhóm A kế tiếp nhau.
(b) X là kim loại,Y là phi kim.
(c) XO là basic oxide còn YO3 là acidic oxide
(d) Hydroxide cao nhất của X có dạng X(OH)2 và có tính base.
Electron của ion X- là 1s22s22p63s23p63d104s24p6. Cho các phát biểu sau:
(a) X ở ô 36, chu kỳ 4, VIIIA.
(b) Ion X- có 36 proton.
(c) X có tính phi kim.
(d) Bán kính ion X- nhỏ hơn bán kính của X.
Nguyên tố X tích luỹ trong các tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. Nguyên tử X chỉ có 7 electron trên phân lớp s; còn nguyên tử Z chỉ có 17 electron trên phân lớp p
(a) X là potassium
(b) Hợp chất tạo bởi X và Z chứa liên kết ion.
(c) Hợp chất tạo bởi X và Z có tính dẫn điện khi bị nóng chảy hoặc hòa tan trong nước
(d) Z thuộc nhóm VIA, chu kì 4.
Soudime ( 11Na) và Magienime (12Mg) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
a. Na và Mg đều có 3 electron hóa trị.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion.
Cho 6 nguyên tố có số hiệu nguyên tử lần lượt là 9, 11, 17, 18, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố phi kim?
Đáp án:
Có bao nhiêu hợp chất tạo được liên kết Hydrogen trong dãy các chất sau: NH3, HF, HCl, PH3, C2H5OH?
Đáp án:
Một nguyên tố tạo hợp chất khí với hydrogen có công thức RH3, được sử dụng để trung hoà các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn trong ngành công nghiệp dầu khí. Nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất. % khối lượng của nguyên tố R trong hợp chất khí với hydrogen là bao nhiêu ?
Đáp án:
Giả thiết trong tinh thể các nguyên tử Fe là những hình cầu chiếm 75% thể tích, phần còn lại là các khe rỗng giữa các quả cầu, cho nguyên tử khối Fe là 55,85 ở 20oC có khối lượng riêng của tinh thể Fe là 7,87g/cm3. Bán kính nguyên tử Fe là?
Đáp án:
Lời giải và đáp án
Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong cafe và trà được biểu diễn ở hình dưới

Nguyên tố N tạo nên cafein, có vị trí trong bảng tuần hoàn là
-
A.
ô số 6, chu kì 3, nhóm IIA.
-
B.
ô số 4, chu kì 2, nhóm VIA
-
C.
ô số 5, chu kì 4, nhóm IVA.
-
D.
ô số 7, chu kì 2, nhóm VA.
Đáp án : D
Dựa vào vị trí nguyên tố trong bảng tuần hoàn.
Nitrogen có 14 electron nên ở ô số 7, chu kì 2, nhóm VA.
Đáp án D
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường nhưng vật chất siêu lỏng này không có ma sát bò trên thành cốc và tự chảy ra ngoài.

Vị trí của helium trong bảng tuần hoàn hóa học thuộc
-
A.
nhóm VA, chu kỳ 4.
-
B.
nhóm IVA, chu kỳ 3.
-
C.
nhóm VIIIA, chu kỳ 1.
-
D.
nhóm VIIA, chu kỳ 2.
Đáp án : C
Dựa vào vị trí nguyên tố trong bảng tuần hoàn.
Helium có 2 electron và là khí hiếm nên ở nhóm VIIIA, chu kì 1.
Đáp án C
-
A.
1 electron.
-
B.
3 electron.
-
C.
4 electron.
-
D.
2 electron.
Đáp án : A
Dựa vào lớp, phân lớp.
Các nguyên tố trong hình đều thuộc nhóm IA nên có 1 electron lớp ngoài cùng.
Đáp án A
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
-
A.
một hay nhiều cặp electron dùng chung.
-
B.
sự cho-nhận electron.
-
C.
một electron chung.
-
D.
một cặp electron góp chung.
Đáp án : A
Dựa vào kiến thức về liên kết hóa học.
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Đáp án A
Cho các chất N2, H2, NH3, NaCl, HCl, H2O, số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
-
A.
3
-
B.
2
-
C.
5
-
D.
4
Đáp án : B
Dựa vào độ âm điện của nguyên tố.
N2, H2 chỉ chứa liên kết cộng hóa trị không phân cực.
Đáp án B
Liên kết hydrogen là loại liên kết hoá học được hình thành giữa các nguyên tử nào sau đây?
-
A.
Phi kim và hydrogen trong hai phân tử khác nhau.
-
B.
F,O,N,… có độ âm điện lớn, đồng thời có cặp electron hoá trị chưa liên kết và nguyên tử hydrogen linh động.
-
C.
Phi kim có độ âm điện lớn và nguyên tử hydrogen.
-
D.
Phi kim và hydrogen trong cùng một phân tử.
Đáp án : B
Dựa vào khái niệm về liên kết hydrogen.
Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động.
Đáp án B
Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
-
A.
X có số thứ tự 17, chu kỳ 4, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
-
B.
X có số thứ tự 17, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
-
C.
X có số thứ tự 18, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 3, nhóm IIA
-
D.
X có số thứ tự 18, chu kỳ 3, nhóm VIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
Đáp án : B
Dựa vào cấu hình electron.
Nguyên tử X đã nhận 1 electron để trở thành anion X- nên nguyên tử X có cấu hình lớp ngoài cùng là 3s23p5
Nguyên tử Y đã nhường 2 electron để trở thành cation Y2+ nên nguyên tử Y có cấu hình lớp ngoài cùng là 3s23p6 4s2
Vậy vị trí của X, Y trong bảng tuần hoàn lần lượt là:
X có số thứ tự 17, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
Đáp án B
Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
-
A.
Kim loại X không khử được ion Cu2+ trong dung dịch.
-
B.
Hợp chất với oxygen của X có dạng X2O7.
-
C.
Trong nguyên tử nguyên tố X có 25 proton.
-
D.
Ở nhiệt độ thường X không khử được H2O.
Đáp án : A
Dựa vào thành phần nguyên tử.
Vì nguyên tố X và Y cùng một chu kì nên có 2 TH:
TH1: Nếu X và Y thuộc chu kì nhỏ ta có:
\(\left\{ \begin{array}{l}{Z_X} + {Z_Y} = 51\\{Z_Y} - {Z_{\rm{X}}} = 3 - 2 = 1\end{array} \right. \to \left\{ \begin{array}{l}{Z_{\rm{X}}} = 25\\{Z_Y} = 26\end{array} \right.\)
Loại do X, Y thuộc nhóm IIA và IIIA.
TH2: Nếu X và Y thuộc cùng chu kì lớn ta có:
\(\left\{ \begin{array}{l}{Z_{\rm{X}}} + {Z_Y} = 51\\{Z_Y} - {Z_{\rm{X}}} = 3 - 1 + 10 = 11\end{array} \right. \to \left\{ \begin{array}{l}{Z_{\rm{X}}} = 20(Ca)\\{Z_Y} = 31(Ga)\end{array} \right.\)
A đúng: Vì Ca tan được trong nước tạo Ca(OH)2 nên không khử được ion Cu2+ trong dung dịch.
B sai, hợp chất oxide của X có dạng XO
C sai, trong nguyên tử nguyên tố X có 20 proton.
D sai, nhiệt độ thường X khử được nước.
Đáp án A
Cation R3+ có cấu hình electron lớp ngoài cùng là 2p6. Công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của R và tính acid – base của chúng là
-
A.
R2O3, R(OH)3 (đều lưỡng tính)
-
B.
RO3 (acidic oxide), H2RO4 (acid)
-
C.
RO2 (acidic oxide), H2RO3 (acid)
-
D.
RO (basic oxide), R(OH)2 (base).
Đáp án : A
Dựa vào xu hướng biến đổi hợp chất trong bảng tuần hoàn.
Nguyên tử R đã nhường 3 electron để thành cation R3+ nên R có cấu hình là 1s2 2s22p6 3s2 3p1
Vậy R là nguyên tố aluminium.
A. Đúng
B, C, D sai do hợp chất oxide của R có tính lưỡng tính.
Đáp án A
Nguyên tố phổ biến nhất trong vỏ trái đất là
-
A.
iron.
-
B.
silicon.
-
C.
aluminium.
-
D.
oxygen.
Đáp án : D
Dựa vào nguyên tố hóa học.
Nguyên tố phổ biến nhất trong vỏ Trái Đất là Oxygen.
Đáp án D
Liên kết ion được tạo thành giữa hai nguyên tử bằng
-
A.
một hay nhiều cặp electron dùng chung.
-
B.
một hay nhiều cặp electron dùng chung nhưng chỉ do một nguyên tử đóng góp.
-
C.
lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
-
D.
một hay nhiều cặp electron dùng chung và cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Đáp án : C
Dựa vào khái niệm liên kết ion.
Liên kết ion được tạo thành giữa hai nguyên tử bằng lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Nguyên tố X thuộc nhóm VIA của bảng tuần hoàn các nguyên tố hóa học. Công thức hợp chất khí với H của X là
-
A.
H4X.
-
B.
H3X.
-
C.
H2X.
-
D.
HX.
Đáp án : C
Dựa vào vị trí của nguyên tố X trong bảng tuần hoàn.
Vì X thuộc nhóm VIA nên hóa trị của X với H là 8 – 6 = 2, vậy công thức hợp chất khí với H của X là H2X.
Đáp án C
Hai ion X+ và Y- đều có cấu hình electron của khí hiếm Ar (Z=18). Cho các phát biểu sau:
(1) Số hạt mang điện của X nhiều hơn số hạt mang điên của Y là 4.
(2) Bán kính ion Y- lớn hơn bán kính ion X+.
(3) X ở chu kì 3, còn Y ở chu kì 4 trong bảng hệ thống tuần hoàn.
(4) Độ âm điện của X nhỏ hơn độ âm điện của Y.
(5) X thuộc loại nguyên tố p.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Dựa vào cấu hình electron của X và Y
X ( Z = 19): [Ar] 4s1; Y (Z=17): [Ne] 2s22p5
(1) đúng
(2) đúng
(3) Sai vì X thuộc chu kì 4, Y thuộc chu kì 3 trong bảng tuần hoàn
(4) đúng
(5) Sai vì X thuộc loại nguyên tố s
-
A.
Quy tắc của Hund.
-
B.
Không vi phạm nguyên lí, quy tắc nào.
-
C.
Nguyên lí Pauli.
-
D.
Quy tắc Klechkovski.
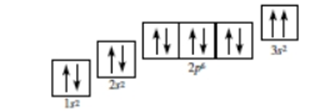
Đáp án : C
Dựa vào các nguyên tắc sắp xếp electron vào orbital.
Nguyên lí Pauli bị vi phạm ở 3s2, 2 spin trong cùng 1 ô sẽ trái dấu nhau.
Đáp án C
Cho công thức hợp chất A như sau: HC≡C – CH2 = CH2. Số liên kết 𝛔 trong hợp chất A là
-
A.
5
-
B.
4
-
C.
6
-
D.
7
Đáp án : C
Dựa vào các loại liên kết.
Liên kết 𝛔 được tạo thành từ sự xen phủ trục. Vậy trong hợp chất A có 6 liên kết 𝛔
Đáp án C
Tỉ lệ phần trăm số nguyên tử các đồng vị của Neon (Ne) được xác định theo phổ khối lượng sau:

Giá trị nguyên tử khối trung bình của Ne là
-
A.
19,19.
-
B.
20,20.
-
C.
19,20.
-
D.
20,19.
Đáp án : D
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Ne}} = \frac{{21.1 + 22.9 + 20.90}}{{100}} = 20,19\)
Đáp án D
Nguyên tố Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Cho biết chlorine là phi kim tại vì
-
A.
lớp ngoài cùng có 2 electron.
-
B.
lớp ngoài cùng có 7 electron.
-
C.
lớp ngoài cùng có 5 electron.
-
D.
lớp ngoài cùng có 6 electron.
Đáp án : B
Dựa vào cấu hình electron của Cl.
Chlorine là phi kim tại vì lớp ngoài cùng có 7 electron.
Đáp án B
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
-
A.
N2, HI, Cl2, CH4.
-
B.
N2, Cl2, H2, HCl.
-
C.
Cl2, O2, N2, F2.
-
D.
N2, CO2, Cl2, H2.
Đáp án : D
Dựa vào độ âm điện của nguyên tử.
N2, CO2, Cl2, H2 chỉ chứa liên kết cộng hóa trị không phân cực.
Đáp án D
X,Y là hai nguyên tố thuộc nhóm A trong cùng một chu kì của bảng tuần hoàn. Oxide cao nhất của X,Y có dạng XO, YO3. Cho các phát biểu sau :
(a) X,Y thuộc 2 nhóm A kế tiếp nhau.
(b) X là kim loại,Y là phi kim.
(c) XO là basic oxide còn YO3 là acidic oxide
(d) Hydroxide cao nhất của X có dạng X(OH)2 và có tính base.
(a) X,Y thuộc 2 nhóm A kế tiếp nhau.
(b) X là kim loại,Y là phi kim.
(c) XO là basic oxide còn YO3 là acidic oxide
(d) Hydroxide cao nhất của X có dạng X(OH)2 và có tính base.
Dựa vào oxide cao nhất của X,Y.
Vì oxide của X có dạng XO nên X ở nhóm IIA.
Oxide của Y có dạng YO3 nên Y ở nhóm VIA.
(a) sai, X,Y thuộc nhóm A không kế tiếp nhau
(b) đúng
(c) đúng
(d) đúng.
Electron của ion X- là 1s22s22p63s23p63d104s24p6. Cho các phát biểu sau:
(a) X ở ô 36, chu kỳ 4, VIIIA.
(b) Ion X- có 36 proton.
(c) X có tính phi kim.
(d) Bán kính ion X- nhỏ hơn bán kính của X.
(a) X ở ô 36, chu kỳ 4, VIIIA.
(b) Ion X- có 36 proton.
(c) X có tính phi kim.
(d) Bán kính ion X- nhỏ hơn bán kính của X.
Dựa vào cấu hình electron của ion X.
Ion X- có 36 electron nên X có 35 electron. Vậy X ô số 35 (bromine).
(a) sai, X ở ô số 35.
(b) sai, ion X- có 35 proton.
(c) đúng
(d) sai vì Khi nguyên tử biến thành anion, electron nhận thêm vào làm tăng tương tác đẩy electron – electron làm cho kích thước ion tăng thêm.
Nguyên tố X tích luỹ trong các tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. Nguyên tử X chỉ có 7 electron trên phân lớp s; còn nguyên tử Z chỉ có 17 electron trên phân lớp p
(a) X là potassium
(b) Hợp chất tạo bởi X và Z chứa liên kết ion.
(c) Hợp chất tạo bởi X và Z có tính dẫn điện khi bị nóng chảy hoặc hòa tan trong nước
(d) Z thuộc nhóm VIA, chu kì 4.
(a) X là potassium
(b) Hợp chất tạo bởi X và Z chứa liên kết ion.
(c) Hợp chất tạo bởi X và Z có tính dẫn điện khi bị nóng chảy hoặc hòa tan trong nước
(d) Z thuộc nhóm VIA, chu kì 4.
Dựa vào vị trí nguyên tố trong bảng tuần hoàn.
Cấu hình X là: 1s2 2s22p6 3s23p6 4s1 nên X có 19 electron.
Cấu hình X: 1s2 2s22p6 3s23p63d10 4s2 4p5 nên Z có 35 electron.
(a) đúng
(b) đúng
(c) đúng
(d) sai, X tuộc nhóm VIIA.
Soudime ( 11Na) và Magienime (12Mg) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
a. Na và Mg đều có 3 electron hóa trị.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion.
a. Na và Mg đều có 3 electron hóa trị.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion.
Dựa vào vị trí của Na và Mg trong bảng tuần hoàn.
a. sai, Na có 1 electron hóa trị, Mg có 2 electron hóa trị.
b. đúng
c. sai, tính base của sodium hydroxide mạnh hơn tính base của magnesium hydroxide.
d. đúng
Cho 6 nguyên tố có số hiệu nguyên tử lần lượt là 9, 11, 17, 18, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố phi kim?
Đáp án:
Đáp án:
Dựa vào cấu hình electron.
Các nguyên tử có số hiệu lần lượt là: 9, 17 thuộc nguyên tố phi kim
Đáp án 2
Có bao nhiêu hợp chất tạo được liên kết Hydrogen trong dãy các chất sau: NH3, HF, HCl, PH3, C2H5OH?
Đáp án:
Đáp án:
Dựa vào liên kết hydrogen.
NH3, HF, HCl, C2H5OH có liên kết hydrogen.
Đáp án 4
Một nguyên tố tạo hợp chất khí với hydrogen có công thức RH3, được sử dụng để trung hoà các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn trong ngành công nghiệp dầu khí. Nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất. % khối lượng của nguyên tố R trong hợp chất khí với hydrogen là bao nhiêu ?
Đáp án:
Đáp án:
Dựa vào % nguyên tố
Vì nguyên tố tạo hợp chất khí với hydrogen có công thứ RH3 nên oxide của R có công thức là R2O5.
Ta có : %R = \(\frac{{2.{M_R}}}{{2.{M_R} + 16.5}}.100 = 25,93\% \to {M_R} = 14(N)\)
%N trong NH3 là : \(\frac{{14}}{{14 + 3}}.100 = 82,35\% \)
Giả thiết trong tinh thể các nguyên tử Fe là những hình cầu chiếm 75% thể tích, phần còn lại là các khe rỗng giữa các quả cầu, cho nguyên tử khối Fe là 55,85 ở 20oC có khối lượng riêng của tinh thể Fe là 7,87g/cm3. Bán kính nguyên tử Fe là?
Đáp án:
Đáp án:
Xét 1 mol tinh thể Fe chứa 6,022.1023 nguyên tử Fe xếp khít nhau và các khe rỗng.
(Ghi chú: Tinh thể viết tắt là tt).
→ mtt = 55,85 gam
→ Vtt = mtt : Dtt = 55,85 : 7,87 = 7,1 cm3
→ Vphần đặc = 7,1.75% = 5,325 cm3
→ V1 nguyên tử = 5,325 : 6,022.1023 = 8,84.10-24 (cm3)
Mà nguyên tử có hình cầu nên:
Vnguyên tử = 4/3.π.r3
→ 8,84.10-24 = 4/3.3,14.r3
→ r = 1,283.10-8 cm.
Hạt mang điện trong hạt nhân nguyên tử là:
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Chu kì là
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Hạt mang điện trong hạt nhân nguyên tử là
Điện tích của hạt nhân do loại hạt nào quyết định?
Hạt mang điện trong nhân nguyên tử là:
Trình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |











Danh sách bình luận