Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 3
Hạt mang điện trong hạt nhân nguyên tử là
Đề bài
-
A.
\({}_3^7Li\).
-
B.
\({}_3^6Li\).
-
C.
\({}_4^7Li\).
-
D.
\({}_3^{10}Li\).
Số N trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối A, số thứ tự của nguyên tố (Z) theo công thức:
-
A.
A = Z – N
-
B.
A = N – Z
-
C.
N = A – Z
-
D.
Z = N + A
Hạt mang điện trong hạt nhân nguyên tử là
-
A.
Electron
-
B.
Proton
-
C.
Neutron
-
D.
Neutron và electron
-
A.
bằng tổng khối lượng các hạt proton và neutron.
-
B.
bằng tổng số các hạt proton và neutron.
-
C.
bằng nguyên tử khối.
-
D.
bằng tổng các hạt proton, neutron và electron.
Nguyên tử của nguyên tố X có tổng số hạt proton, neutron và electron là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
-
A.
26.
-
B.
27.
-
C.
28.
-
D.
23.
Cấu hình electron của nguyên tử lưu huỳnh (Z=16) ở trạng thái cơ bản là
-
A.
1s22s22p63s23p5.
-
B.
1s22s22p63s23p6.
-
C.
1s22s22p63s23p4.
-
D.
1s22s22p63s23p3.
Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26.(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
D.
Phản ứng oxi hoá - khử là phản ứng có sự chuyển electron giữa các chất phản ứng.
Nhóm nào sau đây có tính phi kim và có cấu hình electron lớp ngoài cùng dạng ns2np5
-
A.
Nhóm kim loại kiềm.
-
B.
Nhóm halogen.
-
C.
Nhóm kim loại kiềm thổ.
-
D.
Nhóm khí hiếm.
Để đo kích thước của hạt nhân, nguyên tử..hay các hệ vi mô khác, người ta không dùng các đơn vị đo phổ biến đối với các hệ vĩ mô như cm, m, km.. mà thường dùng đơn vị đo nanomet (nm) hay angstron (Å). Cách đổi đơn vị đúng là:
-
A.
1nm = 10–10m.
-
B.
1 Å =10–9m.
-
C.
1nm =10–7cm.
-
D.
1 Å =10nm.
Số hạt electron của nguyên tử có kí kiệu \({}_8^{16}O\)là
-
A.
8.
-
B.
6.
-
C.
10.
-
D.
14.
Nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu nguyên tử X là
-
A.
\({}_{{\rm{143}}}^{{\rm{235}}}{\rm{X}}\).
-
B.
\({}_{{\rm{92}}}^{{\rm{143}}}{\rm{X}}\).
-
C.
\({}_{{\rm{235}}}^{{\rm{92}}}{\rm{X}}\).
-
D.
\({}_{{\rm{92}}}^{{\rm{235}}}{\rm{X}}\).
Số mol electron dùng để khử 1,5 mol Al3+ thành Al là
-
A.
0,5.
-
B.
1,5.
-
C.
3,0.
-
D.
4,5.
Nhận định nào sau đây đúng khi nói về 3 nguyên tử có kí kiệu \({}_{13}^{26}{\rm{X,}}{}_{26}^{55}{\rm{Y,}}{}_{12}^{26}{\rm{Z}}\):
-
A.
X và Z có cùng số khối.
-
B.
X, Z là 2 đồng vị cùng một nguyên tố hoá học.
-
C.
X, Y thuộc cùng một nguyên tố hoá học.
-
D.
X và Y có cùng số nơtron.
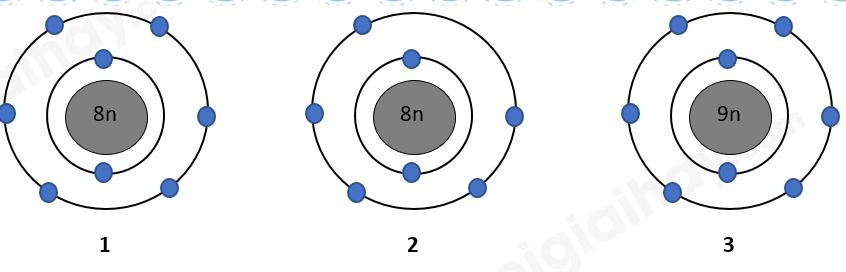
-
A.
1 và 2 là các đồng vị của cùng một nguyên tố hóa học.
-
B.
1 và 3 là các đồng vị của cùng một nguyên tố hóa học.
-
C.
1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau.
-
D.
1 và 3 có cùng số proton trong hạt nhân.
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
-
A.
Ở giữa hai nguyên tử.
-
B.
Lệch về một phía của một nguyên tử.
-
C.
Chuyển hẳn về một nguyên tử.
-
D.
Nhường hẳn về một nguyên tử.
Chọn câu đúng
-
A.
Khối lượng riêng của hạt nhân lớn hơn khối lượng riêng của nguyên tử.
-
B.
Bán kính nguyên tử bằng bán kính hạt nhân.
-
C.
Bán kính nguyên tử bằng tổng bán kính e, p, n.
-
D.
Trong nguyên tử, các hạt p, n, e xếp khít nhau thành một khối bền chặt.
Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) CuSO4 + SO2 + 2H2O, axit sunfuric
-
A.
là chất oxi hóa.
-
B.
vừa là chất oxi hóa, vừa là chất tạo môi trường.
-
C.
là chất khử.
-
D.
vừa là chất khử, vừa là chất tạo môi trường.
Trong tự nhiên, Oxi có 3 đồng vị \(_{\rm{8}}^{{\rm{16}}}{\rm{O,}}_{\rm{8}}^{{\rm{17}}}{\rm{O,}}_{\rm{8}}^{{\rm{18}}}{\rm{O}}\) ; Cacbon có 2 đồng vị là \(_{\rm{6}}^{{\rm{12}}}{\rm{C,}}_{\rm{6}}^{{\rm{13}}}{\rm{C}}\). Số phân tử khí CO2 có thể tạo thành là
-
A.
12
-
B.
10
-
C.
14
-
D.
8
Năm 1911, Rơ-đơ-pho (E. Rutherford) và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:
(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Số kết luận sai là:
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Số electron tối đa có thể phân bố trên lớp d là
-
A.
5.
-
B.
10.
-
C.
7.
-
D.
2.
Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
-
A.
HCl, Cl2, NaCl.
-
B.
NaCl, Cl2, HCl.
-
C.
Cl2, HCl, NaCl.
-
D.
Cl2, NaCl, HCl.
Bản chất của liên kết ion là lực hút tĩnh điện giữa
-
A.
2 ion.
-
B.
2 ion mang điện trái dấu.
-
C.
các hạt mang điện trái dấu.
-
D.
hạt nhân và các electron hóa trị.
Ion nào sau đây có chứa 32 electron?
-
A.
NO3-.
-
B.
SO42-.
-
C.
NH4+.
-
D.
CO32-.
Cho biết số thứ tự của Cu là 29. Cho các phát biểu sau về nguyên tố Cu (Z = 29)
(a) Cu thuộc chu kì 3, nhóm IB;
(b) Cu thuộc chu kì 4, nhóm IB;
(c) Cu thuộc chu kì 4, nhóm IIB;
(d) Ion Cu+ có lớp electron lớp ngoài cùng bão hòa;
(e) Ion Cu2+ có lớp electron lớp ngoài cùng bão hòa;
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Lời giải và đáp án
-
A.
\({}_3^7Li\).
-
B.
\({}_3^6Li\).
-
C.
\({}_4^7Li\).
-
D.
\({}_3^{10}Li\).
Đáp án : A
Dựa vào kiến thức về nguyên tố hóa học
Z = p = e = 3
A = Z + N = 3 + 4 =7
Kí hiệu nguyên tử là \({}_3^7Li\)
Số N trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối A, số thứ tự của nguyên tố (Z) theo công thức:
-
A.
A = Z – N
-
B.
A = N – Z
-
C.
N = A – Z
-
D.
Z = N + A
Đáp án : C
Dựa vào công thức tính số khối của nguyên tử nguyên tố
A = Z + N => N = A – Z
Đáp án C
Hạt mang điện trong hạt nhân nguyên tử là
-
A.
Electron
-
B.
Proton
-
C.
Neutron
-
D.
Neutron và electron
Đáp án : B
Dựa vào kiến thức về thành phần cấu tạo nguyên tử
Hạt mang điện tích trong hạt nhân là proton
Đáp án B
-
A.
bằng tổng khối lượng các hạt proton và neutron.
-
B.
bằng tổng số các hạt proton và neutron.
-
C.
bằng nguyên tử khối.
-
D.
bằng tổng các hạt proton, neutron và electron.
Đáp án : B
Số khối bằng tổng số hạt proton và neutron
Đáp án B
Nguyên tử của nguyên tố X có tổng số hạt proton, neutron và electron là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
-
A.
26.
-
B.
27.
-
C.
28.
-
D.
23.
Đáp án : B
Dựa vào kiến thức về cấu tạo nguyên tử
(1) P + N + E = 40
(2) P + E – N = 12
Từ đó tính được N = 14; E = P = 13
Số khối A = N + P = 13 + 14 = 27
Đáp án B
Cấu hình electron của nguyên tử lưu huỳnh (Z=16) ở trạng thái cơ bản là
-
A.
1s22s22p63s23p5.
-
B.
1s22s22p63s23p6.
-
C.
1s22s22p63s23p4.
-
D.
1s22s22p63s23p3.
Đáp án : C
Dựa vào Z= 16 để viết cấu hình electron của nguyên tử
Cấu hình electron của S là: 1s22s22p63s23p4.
Đáp án C
Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26.(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : B
Đáp án đúng là (2), (3)
Đáp án B
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
D.
Phản ứng oxi hoá - khử là phản ứng có sự chuyển electron giữa các chất phản ứng.
Đáp án : C
Dựa vào khái niệm của phản ứng oxi hóa khử
Đáp án C
Nhóm nào sau đây có tính phi kim và có cấu hình electron lớp ngoài cùng dạng ns2np5
-
A.
Nhóm kim loại kiềm.
-
B.
Nhóm halogen.
-
C.
Nhóm kim loại kiềm thổ.
-
D.
Nhóm khí hiếm.
Đáp án : B
Dựa vào số electron lớp ngoài cùng
Có 7 electron lớp ngoài cùng => nhóm VIIA (halogen)
Đáp án B
Để đo kích thước của hạt nhân, nguyên tử..hay các hệ vi mô khác, người ta không dùng các đơn vị đo phổ biến đối với các hệ vĩ mô như cm, m, km.. mà thường dùng đơn vị đo nanomet (nm) hay angstron (Å). Cách đổi đơn vị đúng là:
-
A.
1nm = 10–10m.
-
B.
1 Å =10–9m.
-
C.
1nm =10–7cm.
-
D.
1 Å =10nm.
Đáp án : B
Đáp án B
Số hạt electron của nguyên tử có kí kiệu \({}_8^{16}O\)là
-
A.
8.
-
B.
6.
-
C.
10.
-
D.
14.
Đáp án : A
Dựa vào kí hiệu của nguyên tử
Số P = E = 8
Đáp án A
Nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu nguyên tử X là
-
A.
\({}_{{\rm{143}}}^{{\rm{235}}}{\rm{X}}\).
-
B.
\({}_{{\rm{92}}}^{{\rm{143}}}{\rm{X}}\).
-
C.
\({}_{{\rm{235}}}^{{\rm{92}}}{\rm{X}}\).
-
D.
\({}_{{\rm{92}}}^{{\rm{235}}}{\rm{X}}\).
Đáp án : D
Kí hiệu của nguyên tố: \({}_Z^AX\)
Số khối X = 92 + 143 = 235
Z = P = E = 92
Kí hiệu X là \({}_{{\rm{92}}}^{{\rm{235}}}{\rm{X}}\)
Đáp án D
Số mol electron dùng để khử 1,5 mol Al3+ thành Al là
-
A.
0,5.
-
B.
1,5.
-
C.
3,0.
-
D.
4,5.
Đáp án : D
Số mol electron= số mol nguyên tử*số electron=1,5*3=4,5
Nhận định nào sau đây đúng khi nói về 3 nguyên tử có kí kiệu \({}_{13}^{26}{\rm{X,}}{}_{26}^{55}{\rm{Y,}}{}_{12}^{26}{\rm{Z}}\):
-
A.
X và Z có cùng số khối.
-
B.
X, Z là 2 đồng vị cùng một nguyên tố hoá học.
-
C.
X, Y thuộc cùng một nguyên tố hoá học.
-
D.
X và Y có cùng số nơtron.
Đáp án : A
Dựa vào kí hiệu của 3 nguyên tử nguyên tố
Nguyên tố X và Z có cùng số khối
Đáp án A
-
A.
1 và 2 là các đồng vị của cùng một nguyên tố hóa học.
-
B.
1 và 3 là các đồng vị của cùng một nguyên tố hóa học.
-
C.
1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau.
-
D.
1 và 3 có cùng số proton trong hạt nhân.
Đáp án : A
Dựa vào mô phỏng của các nguyên tử
Các nguyên tử 1, 2 có cùng số neutron
Các nguyên tử 1, 3 có cùng số proton => cùng 1 nguyên tố hóa học, có số N khác nhau => là đồng vị của nhau
Đáp án A
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
-
A.
Ở giữa hai nguyên tử.
-
B.
Lệch về một phía của một nguyên tử.
-
C.
Chuyển hẳn về một nguyên tử.
-
D.
Nhường hẳn về một nguyên tử.
Đáp án : B
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung lệch về một phía của một nguyên tử.
Đáp án B
Chọn câu đúng
-
A.
Khối lượng riêng của hạt nhân lớn hơn khối lượng riêng của nguyên tử.
-
B.
Bán kính nguyên tử bằng bán kính hạt nhân.
-
C.
Bán kính nguyên tử bằng tổng bán kính e, p, n.
-
D.
Trong nguyên tử, các hạt p, n, e xếp khít nhau thành một khối bền chặt.
Đáp án : A
B sai vì bán kính nguyên tử lớn hơn bán kính hạt nhân khoảng 10 000 lần
C sai vì bán kình e, p, n nhỏ hơn rất nhiều so với bán kính nguyên tử
D sai vì nguyên tử có cấu tạo rỗng và electron chuyển động xung quanh hạt nhân trong không gian rỗng của nguyên tử
Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) CuSO4 + SO2 + 2H2O, axit sunfuric
-
A.
là chất oxi hóa.
-
B.
vừa là chất oxi hóa, vừa là chất tạo môi trường.
-
C.
là chất khử.
-
D.
vừa là chất khử, vừa là chất tạo môi trường.
Đáp án : A
Dựa vào phản ứng oxi hóa khử
H2SO4 là chất oxi hóa
Đáp án A
Trong tự nhiên, Oxi có 3 đồng vị \(_{\rm{8}}^{{\rm{16}}}{\rm{O,}}_{\rm{8}}^{{\rm{17}}}{\rm{O,}}_{\rm{8}}^{{\rm{18}}}{\rm{O}}\) ; Cacbon có 2 đồng vị là \(_{\rm{6}}^{{\rm{12}}}{\rm{C,}}_{\rm{6}}^{{\rm{13}}}{\rm{C}}\). Số phân tử khí CO2 có thể tạo thành là
-
A.
12
-
B.
10
-
C.
14
-
D.
8
Đáp án : A
1 nguyên tử C liên kết với 2 nguyên tử O
Mỗi đồng vị carbon ta được 6 phân tử CO2 => Có 12 phân tử có thể tạo ra
Đáp án A
Năm 1911, Rơ-đơ-pho (E. Rutherford) và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:
(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Số kết luận sai là:
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : B
(1) đúng.
(2) đúng.
(3) sai do hạt nhân nguyên tử mang điện tích dương.
(4) sai do xung quanh hạt nhân là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Vậy (3), (4) sai.
Số electron tối đa có thể phân bố trên lớp d là
-
A.
5.
-
B.
10.
-
C.
7.
-
D.
2.
Đáp án : B
Số electron tối đa trên lớp d là 10
Đáp án B
Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
-
A.
HCl, Cl2, NaCl.
-
B.
NaCl, Cl2, HCl.
-
C.
Cl2, HCl, NaCl.
-
D.
Cl2, NaCl, HCl.
Đáp án : C
| Phân tử | Cl2 | HCl | NaCl |
| Liên kết hóa học | CHT không cực | CHT có cực | ion |
Đáp án C
Bản chất của liên kết ion là lực hút tĩnh điện giữa
-
A.
2 ion.
-
B.
2 ion mang điện trái dấu.
-
C.
các hạt mang điện trái dấu.
-
D.
hạt nhân và các electron hóa trị.
Đáp án : B
Bản chất của liên kết ion là lực hút tĩnh điện giữa 2 ion mà điện trái dấu
Đáp án B
Ion nào sau đây có chứa 32 electron?
-
A.
NO3-.
-
B.
SO42-.
-
C.
NH4+.
-
D.
CO32-.
Đáp án : A
Đáp án A. Vì NO3- có số electron là: 7 + 8.3 + 1 =32
Cho biết số thứ tự của Cu là 29. Cho các phát biểu sau về nguyên tố Cu (Z = 29)
(a) Cu thuộc chu kì 3, nhóm IB;
(b) Cu thuộc chu kì 4, nhóm IB;
(c) Cu thuộc chu kì 4, nhóm IIB;
(d) Ion Cu+ có lớp electron lớp ngoài cùng bão hòa;
(e) Ion Cu2+ có lớp electron lớp ngoài cùng bão hòa;
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
29Cu có cấu hình e là 1s22s22p63s23p63d104s1 → Cu+ có cấu hình e là 1s22s22p63s23p63d10
→ Cu2+ có cấu hình e là 1s22s22p63s23p63d9 .
Vậy ta thấy:
(a) Cu thuộc chu kì 3, nhóm IB; Sai
(b) Cu thuộc chu kì 4, nhóm IB; Đúng
(c) Cu thuộc chu kì 4, nhóm IIB; Sai
(d) Ion Cu+ có lớp electron lớp ngoài cùng bão hòa; Đúng
(e) Ion Cu2+ có lớp electron lớp ngoài cùng bão hòa; Sai.
Đáp án B
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Chu kì là
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Điện tích của hạt nhân do loại hạt nào quyết định?
Hạt mang điện trong nhân nguyên tử là:
Trình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận