Lý thuyết anken
KIẾN THỨC TRỌNG TÂM
I. ĐỒNG ĐẰNG, ĐỒNG PHÂN, DANH PHÁP
1. Đồng đằng, cấu tạo
- CTTQ dãy đồng đẳng CnH2n(n \( \ge \) 2)
- Tên gọi chung là anken hay olefin.
- Công thức đơn giản nhất là etilen (CH2=CH2).
- Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
- Trong phân tử có 1 liên kết đôi: gồm 1 liên kết σ và 1 liên kết π. Nguyên tử cacbon ở liên kết đôi tham gia 3 liên kết σ nhờ obitan lai hóa sp2, còn liên kết π nhờ obitan p không lai hóa.
- Đặc biệt phân tử CH2=CH2 có cấu trúc phẳng.
2. Đồng phân
a) Đồng phân cấu tạo
Anken từ C4H8 trở đi có đồng phân cấu tạo mạch cacbon và vị trí nối đôi.
b) Đồng phân hình học
- Nếu mỗi C mang liên kết đôi dính với 2 nhóm nguyên tử khác nhau thì sẽ có 2 cách phân bố không gian khác nhau là đồng phân cis và trans.
- Cách đọc tên đồng phân hình học: ghi tiền tố cis- trans- trước tên gọi anken
3. Danh pháp
- Tên thông thường của một số ít anken lấy tên từ ankan tương ứng, nhưng đổi hậu tố an thành ilen.
Ví dụ: CH2=CH2: etilen
CH2=CH–CH3: Propilen
- Tên thay thế: số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – Số chỉ vị trí liên kết đôi – en
Ví dụ: CH2=CH-CH2-CH3: But–1–en.
CH3-CH=CH-CH3: But–2–en.
II. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, các anken từ C2 \( \to \) C4 ở dạng khí, từ C5 trở đi là chất lỏng hoặc rắn
- Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng tăng dần theo chiều tăng của phân tử khối
- Anken nhẹ hơn nước và không tan trong nước
III. TÍNH CHẤT HÓA HỌC
Trong phân tử anken có 1 \(\pi \) kém bền nên có phản ứng đặc trưng là phản ứng cộng
1. Phản ứng cộng
- Cộng hiđro : CnH2n + H2 \(\xrightarrow{{Ni,{t^o}}}\) CnH2n + 2
- Cộng halogen: CnH2n + X2 \( \to \) CnH2nX2
- Cộng HA: Cộng nước, hiđro halogenua, axit sulfuric đậm đặc,…
PTTQ: CnH2n+ HA \( \to \) CnH2n + 1A (A là X, OSO3H, OH,...)
*Lưu ý: Phản ứng cộng HA vào anken không đối xứng tuân theo Quy tắc Mac – cop –nhi – côp: “ nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn ở nối kép , A ưu tiên cộng vào nguyên tử cacbon bậc cao hơn”
2. Trùng hợp

- Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
- Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n.
3. Phản ứng oxi hóa
- Anken cháy hoàn toàn tạo thành CO2 và H2O và tỏa nhiều nhiệt.
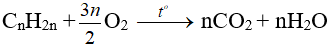
Nhận xét: Đốt anken thu nCO2 = nH2O
- Anken làm mất màu dung dịch KMnO4 (phản ứng được dùng để nhận ra sự có mặt của liên kết đôi) và bị oxi hóa không hoàn toàn thành hợp chất điol.
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
=> Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
IV. ĐIỀU CHẾ
- Trong phòng TN, etilen được điều chế từ ancol etylic
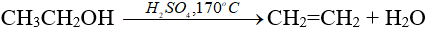
- Trong công nghiệp, các anken được điều chế từ ankan
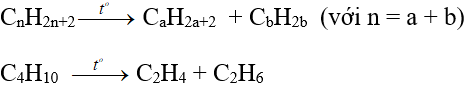
V. ỨNG DỤNG
- Trùng hợp etilen, propilen, butilen người ta thu được các polime để chế tạo màng mỏng, bình chứa, ống dẫn nước, ... dùng cho nhiều mục đích khác nhau.
- Chuyển hoá etilen thành các monome khác để tổng hợp ra hàng loạt polime đáp ứng nhu cầu phong phú của đời sống và kĩ thuật.
- Từ etilen tổng hợp ra những hoá chất hữu cơ thiết yếu như etanol, etilen oxit, etylen glicol, anđehit axetic, ...
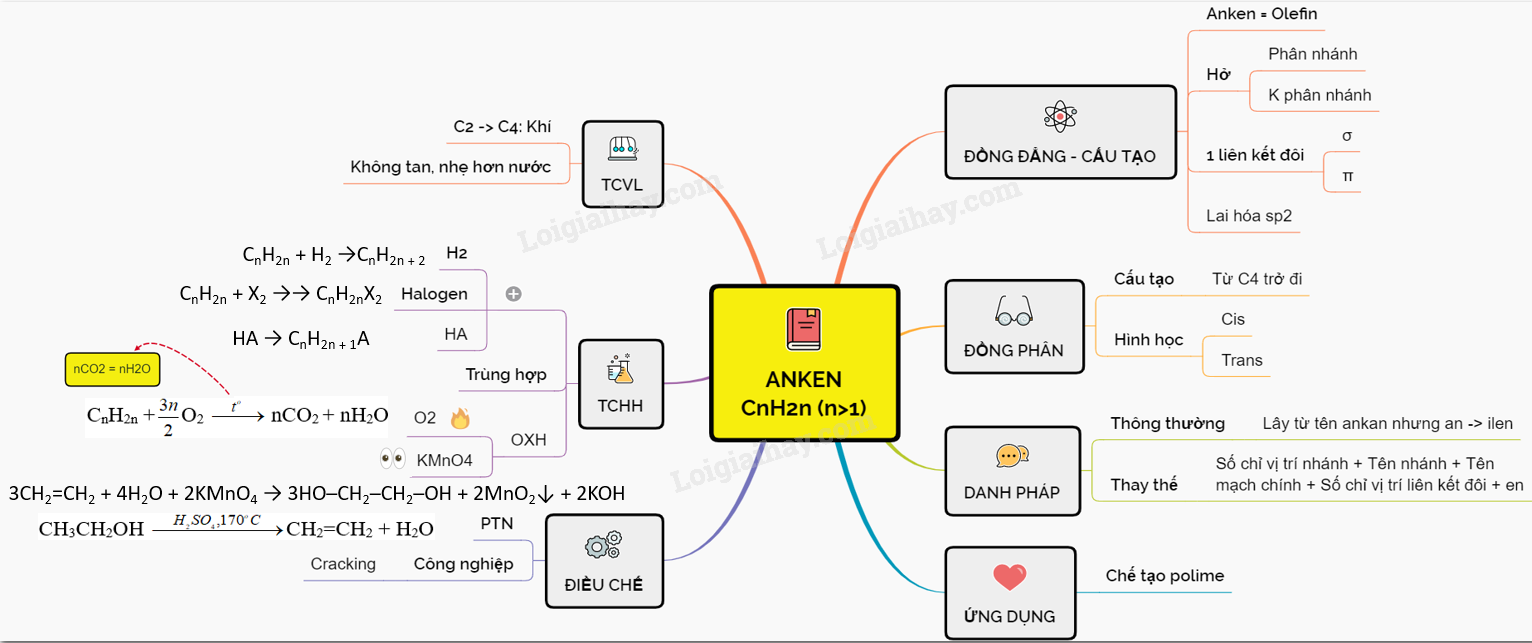
Sơ đồ tư duy: Anken
Loigiaihay.com













Danh sách bình luận