Đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo - Đề số 4
Trong pin Galvani thì
Đề bài
Trong pin Galvani thì
-
A.
sức điện động của pin được đo bằng Volt kế.
-
B.
sức điện động tiêu chuẩn của pin được tính bằng công thức: \(E_{pin}^o\) = \(E_{anode}^o - E_{cathode}^o\).
-
C.
hai điện cực kim loại khác nhau tiếp xúc cùng với một dung dịch hữu cơ có nồng độ cao.
-
D.
diễn ra sự khử tại cực âm.
Pin Mặt trời được đánh giá là một nguồn năng lượng sạch và khá thân thiện với môi trường. Phát biểu nào sau đây là đúng?
-
A.
Pin Mặt trời có khả năng chuyển đổi cơ năng thành điện năng.
-
B.
Ở Việt Nam, Bắc Bộ - Bắc Trung Bộ là khu vực có tiềm năng phát triển năng lượng Mặt Trời tốt hơn khu vực miền Trung và miền Nam.
-
C.
Việc sử dụng pin Mặt trời có một số hạn chế như giá thành sản xuất khá cao, khó di chuyển và phụ thuộc nhiều vào điều kiện khí hậu, thời tiết.
-
D.
Pin Mặt Trời là nguồn năng lượng xanh vì không thải ra khí nhà kính và quá trình xử lí pin sau khi sử dụng khá dễ dàng, không gây ô nhiễm môi trường.
Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hay chống sự ăn mòn. Phát biểu nào sau đây là sai?
-
A.
Các kim loại mạ thường dùng: nickel, đồng, vàng, bạc, platinum.
-
B.
Các kim loại mạ thường dùng: sắt, calcium, sodium, potasium.
-
C.
Bình mạ điện chứa dung dịch của kim loại mạ, vật cần mạ và thanh kim loại mạ.
-
D.
Quá trình mạ điện là một quá trình oxi hóa khử.
Phương pháp điện phân là phương pháp thường dùng để điều chế kim loại trong công nghiệp. Để điều chế kim loại sodium, ta thường
-
A.
điện phân dung dịch NaCl có màng ngăn.
-
B.
điện phân nóng chảy NaCl.
-
C.
điện phân dung dịch NaOH.
-
D.
điện phân dung dịch NaCl không có màng ngăn.
Cho dãy các nguyên tố có cấu hình electron nguyên tử sau đây: Na: [Ne]3s1; Cr:[Ar]3d54s1;Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Phát biểu nào sau đây là đúng?
-
A.
Có 3 nguyên tố khối s trong dãy các nguyên tố trên.
-
B.
Có 2 nguyên tố khối p trong dãy các nguyên tố trên.
-
C.
Có 3 nguyên tố khối d trong dãy các nguyên tố trên.
-
D.
Có 1 nguyên tố khối f trong dãy các nguyên tố trên.
Điều nào sau đây là đúng khi nói về tính chất vật lí chung của kim loại?
-
A.
Kim loại có tính chất vật lí chung là do các electron tự do trong mạng tinh thể gây ra.
-
B.
Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính dẻo, tính cứng.
-
C.
Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính khử, ánh kim.
-
D.
Những tính chất vật lí chung của kim loại là dẫn điện, dẫn nhiệt , ánh kim, khối lượng riêng.
Điều nào sau đây là đúng khi nói về tính chất hóa học của kim loại?
-
A.
Tất cả các kim loại đều tác dụng với oxygen tạo thành oxide.
-
B.
Hg tác dụng với sulfur ngay ở nhiệt độ thường nên sulfur được sử dụng để khử độc thủy ngân khi vỡ nhiệt kế thủy ngân trong phòng thí nghiệm.
-
C.
Kim loại Fe tác dụng với phi kim S, Cl2 ra hợp chất sắt (II)
-
D.
Cu có tính khử mạnh hơn Ag nên tác dụng được với dung dịch HCl giải phóng H2.
Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,… ) trong quặng, chỉ một số kim loại kém hoạt động được tìm thấy dưới dạng đơn chất. Khi nói đến một số loại quặng kim loại thông dụng, điều nào sau đây là không chính xác?
-
A.
Bauxite là quặng thông dụng của aluminum có thành phần chính là Al2O3.
-
B.
Hematite là quặng thông dụng của Iron có thành phần chính là FeS2.
-
C.
Pyrite là quặng thông dụng của Iron có thành phần chính là FeS2.
-
D.
Quặng kim loại thông dụng của Zinc ( Zinc blende) có thành phần chính là ZnS.
Hợp kim thường khó bị oxi hoá và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau. Điều nào sau đây là đúng khi nói về ứng dụng của hợp kim?
-
A.
Hợp kim không được sử dụng phổ biến như kim loại.
-
B.
Hợp kim thường được điều chế bằng cách nung chảy các thành phần rồi để nguội.
-
C.
Thép inox hay thép không gỉ là hợp kim của sắt có chứa ít nhất 5% chromium theo khối lượng.
-
D.
Trong lĩnh vực chế tạo máy bay, ô tô,... sử dụng những hợp kim có tính bền hóa học và cơ học cao,...
Nếu vật làm bằng hợp kim Fe - Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn
-
A.
sắt đóng vai trò anode và bị oxi hoá.
-
B.
kẽm đóng vai trò anode và bị oxi hoá.
-
C.
sắt đóng vai trò cathode và ion H+ bị oxi hóa.
-
D.
kẽm đóng vai trò cathode và bị oxi hóa.
Cho lá Al vào dung dịch HCl thấy có khí thoát ra, khi thêm vài giọt dung dịch CuSO4 vào thì
-
A.
phản ứng ngừng lại.
-
B.
tốc độ thoát khí tăng.
-
C.
tốc độ thoát khí giảm.
-
D.
tốc độ thoát khí không đổi.
Một pin Galvani được thiết lập ở điều kiện chuẩn theo sơ đồ dưới đây:
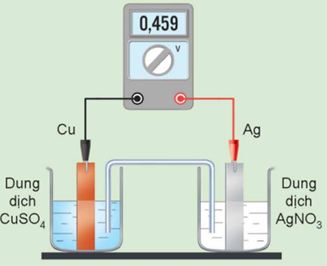
Phát biểu nào sau đây là đúng?
-
A.
Điều kiện thực hiện thí nghiệm trên là nồng độ ion kim loại bằng 1 M và nhiệt độ thường được chọn là 298oC.
-
B.
Điện cực Cu là nơi nhận electron nên đóng vai trò là cực dương (cathode).
-
C.
\(E_{A{g^ + }/Ag}^o\)= -0,459 V.
-
D.
Chiều của dòng electron chạy qua dây dẫn là từ cực Ag sang cực Cu.
So sánh tính oxi hóa và tính khử giữa các cặp oxi hóa khử. Xét bảng giá trị thế điện cực của các cặp oxi hóa – khử sau:
|
Cặp oxi hóa - khử |
Al3+/Al |
Zn2+ /Zn |
Fe2+ /Fe |
|
E0(V) |
-1,676 |
-0,763 |
-0,440 |
a. Aluminium là chất có tính khử mạnh nhất trong các chất trên.
b. Zn2+ có tính oxi hóa mạnh hơn Fe2+ .
c. Thứ tự tính khử tăng dần là Zn < Fe < Al.
d. Tính oxi hóa của Fe2+ > Al3+.
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch
d. Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm.
Suất điện động của pin điện hoá phụ thuộc vào bao nhiêu yếu tố trong các yếu tố sau?
(1) Bản chất của kim loại làm điện cực.
(2) Nồng độ dung dịch
(3) Nhiệt độ.
(4) Cơ chế phát sinh dòng điện trong pin điện hoá.
Đáp án:
Cho phản ứng xảy ra trong pin: Fe2+ + Ag+ → Fe3+ + Ag
Biết \(E_{A{g^ + }/Ag}^0\) = 0,80 V ; \(E_{F{e^{3 + }}/F{e^{2 + }}}^0\) = 0,77 V. Tính E0 pin?
Đáp án:
Một học sinh đã đưa ra các phương án để điều chế copper như sau:
(1) Điện phân dung dịch CuSO4.
(2) Dùng potassium cho vào dung dịch CuSO4.
(3) Dùng carbon khử CuO ở nhiệt độ cao.
(4) Dùng CO khử CuO ở nhiệt độ cao.
Trong các phương án điều chế trên, có bao nhiêu phương án có thể áp dụng đề điều chế copper?
Đáp án:
Tiến hành các thí nghiệm sau;
(a) Cho kim loại Ba vào nước.
(b) Cho Cu tác dụng với dung dịch HCl.
(c) Cho Al tác dụng với dung dịch HNO3 đặc nguội.
(d) Cho Ag tác dụng với dung dịch H2SO4 đặc, nóng, dư.
Số thí nghiệm tạo ra chất khí?
Đáp án:
Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là Epin = 0,46V; Biết \({{\rm{E}}^{\rm{0}}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}{\rm{ = 0,34V}}\)
Xác định thế điện cực chuẩn của cặp oxi hóa – khử Ag+/ Ag.
Đáp án:
Điện phân dung dịch NiSO₄ để mạ nickel lên một vật kim loại. Nếu dòng điện có cường độ 1.5 A chạy qua dung dịch trong 2 giờ, khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58.7 g/mol, Faraday F = 96500 C/mol). (kết quả làm tròn đến hàng phần trăm)
Đáp án:
Hòa tan hỗn hợp bột kim loại gồm 8,4 g Fe và 6,4 g Cu vào 350 mL dung dịch AgNO3 2 M. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu gam chất rắn?
Đáp án:
Giá trị biến thiên tạo thành chuẩn (kJ mol-1) của NaHCO3(s), Na2CO3(s), CO2(g) và H2O(g) lần lượt là -960,81; -1130,70; -393,51 và -241,8. Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau: (làm tròn đến đơn vị)
2NaHCO3(s)→ Na2CO3(s) + H2O(g) + CO2(g)
Đáp án:
Lời giải và đáp án
Trong pin Galvani thì
-
A.
sức điện động của pin được đo bằng Volt kế.
-
B.
sức điện động tiêu chuẩn của pin được tính bằng công thức: \(E_{pin}^o\) = \(E_{anode}^o - E_{cathode}^o\).
-
C.
hai điện cực kim loại khác nhau tiếp xúc cùng với một dung dịch hữu cơ có nồng độ cao.
-
D.
diễn ra sự khử tại cực âm.
Đáp án : A
Dựa vào cấu tạo của pin Galvani
Trong pin Galvani sức điện động của pin được đo bằng Volt kế.
Đáp án A
Pin Mặt trời được đánh giá là một nguồn năng lượng sạch và khá thân thiện với môi trường. Phát biểu nào sau đây là đúng?
-
A.
Pin Mặt trời có khả năng chuyển đổi cơ năng thành điện năng.
-
B.
Ở Việt Nam, Bắc Bộ - Bắc Trung Bộ là khu vực có tiềm năng phát triển năng lượng Mặt Trời tốt hơn khu vực miền Trung và miền Nam.
-
C.
Việc sử dụng pin Mặt trời có một số hạn chế như giá thành sản xuất khá cao, khó di chuyển và phụ thuộc nhiều vào điều kiện khí hậu, thời tiết.
-
D.
Pin Mặt Trời là nguồn năng lượng xanh vì không thải ra khí nhà kính và quá trình xử lí pin sau khi sử dụng khá dễ dàng, không gây ô nhiễm môi trường.
Đáp án : C
Dựa vào các loại pin.
Việc sử dụng pin Mặt trời có một số hạn chế như giá thành sản xuất khá cao, khó di chuyển và phụ thuộc nhiều vào điều kiện khí hậu, thời tiết.
Đáp án C
Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hay chống sự ăn mòn. Phát biểu nào sau đây là sai?
-
A.
Các kim loại mạ thường dùng: nickel, đồng, vàng, bạc, platinum.
-
B.
Các kim loại mạ thường dùng: sắt, calcium, sodium, potasium.
-
C.
Bình mạ điện chứa dung dịch của kim loại mạ, vật cần mạ và thanh kim loại mạ.
-
D.
Quá trình mạ điện là một quá trình oxi hóa khử.
Đáp án : B
Dựa vào ứng dụng của điện phân
B sai vì các kim loại IA, IIA tan trong nước không sử dụng để mạ kim loại.
Đáp án B
Phương pháp điện phân là phương pháp thường dùng để điều chế kim loại trong công nghiệp. Để điều chế kim loại sodium, ta thường
-
A.
điện phân dung dịch NaCl có màng ngăn.
-
B.
điện phân nóng chảy NaCl.
-
C.
điện phân dung dịch NaOH.
-
D.
điện phân dung dịch NaCl không có màng ngăn.
Đáp án : B
Dựa vào kiến thức về điện phân
Sodium là kim loại mạnh để điều chế kim loại sodium, ta thường điện phân nóng chảy NaCl.
Đáp án B
Cho dãy các nguyên tố có cấu hình electron nguyên tử sau đây: Na: [Ne]3s1; Cr:[Ar]3d54s1;Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Phát biểu nào sau đây là đúng?
-
A.
Có 3 nguyên tố khối s trong dãy các nguyên tố trên.
-
B.
Có 2 nguyên tố khối p trong dãy các nguyên tố trên.
-
C.
Có 3 nguyên tố khối d trong dãy các nguyên tố trên.
-
D.
Có 1 nguyên tố khối f trong dãy các nguyên tố trên.
Đáp án : B
Dựa vào đặc điểm cấu tạo của kim loại.
Có 2 nguyên tố khối p trong dãy các nguyên tố là: [Ar]3d104s24p5; F: 1s22s22p5
Đáp án B
Điều nào sau đây là đúng khi nói về tính chất vật lí chung của kim loại?
-
A.
Kim loại có tính chất vật lí chung là do các electron tự do trong mạng tinh thể gây ra.
-
B.
Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính dẻo, tính cứng.
-
C.
Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính khử, ánh kim.
-
D.
Những tính chất vật lí chung của kim loại là dẫn điện, dẫn nhiệt , ánh kim, khối lượng riêng.
Đáp án : A
Dựa vào tính chất vật lí chung của kim loại.
Kim loại có tính chất vật lí chung là do các electron tự do trong mạng tinh thể gây ra. Tính chất vật lí chung bao gồm: tính dẫn điện, dẫn nhiệt, ánh kim, tính dẻo.
Đáp án A
Điều nào sau đây là đúng khi nói về tính chất hóa học của kim loại?
-
A.
Tất cả các kim loại đều tác dụng với oxygen tạo thành oxide.
-
B.
Hg tác dụng với sulfur ngay ở nhiệt độ thường nên sulfur được sử dụng để khử độc thủy ngân khi vỡ nhiệt kế thủy ngân trong phòng thí nghiệm.
-
C.
Kim loại Fe tác dụng với phi kim S, Cl2 ra hợp chất sắt (II)
-
D.
Cu có tính khử mạnh hơn Ag nên tác dụng được với dung dịch HCl giải phóng H2.
Đáp án : B
Dựa vào tính chất hóa học của kim loại.
A sai vì Au, Pt không tác dụng với oxygen.
B đúng
C sai, Fe tác dụng với phi kim tạo ra hợp chất sắt (III)
D sai, thế điện cực chuẩn của đồng lớn hơn thế điện cực chuẩn của hydrogen nên không phản ứng với acid.
Đáp án B
Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,… ) trong quặng, chỉ một số kim loại kém hoạt động được tìm thấy dưới dạng đơn chất. Khi nói đến một số loại quặng kim loại thông dụng, điều nào sau đây là không chính xác?
-
A.
Bauxite là quặng thông dụng của aluminum có thành phần chính là Al2O3.
-
B.
Hematite là quặng thông dụng của Iron có thành phần chính là FeS2.
-
C.
Pyrite là quặng thông dụng của Iron có thành phần chính là FeS2.
-
D.
Quặng kim loại thông dụng của Zinc ( Zinc blende) có thành phần chính là ZnS.
Đáp án : B
Dựa vào kim loại trong tự nhiên.
B sai, hematite là quặng thông dụng của iron có thành phần chính là Fe2O3.
Đáp án B
Hợp kim thường khó bị oxi hoá và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau. Điều nào sau đây là đúng khi nói về ứng dụng của hợp kim?
-
A.
Hợp kim không được sử dụng phổ biến như kim loại.
-
B.
Hợp kim thường được điều chế bằng cách nung chảy các thành phần rồi để nguội.
-
C.
Thép inox hay thép không gỉ là hợp kim của sắt có chứa ít nhất 5% chromium theo khối lượng.
-
D.
Trong lĩnh vực chế tạo máy bay, ô tô,... sử dụng những hợp kim có tính bền hóa học và cơ học cao,...
Đáp án : B
Dựa vào các loại hợp kim phổ biến.
Hợp kim thường được điều chế bằng cách nung chảy các thành phần rồi để nguội.
Đáp án B
Nếu vật làm bằng hợp kim Fe - Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn
-
A.
sắt đóng vai trò anode và bị oxi hoá.
-
B.
kẽm đóng vai trò anode và bị oxi hoá.
-
C.
sắt đóng vai trò cathode và ion H+ bị oxi hóa.
-
D.
kẽm đóng vai trò cathode và bị oxi hóa.
Đáp án : B
Dựa vào quá trình xảy ra trong pin Galvani
Kẽm đóng vai trò là anode và bị oxi hóa
Đáp án B
Cho lá Al vào dung dịch HCl thấy có khí thoát ra, khi thêm vài giọt dung dịch CuSO4 vào thì
-
A.
phản ứng ngừng lại.
-
B.
tốc độ thoát khí tăng.
-
C.
tốc độ thoát khí giảm.
-
D.
tốc độ thoát khí không đổi.
Đáp án : B
Dựa vào các dạng ăn mòn hóa học.
Khi cho lá Al vào dung dịch HCl là quá trình ăn mòn hóa học, thêm vài giọt dung dịch CuSO4 trở thành ăn mòn điện hóa từ đó tốc độ thoát khi tăng.
Đáp án B
Một pin Galvani được thiết lập ở điều kiện chuẩn theo sơ đồ dưới đây:

Phát biểu nào sau đây là đúng?
-
A.
Điều kiện thực hiện thí nghiệm trên là nồng độ ion kim loại bằng 1 M và nhiệt độ thường được chọn là 298oC.
-
B.
Điện cực Cu là nơi nhận electron nên đóng vai trò là cực dương (cathode).
-
C.
\(E_{A{g^ + }/Ag}^o\)= -0,459 V.
-
D.
Chiều của dòng electron chạy qua dây dẫn là từ cực Ag sang cực Cu.
Đáp án : C
Dựa vào cấu tạo của pin Galvani.
A sai, nhiệt độ thường được chọn 25o C
B sai, điện cực Cu là nơi cho electron nên đóng vai trò là cực âm (anode)
C đúng
Đ sai, chiều của dòng electron chạy qua dây dẫn từ cực Cu sang cực Ag.
Đáp án C
So sánh tính oxi hóa và tính khử giữa các cặp oxi hóa khử. Xét bảng giá trị thế điện cực của các cặp oxi hóa – khử sau:
|
Cặp oxi hóa - khử |
Al3+/Al |
Zn2+ /Zn |
Fe2+ /Fe |
|
E0(V) |
-1,676 |
-0,763 |
-0,440 |
a. Aluminium là chất có tính khử mạnh nhất trong các chất trên.
b. Zn2+ có tính oxi hóa mạnh hơn Fe2+ .
c. Thứ tự tính khử tăng dần là Zn < Fe < Al.
d. Tính oxi hóa của Fe2+ > Al3+.
a. Aluminium là chất có tính khử mạnh nhất trong các chất trên.
b. Zn2+ có tính oxi hóa mạnh hơn Fe2+ .
c. Thứ tự tính khử tăng dần là Zn < Fe < Al.
d. Tính oxi hóa của Fe2+ > Al3+.
Dựa vào ý nghĩa của thế điện cực chuẩn của kim loại.
a. Đúng
b. Sai vì Zn2+ có tính oxi hóa yếu hơn Fe2+ .
c. Sai vì Thứ tự tính khử tăng dần là Fe < Zn < Al.
d. Đúng
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch
d. Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm.
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch
d. Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm.
Dựa vào tính chất hóa học của kim loại.
a. Đúng
b. Đúng
c. Sai vì Ở ống nghiệm thứ hai, thấy có khí không màu, hóa nâu thoát ra khỏi dung dịch
d. Đúng
Suất điện động của pin điện hoá phụ thuộc vào bao nhiêu yếu tố trong các yếu tố sau?
(1) Bản chất của kim loại làm điện cực.
(2) Nồng độ dung dịch
(3) Nhiệt độ.
(4) Cơ chế phát sinh dòng điện trong pin điện hoá.
Đáp án:
Đáp án:
Dựa vào suất điện động của pin.
Suất điện động của pin điện hóa phụ thuộc vào yếu tố (1), (2), (3)
Đáp án 3
Cho phản ứng xảy ra trong pin: Fe2+ + Ag+ → Fe3+ + Ag
Biết \(E_{A{g^ + }/Ag}^0\) = 0,80 V ; \(E_{F{e^{3 + }}/F{e^{2 + }}}^0\) = 0,77 V. Tính E0 pin?
Đáp án:
Đáp án:
Dựa vào công thức tính suất điện động của pin.
\[E_{pin}^o = E_{A{g^ + }/Ag}^o - E_{F{e^{3 + }}/F{e^{2 + }}}^o = 0,8 - 0,77 = 0,03V\]
Đáp án 0,03
Một học sinh đã đưa ra các phương án để điều chế copper như sau:
(1) Điện phân dung dịch CuSO4.
(2) Dùng potassium cho vào dung dịch CuSO4.
(3) Dùng carbon khử CuO ở nhiệt độ cao.
(4) Dùng CO khử CuO ở nhiệt độ cao.
Trong các phương án điều chế trên, có bao nhiêu phương án có thể áp dụng đề điều chế copper?
Đáp án:
Đáp án:
Dựa vào phương pháp tách kim loại.
Copper là kim loại yếu nên có thể điều chế bằng phương pháp điện phân dung dịch, nhiệt luyện và thủy luyện nên chỉ có (1), (3), (4):
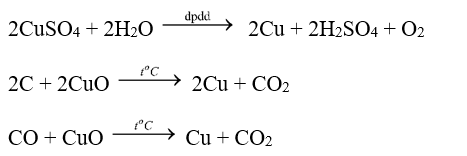
Tiến hành các thí nghiệm sau;
(a) Cho kim loại Ba vào nước.
(b) Cho Cu tác dụng với dung dịch HCl.
(c) Cho Al tác dụng với dung dịch HNO3 đặc nguội.
(d) Cho Ag tác dụng với dung dịch H2SO4 đặc, nóng, dư.
Số thí nghiệm tạo ra chất khí?
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của kim loại.
(a) Ba + 2H2O → Ba(OH)2 + H2
(b) Cu không phản ứng
(c) Al bị thụ động trong HNO3 đặc nguội.
(d) 2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
Đáp án 2
Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là Epin = 0,46V; Biết \({{\rm{E}}^{\rm{0}}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}{\rm{ = 0,34V}}\)
Xác định thế điện cực chuẩn của cặp oxi hóa – khử Ag+/ Ag.
Đáp án:
Đáp án:
Dựa vào công thức tính sức điện động của pin.
\(E_{pin}^o = E_{A{g^ + }/Ag}^o - E_{C{u^{2 + }}/Cu}^o\)→ \(E_{A{g^ + }/Ag}^o = E_{pin}^o + E_{C{u^{2 + }}/Cu}^o = 0,46 + 0,34 = 0,8V\)
Đáp án 0,8
Điện phân dung dịch NiSO₄ để mạ nickel lên một vật kim loại. Nếu dòng điện có cường độ 1.5 A chạy qua dung dịch trong 2 giờ, khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58.7 g/mol, Faraday F = 96500 C/mol). (kết quả làm tròn đến hàng phần trăm)
Đáp án:
Đáp án:
Dựa vào ứng dụng của phương pháp điện phân.
Số mol electron trao đổi = \(\frac{{I.t}}{F} = \frac{{1,5.2.60.60}}{{96500}} = 0,11mol\)
Ni2+ + 2e → Ni
0,11→0,055
m Ni = 0,055.58,7 = 3,28g
Hòa tan hỗn hợp bột kim loại gồm 8,4 g Fe và 6,4 g Cu vào 350 mL dung dịch AgNO3 2 M. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu gam chất rắn?
Đáp án:
Đáp án:
nFe = 0,15 mol; nCu = 0,1 mol
nAgNO3 =0,7 mol => 3.nFe + 2nCu ⇒ AgNO3 dư
mrắn = mAg = (0,15.3 + 0,1.2).108= 70,2 g
Giá trị biến thiên tạo thành chuẩn (kJ mol-1) của NaHCO3(s), Na2CO3(s), CO2(g) và H2O(g) lần lượt là -960,81; -1130,70; -393,51 và -241,8. Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau: (làm tròn đến đơn vị)
2NaHCO3(s)→ Na2CO3(s) + H2O(g) + CO2(g)
Đáp án:
Đáp án:
Dựa vào công thức tính biến thiên enthalpy của phản ứng: \({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(sp) - {\Delta _f}H_{298}^o(tg)\)
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(N{a_2}C{O_3}) + {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o({H_2}{\rm{O}}) - 2.{\Delta _f}H_{298}^o(NaHC{O_3})\)
= (-1130,70) + (-393,51) + (-241,8) – 2.(-960,81) ≈156 kJ
Đáp số: 156
Dựa vào phương pháp tách kim loại.
Vì nCO = nCO2 = \(\frac{{99,{{16.10}^3}}}{{24,79}}.\frac{1}{2}\) = 2.103 mol
Theo (2) và (3), ta được: nO2 = \(\frac{1}{2}{n_{CO}} + {n_{C{O_2}}}\)= \(\frac{1}{2} \times {2.10^3} + {2.10^3} = {3.10^3}\) (mol)
Theo (1), nAl2O3 = \(\frac{2}{3}{n_{{O_2}}} = \frac{2}{3}{.3.10^3}\) = 2.103 (mol)
Khối lượng quặng: mAl2O3.2H2O = 2.103.138 = 276.103 (gam) = 276 kg
Vì hiệu suất cả quá trình là 80% nên mquặng = 276.100/80 = 345 (kg).
Dựa vào phương pháp tách kim loại.
Ta có : = 1,05 tấn
Fe2O3 + 3H2 → 2Fe + 3H2O
Ta có : Cứ 160 tấn Fe2O3 → (2.56 = 112) tấn Fe
→ 1,05 tấn Fe2O3 → 0,735 tấn Fe
Vì H = 83% nên khối lượng Fe thu được là m = 0,735.83% = 0,61 (tấn)
Cho biết các phản ứng xảy ra sau:
Trong pin điện hóa, quá trình khử
Cặp oxi hóa – khử của kim loại là
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là










Danh sách bình luận