Đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo - Đề số 5
Cho biết các phản ứng xảy ra sau:
Đề bài
Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3 (1)
2NaBr + Cl2 → NaCl + Br2. (2)
Phát biểu nào sau đây đúng?
-
A.
Tính khử của Cl- mạnh hơn Br-.
-
B.
Tính oxi hoá của Br2 mạnh hơn Cl2.
-
C.
Tính khử của Br- mạnh hơn Fe2+.
-
D.
Tính oxi hoá của Cl2 mạnh hơn của Fe3+.
Điện phân dung dịch CuSO4 với điện cực trơ, sản phẩm thu được ở cực dương là
-
A.
O2.
-
B.
H2.
-
C.
Cu.
-
D.
SO2.
Kim loại chỉ được điều chế bằng phương pháp điện phân nóng chảy là
-
A.
Fe.
-
B.
Cu.
-
C.
Na.
-
D.
Ag.
Cấu hình e nào sau đây là của nguyên tử kim loại?
-
A.
1s22s22p6.
-
B.
1s22s22p63s23p4.
-
C.
1s22s22p63s23p5.
-
D.
1s22s22p63s1.
Kim loại nào sau đây có thể dát thành lá mỏng 0,01 mm và dùng làm giấy gói kẹo, gói thuốc lá,.?
-
A.
Cu.
-
B.
Fe.
-
C.
Al.
-
D.
Ag.
Trong số các kim loại: Fe, Ag, Al,Cu, kim loại dẫn điện tốt nhất là
-
A.
Au.
-
B.
Ag.
-
C.
Cu.
-
D.
Al.
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ như hình 16.2
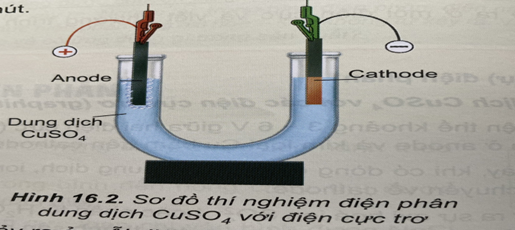
Học sinh có các kết luận sau :
(1) Ở anode xảy ra sự khử nước : H2O → \(\frac{1}{2}\)O2 + 2H+ + 2e
(2) Ở cathode xảy ra sự oxi hoá Cu2+ : Cu2+ + 2e → Cu
(3) Ở cathode có lớp bột màu đỏ bám vào điện cực than chì
(4) Màu xanh lam của dung dịch CuSO4 nhạt dần theo thời gian điện phân.
Số kết luận đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Phát biểu nào dưới đây là đúng?
-
A.
Thép là hợp kim của Fe có Mn, Si.
-
B.
Thép là hợp kim của Fe có từ 0,01 - 2% C.
-
C.
Thép là hợp kim của Fe có từ 2-5% C.
-
D.
Thép là hợp kim của Fe có từ 5-10% C.
Để bảo vệ vỏ tàu biển làm bằng thép, người ta thường gắn vào vỏ tàu (phần chìm dưới nước) các khối kim loại nào sau đây?
-
A.
Ag.
-
B.
Na.
-
C.
Zn.
-
D.
Cu.
Điện phân dung dịch chứa 23,4 gam NaCl (với điện cực trơ, màng ngăn xốp), thu được 2,5 lít dung dịch có pH=13. Phần trăm muối ăn bị điện phân là
-
A.
62,5%.
-
B.
65%.
-
C.
70%.
-
D.
80%.
Trong số các phát biểu sau về ăn mòn, bảo vệ khỏi sự ăn mòn điện hóa, phát biểu nào đúng?
-
A.
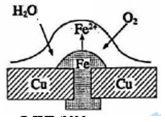
Sau khi tấm đồng (Cu) bị đóng đinh tán bằng sắt (Fe), tấm đồng dễ bị ăn mòn hơn.
-
B.

Quét dầu lên bề mặt bộ tản nhiệt có thể ngăn chặn ăn mòn kim loại.
-
C.
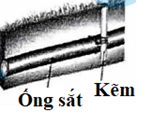
Sau khi nối thanh kẽm (zinc), dòng electron chuyển dịch từ ống sắt (iron) sang ống kẽm.
-
D.

Phản ứng ở cathode là : \(Fe \to F{e^{2 + }} + 2e\).
Sắt tây (sắt tráng thiếc) được dùng phổ biến làm hộp đựng thực phẩm vì chúng có độ bền cơ học cao, bảo quản hương vị thực phẩm tốt, không độc, chống ánh sáng, và không thấm nước. Nếu vật làm bằng sắt tây bị ăn mòn điện hoá thì trong quá trình ăn mòn
-
A.
sắt đóng vai trò cathode và bị oxi hoá.
-
B.
thiếc đóng vai trò cathode và ion H⁺ bị oxi hoá.
-
C.
sắt đóng vai trò anode và bị oxi hoá.
-
D.
thiếc đóng vai trò anode và bị oxi hoá.
Cho 2 phản ứng:
Fe + H2SO4 loãng --> FeSO4 + H2 (1)
Zn + 2H2SO4 đặc --> CuSO4 + SO2 + 2H2O (2)
a) H2SO4 ở phản ứng (2) có tính oxi hóa mạnh hơn ở phản ứng (1).
b) ở cả phản ứng (1) và (2), ion H+ là chất oxi hóa.
c) Trong phản ứng (1) và (2), acid vừa là chất oxi hóa vừa là môi trường.
d) Trong phản ứng (1) iron (Fe) thể hiện tính khử yếu, trong phản ứng (2) zinc (Zn) thể hiện tính khử mạnh.
Trong công nghiệp, nhôm được điều chế bằng cách điện phân nóng chảy hỗn hợp alumina (Al2O3) và cryolite (Na3AlF6) còn gọi là quy trình Hall-Héroul: 2Al2O3(l) 4Al(l) + 3O2(g) như hình dưới đây. Nhiệt độ nóng chảy của hỗn hợp alumina và cryolite khoảng 950oC, thấp hơn nhiều so với nhiệt độ nóng chảy của alumina (> 2000oC); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục bị nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.
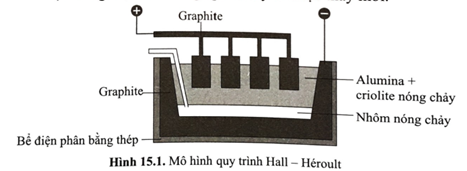
a. Nhôm kim loại được tách ra tại cathode.
b. Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
c. Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
d. Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn xảy ra bình thường.
Một pin điện hóa được thiết lập bởi một điện cực Zn nhúng trong dung dịch Zn(NO3)2 1M và một điện cực Ag nhúng trong dung dịch AgNO3 1M (ở 250C). Cho biết \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^0{\rm{ = - }}\,{\rm{0,76V; E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^0{\rm{ = 0,8V}}\). Tính sức điện động của pin.
Đáp án:
Thả một đinh làm bằng thép nặng 5,7 gam vào dung dịch H2SO4 (loãng, dư) thấy thoát ra 2,479 Lit khí ở điều kiện chuẩn. Tính phần trăm khối lượng carbon trong mẫu thép làm đinh trên. Coi thép là hợp kim của iron và carbon, các nguyên tố khác có hàm lượng không đáng kể.
Đáp án:
Người ta muốn mạ một lớp bạc dày d = 15 mm trên một miếng kim loại có diện tích s = 2 cm2 bằng phương pháp điện phân. Cường độ dòng điện là 1A. Cho biết khối lượng riêng của bạc là 10490 kg/m3. Sau khoảng thời gian t (giờ) thì lớp bạc được bọc ra hết khỏi bề mặt miếng kim loại và khối lượng của lớp bạc thu được là m gam. Giá trị của t bằng bao nhiêu?
Đáp án:
Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Mg; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch acid HCl loãng, có bao nhiêu cặp kim loại trong đó Fe bị phá hủy trước?
Đáp án:
Cho các biện pháp chống ăn mòn kim loại sau:
(1) Không để kim loại tiếp xúc với môi trường nước hoặc hơi nước.
(2) Để bảo vệ vỏ tàu biển bằng thép, người ta hàn những khối kẽm lên mặt ngoài vỏ tàu phần tiếp xúc với nước.
(3) Để đồ vật nơi khô ráo, thường xuyên lau chùi sạch sẽ sau khi sử dụng.
(4) Bôi dầu mỡ lên bề mặt kim loại.
Sắp xếp các biện pháp đúng theo thứ tự giảm dần.
Đáp án:
Cho các thí nghiệm sau:
(1) Đốt cháy dây sắt trong không khí khô.
(2) Cho hợp kim Fe – Cu vào dung dịch CuSO4.
(3) Đặt mẫu gang lâu ngày trong không khí ẩm.
(4) Cho kim loại Fe vào dung dịch AgNO3.
(5) Cho kim loại Fe vào dung dịch H2SO4 loãng
Những thí nghiệm xảy ra ăn mòn điện hóa được viết theo thứ tự tăng dần là (ví dụ: 125...)
Đáp án:
Kim loại đồng và hợp kim của nó dùng để chế tạo những vật dung quen thuộc trong cuộc sống. Có thể điều chế đồng bằng phương pháp điện phân dung dịch muối copper(II) sulfate với anode trơ. Tính khối lượng (gam) đồng thu được khi điện phân hoàn toàn 400mL dung dịch CuSO4 2M (hiệu suất 100%)?
Đáp án:
Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thì thu được 1,9832 lít H2 (đkc). Thành phần phần trăm về khối lượng của A trong hỗn hợp là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Lời giải và đáp án
Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3 (1)
2NaBr + Cl2 → NaCl + Br2. (2)
Phát biểu nào sau đây đúng?
-
A.
Tính khử của Cl- mạnh hơn Br-.
-
B.
Tính oxi hoá của Br2 mạnh hơn Cl2.
-
C.
Tính khử của Br- mạnh hơn Fe2+.
-
D.
Tính oxi hoá của Cl2 mạnh hơn của Fe3+.
Đáp án : D
Dựa vào ý nghĩa thế điện cực chuẩn của kim loại.
Tính oxi hóa của Cl2 mạnh hơn Fe
Đáp án D
Điện phân dung dịch CuSO4 với điện cực trơ, sản phẩm thu được ở cực dương là
-
A.
O2.
-
B.
H2.
-
C.
Cu.
-
D.
SO2.
Đáp án : A
Dựa vào phương pháp điện phân dung dịch.
Cực dương (cực anode) xảy ra quá trình oxi hóa nước: 2H2O → O2 + 4H+
Đáp án A
Kim loại chỉ được điều chế bằng phương pháp điện phân nóng chảy là
-
A.
Fe.
-
B.
Cu.
-
C.
Na.
-
D.
Ag.
Đáp án : C
Dựa vào phương pháp điện phân nóng chảy.
Na là kim loại mạnh chỉ được điều chế bằng phương pháp điện phân nóng chảy
Đáp án C
Cấu hình e nào sau đây là của nguyên tử kim loại?
-
A.
1s22s22p6.
-
B.
1s22s22p63s23p4.
-
C.
1s22s22p63s23p5.
-
D.
1s22s22p63s1.
Đáp án : D
Cấu hình nguyên tử kim loại thường có 1,2,3 electron lớp ngoài cùng
1s22s22p63s1 là cấu hình của nguyên tử kim loại
Đáp án D
Kim loại nào sau đây có thể dát thành lá mỏng 0,01 mm và dùng làm giấy gói kẹo, gói thuốc lá,.?
-
A.
Cu.
-
B.
Fe.
-
C.
Al.
-
D.
Ag.
Đáp án : C
Dựa vào tính chất vật lí của kim loại.
Dùng kim loại Al để dùng làm giấy gói kẹo, gói thuốc lá.
Đáp án C
Trong số các kim loại: Fe, Ag, Al,Cu, kim loại dẫn điện tốt nhất là
-
A.
Au.
-
B.
Ag.
-
C.
Cu.
-
D.
Al.
Đáp án : B
Dựa vào tính chất vật lí của kim loại.
Ag là kim loại dẫn điện tốt nhất.
Đáp án B
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ như hình 16.2

Học sinh có các kết luận sau :
(1) Ở anode xảy ra sự khử nước : H2O → \(\frac{1}{2}\)O2 + 2H+ + 2e
(2) Ở cathode xảy ra sự oxi hoá Cu2+ : Cu2+ + 2e → Cu
(3) Ở cathode có lớp bột màu đỏ bám vào điện cực than chì
(4) Màu xanh lam của dung dịch CuSO4 nhạt dần theo thời gian điện phân.
Số kết luận đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào nguyên tắc điện phân dung dịch
(1) sai, ở anode xảy ra sự oxi hóa nước.
(2) sai, ở anode xảy ra sự khử Cu2+
(3) đúng
(4) đúng
Đáp án B
Phát biểu nào dưới đây là đúng?
-
A.
Thép là hợp kim của Fe có Mn, Si.
-
B.
Thép là hợp kim của Fe có từ 0,01 - 2% C.
-
C.
Thép là hợp kim của Fe có từ 2-5% C.
-
D.
Thép là hợp kim của Fe có từ 5-10% C.
Đáp án : B
Dựa vào thành phần của hợp kim.
Thép là hợp kim của Fe có từ 0,01% - 2% C
Đáp án B
Để bảo vệ vỏ tàu biển làm bằng thép, người ta thường gắn vào vỏ tàu (phần chìm dưới nước) các khối kim loại nào sau đây?
-
A.
Ag.
-
B.
Na.
-
C.
Zn.
-
D.
Cu.
Đáp án : C
Dựa vào cách bảo vệ kim loại.
Dùng Zn có tính khử mạnh hơn để bảo vệ tàu biển làm bằng thép.
Đáp án C
Điện phân dung dịch chứa 23,4 gam NaCl (với điện cực trơ, màng ngăn xốp), thu được 2,5 lít dung dịch có pH=13. Phần trăm muối ăn bị điện phân là
-
A.
62,5%.
-
B.
65%.
-
C.
70%.
-
D.
80%.
Đáp án : A
Dựa vào ứng dụng của phương pháp điện phân dung dịch.
Vì pH = 13 →[H+] = 10-13 → [OH-] = 10-1M
n OH- = 0,1.2,5 = 0,25 mol
2NaCl + 2H2O 2NaOH + Cl2 + H2
0,25 ← 0,25
m NaCl bị điện phân = 0,25.58,5 = 14,625g
%NaCl bị điện phân : \(\frac{{14,625}}{{23,4}}.100\% = 62,5\% \)
Đáp án A
Trong số các phát biểu sau về ăn mòn, bảo vệ khỏi sự ăn mòn điện hóa, phát biểu nào đúng?
-
A.

Sau khi tấm đồng (Cu) bị đóng đinh tán bằng sắt (Fe), tấm đồng dễ bị ăn mòn hơn.
-
B.

Quét dầu lên bề mặt bộ tản nhiệt có thể ngăn chặn ăn mòn kim loại.
-
C.

Sau khi nối thanh kẽm (zinc), dòng electron chuyển dịch từ ống sắt (iron) sang ống kẽm.
-
D.

Phản ứng ở cathode là : \(Fe \to F{e^{2 + }} + 2e\).
Đáp án : B
Dựa vào cách bảo vệ kim loại.
A sai, Fe bị ăn mòn trước
B đúng
C sai, dòng electron di chuyển từ Zn sang Fe
D sai, phản ứng ở anode : \(Fe \to F{e^{2 + }} + 2e\)
Đáp án B
Sắt tây (sắt tráng thiếc) được dùng phổ biến làm hộp đựng thực phẩm vì chúng có độ bền cơ học cao, bảo quản hương vị thực phẩm tốt, không độc, chống ánh sáng, và không thấm nước. Nếu vật làm bằng sắt tây bị ăn mòn điện hoá thì trong quá trình ăn mòn
-
A.
sắt đóng vai trò cathode và bị oxi hoá.
-
B.
thiếc đóng vai trò cathode và ion H⁺ bị oxi hoá.
-
C.
sắt đóng vai trò anode và bị oxi hoá.
-
D.
thiếc đóng vai trò anode và bị oxi hoá.
Đáp án : C
Dựa vào sự ăn mòn kim loại.
Sắt đóng vai trò anode và bị oxi hóa.
Đáp án C
Cho 2 phản ứng:
Fe + H2SO4 loãng --> FeSO4 + H2 (1)
Zn + 2H2SO4 đặc --> CuSO4 + SO2 + 2H2O (2)
a) H2SO4 ở phản ứng (2) có tính oxi hóa mạnh hơn ở phản ứng (1).
b) ở cả phản ứng (1) và (2), ion H+ là chất oxi hóa.
c) Trong phản ứng (1) và (2), acid vừa là chất oxi hóa vừa là môi trường.
d) Trong phản ứng (1) iron (Fe) thể hiện tính khử yếu, trong phản ứng (2) zinc (Zn) thể hiện tính khử mạnh.
a) H2SO4 ở phản ứng (2) có tính oxi hóa mạnh hơn ở phản ứng (1).
b) ở cả phản ứng (1) và (2), ion H+ là chất oxi hóa.
c) Trong phản ứng (1) và (2), acid vừa là chất oxi hóa vừa là môi trường.
d) Trong phản ứng (1) iron (Fe) thể hiện tính khử yếu, trong phản ứng (2) zinc (Zn) thể hiện tính khử mạnh.
Dựa vào ý nghĩa thế điện cực chuẩn của kim loại.
a. đúng
b. sai, ở phản ứng (2) S+6 là chất oxi hóa
c. sai, ở phản ứng (1) acid đóng vai trò chất oxi hóa
d. đúng, Zn có tính khử mạnh hơn Fe.
Trong công nghiệp, nhôm được điều chế bằng cách điện phân nóng chảy hỗn hợp alumina (Al2O3) và cryolite (Na3AlF6) còn gọi là quy trình Hall-Héroul: 2Al2O3(l) 4Al(l) + 3O2(g) như hình dưới đây. Nhiệt độ nóng chảy của hỗn hợp alumina và cryolite khoảng 950oC, thấp hơn nhiều so với nhiệt độ nóng chảy của alumina (> 2000oC); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục bị nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.

a. Nhôm kim loại được tách ra tại cathode.
b. Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
c. Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
d. Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn xảy ra bình thường.
a. Nhôm kim loại được tách ra tại cathode.
b. Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
c. Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
d. Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn xảy ra bình thường.
Dựa vào phương pháp điện phân nóng chảy.
a. Đúng. Tại cathode (-): Al3+(l) + 3e → Al(l), theo hình vẽ, lớp nhôm nóng chảy thu được tại cực âm (phần đáy của bể điện phân).
b. Đúng. Cryolite làm giảm sâu nhiệt độ nóng chảy, từ đó giảm lượng năng lượng cần cung cấp để nấu chảy hỗn hợp. Ngoài ra, việc tăng độ dẫn điện còn làm tăng hiệu suất của quá trình điện phân. Do đó, làm giảm chi phí sản xuất.
c. Sai. Tại anode, graphite bị ăn mòn do phản ứng với oxygen tạo thành các oxide của carbon thoát ra cùng với oxygen.
C(s) + O2(g) → CO2(g)
C(s) + CO2(g) → 2CO(g)
d. Sai. Việc thiết kế cathode bên dưới bể điện phân giúp nhôm nóng chảy sinh ra ở đáy bể tráng tiếp xúc với oxygen trong không khí, ngoài ra tỉ trọng của nhôm lỏng lớn hơn hỗn hợp điện phân giúp nhôm lỏng chìm xuống đáy bể, không ảnh hưởng đến quá trình điện phân. Anode ở phía trên dễ dàng nhúng xuống bể liên tục khi bị ăn mòn (việc này gần như không thể thực hiện nếu đặt anode ở đáy bể). Bên cạnh đó, nếu anode ở đáy bể, các khi sinh ra tại anode sẽ thoát vào hỗn hợp lỏng, ảnh hưởng đến quá trình điện phân.
Một pin điện hóa được thiết lập bởi một điện cực Zn nhúng trong dung dịch Zn(NO3)2 1M và một điện cực Ag nhúng trong dung dịch AgNO3 1M (ở 250C). Cho biết \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^0{\rm{ = - }}\,{\rm{0,76V; E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^0{\rm{ = 0,8V}}\). Tính sức điện động của pin.
Đáp án:
Đáp án:
Dựa vào công thức tính sức điện động của pin.
\(E_{pin}^o = E_{A{g^ + }/Ag}^o - E_{Z{n^{2 + }}/Zn}^o = 0,8 - ( - 0,76) = 1,56V\)
Thả một đinh làm bằng thép nặng 5,7 gam vào dung dịch H2SO4 (loãng, dư) thấy thoát ra 2,479 Lit khí ở điều kiện chuẩn. Tính phần trăm khối lượng carbon trong mẫu thép làm đinh trên. Coi thép là hợp kim của iron và carbon, các nguyên tố khác có hàm lượng không đáng kể.
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của hợp kim.
n H2 = 2,479 : 24,79 = 0,1 mol
Fe + H2SO4 → FeSO4 + H2
n Fe = n H2 = 0,1 mol
m Fe = 0,1.56 = 5,6g
m C = 5,7 – 5,6 = 0,1g
%C = \(\frac{{0,1}}{{5.7}}.100\% = 1,75\% \)
Người ta muốn mạ một lớp bạc dày d = 15 mm trên một miếng kim loại có diện tích s = 2 cm2 bằng phương pháp điện phân. Cường độ dòng điện là 1A. Cho biết khối lượng riêng của bạc là 10490 kg/m3. Sau khoảng thời gian t (giờ) thì lớp bạc được bọc ra hết khỏi bề mặt miếng kim loại và khối lượng của lớp bạc thu được là m gam. Giá trị của t bằng bao nhiêu?
Đáp án:
Đáp án:
Dựa vào ứng dụng của phương pháp điện phân
\(\;{m_{Ag}} = DV = D.S.d = {10490.2.10^{ - 4}}{.15.10^{ - 3}} = 0,03147\;(kg) = 31,47\;(gam)\)
Thời gian để mạ lớp bạc là
\(\;\;t = \frac{{mFn}}{{AI}} = \frac{{31,47.96500.1}}{{108.1}} = 28119\;(s)\; = 7,81\;\)(giờ)
Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Mg; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch acid HCl loãng, có bao nhiêu cặp kim loại trong đó Fe bị phá hủy trước?
Đáp án:
Đáp án:
Dựa vào sự ăn mòn kim loại.
Fe và Pb; Fe và Ni là 2 cặp kim loại trong đó Fe bị phá hủy trước.
Đáp án 2
Cho các biện pháp chống ăn mòn kim loại sau:
(1) Không để kim loại tiếp xúc với môi trường nước hoặc hơi nước.
(2) Để bảo vệ vỏ tàu biển bằng thép, người ta hàn những khối kẽm lên mặt ngoài vỏ tàu phần tiếp xúc với nước.
(3) Để đồ vật nơi khô ráo, thường xuyên lau chùi sạch sẽ sau khi sử dụng.
(4) Bôi dầu mỡ lên bề mặt kim loại.
Sắp xếp các biện pháp đúng theo thứ tự giảm dần.
Đáp án:
Đáp án:
Dựa vào nguyên tắc chống ăn mòn kim loại.
(1) đúng, vì khi tiếp xúc trực tiếp với môi trường nước hoặc hơi nước, sẽ có sự ăn mòn điện hóa làm cho kim loại dễ bị gỉ.
(2) đúng, vì kẽm có tính khử mạnh hơn thép nên sẽ bị ăn mòn trước bảo vệ phần thép bên trong.
(3) đúng, tránh tiếp xúc với nước hoặc hơi nước.
(4) đúng, lớp dầu mỡ bôi lên kim loại sẽ giúp bảo vệ kim loại tránh tiếp xúc trực tiếp với môi trường.
Đáp án 4321
Cho các thí nghiệm sau:
(1) Đốt cháy dây sắt trong không khí khô.
(2) Cho hợp kim Fe – Cu vào dung dịch CuSO4.
(3) Đặt mẫu gang lâu ngày trong không khí ẩm.
(4) Cho kim loại Fe vào dung dịch AgNO3.
(5) Cho kim loại Fe vào dung dịch H2SO4 loãng
Những thí nghiệm xảy ra ăn mòn điện hóa được viết theo thứ tự tăng dần là (ví dụ: 125...)
Đáp án:
Đáp án:
Dựa vào nguyên tắc xảy ra ăn mòn điện hóa.
(1) chỉ xảy ra ăn mòn hóa học.
(2) có xảy ra ăn mòn điện hóa.
(3) có xảy ra ăn mòn điện hóa.
(4) chỉ xảy ra ăn mòn hóa học.
(5) chỉ xảy ra ăn mòn hóa học.
Đáp án 23
Kim loại đồng và hợp kim của nó dùng để chế tạo những vật dung quen thuộc trong cuộc sống. Có thể điều chế đồng bằng phương pháp điện phân dung dịch muối copper(II) sulfate với anode trơ. Tính khối lượng (gam) đồng thu được khi điện phân hoàn toàn 400mL dung dịch CuSO4 2M (hiệu suất 100%)?
Đáp án:
Đáp án:
Dựa vào ứng dụng của điện phân.
n CuSO4 = 0,4.2 = 0,8 mol
Cu2+ + 2e → Cu
0,8 → 0,8
m Cu = 0,8.64 = 51,2g
Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thì thu được 1,9832 lít H2 (đkc). Thành phần phần trăm về khối lượng của A trong hỗn hợp là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Đáp án:
Đáp án:
Dựa vào tính chất tác dụng với nước của một số kim loại kiềm IA, IIA.
n H2 = 1,9832 : 24,79 = 0,08 mol
Gọi M là kim loại trung bình của hỗn hợp
M + H2O → MOH + ½ H2
0,16 ← 0,08
MM = \(\frac{{3,36}}{{0,16}} = 21\)
Vậy A là Li
Đặt số mol của Li và K lần lượt là a và b ta có:
\(\left\{ \begin{array}{l}a + b = 0,16\\7{\rm{a}} + 39b = 3,36\end{array} \right. \to \left\{ \begin{array}{l}a = 0,09\\b = 0,07\end{array} \right.\)
%Li = \(\frac{{0,09.7}}{{3,36}}.100 = 18,75\% \approx 18,8\% \)
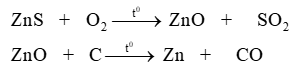
Tính khối lượng ZnS có trong quặng blend, sau đó tính số mol ZnS. Dựa vào phương trình phản ứng tính n Zn tạo thành, sau đó tính thể tích Zn.
Khối lượng ZnS trong quặng là: 60.80% = 48 tấn = 48.106 gam
n ZnS = \(\frac{{{{48.10}^6}}}{{97}}mol\)
Theo phương trình: n Zn thu được = \(\frac{{{{48.10}^6}}}{{97}}.97\% mol\)
m Zn = \(\frac{{{{48.10}^6}}}{{97}}.97\% mol\).65 = 31,2.106 gam
V Zn = 31,2.106 : 7,14 = 4,37.106 cm3
V 1 hình hộp chữ nhật là: 120.30.10 = 36000 cm3
Số thanh Zn được đúng là: 4,37.106 : 36000 = 121 thanh.
Dựa vào tính chất hóa học của kim loại.
n Fe = \(\frac{{8,4}}{{56}} = 0,15mol\); n Cu = \(\frac{{3,2}}{{64}} = 0,05mol\); n AgNO3 = 0,4.2 = 0,8 mol
Fe + 2AgNO3 \( \to \) Fe(NO3)2 + 2Ag
0,15 \( \to \) 0,15 0,3
Cu + 2AgNO3 \( \to \) Cu(NO3)2 + 2Ag
0,05 \( \to \) 0,1
n AgNO3 dư = 0,8 – 0,3 – 0,1 = 0,4 mol
Vì AgNO3 dư nên có quy tắc \(\alpha \) xảy ra ở cặp Fe3+/Fe2+ và Ag+/Ag
Fe(NO3)2 + AgNO3 \( \to \) Fe(NO3)3 + Ag
0,15 0,4 0,15
n Ag = 0,3 + 0,1+ 0,15 = 0,55
m Ag = 0,55.108 = 59,4g
Trong pin Galvani thì
Trong pin điện hóa, quá trình khử
Cặp oxi hóa – khử của kim loại là
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là










Danh sách bình luận