Đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo - Đề số 3
Trong pin điện hóa, quá trình khử
Đề bài
Trong pin điện hóa, quá trình khử
-
A.
xảy ra ở cực âm.
-
B.
xảy ra ở cực dương.
-
C.
xảy ra ở cực âm và cực dương.
-
D.
không xảy ra ở cả cực âm và cực dương.
Thế điện cực chuẩn của các cặp oxi hóa – khử của kim loại M+/M và R2+/R lần lượt là +0,799 V và +0,34 V. Nhận xét nào sau đây là đúng ở điều kiện chuẩn?
-
A.
M có tính khử mạnh hơn R.
-
B.
M+ có tính oxi hóa yếu hơn R2+.
-
C.
M khử được ion H+ thành H2.
-
D.
R khử được ion M+ thành M.
Cho giá trị thế điện cực chuẩn của 5 cặp oxi hóa-khử (Ag+/Ag, Al3+/Al, Cu2+/Cu, Fe2+/Fe, Zn2+/Zn) như khung bên dưới (được sắp xếp một cách ngẫu nhiên, không đúng theo thứ tự trên).
|
Thế điện cực chuẩn (Eo, V) |
–0,762 |
+0,799 |
–0,44 |
+0,340 |
–1,676 |
Cặp oxi hóa – khử có giá trị thế điện cực chuẩn +0,799 V là cặp
-
A.
Fe2+/Fe.
-
B.
Ag+/Ag.
-
C.
Zn2+/Zn.
-
D.
Al3+/Al.
Cho biết thế điện cực chuẩn của các cặp oxi hóa – khử Mg2+/Mg ; Zn2+/Zn ; Cu2+/Cu ; Ag+/Ag ; Hg2+/Hg lần lượt là – 2,37 V; – 0,76 V ; 0,34 V ; 0,8 V và 0,85 V. \(E_{pin}^0\) = 3,22 V là sức điện động chuẩn của pin nào trong số các pin sau?
-
A.
Zn – Ag
-
B.
Mg – Zn
-
C.
Zn – Hg
-
D.
Mg – Hg
Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu và ở anode có V mL khí O2 (25°C, 1 bar ) bay ra.
Giá trị của V là
-
A.
495,8.
-
B.
124,0.
-
C.
247,9.
-
D.
743,7.
Khi pin Galvani Zn-Cu hoạt động thì nồng độ
-
A.
Cu2+ giảm, Zn2+ tăng.
-
B.
Cu2+ giảm, Zn2+ giảm.
-
C.
Cu2+ tăng, Zn2+ tăng.
-
D.
Cu2+ tăng, Zn2+ giảm.
Cho các cấu hình electron nguyên tử sau:
1) 1s22s22p63s1 2) 1s22s22p63s23p64s2 3) 1s22s1 4) 1s22s22p63s23p1
Các cấu hình đó lần lượt là của những nguyên tố:
-
A.
Ca (Z=20), Na(Z=11), Li(Z=3), Al(Z=13)
-
B.
Na(Z=11), Ca(Z=20), Li(Z=3), Al(Z=13)
-
C.
Na(Z=11), Li(Z=3), Al(Z=13), Ca(Z=20)
-
D.
Li(Z=3), Na(Z=11), Al(Z=13), Ca(Z=20)
Liên kết trong mạng tinh thể kim loại là liên kết:
-
A.
Cộng hoá trị
-
B.
ion
-
C.
Kim loại
-
D.
Cho nhận
Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch FeCl3.
(2) Cho Ba vào lượng dư dung dịch CuSO4.
(3) Cho Zn vào dung dịch CuSO4.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Thí nghiệm nào thu được kim loại?
-
A.
(3) và (4).
-
B.
(1) và (2).
-
C.
(2) và (3).
-
D.
(1) và (4).
Cation kim loại X khi vào cơ thể sẽ gây nguy hiểm với sự phát triển cả về trí tuệ và thể chất con người. Ở các làng nghề tái chế acquy cũ, nhiều người bị ung thư, trẻ em chậm phát triển trí tuệ, còi cọc vì nhiễm độc cation kim loại này. Kim loại X là
-
A.
Cooper.
-
B.
Magnesium.
-
C.
Lead.
-
D.
Iron.
Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là
-
A.
1
-
B.
4
-
C.
3
-
D.
2
Cho các phát biểu về tách kim loại;
(1) Đồng có thể được tách từ copper(II) oxide bằng cách nung nóng.
(2) Trong phương pháp điện phân nóng chảy aluminium oxide, có thể thu được nhôm nóng chảy ở điện cực âm của bình điện phân.
(3) Kẽm có thể được tách từ zinc oxide bằng cách nung nóng zinc oxide với carbon.
Các phát biểu đúng là
-
A.
(1) và (2).
-
B.
(1) và (3).
-
C.
(2) và (3).
-
D.
(1), (2) và (3).
Trong công nghiệp, một số kim loại được điều chế bằng phương pháp điện phân dung dịch. Hơn 50% sản lượng kẽm trên thế giới được sản xuất bằng phương pháp điện phân
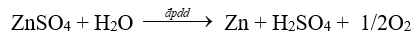
a. Khí oxygen sinh ra ở điện cực anode.
b. Ở anode xảy ra quá trình khử ion Zn2+
c. Ở cathode xảy ra quá trình oxi hóa nước thu được khí O2.
d. Phản ứng xảy ra tương tự khi thay ZnSO4 bằng Na2SO4.
Tiến hành thí nghiệm theo các bước sau đây:
- Bước 1: Nhỏ vào ba ống nghiệm, mỗi ống nghiệm 3 ml dung dịch HCl loãng cùng nồng độ.
- Bước 2: Cho lần lượt mẫu Al, mẫu Fe, mẫu Cu có số mol bằng nhau vào 3 ống nghiệm.
- Bước 3: Nhỏ tiếp vài giọt dung dịch CuSO4 vào các ống nghiệm.
a. Khí H2 thoát ở 2 ống nghiệm chứa Al và Fe; Al và Fe bị ăn mòn hoá học.
b. Mẫu Fe bị hòa tan nhanh hơn so với mẫu Al.
c. Ở bước 3, Al, Fe bị ăn mòn điện hoá, Cu bị ăn mòn hoá học.
d. Ở bước 3, khí thoát ra nhanh hơn so với ở bước 2.
Điện phân dung dịch hỗn hợp gồm: NaCl, Mg(NO3)2, ZnCl2; CuSO4 và Fe2(SO4)3, thu được bao nhiêu chất rắn ở cathode?
Đáp án:
Cho một pin Galvani với điện cực \({\rm{Zn}}\) và \({\rm{Cu}}\) có sức điện động chuẩn là 1,34V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02A. Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là bao nhiêu giờ ? Cho biết các công thức:
\({\rm{Q}} = {\rm{n}}.{\rm{F}} = {\rm{I}}.{\rm{t}}\), trong đó: \({\rm{Q}}\) là điện lượng \(({\rm{C}})\), \({\rm{n}}\) là số mol electron đi qua dây dẫn, \({\rm{I}}\) là cường độ dòng điện \(({\rm{A}}),{\rm{t}}\) là thời gian (giây), \({\rm{F}}\) là hằng số Faraday ( \(96500\,{\rm{Cmo}}{{\rm{l}}^{ - 1}}\) ).
Đáp án:
Một vết nứt trên đường ray tàu hỏa có thể tích 6,72 cm3. Dùng hỗn hợp tecmit (Al và Fe2O3 theo tỉ lệ mol tương ứng 2: 1) để hàn vết nứt trên.
Biết: lượng Fe cần hàn cho vết nứt bằng 79% lượng Fe sinh ra; khối lượng riêng của sắt là 7,9 gam/cm3; chỉ xảy ra phản ứng khử Fe2O3 thành Fe với hiệu suất của phản ứng bằng 96%. Khối lượng của hỗn hợp tecmit tối thiểu cần dùng là? (Làm tròn đến phần nguyên)
Đáp án:
Một học sinh đã đưa ra các phương án để điều chế copper như sau:
(1) Điện phân dung dịch CuSO4.
(2) Dùng potassium cho vào dung dịch CuSO4.
(3) Dùng carbon khử CuO ở nhiệt độ cao.
(4) Dùng CO khử CuO ở nhiệt độ cao.
Trong các phương án điều chế trên, phương án có thể áp dụng đề điều chế copper? Sắp xếp các phương án theo thứ tự đăng dần.
Đáp án:
Hoà tan hoàn toàn 10,4 gam hỗn hợp Mg, Al và Zn trong dung dịch HCl dư, thu được 7,437 lít khí H2 (đkc) và dung dịch chứa m gam muối. Giá trị của m là bao nhiêu?
Đáp án:
Cho các phát biểu sau
(a) Hợp kim được sử dụng trong đời sống và sản xuất phổ biến hơn so với kim loại.
(b) Kim loại A có nhiệt độ nóng chảy cao hơn kim loại B, nhiệt độ nóng chảy của hợp kim A-B luôn cao hơn nhiệt độ nóng chảy của B.
(c) Tính chất hoá học của hợp kim thường tương tự tính chất của các kim loại thành phần.
(d) Hợp kim có thể cứng hơn rất nhiều các kim loại tạo nên nó.
(e) Hợp kim thường khó bị oxi hoá hơn các đơn kim loại thành phần.
Số phát biểu đúng là ?
Đáp án:
Cho 4 dung dịch riêng biệt: (1) HCl, (2) CuCl2, (3) FeCl3, (4) hỗn hợp HCl, CuCl2. Nhúng một thanh sắt nguyên chất vào mỗi dung dịch nếu trên. Số trường hợp xuất hiện ăn mòn điện hoá là
Đáp án:
Trong hợp kim Al – Ni, cứ 10 mol Al thì có 1 mol Ni. Phần trăm về khối lượng của Ni trong mẫu hợp kim này là? Làm tròn đến hàng chục
Đáp án:
Lời giải và đáp án
Trong pin điện hóa, quá trình khử
-
A.
xảy ra ở cực âm.
-
B.
xảy ra ở cực dương.
-
C.
xảy ra ở cực âm và cực dương.
-
D.
không xảy ra ở cả cực âm và cực dương.
Đáp án : B
Dựa vào quá trình xảy ra trong pin điện.
Quá trình khử (nhận electron) xảy ra ở điện cực dương.
Đáp án B
Thế điện cực chuẩn của các cặp oxi hóa – khử của kim loại M+/M và R2+/R lần lượt là +0,799 V và +0,34 V. Nhận xét nào sau đây là đúng ở điều kiện chuẩn?
-
A.
M có tính khử mạnh hơn R.
-
B.
M+ có tính oxi hóa yếu hơn R2+.
-
C.
M khử được ion H+ thành H2.
-
D.
R khử được ion M+ thành M.
Đáp án : D
Dựa vào ý nghĩa của thế điện chuẩn của kim loại.
Kim loại R có tính khử mạnh hơn M
Ion R2+ có tính oxi hóa yếu hơn ion M+
Đáp án D
Cho giá trị thế điện cực chuẩn của 5 cặp oxi hóa-khử (Ag+/Ag, Al3+/Al, Cu2+/Cu, Fe2+/Fe, Zn2+/Zn) như khung bên dưới (được sắp xếp một cách ngẫu nhiên, không đúng theo thứ tự trên).
|
Thế điện cực chuẩn (Eo, V) |
–0,762 |
+0,799 |
–0,44 |
+0,340 |
–1,676 |
Cặp oxi hóa – khử có giá trị thế điện cực chuẩn +0,799 V là cặp
-
A.
Fe2+/Fe.
-
B.
Ag+/Ag.
-
C.
Zn2+/Zn.
-
D.
Al3+/Al.
Đáp án : B
Dựa vào ý nghĩa của thế điện cực chuẩn của kim loại.
Giá trị thế điện cực chuẩn +0,799V lớn nhất trong các thế điện cực chuẩn vậy ion kim loại có tính oxi hóa mạnh nhất.
Cặp oxi hóa – khử có giá trị thế điện cực chuẩn +0,799V là Ag+/Ag.
Đáp án B
Cho biết thế điện cực chuẩn của các cặp oxi hóa – khử Mg2+/Mg ; Zn2+/Zn ; Cu2+/Cu ; Ag+/Ag ; Hg2+/Hg lần lượt là – 2,37 V; – 0,76 V ; 0,34 V ; 0,8 V và 0,85 V. \(E_{pin}^0\) = 3,22 V là sức điện động chuẩn của pin nào trong số các pin sau?
-
A.
Zn – Ag
-
B.
Mg – Zn
-
C.
Zn – Hg
-
D.
Mg – Hg
Đáp án : D
Dựa vào công thức tính sức điện động của pin.
Cặp pin Mg – Hg có sức điện động 3,22V.
Đáp án D
Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu và ở anode có V mL khí O2 (25°C, 1 bar ) bay ra.
Giá trị của V là
-
A.
495,8.
-
B.
124,0.
-
C.
247,9.
-
D.
743,7.
Đáp án : C
Dựa vào phương pháp điện phân dung dịch.
n Cu = 1,28 : 64 = 0,02 mol
n e trao đổi = 0,02.2 = 0,04 mol
Tại anode: H2O → O2 + 4H+ + 4e
0,01 ← 0,04
V O2 = 0,01.24,79 = 0,2479L = 247,9ml
Đáp án C
Khi pin Galvani Zn-Cu hoạt động thì nồng độ
-
A.
Cu2+ giảm, Zn2+ tăng.
-
B.
Cu2+ giảm, Zn2+ giảm.
-
C.
Cu2+ tăng, Zn2+ tăng.
-
D.
Cu2+ tăng, Zn2+ giảm.
Đáp án : A
Dựa vào nguyên tắc hoạt động của pin Galvani.
Khi pin Galvani Zn – Cu hoạt động thì nồng độ Cu2+ giảm dần, Zn2+ tăng dần.
Đáp án A
Cho các cấu hình electron nguyên tử sau:
1) 1s22s22p63s1 2) 1s22s22p63s23p64s2 3) 1s22s1 4) 1s22s22p63s23p1
Các cấu hình đó lần lượt là của những nguyên tố:
-
A.
Ca (Z=20), Na(Z=11), Li(Z=3), Al(Z=13)
-
B.
Na(Z=11), Ca(Z=20), Li(Z=3), Al(Z=13)
-
C.
Na(Z=11), Li(Z=3), Al(Z=13), Ca(Z=20)
-
D.
Li(Z=3), Na(Z=11), Al(Z=13), Ca(Z=20)
Đáp án : B
Dựa vào đặc điểm cấu tạo của kim loại.
1. Na; 2. Ca; 3. Li; 4. Al
Đáp án B
Liên kết trong mạng tinh thể kim loại là liên kết:
-
A.
Cộng hoá trị
-
B.
ion
-
C.
Kim loại
-
D.
Cho nhận
Đáp án : C
Dựa vào liên kết trong kim loại.
Liên kết trong mạng tinh thể kim loại là liên kết kim loại.
Đáp án C
Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch FeCl3.
(2) Cho Ba vào lượng dư dung dịch CuSO4.
(3) Cho Zn vào dung dịch CuSO4.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Thí nghiệm nào thu được kim loại?
-
A.
(3) và (4).
-
B.
(1) và (2).
-
C.
(2) và (3).
-
D.
(1) và (4).
Đáp án : A
Dựa vào tính chất hóa học của kim loại.
(1) Mg + 2FeCl3 → MgCl2 + 2FeCl2
(2) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2
(3) Zn + CuSO4 → ZnSO4 + Cu
(4) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
Đáp án A
Cation kim loại X khi vào cơ thể sẽ gây nguy hiểm với sự phát triển cả về trí tuệ và thể chất con người. Ở các làng nghề tái chế acquy cũ, nhiều người bị ung thư, trẻ em chậm phát triển trí tuệ, còi cọc vì nhiễm độc cation kim loại này. Kim loại X là
-
A.
Cooper.
-
B.
Magnesium.
-
C.
Lead.
-
D.
Iron.
Đáp án : C
Dựa vào ứng dụng của kim loại.
Kim loại X là chì (lead)
Đáp án C
Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là
-
A.
1
-
B.
4
-
C.
3
-
D.
2
Đáp án : D
Dựa vào các phương pháp tách kim loại.
Cu và Ag là kim loại yếu nên được điều chế bằng phương pháp điện phân dung dịch.
Đáp án D
Cho các phát biểu về tách kim loại;
(1) Đồng có thể được tách từ copper(II) oxide bằng cách nung nóng.
(2) Trong phương pháp điện phân nóng chảy aluminium oxide, có thể thu được nhôm nóng chảy ở điện cực âm của bình điện phân.
(3) Kẽm có thể được tách từ zinc oxide bằng cách nung nóng zinc oxide với carbon.
Các phát biểu đúng là
-
A.
(1) và (2).
-
B.
(1) và (3).
-
C.
(2) và (3).
-
D.
(1), (2) và (3).
Đáp án : D
Dựa vào các phương pháp tách kim loại.
(1) đúng
(2) đúng
(3) đúng
Đáp án D
Trong công nghiệp, một số kim loại được điều chế bằng phương pháp điện phân dung dịch. Hơn 50% sản lượng kẽm trên thế giới được sản xuất bằng phương pháp điện phân
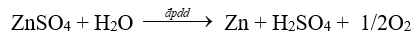
a. Khí oxygen sinh ra ở điện cực anode.
b. Ở anode xảy ra quá trình khử ion Zn2+
c. Ở cathode xảy ra quá trình oxi hóa nước thu được khí O2.
d. Phản ứng xảy ra tương tự khi thay ZnSO4 bằng Na2SO4.
a. Khí oxygen sinh ra ở điện cực anode.
b. Ở anode xảy ra quá trình khử ion Zn2+
c. Ở cathode xảy ra quá trình oxi hóa nước thu được khí O2.
d. Phản ứng xảy ra tương tự khi thay ZnSO4 bằng Na2SO4.
Dựa vào phương pháp điện phân dung dịch.
a. đúng, bên anode nước bị điện phân tạo ra khí oxygen.
b. sai, ở cathode xảy ra quá trình khử ion Zn2+
c. sai, ở anode xảy ra quá trình oxi hóa nước thu được khí O2.
d. sai, sodium không bị điện phân.
Tiến hành thí nghiệm theo các bước sau đây:
- Bước 1: Nhỏ vào ba ống nghiệm, mỗi ống nghiệm 3 ml dung dịch HCl loãng cùng nồng độ.
- Bước 2: Cho lần lượt mẫu Al, mẫu Fe, mẫu Cu có số mol bằng nhau vào 3 ống nghiệm.
- Bước 3: Nhỏ tiếp vài giọt dung dịch CuSO4 vào các ống nghiệm.
a. Khí H2 thoát ở 2 ống nghiệm chứa Al và Fe; Al và Fe bị ăn mòn hoá học.
b. Mẫu Fe bị hòa tan nhanh hơn so với mẫu Al.
c. Ở bước 3, Al, Fe bị ăn mòn điện hoá, Cu bị ăn mòn hoá học.
d. Ở bước 3, khí thoát ra nhanh hơn so với ở bước 2.
a. Khí H2 thoát ở 2 ống nghiệm chứa Al và Fe; Al và Fe bị ăn mòn hoá học.
b. Mẫu Fe bị hòa tan nhanh hơn so với mẫu Al.
c. Ở bước 3, Al, Fe bị ăn mòn điện hoá, Cu bị ăn mòn hoá học.
d. Ở bước 3, khí thoát ra nhanh hơn so với ở bước 2.
a. Đúng vì Al, Fe tác dụng được với dung dịch HCl
b. Sai vì Al có tính khử mạnh hơn Fe nên Al tan nhanh hơn Fe
c. Sai vì Cu không bị ăn mòn ở thí nghiệm này
d. Đúng, ở bước 2, khí thoát ra trên bề mặt kim loại Al, Fe cản trở sự tiếp xúc của dung dịch HCl với Al, Fe. Ở bước 3, khí thoát ra trên bề mặt Cu không gây cản trở sự tiếp xúc của Al, Fe với dung dịch HCl
Điện phân dung dịch hỗn hợp gồm: NaCl, Mg(NO3)2, ZnCl2; CuSO4 và Fe2(SO4)3, thu được bao nhiêu chất rắn ở cathode?
Đáp án:
Đáp án:
Dựa vào ứng dụng của phương pháp điện phân dung dịch.
ZnCl2, CuSO4 và Fe2(SO4)3 khi điện phân hoàn toàn thu được Cu và Fe ở cathode.
Đáp án 3
Cho một pin Galvani với điện cực \({\rm{Zn}}\) và \({\rm{Cu}}\) có sức điện động chuẩn là 1,34V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02A. Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là bao nhiêu giờ ? Cho biết các công thức:
\({\rm{Q}} = {\rm{n}}.{\rm{F}} = {\rm{I}}.{\rm{t}}\), trong đó: \({\rm{Q}}\) là điện lượng \(({\rm{C}})\), \({\rm{n}}\) là số mol electron đi qua dây dẫn, \({\rm{I}}\) là cường độ dòng điện \(({\rm{A}}),{\rm{t}}\) là thời gian (giây), \({\rm{F}}\) là hằng số Faraday ( \(96500\,{\rm{Cmo}}{{\rm{l}}^{ - 1}}\) ).
Đáp án:
Đáp án:
Dựa vào phương pháp điện phân dung dịch.
Thời gian tối đa mà pin tắp sáng được là: \(\frac{{n.F}}{I} = \frac{{0,2.96500}}{{0,02}} = 482500s\)=268 giờ
Đáp án 134
Một vết nứt trên đường ray tàu hỏa có thể tích 6,72 cm3. Dùng hỗn hợp tecmit (Al và Fe2O3 theo tỉ lệ mol tương ứng 2: 1) để hàn vết nứt trên.
Biết: lượng Fe cần hàn cho vết nứt bằng 79% lượng Fe sinh ra; khối lượng riêng của sắt là 7,9 gam/cm3; chỉ xảy ra phản ứng khử Fe2O3 thành Fe với hiệu suất của phản ứng bằng 96%. Khối lượng của hỗn hợp tecmit tối thiểu cần dùng là? (Làm tròn đến phần nguyên)
Đáp án:
Đáp án:
Dựa vào ứng dụng của phương pháp tách kim loại.
Khối lượng sắt cần hàn là: m = d.V = 6,72.7,9 = 53,088g
n Fe = 53,088 : 56 = 0,948 mol
Lượng sắt sinh ra từ phản ứng là: 53,088 : 79% = 67,2g
n Fe sinh ra: 67,2 : 56 = 1,2 mol
Fe2O3 + 2Al → 2Fe + Al2O3
n Al thực tế cần dùng: 1,2 : 96% = 1,25 mol
n Fe2O3 = 0,625 mol
Khối lượng tecmit cần dùng là: 1,25.27 + 0,625.160 = 133,75g ≈ 134g
Một học sinh đã đưa ra các phương án để điều chế copper như sau:
(1) Điện phân dung dịch CuSO4.
(2) Dùng potassium cho vào dung dịch CuSO4.
(3) Dùng carbon khử CuO ở nhiệt độ cao.
(4) Dùng CO khử CuO ở nhiệt độ cao.
Trong các phương án điều chế trên, phương án có thể áp dụng đề điều chế copper? Sắp xếp các phương án theo thứ tự đăng dần.
Đáp án:
Đáp án:
Cu là kim loại có tính khử yếu nên có thể dùng phương pháp thủy luyện, nhiệt luyện hoặc điện phân dung dịch để điều chế.
(1), (3), (4) là các phương án có thể điều chế Cu.
Sắp xếp: 134.
Hoà tan hoàn toàn 10,4 gam hỗn hợp Mg, Al và Zn trong dung dịch HCl dư, thu được 7,437 lít khí H2 (đkc) và dung dịch chứa m gam muối. Giá trị của m là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của kim loại.
n H2 = 7,437 : 24,79 = 0,3 mol
Áp dụng bảo toàn nguyên tố ta có: n HCl = 2. n H2 = 2.0,3 = 0,6 mol
Bảo toàn khối lượng: m hỗn hợp + m HCl = m muối + m H2
\( \to \)m muối = m hỗn hợp + m HCl – m H2 = 10,4 + 0,6.36,5 – 0,3.2 = 31,7gam
Đáp án 31,7
Cho các phát biểu sau
(a) Hợp kim được sử dụng trong đời sống và sản xuất phổ biến hơn so với kim loại.
(b) Kim loại A có nhiệt độ nóng chảy cao hơn kim loại B, nhiệt độ nóng chảy của hợp kim A-B luôn cao hơn nhiệt độ nóng chảy của B.
(c) Tính chất hoá học của hợp kim thường tương tự tính chất của các kim loại thành phần.
(d) Hợp kim có thể cứng hơn rất nhiều các kim loại tạo nên nó.
(e) Hợp kim thường khó bị oxi hoá hơn các đơn kim loại thành phần.
Số phát biểu đúng là ?
Đáp án:
Đáp án:
Dựa vào tính chất của hợp kim
(a) đúng
(b) sao, hợp kim A-B có thể có nhiệt độ nóng chảy thấp hơn.
(c) đúng
(d) đúng
(e) đúng
Đáp án 4
Cho 4 dung dịch riêng biệt: (1) HCl, (2) CuCl2, (3) FeCl3, (4) hỗn hợp HCl, CuCl2. Nhúng một thanh sắt nguyên chất vào mỗi dung dịch nếu trên. Số trường hợp xuất hiện ăn mòn điện hoá là
Đáp án:
Đáp án:
Dựa vào sự ăn mòn kim loại.
Khi nhúng thanh sắt nguyên chất vào dung dịch (2) và (4) sẽ xảy ra ăn mòn điện hóa
Đáp án 2
Trong hợp kim Al – Ni, cứ 10 mol Al thì có 1 mol Ni. Phần trăm về khối lượng của Ni trong mẫu hợp kim này là? Làm tròn đến hàng chục
Đáp án:
Đáp án:
Dựa vào thành phần của hợp kim.
%Ni = \(\frac{{1.58}}{{10.27 + 1.58}}.100\% = 17,68\% \) ≈ 17,7%
Dựa vào phương pháp tách kim loại.
Khối lượng sắt có trong 1 tấn gang là: 1.95% = 0,95 tấn
Fe2O3 → 2Fe
0,95
m Fe2O3 = \(\frac{{0,95}}{{56.2}}:80\% .160 = 1,7\tan \)
Khối lượng quặng hematite: 1,7 : 60% = 2,8 tấn
Dựa vào tính chất hóa học của kim loại.
n H2 = 0,7437 : 24,79 = 0,03 mol n Mg + n Zn = n H2 = 0,03 mol
n CuSO4 = 0,2.0,2 = 0,04 mol
gọi số mol lần lượt của Mg và Zn là a và b mol
ta có: a + b = 0,03 mol
thí nghiệm 2:
Mg + CuSO4 MgSO4 + Cu (1)
a a a
Zn + CuSO4 ZnSO4 + Cu (2)
b b b
Ta có: n CuSO4 = a + b = 0,04 > a + b = 0,03 nên CuSO4 dư.
n Cu = a + b = 0,03 mol m Cu = 0,03.64 = 1,92g
Trong pin Galvani thì
Cho biết các phản ứng xảy ra sau:
Cặp oxi hóa – khử của kim loại là
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là










Danh sách bình luận