Đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo - Đề số 2
Cặp oxi hóa – khử của kim loại là
Đề bài
Cặp oxi hóa – khử của kim loại là
-
A.
dạng oxi hóa và dạng khử tương ứng của một nguyên tố.
-
B.
dạng oxi hóa và dạng khử tương ứng của một nguyên tố kim loại.
-
C.
dạng khử và dạng oxi hóa tương ứng của một nguyên tố.
-
D.
dạng khử và dạng oxi hóa tương ứng của một nguyên tố kim loại.
Cho hình minh họa điện cực hydrogen chuẩn như sau:
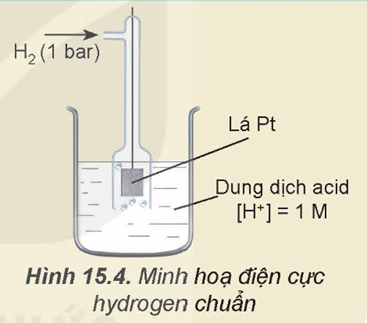
Cho biết tại ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng nào sau đây?
-
A.
H2O + 2e → ½ H2 + OH-
-
B.
Pt → Pt2+ + 2e
-
C.
2H+ + 2e ⥦ H2
-
D.
H2O → ½ O2 + 2H+ + 2e
Phản ứng nào xảy ra ở cathode trong quá trình điện phân MgCl2 nóng chảy?
-
A.
Sự oxi hóa ion Mg2+
-
B.
Sự khử ion Mg2+
-
C.
Sự oxi hóa ion Cl-
-
D.
Sự khử ion Cl-
Ứng dụng nào sau đây không phải là ứng dụng của phương pháp điện phân?
-
A.
Sản xuất kim loại
-
B.
Tinh chế kim loại
-
C.
Mạ điện
-
D.
Tìm hiểu tính chất của kim loại
Sản phẩm thu được trong quá trình điện phân dung dịch NaCl có màng ngăn xốp là
-
A.
NaOH; Cl2; H2
-
B.
Na; Cl2
-
C.
NaOH; O2; Cl2
-
D.
Na; H2; Cl2
Vai trò của cầu muối trong pin điện hóa là
-
A.
cung cấp thêm ion cho các dung dịch muối
-
B.
cân bằng điện tích trong các dung dịch
-
C.
làm chất xúc tác cho phản ứng oxi hóa – khử xảy ra khi pin hoạt động
-
D.
con đường di chuyển của các electron từ cực âm sang cực dương
Kim loại có tính dẻo là nhờ:
-
A.
Các nút của mạng tinh thể dao động liên tục làm kim loại không bị gãy rời.
-
B.
Các electron tự do chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau.
-
C.
Các ion dương chuyển động nhanh giữ cho các lớp mạng không tách rời nhau.
-
D.
Các nút mạng chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau.
Bản chất của liên kết kim loại:
-
A.
Lực hút tĩnh điện của các ion trái dấu.
-
B.
Được hình thành do sự dùng chung các electron tự do.
-
C.
Là lực hút tĩnh điện giữa các electron tự do trong mạng tinh thể với các ion dương ở nút mạng.
-
D.
Lực hút tĩnh điện giữa electron với các ion dương trong mạng tinh thể.
Khi pin điện hoá Zn-Cu hoạt động, phản ứng xảy ra ở cathode là
-
A.
Cu2+ + 2e → Cu.
-
B.
Zn2+ + 2e → Zn.
-
C.
Cu → Cu2+ + 2e.
-
D.
Zn → Zn2+ + 2e.
Cấu hình electron của Sodium (Z = 11) là
-
A.
1s22s22p63s23p63d34s2
-
B.
1s22s22p63s1
-
C.
1s22s22p63s23p1
-
D.
1s22s22p6
Dãy kim loại tác dụng được với nước ở nhiệt độ thường là
-
A.
Fe, Zn, Li, Sn
-
B.
Cu, Pb, Rb, Ag
-
C.
K, Na, Ca, Ba
-
D.
Al, Hg, Cs, Sr
Thực hiện thí nghiệm sau: Cho đinh sắt (iron) vào cốc. Thêm tiếp 2 – 3 mL dung dịch CuSO4 1M. Sau 5 phút, dùng kẹp lấy đinh sắt (iron) ra khỏi dung dịch. Hiện tượng quan sát được là:
-
A.
Có lớp chất rắn màu trắng bám lên đinh sắt (iron).
-
B.
Có lớp chất rắn màu đen bám lên đinh sắt (iron).
-
C.
Có lớp chất rắn màu đỏ bám lên đinh sắt (iron).
-
D.
Có lớp chất rắn màu vàng bám lên đinh sắt (iron).
Dựa vào giá trị thế điện cực chuẩn của hai cặp oxi hoá – khử có thể dự đoán được vai trò của mỗi chất và chiều phản ứng xảy ra giữa chúng như sau:
a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Tiến hành thí nghiệm điện phân dung dịch CuSO4 với hai điện cực bằng than chì, khi dung dịch vẫn còn màu xanh thì dừng điện phân.
a) Tại anode xảy ra quá trình khử nước.
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
Những ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) dưới lòng đất được quấn quanh bởi những vòng kim loại để chống ăn mòn bằng phương pháp điện hoá. Có bao nhiêu kim loại có thể làm thành vòng trong số các kim loại sau: Na, Mg, Zn, Fe, Cu, Ag?
Đáp án:
Cho thế điện cực chuẩn của các cặp oxi hoá – khử của kim loại:
|
Cặp oxi hoá – khử |
Fe2+/Fe |
Na+/Na |
Ag+/Ag |
Mg2+/Mg |
Cu2+/Cu |
|
Thế điện cực chuẩn, V |
–0,44 V |
–2,713 |
0,799 |
–2,353 |
+0,340 |
Ở điều kiện chuẩn, có bao nhiêu ion kim loại oxi hoá được Fe thành Fe2+?
Đáp án:
Hoà tan hết 1,635 g kim loại R (hoá trị II) vào dung dịch H2SO4 loãng, thu được 619,75 mL khí H2 (250 C, 1 bar). Nguyên tử khối của kim loại R là bao nhiêu ? (Làm tròn kết quả đến phần mười)
Đáp án:
Người ta mạ nickel lên mẫu vật kim loại bằng phương pháp mạ điện trong bể mạ chứa dung dịch nickel sulfate với cường độ dòng diện 2,5A. Kích thước mẫu vật kim loại hình trụ đặc có bán kính 2,5cm, cao 20cm. Lớp mạ nickel dày 0,4 mm. Tính thời gian (giờ) cần thực hiện. Biết: Nikel có khối lượng riêng D = 8,9 g/cm3; khối lượng mol nguyên tử là 58,7(g/mol), lấy π là 3,14.
Đáp án:
Trong công nghiệp luyện kim, quặng blende có thành phần chính là zinc sulfide (ZnS) được sử dụng làm nguyên liệu để sản xuất zinc. Quá trình xảy ra theo các giai đoạn:
ZnS(s) + 3/2O2 (g) → ZnO(s) + SO2 (g) (1)
ZnO(s) + C(s) → Zn(s) + CO(g) (2)
|
Chất |
ZnS(s) |
ZnO(s) |
Zn(s) |
SO2(g) |
CO(g) |
|
( KJ/ mol) |
–206,0 |
–350,4 |
+130,4 |
–296,8 |
–110,5 |
Nhiệt lượng cần cung cấp để sản xuất 1 tấn Zn ở (2) là x.106 ( Làm tròn kết quả đến phần mười). Giá trị của x là?
Đáp án:
Cho 10,8 g kim loại M phản ứng hoàn toàn với khí chlorine dư, thu được 53,4g muối. Phân tử khối của M là?
Đáp án:
Biết \(E_{pin}^o(Mg - Fe)\)= 1,93V và \(E_{F{e^{2 + }}/Fe}^o = - 0,44V\). Giá trị \(E_{M{g^{2 + }}/Mg}^o\)là?
Đáp án:
Điện phân dung dịch CuSO4 (điện cực trơ) cho đến khi ở cathode thu được 3,2 gam kim loại thì thể tích khí (đkc) thu được ở anode là V (L). Giá trị của V gần nhất là?
Đáp án:
Lời giải và đáp án
Cặp oxi hóa – khử của kim loại là
-
A.
dạng oxi hóa và dạng khử tương ứng của một nguyên tố.
-
B.
dạng oxi hóa và dạng khử tương ứng của một nguyên tố kim loại.
-
C.
dạng khử và dạng oxi hóa tương ứng của một nguyên tố.
-
D.
dạng khử và dạng oxi hóa tương ứng của một nguyên tố kim loại.
Đáp án : B
Dựa vào cặp oxi hóa – khử của kim loại.
Cặp oxi hóa – khử của kim loại là dạng oxi hóa và dạng khử tương ứng của một nguyên tố kim loại.
Đáp án B
Cho hình minh họa điện cực hydrogen chuẩn như sau:

Cho biết tại ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng nào sau đây?
-
A.
H2O + 2e → ½ H2 + OH-
-
B.
Pt → Pt2+ + 2e
-
C.
2H+ + 2e ⥦ H2
-
D.
H2O → ½ O2 + 2H+ + 2e
Đáp án : C
Dựa vào pin điện Galvani.
Ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng 2H+ + 2e ⥦ H2
Đáp án C
Phản ứng nào xảy ra ở cathode trong quá trình điện phân MgCl2 nóng chảy?
-
A.
Sự oxi hóa ion Mg2+
-
B.
Sự khử ion Mg2+
-
C.
Sự oxi hóa ion Cl-
-
D.
Sự khử ion Cl-
Đáp án : B
Dựa vào phương pháp điện phân nóng chảy.
Ở cathode, xảy ra quá trình khử ion Mg2+
Đáp án B
Ứng dụng nào sau đây không phải là ứng dụng của phương pháp điện phân?
-
A.
Sản xuất kim loại
-
B.
Tinh chế kim loại
-
C.
Mạ điện
-
D.
Tìm hiểu tính chất của kim loại
Đáp án : D
Dựa vào ứng dụng của điện phân
Ứng dụng của phương pháp điện phân không tìm hiểu tính chất của kim loại.
Đáp án D
Sản phẩm thu được trong quá trình điện phân dung dịch NaCl có màng ngăn xốp là
-
A.
NaOH; Cl2; H2
-
B.
Na; Cl2
-
C.
NaOH; O2; Cl2
-
D.
Na; H2; Cl2
Đáp án : A
Dựa vào phương pháp điện phân dung dịch.
Vai trò của cầu muối trong pin điện hóa là
-
A.
cung cấp thêm ion cho các dung dịch muối
-
B.
cân bằng điện tích trong các dung dịch
-
C.
làm chất xúc tác cho phản ứng oxi hóa – khử xảy ra khi pin hoạt động
-
D.
con đường di chuyển của các electron từ cực âm sang cực dương
Đáp án : B
Dựa vào cấu tạo pin điện Galvani
Cầu muối có tác dụng làm câu bằng điện tích trong dung dịch.
Đáp án B
Kim loại có tính dẻo là nhờ:
-
A.
Các nút của mạng tinh thể dao động liên tục làm kim loại không bị gãy rời.
-
B.
Các electron tự do chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau.
-
C.
Các ion dương chuyển động nhanh giữ cho các lớp mạng không tách rời nhau.
-
D.
Các nút mạng chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau.
Đáp án : B
Dựa vào tính chất vật lí của kim loại.
Kim loại có tính dẻo là nhớ các electron tự do chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau.
Đáp án B
Bản chất của liên kết kim loại:
-
A.
Lực hút tĩnh điện của các ion trái dấu.
-
B.
Được hình thành do sự dùng chung các electron tự do.
-
C.
Là lực hút tĩnh điện giữa các electron tự do trong mạng tinh thể với các ion dương ở nút mạng.
-
D.
Lực hút tĩnh điện giữa electron với các ion dương trong mạng tinh thể.
Đáp án : C
Dựa vào đặc điểm liên kết kim loại.
Bản chất của liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron tự do trong mạng tinh thể với các ion dương ở nút mạng.
Đáp án C
Khi pin điện hoá Zn-Cu hoạt động, phản ứng xảy ra ở cathode là
-
A.
Cu2+ + 2e → Cu.
-
B.
Zn2+ + 2e → Zn.
-
C.
Cu → Cu2+ + 2e.
-
D.
Zn → Zn2+ + 2e.
Đáp án : A
Dựa vào quá trình xảy ra ở pin điện hóa.
Ở cathode xảy ra quá trình khử Cu2+ + 2e → Cu
Đáp án A
Cấu hình electron của Sodium (Z = 11) là
-
A.
1s22s22p63s23p63d34s2
-
B.
1s22s22p63s1
-
C.
1s22s22p63s23p1
-
D.
1s22s22p6
Đáp án : B
Dựa vào đặc điểm cấu tạo của kim loại.
Cấu hình electron của Na là: 1s22s22p63s1
Đáp án B
Dãy kim loại tác dụng được với nước ở nhiệt độ thường là
-
A.
Fe, Zn, Li, Sn
-
B.
Cu, Pb, Rb, Ag
-
C.
K, Na, Ca, Ba
-
D.
Al, Hg, Cs, Sr
Đáp án : C
Dựa vào tính chất hóa học của kim loại.
Na, K, Ca, Ba có thể tác dụng với nước ở nhiệt độ thường.
Đáp án C
Thực hiện thí nghiệm sau: Cho đinh sắt (iron) vào cốc. Thêm tiếp 2 – 3 mL dung dịch CuSO4 1M. Sau 5 phút, dùng kẹp lấy đinh sắt (iron) ra khỏi dung dịch. Hiện tượng quan sát được là:
-
A.
Có lớp chất rắn màu trắng bám lên đinh sắt (iron).
-
B.
Có lớp chất rắn màu đen bám lên đinh sắt (iron).
-
C.
Có lớp chất rắn màu đỏ bám lên đinh sắt (iron).
-
D.
Có lớp chất rắn màu vàng bám lên đinh sắt (iron).
Đáp án : C
Dựa vào tính chất hóa học của kim loại.
Hiện tượng quan sát được: Fe tan dần ra, có lớp rắn màu đỏ bám lên đinh sắt.
Đáp án C
Dựa vào giá trị thế điện cực chuẩn của hai cặp oxi hoá – khử có thể dự đoán được vai trò của mỗi chất và chiều phản ứng xảy ra giữa chúng như sau:
a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Dựa vào giá trị thế điện cực chuẩn của kim loại.
a) đúng
b) đúng
c) đúng
d) sai, dạng khử của cặp có giá trị thế điện cực chuẩn nhỏ hơn khử dạng oxi hóa của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Tiến hành thí nghiệm điện phân dung dịch CuSO4 với hai điện cực bằng than chì, khi dung dịch vẫn còn màu xanh thì dừng điện phân.
a) Tại anode xảy ra quá trình khử nước.
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
a) Tại anode xảy ra quá trình khử nước.
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
Dựa vào phương pháp điện phân dung dịch.
a) Sai, Tại anode xảy ra quá trình oxi hóa nước.
b) Đúng
c) Sai, pH dung dịch điện phân giảm dần trong thời gian điện phân vì sinh ra ion H+ tại cực anode.
d) Đúng
Những ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) dưới lòng đất được quấn quanh bởi những vòng kim loại để chống ăn mòn bằng phương pháp điện hoá. Có bao nhiêu kim loại có thể làm thành vòng trong số các kim loại sau: Na, Mg, Zn, Fe, Cu, Ag?
Đáp án:
Đáp án:
Dựa vào các biện pháp chống ăn mòn kim loại.
Thép là hợp kim của sắt và carbon, nên để bảo vệ sắt cần làm vòng bằng kim loại có tính khử mạnh hơn Fe
Kim loại có tính khử mạnh hơn Fe: Mg và Zn
Đáp án 2
Cho thế điện cực chuẩn của các cặp oxi hoá – khử của kim loại:
|
Cặp oxi hoá – khử |
Fe2+/Fe |
Na+/Na |
Ag+/Ag |
Mg2+/Mg |
Cu2+/Cu |
|
Thế điện cực chuẩn, V |
–0,44 V |
–2,713 |
0,799 |
–2,353 |
+0,340 |
Ở điều kiện chuẩn, có bao nhiêu ion kim loại oxi hoá được Fe thành Fe2+?
Đáp án:
Đáp án:
Dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử
Ion kim loại Cu2+ và Ag+ oxi hóa được Fe thành Fe2+
Đáp án 2
Hoà tan hết 1,635 g kim loại R (hoá trị II) vào dung dịch H2SO4 loãng, thu được 619,75 mL khí H2 (250 C, 1 bar). Nguyên tử khối của kim loại R là bao nhiêu ? (Làm tròn kết quả đến phần mười)
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của kim loại
n H2 = 619,75.10-3 : 24,79 = 0,025 mol
R + H2SO4 → RSO4 + H2
0,025 ← 0,025
MR = 1,635 : 0,025 = 65,4
Người ta mạ nickel lên mẫu vật kim loại bằng phương pháp mạ điện trong bể mạ chứa dung dịch nickel sulfate với cường độ dòng diện 2,5A. Kích thước mẫu vật kim loại hình trụ đặc có bán kính 2,5cm, cao 20cm. Lớp mạ nickel dày 0,4 mm. Tính thời gian (giờ) cần thực hiện. Biết: Nikel có khối lượng riêng D = 8,9 g/cm3; khối lượng mol nguyên tử là 58,7(g/mol), lấy π là 3,14.
Đáp án:
Đáp án:
Dựa vào ứng dụng của phương pháp điện phân.
- Thể tích hình trụ đặc chưa mạ nickel:
V1 = π.r2.h = 3,14x 2,5x2,5x20 = 392,5 cm3
- Thể tích hình trụ đã mạ nickel:
V2 = π.(r+ 0,04)2.(h +0,08)= 3,14x(2,5+ 0,04)x(2,5+ 0,04) x(20+0,08) = 406,78 cm3
- Thể tích nickel đã mạ lên hình trụ là:
V2 - V1 = 406,78 - 392,5= 14,28 cm3
- Khối lượng nickel cần dùng: 14,28 x 8,9 = 127,092 gam
- Thời gian cần điện phân để mạ là
t = m.n.F/A.I = 167146,55 giây= 46,4 giờ
Trong công nghiệp luyện kim, quặng blende có thành phần chính là zinc sulfide (ZnS) được sử dụng làm nguyên liệu để sản xuất zinc. Quá trình xảy ra theo các giai đoạn:
ZnS(s) + 3/2O2 (g) → ZnO(s) + SO2 (g) (1)
ZnO(s) + C(s) → Zn(s) + CO(g) (2)
|
Chất |
ZnS(s) |
ZnO(s) |
Zn(s) |
SO2(g) |
CO(g) |
|
( KJ/ mol) |
–206,0 |
–350,4 |
+130,4 |
–296,8 |
–110,5 |
Nhiệt lượng cần cung cấp để sản xuất 1 tấn Zn ở (2) là x.106 ( Làm tròn kết quả đến phần mười). Giá trị của x là?
Đáp án:
Đáp án:
Dựa vào công thức tính biến thiên enthalpy của phản ứng
\({\Delta _r}H_{298}^0\)= +130,4 × 1 – 110,5 × 1 – (–350,4 × 1) = +370,3 (kJ).
Nhiệt lượng cần cung cấp = 370,3.106 /65 = 5,7.106 ( kJ)
Cho 10,8 g kim loại M phản ứng hoàn toàn với khí chlorine dư, thu được 53,4g muối. Phân tử khối của M là?
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của kim loại.
2M + xCl2 → 2MClx
Bảo toàn khối lượng: m M + m Cl2 = m muối
→ m Cl2 = 53,4 – 10,8 = 42,6g
n Cl2 = 42,6 : 71 = 0,6 mol
Theo PTHH: n M = \(\frac{{0,6.2}}{x} = \frac{{1,2}}{x}\)mol
M M = \(\frac{{10,8}}{{\frac{{1,2}}{x}}} = 9{\rm{x}}\)
Với x = 3 → MM = 27 (Al)
Biết \(E_{pin}^o(Mg - Fe)\)= 1,93V và \(E_{F{e^{2 + }}/Fe}^o = - 0,44V\). Giá trị \(E_{M{g^{2 + }}/Mg}^o\)là?
Đáp án:
Đáp án:
Dựa vào công thức tính sức điện động của pin.
\(E_{pin}^o(Mg - Fe)\) = \(E_{F{e^{2 + }}/Fe}^o\) - \(E_{M{g^{2 + }}/Mg}^o\)→ \(E_{M{g^{2 + }}/Mg}^o\)= \(E_{F{e^{2 + }}/Fe}^o\)- \(E_{pin}^o(Mg - Fe)\)= -0,44 – 1,93 = - 2,37V
Điện phân dung dịch CuSO4 (điện cực trơ) cho đến khi ở cathode thu được 3,2 gam kim loại thì thể tích khí (đkc) thu được ở anode là V (L). Giá trị của V gần nhất là?
Đáp án:
Đáp án:
Dựa vào phương pháp điện phân dung dịch.
Kim loại thu được ở cathode là copper (Cu)
n Cu = 3,2 : 64 = 0,05 mol
ne trao đổi = 0,05.2 = 0,1 mol
Tại anode: H2O → O2 + 4H+ + 4e
0,025 ← 0,1
V O2 = 0,025.24,79 = 0,62 Lít.
Tính thể tích lớp mạ kẽm sau đó tính khối lượng kẽm cần dùng.
+ Diện tích bề mặt = 3 m² = 30.000 cm² (1 m² = 10.000 cm²).
+ Độ dày = 0,05 mm = 0,005 cm.
Tính thể tích lớp mạ kẽm:
+ Thể tích = Diện tích bề mặt * Độ dày = 30.000 cm² * 0,005 cm = 150 cm³.
Tính khối lượng kẽm:
+ Khối lượng kẽm = Thể tích * Khối lượng riêng = 150 cm³ * 7,14 g/cm³ = 1071 g = 1,071 kg. Vậy khối lượng kẽm cần thiết để mạ 1 tấm thép là 1,071 kg.
Vậy khối lượng kẽm cần thiết để mạ 3 tấm thép là 3,21 kg.
Dựa vào tính chất hóa học của kim loại.
nFe = 0,06 mol; nS = 0,04 mol.
Fe + S FeS
nbđ 0,06 0,04
nsp.ư 0,02 0 0,04
hỗn hợp Y gồm: Fe (0,02 mol); FeS (0,04 mol)
Fe + 2HCl FeCl2 + H2
0,02 0,02
FeS + 2HCl FeCl2 + H2S
0,04 0,04
Hỗn hợp khí Z gồm ( H2: 0,02 mol; H2S: 0,04 mol ) + O2
2H2 + O2 2H2O
0,02 0,01
2H2S + 3O2 2SO2 + 2H2O
0,04 0,06
nO2 = 0,07 mol.
Trong pin điện hóa, quá trình khử
Trong pin Galvani thì
Cho biết các phản ứng xảy ra sau:
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là










Danh sách bình luận