Trong công nghiệp, kim loại nhôm được sản xuất từ quặng bauxite Al2O3.2H2O bằng phương pháp điện phân nóng chảy với điện cực than chì và có mặt cryolite. Ở cathode thu được kim loại nhôm, ở anode chỉ thu được hỗn hợp khí CO và CO2 theo tỉ lệ thể tích 1:1. Nếu thu được 99,16 m3 (ở đkc) hỗn hợp khí ở anode thì cần bao nhiêu quặng bauxite, biết hiệu suất cả quá trình điện phân là 80%?
Dựa vào phương pháp tách kim loại.
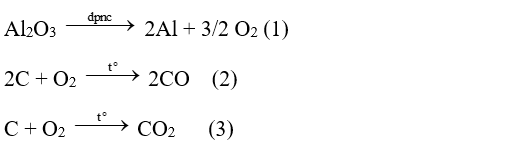
Vì nCO = nCO2 = \(\frac{{99,{{16.10}^3}}}{{24,79}}.\frac{1}{2}\) = 2.103 mol
Theo (2) và (3), ta được: nO2 = \(\frac{1}{2}{n_{CO}} + {n_{C{O_2}}}\)= \(\frac{1}{2} \times {2.10^3} + {2.10^3} = {3.10^3}\) (mol)
Theo (1), nAl2O3 = \(\frac{2}{3}{n_{{O_2}}} = \frac{2}{3}{.3.10^3}\) = 2.103 (mol)
Khối lượng quặng: mAl2O3.2H2O = 2.103.138 = 276.103 (gam) = 276 kg
Vì hiệu suất cả quá trình là 80% nên mquặng = 276.100/80 = 345 (kg).








Danh sách bình luận