Đề thi giữa kì 1 Hóa 11 Cánh diều - Đề số 9
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
Đề bài
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
-
A.
NH3 + HCl \( \to \)NH4Cl
-
B.
8NH3 + 3Cl2 \( \to \)6NH4Cl + N2
-
C.
2NH3 + 3CuO \( \to \)3Cu + N2 + 3H2O
-
D.
4NH3 + 5O2 \( \to \)4NO + 6H2O.
Hệ cân bằng sau được thực hiện trong bình kín:
CO(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO2(g) + H2(g) \({\Delta _r}H_{298}^o < 0\)
Cân bằng trên chuyển dịch theo chiều thuận khi
-
A.
Cho chất xúc tác vào hệ
-
B.
Giảm nhiệt độ của hệ.
-
C.
Thêm khí H2 vào hệ
-
D.
Tăng áp suất chung của hệ.
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
-
A.
chất
-
B.
ion âm
-
C.
ion trái dấu
-
D.
ion dương
Phát biểu nào sau đây không đúng?
-
A.
phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau trong cùng một điều kiện.
-
B.
khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
-
C.
sự chuyển dịch cân bằng của phản ứng: 2NO2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)N2O4(g) phụ thuộc sự thay đổi áp suất.
-
D.
cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
Theo Bronsted, phát biểu nào dưới đây đúng?
-
A.
Acid là chất có khả năng cho proton.
-
B.
Acid là chất hòa tan được mọi kim loại.
-
C.
Acid là chất điện li mạnh.
-
D.
Acid tác dụng được với mọi base.
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng. Thành phần của khói trắng là
-
A.
H2O(g)
-
B.
NH4Cl
-
C.
NH3
-
D.
HCl
Các yếu tố ảnh hưởng đến cân bằng hóa học là
-
A.
Nồng độ, áp suất và diện tích bề mặt.
-
B.
Áp suất, nhiệt độ và chất xúc tác.
-
C.
Nồng độ, nhiệt độ và chất xúc tác.
-
D.
Nồng độ, nhiệt độ và áp suất.
Dung dịch nào sau đây có pH > 7?
-
A.
HClO4
-
B.
NaCl
-
C.
NaOH
-
D.
HF
Nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng là do nitric acid có
-
A.
tính base mạnh
-
B.
tính khử mạnh
-
C.
tính acid mạnh
-
D.
tính oxi hóa mạnh.
Xét câu bằng: \(F{e_2}{O_3}(s) + 3CO(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2Fe(s) + 3C{O_2}(g)\). Biểu thức hằng số cân bằng của hệ là
-
A.
\({K_C} = \frac{{{{{\rm{[}}Fe]}^2}.{{{\rm{[CO]}}}^3}}}{{{\rm{[}}F{e_2}{O_3}]{{{\rm{[}}C{O_2}]}^2}}}\)
-
B.
\({K_C} = \frac{{{{{\rm{[}}C{O_2}]}^3}}}{{{{{\rm{[}}CO]}^3}}}\)
-
C.
\({K_C} = \frac{{{\rm{[}}F{e_2}{O_3}]{{{\rm{[}}CO]}^3}}}{{{{{\rm{[}}Fe]}^2}{{{\rm{[C}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}^2}}}\)
-
D.
\({K_C} = \frac{{{{{\rm{[}}CO]}^3}}}{{{{{\rm{[}}C{O_2}]}^3}}}\)
Cho 7,437 lít N2 tác dụng với 12,395 lít H2, thu được 14,874 lít hỗn hợp khí. Hiệu suất của phản ứng là
-
A.
50%
-
B.
30%
-
C.
60%
-
D.
40%
Chất nào sau đây không phải chất điện li
-
A.
HCl
-
B.
HNO3
-
C.
NaOH
-
D.
C6H12O6
Công thức tính pH là
-
A.
pH = - lg [OH-]
-
B.
pH = - lg[H+]
-
C.
pH = 10.lg[H+]
-
D.
pH = lg[H+]
Trộn 200ml dung dịch H2SO4 0,1375M với 300ml dung dịch NaOH 0,2M. Tính pH của dung dịch tạo thành
-
A.
pH = 10
-
B.
pH = 2
-
C.
pH = 7
-
D.
pH = 12
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10ml dung dịch HCl này cần 20ml dung dịch NaOH. Giá trị nồng độ của dung dịch HCl trên là?
-
A.
0,25
-
B.
0,5
-
C.
0,2
-
D.
0,15
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
-
A.
HNO3 tan nhiều trong nước.
-
B.
khi để lâu thì HNO3 bị khử bởi các chất của môi trường
-
C.
dung dịch HNO3 có tính oxi hóa mạnh.
-
D.
dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Oxide phổ biến của nitrogen trong không khí là
-
A.
NO, N2O.
-
B.
NO, NO2.
-
C.
N2O3, NO2.
-
D.
NO, N2O4.
-
A.
chỉ thể hiện tính oxi hóa.
-
B.
chỉ thể hiện tính khử.
-
C.
thể hiện tính khử và tính oxi hóa.
-
D.
không thể hiện tính khử và tính oxi hóa.
Phản ứng trên là phản ứng thuận nghịch.
Cl2, H2O là chất tham gia của phản ứng thuận.
HCl, HClO là sản phẩm của phản ứng nghịch.
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Xét tính chất hóa học của NH3.
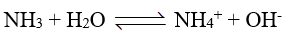
Khí NH3 tác dụng với nước theo phản ứng:
Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Phản ứng: 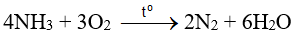 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
Nitric acid là một chất có tính oxi hóa mạnh.
Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Lời giải và đáp án
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
-
A.
NH3 + HCl \( \to \)NH4Cl
-
B.
8NH3 + 3Cl2 \( \to \)6NH4Cl + N2
-
C.
2NH3 + 3CuO \( \to \)3Cu + N2 + 3H2O
-
D.
4NH3 + 5O2 \( \to \)4NO + 6H2O.
Đáp án : A
Dựa vào tính chất hóa học của ammonia.
Khí NH3 không thể hiện tính khử khi phản ứng với HCl, vì không thay đổi số oxi hóa.
Đáp án A
Hệ cân bằng sau được thực hiện trong bình kín:
CO(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO2(g) + H2(g) \({\Delta _r}H_{298}^o < 0\)
Cân bằng trên chuyển dịch theo chiều thuận khi
-
A.
Cho chất xúc tác vào hệ
-
B.
Giảm nhiệt độ của hệ.
-
C.
Thêm khí H2 vào hệ
-
D.
Tăng áp suất chung của hệ.
Đáp án : B
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier.
Cân bằng trên chuyển dịch theo chiều thuận khi giảm nhiệt độ của hệ vì phản ứng tỏa nhiệt.
Đáp án B
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
-
A.
chất
-
B.
ion âm
-
C.
ion trái dấu
-
D.
ion dương
Đáp án : C
Dựa vào chất điện li.
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các ion trái dấu.
Đáp án C
Phát biểu nào sau đây không đúng?
-
A.
phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau trong cùng một điều kiện.
-
B.
khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
-
C.
sự chuyển dịch cân bằng của phản ứng: 2NO2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)N2O4(g) phụ thuộc sự thay đổi áp suất.
-
D.
cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
Đáp án : D
Dựa vào cân bằng hóa học.
D sai, vì cân bằng hóa học là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch và tại đó phản ứng vẫn tiếp tục xảy ra.
Đáp án D
Theo Bronsted, phát biểu nào dưới đây đúng?
-
A.
Acid là chất có khả năng cho proton.
-
B.
Acid là chất hòa tan được mọi kim loại.
-
C.
Acid là chất điện li mạnh.
-
D.
Acid tác dụng được với mọi base.
Đáp án : A
Dựa vào thuyết acid – base của Lowry – Bronsted.
Theo Bronsted, acid là chất có khả năng cho proton.
Đáp án A
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng. Thành phần của khói trắng là
-
A.
H2O(g)
-
B.
NH4Cl
-
C.
NH3
-
D.
HCl
Đáp án : B
Dựa vào tính chất hóa học của ammonia.
Khi NH3 đặc tác dụng với dung dịch HCl đặc, thu được muối NH4Cl.
Đáp án B
Các yếu tố ảnh hưởng đến cân bằng hóa học là
-
A.
Nồng độ, áp suất và diện tích bề mặt.
-
B.
Áp suất, nhiệt độ và chất xúc tác.
-
C.
Nồng độ, nhiệt độ và chất xúc tác.
-
D.
Nồng độ, nhiệt độ và áp suất.
Đáp án : D
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học.
Nồng độ, nhiệt độ và áp suất là các yếu tố ảnh hưởng đến cân bằng hóa học.
Đáp án D
Dung dịch nào sau đây có pH > 7?
-
A.
HClO4
-
B.
NaCl
-
C.
NaOH
-
D.
HF
Đáp án : C
Dựa vào kiến thức về pH.
NaOH là dung dịch base có pH > 7.
Đáp án C
Nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng là do nitric acid có
-
A.
tính base mạnh
-
B.
tính khử mạnh
-
C.
tính acid mạnh
-
D.
tính oxi hóa mạnh.
Đáp án : D
Dựa vào tính chất hóa học của nitric acid.
Nitric acid có tính oxi hóa mạnh nên thường được sử dụng để phá mẫu quặng trong việc nghiên cứu.
Đáp án D
Xét câu bằng: \(F{e_2}{O_3}(s) + 3CO(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2Fe(s) + 3C{O_2}(g)\). Biểu thức hằng số cân bằng của hệ là
-
A.
\({K_C} = \frac{{{{{\rm{[}}Fe]}^2}.{{{\rm{[CO]}}}^3}}}{{{\rm{[}}F{e_2}{O_3}]{{{\rm{[}}C{O_2}]}^2}}}\)
-
B.
\({K_C} = \frac{{{{{\rm{[}}C{O_2}]}^3}}}{{{{{\rm{[}}CO]}^3}}}\)
-
C.
\({K_C} = \frac{{{\rm{[}}F{e_2}{O_3}]{{{\rm{[}}CO]}^3}}}{{{{{\rm{[}}Fe]}^2}{{{\rm{[C}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}^2}}}\)
-
D.
\({K_C} = \frac{{{{{\rm{[}}CO]}^3}}}{{{{{\rm{[}}C{O_2}]}^3}}}\)
Đáp án : B
Dựa vào công thức tính hằng số cân bằng.
Biểu thức cân bằng của phản ứng là: \({K_C} = \frac{{{{{\rm{[}}C{O_2}]}^3}}}{{{{{\rm{[}}CO]}^3}}}\)
Đáp án B
Cho 7,437 lít N2 tác dụng với 12,395 lít H2, thu được 14,874 lít hỗn hợp khí. Hiệu suất của phản ứng là
-
A.
50%
-
B.
30%
-
C.
60%
-
D.
40%
Đáp án : C
Dựa vào tính chất hóa học của nitrogen.
n N2 = 7,437 : 24,79 = 0,3 mol
n H2 = 12,395 : 24,79 = 0,5 mol
n hỗn hợp khí = 14,874 : 24,79 = 0,6 mol
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NH3
Trước phản ứng: 0,3 0,5 0
Phản ứng: a 3a 2a
Sau phản ứng: 0,3 – a 0,5 – 3a 2a
n hỗn hợp khí = n N2 dư + n H2 dư + n NH3 = 0,3 – a + 0,5 – 3a + 2a = 0,6
\( \to \)a = 0,1 mol
H% = \(\frac{{{n_{H2tt}}}}{{{n_{H2lt}}}}.100 = \frac{{0,3}}{{0,5}}.100 = 60\% \)
Đáp án C
Chất nào sau đây không phải chất điện li
-
A.
HCl
-
B.
HNO3
-
C.
NaOH
-
D.
C6H12O6
Đáp án : D
Dựa vào khái niệm về chất điện li.
C6H12O6 không phải chất điện li.
Đáp án D
Công thức tính pH là
-
A.
pH = - lg [OH-]
-
B.
pH = - lg[H+]
-
C.
pH = 10.lg[H+]
-
D.
pH = lg[H+]
Đáp án : B
Dựa vào công thức tính pH.
pH = = - lg[H+]
Đáp án B
Trộn 200ml dung dịch H2SO4 0,1375M với 300ml dung dịch NaOH 0,2M. Tính pH của dung dịch tạo thành
-
A.
pH = 10
-
B.
pH = 2
-
C.
pH = 7
-
D.
pH = 12
Đáp án : D
Dựa vào công thức tính pH.
n H2SO4 = 0,2.0,1375 = 0,0275 mol\( \to \)n H+ = 0,0275.2 = 0,055 mol
n NaOH = 0,3.0,2 = 0,06 mol
H+ + OH- \( \to \) H2O
0,055 0,06
n H+ < n OH- \( \to \)OH – dư \( \to \)[OH-] dư = \(\frac{{0,06 - 0,055}}{{0,2 + 0,3}} = 0,01M\)
pOH = -lg[OH-] = -lg[0,01] = 2 \( \to \)pH = 14 – 2 = 12
Đáp án D
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10ml dung dịch HCl này cần 20ml dung dịch NaOH. Giá trị nồng độ của dung dịch HCl trên là?
-
A.
0,25
-
B.
0,5
-
C.
0,2
-
D.
0,15
Đáp án : C
Dựa vào Phương pháp chuẩn độ.
CM HCl = \(\frac{{20.0,1}}{{10}} = 0,2M\)
Đáp án C
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
-
A.
HNO3 tan nhiều trong nước.
-
B.
khi để lâu thì HNO3 bị khử bởi các chất của môi trường
-
C.
dung dịch HNO3 có tính oxi hóa mạnh.
-
D.
dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Đáp án : D
Dựa vào tính chất vật lí của nitric acid.
Dung dịch HNO3 bị oxi hóa phân hủy 1 phần NO2, Khí NO2 hòa tan vào dung dịch nên HNO3 để lâu thường ngả sang màu vàng.
Đáp án D
Oxide phổ biến của nitrogen trong không khí là
-
A.
NO, N2O.
-
B.
NO, NO2.
-
C.
N2O3, NO2.
-
D.
NO, N2O4.
Đáp án : B
Dựa vào các oxide phổ biến của nitrogen.
NO và NO2 là oxide phổ biến của nitrogen trong không khí.
Đáp án B
-
A.
chỉ thể hiện tính oxi hóa.
-
B.
chỉ thể hiện tính khử.
-
C.
thể hiện tính khử và tính oxi hóa.
-
D.
không thể hiện tính khử và tính oxi hóa.
Đáp án : C
Dựa vào tính chất hóa học của nitrogen.
Nitrogen thể hiện tính khử và tính oxi hóa.
Đáp án C
Phản ứng trên là phản ứng thuận nghịch.
Cl2, H2O là chất tham gia của phản ứng thuận.
HCl, HClO là sản phẩm của phản ứng nghịch.
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Phản ứng trên là phản ứng thuận nghịch.
Cl2, H2O là chất tham gia của phản ứng thuận.
HCl, HClO là sản phẩm của phản ứng nghịch.
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Dựa vào nguyên lí chuyển dịch cân bằng.
a. Đúng.
b. Đúng.
c. Sai vì phản ứng nghịch (từ phải → trái) nên HCl, HClO là chất tham gia của phản ứng nghịch.
d. Sai vì phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
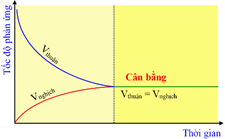
Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Dựa vào cân bằng hóa học
Xét tính chất hóa học của NH3.
Khí NH3 tác dụng với nước theo phản ứng:

Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Phản ứng: 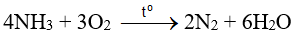 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
Khí NH3 tác dụng với nước theo phản ứng:

Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Phản ứng: 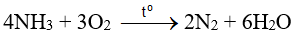 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
Dựa vào tính chất hóa học của ammonia.
a. đúng
b. sai, trong phản ứng của NH3 tác dụng với dung dịch HCl, NH3 đóng vai trò là base.
c. đúng
d. sai, phản ứng 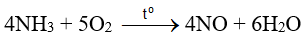 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp
Nitric acid là một chất có tính oxi hóa mạnh.
Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Dựa vào tính chất hóa học của nitric acid.
a. đúng
b. sai, Al không tan trong HNO3 đặc nguội.
c. đúng
d. đúng
Dựa vào công thức tính pH.
pH = - lg[H+] = 4,3
Dựa vào công thức tính hằng số cân bằng KC.
\[{K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}]{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^3}}} = \frac{{0,{{68}^2}}}{{0,54.{{(0,18)}^3}}} = 146,8\]
Dựa vào sơ đồ sản xuất nitric acid HNO3.
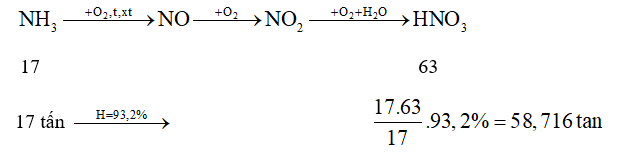
Khối lượng dung dịch nitric acid 65% là: 58,716 : 65% = 90,33 tấn.
Dựa vào cách pha loãng dung dịch.
Gọi x (L) là thể tích nước cần cho vào dịch để thực hiện việc pha chế.
pH= 3 \( \Rightarrow \)[H+] = 0,01 (M) \( \Rightarrow \) \({{\rm{n}}_{{{\rm{H}}^{\rm{ + }}}}}{\rm{ = }}{{\rm{n}}_{{\rm{HCl}}}}{\rm{ = 0,01 x 0,001 = 1}}{{\rm{0}}^{{\rm{ - 5}}}}{\rm{ (mol)}}{\rm{.}}\)
pH= 4 \( \Rightarrow \)[H+] = 0,0001 (M) = \(\frac{{{{10}^{ - 5}}}}{{x + 0,01}} \Rightarrow x = 0,09{\rm{ (L) = 90 (mL)}}{\rm{.}}\)
Cách pha: Đong 90 mL nước cất cho từ từ vào bình đựng 10 mL dung dịch HCl có pH = 3. Dùng đũa thủy tinh khuấy đều.
Phản ứng nào sau đây viết sai
I. Phần trắc nghiệm
I. Phần trắc nghiệm
I. Trắc nghiệm
Cân bằng hóa học liên quan đến loại phản ứng
Câu 1: Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?
Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M);
Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi A. tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch. B. nồng độ của các chất tham gia phản ứng bằng nồng độ của các chất sản phẩm. C. phản ứng thuận đã kết thúc. D. phản ứng nghịch đã kết thúc.
Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid. Nếu hào tan thuốc này vào nước, người ta xác định được PH của dung dịch tạo thành 2,8. Nồng độ OH- của dung dịch tạo thành là:
Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ? A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Thao tác nào sau đây không làm chuyển dịch cân bằng ? A. Tăng nồng độ I2 B. Giảm nồng độ HI C. Giảm thấp nhiệt độ của hệ D. Thay đổi áp suất của hệ
Phát biểu nào sau đây đúng ? A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận C. Nếu tăng lượng xúc tác V2O5 thì cân bằng dịch chuyển theo chiều thuận D. Nếu giảm nồng độ của SO3 thì cân bằng dịch chuyển theo chiều thuận
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |





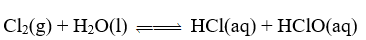
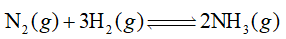
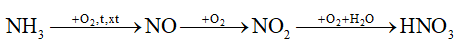






Danh sách bình luận