Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
-
A.
NH3 + HCl \( \to \)NH4Cl
-
B.
8NH3 + 3Cl2 \( \to \)6NH4Cl + N2
-
C.
2NH3 + 3CuO \( \to \)3Cu + N2 + 3H2O
-
D.
4NH3 + 5O2 \( \to \)4NO + 6H2O.
Dựa vào tính chất hóa học của ammonia.
Khí NH3 không thể hiện tính khử khi phản ứng với HCl, vì không thay đổi số oxi hóa.
Đáp án A
Đáp án : A

Các bài tập cùng chuyên đề
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Trong hai phản ứng oxi hóa ammonia bằng oxygen ở trên, hãy:
a) Xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
Nhận biết ion ammonium trong phân đạm.
Chuẩn bị: phân bón potassium nitrate và phân bón ammonium chloride dạng rắn, dung dịch NaOH 20%, giấy pH; bình xịt tia nước cất, 2 ống nghiệm, kẹp gỗ, đèn cồn.
Tiến hành:
– Cho khoảng 1 g phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 g phân bón ammonium chloride vào ống nghiệm (2).
– Thêm vào mỗi ống nghiệm khoảng 3 mL nước cất, lắc đều cho tan hết.
– Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
– Đưa hai mẩu giấy pH đã tẩm ướt vào miệng mỗi ống nghiệm.
Quan sát hiện tượng và trả lời câu hỏi:
Dựa vào dấu hiệu nào để nhận biết ion ammonium? Giải thích bằng phương trình hoá học.
a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hóa trị, số oxi hóa của nguyên tử nitrogen.
b) Viết phương trình hóa học minh họa tính acid/base của ammonia và ammonium.
Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây?
A. H2O. B. HCI. C. H3PO4. D. O2 (Pt, t°).
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g)
a) Tính ΔrH0298 của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.
b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
Quan sát Hình 4.1, mô tả cấu tạo phân tử ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa – khử của ammonia. Giải thích.
Từ sự kết hợp giữa NH3 với nước, nhận xét tính acid — base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích
Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó để xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc.
Cho biết ammonia thể hiện tính chất gì trong phản ứng với acid và oxygen.
Trong các ao tù có thể tích tụ lượng đáng kể ion ammonium. Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng những cách nào? Giải thích.
Cho thí nghiệm được thiết kế như hình dưới đây.
Trong thí nghiệm này, nước pha phenolphthalein sẽ bị hút lên bình chứa khí ammonia và phun thành những tia màu hồng. Hãy giải thích hiện tượng trên.
Khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì hiện tượng gì sẽ xảy ra?
Ammonia thể hiện tính base, tính khử ở quá trình nào dưới đây? Giải thích.
(1) Cho ammonia phản ứng với nitric acid (HNO3) để tạo phân bón ammonium nitrate (NH4NO3).
(2) Dùng ammonia tẩy rửa lớp copper (II) oxide phủ trên bề mặt kim loại đồng, tạo kim loại, nước và khí nitrogen.
Nhận biết ion ammonium
Chuẩn bị: Phân đạm ammonium chloride, dung dịch NaOH; ống nghiệm, đèn cồn, giấy quỳ.
Tiến hành: Cho vài hạt phân đạm với thành phần chính là ammonium chloride vào ống nghiệm chứa dung dịch NaOH. Hơ nhẹ ống nghiệm trên ngọn lửa đèn cồn. Cho mẩu giấy quỳ đã tẩm ướt bằng nước lên miệng ống nghiệm.
Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học của phản ứng đã xảy ra.
Xác định tỉ lệ mol kết hợp giữa NH3 và H3PO4 để tạo ra diammonium hydrogen phosphate (dùng làm phân bón phức hợp DAP). Viết phương trình hoá học của phản ứng.
Vì sao nói ammonia có vai trò rất quan trọng đối với nông nghiệp? Cho ví dụ minh hoạ.
Ở 472 °C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen theo quá trình Haber là Kc = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,0201 M và 0,0602 M.
a) Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
b) Làm thế nào để tách được ammonia ra khỏi hỗn hợp?
Trong công nghiệp, nitrogen được sản xuất từ nguồn nguyên liệu dồi dào là không khí. Giả thiết không khí chứa 78% N2, 21% O2 và 1% Ar về thể tích. Cho biết nhiệt độ sôi của các chất trên lần lượt là –196 °C, −183 °C và –186 °C. Em hãy nêu nguyên tắc sản xuất N2 từ không khí.
Hỗn hợp khí X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng X trong bình kín có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là
A. 25%. B. 23%. C. 16%. D. 20%.
Các chất khí được thu vào bình theo đúng nguyên tắc bằng cách đẩy không khí (X, Y, Z) và đẩy nước (T) như
sau:
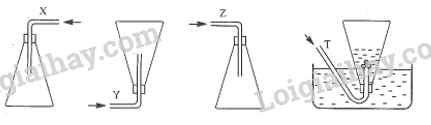
Nhận xét nào sau đây không đúng?
A. X là chlorine. B. Y là hydrogen.
C. Z là nitrogen dioxide. D. T là ammonia.
Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
A. NH3. B.\({\rm{NH}}_4^ + \). C.\({\rm{NO}}_3^ - \). D. N2.
Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
A. Hồng. B. Xanh. C. Không màu. D. Vàng.
Cho dung dịch NH3 vào dung dịch chất nào sau đây thu được kết tủa trắng?
A. HCl. B. H2SO4. C. H3PO4. D. AlCl3.
Trong phương pháp Ostwald, ammonia bị oxi hoá bởi oxygen không khí tạo thành sản phẩm chính là
A. NO. B. N2. C. N2O. D. NO2.
Khi tác dụng với nước và hydrochloric acid, ammonia đóng vai trò là
A. acid. B. base. C. chất oxi hoá. D. chất khử.
Nhận định nào sau đây về phân tử ammonia không đúng?
A. Phân cực mạnh. B. Có một cặp electron không liên kết.
C. Có độ bền nhiệt rất cao. D. Có khả năng nhận proton.
Một lượng lớn ammonium ion trong nước rác thải sinh ra khi vứt bỏ vào ao hồ được vi khuẩn oxi hoá thành nitrate và quá trình đó làm giảm oxygen hòa tan trong nước gây ngạt cho sinh vật sống dưới nước. Người ta có thể xử lí nguồn gây ô nhiễm đó bằng nước vôi trong (dung dịch Ca(OH)2) và khí chlorine để chuyển ammonium ion thành ammonia rồi chuyển tiếp thành nitrogen không độc thải ra môi trường. Giải thích cách làm này bằng phương trình hoá học.
Cho một ít chất chỉ thị phenolphtalein vào dung dịch NH3 loãng thu được dung dịch (A). Màu của dung dịch (A) thay đổi như thế nào khi
a) đun nóng dung dịch một hồi lâu.
b) thêm dung dịch HCl với số mol HCl bằng số mol NH3 có trong dung dịch (A).
c) thêm vài giọt dung dịch Na2CO3.
d) thêm từ từ dung dịch AlCl3 tới dư.
Khi phun NH3 vào không khí bị nhiễm Cl2 thấy xuất hiện “khói trắng”. Giải thích và viết phương trình hoá học minh hoạ.







Danh sách bình luận