Đề thi giữa kì 1 Hóa 11 Cánh diều - Đề số 10
Phản ứng nào sau đây viết sai
Đề bài
Phản ứng nào sau đây viết sai
-
A.
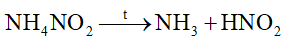
-
B.
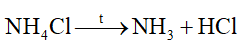
-
C.
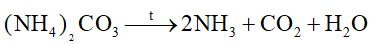
-
D.
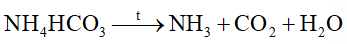
Kim loại nào sau đây không tác dụng với nitric acid?
-
A.
Zn
-
B.
Cu
-
C.
Ag
-
D.
Au
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nào trong nước?
-
A.
Fe, Mn
-
B.
N, P
-
C.
Ca, Mg
-
D.
Cl, F
pH của dung dịch KOH 0,004M có giá trị là:
-
A.
2,4
-
B.
11,6
-
C.
3,7
-
D.
10,3
Trong phản ứng sau đây, những chất nào đóng vai trò là base theo thuyết Bronsted – Lowry?
\(CO_3^{2 - }(aq) + {H_2}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - (aq) + O{H^ - }(aq)\)
-
A.
\(CO_3^{2 - }\)và \(O{H^ - }\)
-
B.
\(CO_3^{2 - }\)và \(HCO_3^ - \)
-
C.
H2O và \(O{H^ - }\)
-
D.
H2O và \(CO_3^{2 - }\)
Cho phản ứng A(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)B(g). Hằng số cân bằng của phản ứng đã cho là KC = 1,0.10-3. Tại trạng thái cân bằng, nồng độ của chất A là 1.10-3M thì nồng độ cân bằng B là
-
A.
1.10-3
-
B.
1
-
C.
2
-
D.
1.103
Cho phản ứng: aFe + b HNO3 \( \to \)c Fe(NO3)3 + d NO2 + e H2O
Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng a + b + c + d + e bằng
-
A.
14
-
B.
15
-
C.
12
-
D.
13
Cho phản ứng hóa học sau: \(2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{O_2}(g)\) \({\Delta _r}H_{298}^o = 115kJ\)
Nhận xét nào sau đây không đúng?
-
A.
Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
-
B.
Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
-
C.
Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
-
D.
Phản ứng thuận là phản ứng tỏa nhiệt.
Chất khí nào sau đây không phải là nguyên nhân chính gây nên hiện tượng mưa acid?
-
A.
SO2
-
B.
NO2
-
C.
NO
-
D.
CO2
Cho các phát biểu sau:
(1) Dung dịch Na2CO3 làm phenolphtalein chuyển sang màu hồng.
(2) Trong phản ứng thuận nghịch, tại thời điểm, tốc độ phản ứng nghịch ban đầu đạt lớn nhất sau đó giảm dần.
(3) Nước cất chứa H2O, H+ và OH-
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
(5) Trong dung dịch, ion HS- và HCO3- đều thể hiện tính lưỡng tính
Số phát biểu đúng là:
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng: 2NO2(g) N2O4(g)
Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là:
-
A.
Tỏa nhiệt
-
B.
Thu nhiệt
-
C.
Không tỏa hay thu nhiệt
-
D.
Một phương án khác
Cho phương trình nhiệt hóa học sau:
C2H2(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CH3CHO(g) \({\Delta _r}H_{298}^o = - 151kJ\)
Cân bằng hóa học sẽ chuyển dịch về phía tạo ra nhiều CH3CHO hơn khi
-
A.
Giảm nồng độ của khí C2H2
-
B.
Tăng nhiệt độ của hệ phản ứng
-
C.
Không sử dụng chất xúc tác.
-
D.
Tăng áp suất của hệ phản ứng.
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1M) bằng dung dịch chuẩn HCl 0,1M với chỉ thị phenolphtalein. Tại thời điểm tương đương, điều nào sau đây không đúng?
-
A.
Số mol ion H+ bằng số mol OH- đã phản ứng.
-
B.
Nếu thêm tiếp NaOH, bình tam giác chứa phenolphtalein không chuyển sang màu hồng.
-
C.
Các chất phản ứng vừa đủ với nhau.
-
D.
Phenolphthalein mất màu hồng.
Cho các phát biểu sau:
(1) Các muối ammonium đều là chất điện li mạnh, trong nước muối ammonium điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường base.
(2) Khi cho Fe vào các acid HNO3 đặc, nguội có xảy ra phản ứng.
(3) Sự chuyển dịch cân bằng là chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác.
(4) Nitrogen được dùng làm căng vỏ bao bì thực phẩm do nitrogen nhẹ hơn không khí.
(5) Các dung dịch NaCl, HCl, CH3COOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là H2SO4.
Số phát biểu không đúng là
-
A.
3
-
B.
2
-
C.
4
-
D.
5
Phản ứng tổng hợp 3-methylbutyl acetate (isoamyl acetate) trong phòng thí nghiệm từ acetic acid và 3-methylbutan-1-ol (isoamyl alcohol) với xúc tác dung dịch H2SO4 đặc, đun nóng xảy ra theo phương trình hóa học sau:
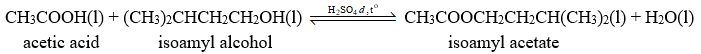
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Cho dung dịch HNO3 0,1 M (bỏ qua sự điện li của H2O).
Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Nồng độ cation trong dung dịch là 0,1 M.
Nồng độ anion trong dung dịch là 0,3 M.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh.
Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Xét cấu tạo của phân tử NH3.
Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Giữa các phân tử NH3 có liên kết hydrogen.
Lời giải và đáp án
Phản ứng nào sau đây viết sai
-
A.
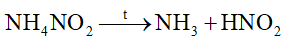
-
B.
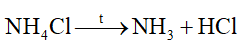
-
C.
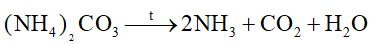
-
D.
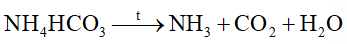
Đáp án : A
Dựa vào phản ứng nhiệt phân của ammonium.
sai vì phân hủy tạo N2 và H2O.
Đáp án A
Kim loại nào sau đây không tác dụng với nitric acid?
-
A.
Zn
-
B.
Cu
-
C.
Ag
-
D.
Au
Đáp án : D
Dựa vào tính chất oxi hóa mạnh của nitric acid.
Au không tác dụng với nitric acid.
Đáp án D
Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.

Khi các khí sulfur dioxide, nitrogen dioxide bị oxi hóa và bị hòa tan trong nước tạo thành dung dịch acid HNO3 và H2SO4, làm nước mưa có độ pH < 5,6, gây nên mưa acid.
Mưa acid là hiện tượng nước mưa có pH < 5,6.
→ Chọn A.
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nào trong nước?
-
A.
Fe, Mn
-
B.
N, P
-
C.
Ca, Mg
-
D.
Cl, F
Đáp án : B
Dựa vào kiến thức về phú dưỡng.
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng nguyên tố dinh dưỡng: N, P.
Đáp án B
pH của dung dịch KOH 0,004M có giá trị là:
-
A.
2,4
-
B.
11,6
-
C.
3,7
-
D.
10,3
Đáp án : B
Dựa vào công thức tính pH.
pOH = -lg [OH-] = 2,4 \( \to \)pH = 14 – 2,4 = 11,6
Đáp án B
Trong phản ứng sau đây, những chất nào đóng vai trò là base theo thuyết Bronsted – Lowry?
\(CO_3^{2 - }(aq) + {H_2}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - (aq) + O{H^ - }(aq)\)
-
A.
\(CO_3^{2 - }\)và \(O{H^ - }\)
-
B.
\(CO_3^{2 - }\)và \(HCO_3^ - \)
-
C.
H2O và \(O{H^ - }\)
-
D.
H2O và \(CO_3^{2 - }\)
Đáp án : A
Dựa vào thuyết Bronsted – Lowry.
\(CO_3^{2 - }\)và \(O{H^ - }\)đóng vai trò là base theo thuyết Bronsted – Lowry.
Đáp án A
Cho phản ứng A(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)B(g). Hằng số cân bằng của phản ứng đã cho là KC = 1,0.10-3. Tại trạng thái cân bằng, nồng độ của chất A là 1.10-3M thì nồng độ cân bằng B là
-
A.
1.10-3
-
B.
1
-
C.
2
-
D.
1.103
Đáp án : B
Dựa vào công thức tính hằng số cân bằng.
KC = \(\frac{{{\rm{[}}B{\rm{]}}}}{{{\rm{[}}A]}} = \frac{{{\rm{[}}B{\rm{]}}}}{{{{1.10}^{ - 3}}}} = {1.10^{ - 3}} \to {\rm{[}}B{\rm{]}} = 1M\)
Cho phản ứng: aFe + b HNO3 \( \to \)c Fe(NO3)3 + d NO2 + e H2O
Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng a + b + c + d + e bằng
-
A.
14
-
B.
15
-
C.
12
-
D.
13
Đáp án : A
Dựa vào Phương pháp thăng bằng electron.
Feo \( \to \)Fe+3 + 3e |x1
N+5 +1e\( \to \)N+4 |x3
Fe + 6HNO3 \( \to \) Fe(NO3)3 + 3 NO2 + 3H2O
Tổng a + b + c + d + e = 1 + 6 + 1 + 3 + 3 = 14
Đáp án A
Cho phản ứng hóa học sau: \(2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{O_2}(g)\) \({\Delta _r}H_{298}^o = 115kJ\)
Nhận xét nào sau đây không đúng?
-
A.
Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
-
B.
Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
-
C.
Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
-
D.
Phản ứng thuận là phản ứng tỏa nhiệt.
Đáp án : B
Dựa vào giá trị biến thiên enthalpy của phản ứng.
Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều thuận do tổng mol khí tham gia lớn hơn mol khí sản phẩm.
Đáp án B
Sulfur tác dụng với thủy ngân (mercury) ở ngay nhiệt độ thường: phản ứng này được dùng để xử lí mercury rơi vãi.
Hg + S → HgS
Khi nhiệt kế thuỷ ngân vỡ, rắc chất bột sulfur lên thuỷ ngân rơi vãi sẽ chuyển hoá chúng thành hợp chất bền, ít độc hại.
→ Chọn D.
Chất khí nào sau đây không phải là nguyên nhân chính gây nên hiện tượng mưa acid?
-
A.
SO2
-
B.
NO2
-
C.
NO
-
D.
CO2
Đáp án : D
Dựa vào nguyên nhân gây hiện tượng mưa acid.
CO2 không phải là nguyên nhân gây hiện tượng mưa acid.
Đáp án D
Cho các phát biểu sau:
(1) Dung dịch Na2CO3 làm phenolphtalein chuyển sang màu hồng.
(2) Trong phản ứng thuận nghịch, tại thời điểm, tốc độ phản ứng nghịch ban đầu đạt lớn nhất sau đó giảm dần.
(3) Nước cất chứa H2O, H+ và OH-
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
(5) Trong dung dịch, ion HS- và HCO3- đều thể hiện tính lưỡng tính
Số phát biểu đúng là:
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Đáp án : B
Dựa vào thuyết Bronsed – Lowry.
(1) đúng
(2) sai, tốc độ phản ứng nghịch ban đầu nhỏ nhất sau đó tăng dần.
(3) đúng
(4) sai, khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng vẫn tiếp tục.
(5) đúng
Đáp án B
Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào tính chất hóa học của nitric acid.
Nitric acid có tính acid mạnh và tính oxi hóa mạnh
Đáp án B
Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng: 2NO2(g) N2O4(g)
Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là:
-
A.
Tỏa nhiệt
-
B.
Thu nhiệt
-
C.
Không tỏa hay thu nhiệt
-
D.
Một phương án khác
Đáp án : A
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier.
Phản ứng trên là phản ứng tỏa nhiệt vì phản ứng tỏa nhiệt vì NO2 (nâu đỏ) chuyển dần sang N2O4 (không màu) nên thấy màu trong bình khí nhạt dần.
Đáp án A
Cho phương trình nhiệt hóa học sau:
C2H2(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CH3CHO(g) \({\Delta _r}H_{298}^o = - 151kJ\)
Cân bằng hóa học sẽ chuyển dịch về phía tạo ra nhiều CH3CHO hơn khi
-
A.
Giảm nồng độ của khí C2H2
-
B.
Tăng nhiệt độ của hệ phản ứng
-
C.
Không sử dụng chất xúc tác.
-
D.
Tăng áp suất của hệ phản ứng.
Đáp án : D
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier.
Để cân bằng hóa học chuyển dịch chiều thuận thì tăng áp suất của hệ phản ứng vì tổng số mol khí tham gia lớn hơn mol khí sản phẩm.
Đáp án D
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1M) bằng dung dịch chuẩn HCl 0,1M với chỉ thị phenolphtalein. Tại thời điểm tương đương, điều nào sau đây không đúng?
-
A.
Số mol ion H+ bằng số mol OH- đã phản ứng.
-
B.
Nếu thêm tiếp NaOH, bình tam giác chứa phenolphtalein không chuyển sang màu hồng.
-
C.
Các chất phản ứng vừa đủ với nhau.
-
D.
Phenolphthalein mất màu hồng.
Đáp án : B
Dựa vào Phương pháp chuẩn độ.
Tại thời điểm tương đương, số mol H+ bằng số mol OH – đã phản ứng. Khi thêm tiếp NaOH, bình tam giác chứa phenolphtalein sẽ chuyển sang màu hồng.
Đáp án B
Cho các phát biểu sau:
(1) Các muối ammonium đều là chất điện li mạnh, trong nước muối ammonium điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường base.
(2) Khi cho Fe vào các acid HNO3 đặc, nguội có xảy ra phản ứng.
(3) Sự chuyển dịch cân bằng là chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác.
(4) Nitrogen được dùng làm căng vỏ bao bì thực phẩm do nitrogen nhẹ hơn không khí.
(5) Các dung dịch NaCl, HCl, CH3COOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là H2SO4.
Số phát biểu không đúng là
-
A.
3
-
B.
2
-
C.
4
-
D.
5
Đáp án : A
Dựa vào tính chất của nitric acid
(1) sai, vì NH4+ tạo môi trường acid.
(2) sai, Fe thụ động trong nitric acid đặc, nguội.
(3) đúng
(4) đúng
(5) đúng
Đáp án A
Phản ứng tổng hợp 3-methylbutyl acetate (isoamyl acetate) trong phòng thí nghiệm từ acetic acid và 3-methylbutan-1-ol (isoamyl alcohol) với xúc tác dung dịch H2SO4 đặc, đun nóng xảy ra theo phương trình hóa học sau:
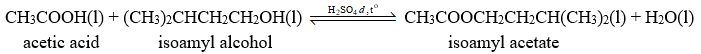
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học.
a. Đúng vì khi dùng dư (nhiều) acetic acid thì cân bằng chuyển dịch làm giảm acetic acid \( \Rightarrow \) chiều thuận \( \Rightarrow \) tăng hiệu suất phản ứng.
b. Đúng vì khi tách lấy ester thì cân bằng chuyển dịch tạo ra ester \( \Rightarrow \) chiều thuận.
c. Sai vì cân bằng hóa học trên không có chất khí tham gia nên áp suất không ảnh hưởng.
d. Đúng vì H2SO4 đặc hút nước \( \Rightarrow \) cân bằng chuyển dịch tạo ra nước \( \Rightarrow \) chiều thuận \( \Rightarrow \) tăng hiệu suất phản ứng.
Cho dung dịch HNO3 0,1 M (bỏ qua sự điện li của H2O).
Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Nồng độ cation trong dung dịch là 0,1 M.
Nồng độ anion trong dung dịch là 0,3 M.
Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Nồng độ cation trong dung dịch là 0,1 M.
Nồng độ anion trong dung dịch là 0,3 M.
Dựa vào sự điện li của nitric acid.
a. Đúng.
b. Sai vì dung dịch HNO3 trong nước chứa: H+, NO3-, H2O.
c. Đúng. [H+] = [NO3-] = [HNO3] = 0,1 M.
d. Sai vì [NO3-] = 0,1 M.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh.
Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Dựa vào hiện tượng phú dưỡng.
a. đúng
b. sai, làm giảm nguồn oxygen hòa tan trong nước.
c. sai, các loại tôm, cá,… ở ao hồ có hiện tượng phú dưỡng thường chết, sinh trưởng chậm.
d. đúng
Xét cấu tạo của phân tử NH3.
Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Giữa các phân tử NH3 có liên kết hydrogen.
Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Giữa các phân tử NH3 có liên kết hydrogen.
Dựa vào cấu tạo của phân tử NH3
a. đúng
b. sai, N – H là liên kết cộng hóa trị phân cực về phía N.
c. đúng
d. đúng
Dựa vào môi trường của các loại muối.
Na2CO3, KOH, K3PO4 có môi trường base làm quỳ tím chuyển sang màu xanh.
Đáp án 3
Dựa vào công thức tính hằng số cân bằng hóa học.
[N2O4] = \(\frac{{0,02}}{{0,5}} = 0,04M\)
N2O4(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NO2(g)
Trước phản ứng: 0,04 0
Phản ứng: x 2x
Cân bằng: 0,0055 2x
[NO2] = 2.(0,04 – 0,0055) = 0,069M
KC = \(\frac{{{{{\rm{[}}N{O_2}]}^2}}}{{{\rm{[}}{N_2}{{\rm{O}}_4}]}} = \frac{{{{(0,069)}^2}}}{{0,0055}} = 0,865\)
Dựa vào tính chất hóa học của nitrogen.
n N2 = 9,916 : 24,79 = 0,4 mol
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NH3
n NH3 = 0,4.2.25% = 0,2 mol
m NH3 = 0,2.17 = 3,4 g
Dựa vào Phương pháp chuẩn độ.
n OH – = 0,04.V
n H+ = 0,02V
\(O{H^ - } + {H^ + } \to {H_2}O\)
0,04V 0,02V
n OH – dư = 0,04V – 0,02V = 0,02V
[OH-] dư = \(\frac{{0,02V}}{{2V}} = 0,01M\)
pOH = -lg[OH-] = 2 \( \to \) pH= 14 – 2 = 12
I. Phần trắc nghiệm
I. Phần trắc nghiệm
I. Trắc nghiệm
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
Cân bằng hóa học liên quan đến loại phản ứng
Câu 1: Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?
Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M);
Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi A. tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch. B. nồng độ của các chất tham gia phản ứng bằng nồng độ của các chất sản phẩm. C. phản ứng thuận đã kết thúc. D. phản ứng nghịch đã kết thúc.
Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid. Nếu hào tan thuốc này vào nước, người ta xác định được PH của dung dịch tạo thành 2,8. Nồng độ OH- của dung dịch tạo thành là:
Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ? A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Thao tác nào sau đây không làm chuyển dịch cân bằng ? A. Tăng nồng độ I2 B. Giảm nồng độ HI C. Giảm thấp nhiệt độ của hệ D. Thay đổi áp suất của hệ
Phát biểu nào sau đây đúng ? A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận C. Nếu tăng lượng xúc tác V2O5 thì cân bằng dịch chuyển theo chiều thuận D. Nếu giảm nồng độ của SO3 thì cân bằng dịch chuyển theo chiều thuận
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |




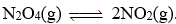 Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là
Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là





Danh sách bình luận