 Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
 Đề thi giữa kì 1 Hóa 11 - Cánh diều
Đề thi giữa kì 1 Hóa 11 - Cánh diều Đề thi giữa kì 1 Hóa 11 Cánh diều - Đề số 6
Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M);
Đề thi
Câu 1: Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M); [NH3] = 0,62 (M). Giá trị hằng số cân bằng KC của phản ứng trên gần nhất với
A. 10. B. 311. C. 502. D. 6.
Câu 2: Cho phản ứng hóa học: H2(g) + I2(g) ⇌ 2HI(g)
Ở 430oC, hằng số KC = 51,52. Biết nồng độ ban đầu của H2 và I2 lần lượt là 1,0 (M) và 3,0 (M). Nồng độ của hydrogen tại thời điểm cân bằng là
A. 2,06 M. B. 0,96 M. C. 2,04 M. D. 0,94 M.
Câu 3: Nhận xét nào sau đây sai?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn diễn ra theo nhiều hướng và xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch, tại thời điểm tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì phản ứng đạt trạng thái cân bằng.
Câu 4: Cho cân bằng hóa học: CaO(s) + CO2(g) ⇌ CaCO3(s) ∆rH < 0
Khi áp suất tăng thì
A. cân bằng chuyển dịch theo chiều thuận. B. cân bằng chuyển dịch theo chiều nghịch.
C. cân bằng không chuyển dịch. D. cân bằng chuyển dịch theo cả hai chiều.
Câu 5: Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
A. 2SO2(g) + O2(g) ⇌ 2SO3 (g). B. CH4(g) + Cl2(g) ⇌ CH3Cl (g) + HCl(g).
C. PCl5(g) ⇌ PCl3(g) + Cl2(g). D. 2CO(g) + O2(g) ⇌ 2CO2(g)
Câu 6: Cho các chất sau: nitric acid, hydrofluoric acid, hydrochloric acid, sodium hydroxide, potassium chloride, copper hydroxide, acetic acid. Số chất điện li mạnh là:
A. 2. B. 3. C. 4. D. 1.
Câu 7: Phương trình điện li nào dưới đây sai?
A. NaCl ⟶ Na+ + Cl-. B. HF ⇌ H+ + F-.
C. CH3COOH ⟶ CH3COO- + H+. D. KNO3 ⟶ K+ + NO3-.
Câu 8: Dung dịch X chứa các ion sau: 0,10 mol Cl-; 0,15 mol SO42-; 0,10 mol Na+ và a mol Cu2+. Giá trị của a là
A. 0,10. B. 0,05. C. 0.20. D. 0,15.
Câu 9: Cho những mô tả dưới đây nói về ứng dụng của chất nào?
(a) Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
(b) Dạng lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
(c) Sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc,…
A. Sulfur. B. Sulfur dioxide. C. Sulfuric acid. D. Sulfur trioxide.
Câu 10: Khi nhỏ sulfuric acid đặc vào cốc đựng đường mía thì xuất hiện hiện tượng
A. đường bị chuyển thành màu đen.
B. đường bị than hóa và có khí mùi hắc thoát ra khỏi cốc.
C. đường bị than hóa và bị đẩy ra khỏi cốc.
D. đường thị than hóa, bị đẩy ra khỏi cốc và có không màu, không mùi thoát ra.
Câu 11: Khẳng định nào dưới đây là sai khi nói về cân bằng của H2SO4 trong nước (Hình 2.6).
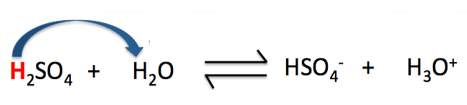
Hình 4.11. Cân bằng của H2SO4 trong nước
A. Trong phản ứng thuận, H2SO4 đóng vai trò là acid.
B. Trong phản ứng thuận, H2O đóng vai trò là base.
C. Trong phản ứng nghịch, H3O+ đóng vai trò là acid.
D. Trong phản ứng thuận, H2O là chất cho H+.
Câu 12: Cho các phát biểu:
(a) HCl khi tan trong nước cho dung dịch có pH < 7.
(b) Dãy các chất: HF, NaF, NaOH đều là chất điện li mạnh.
(c) Dãy các chất: C2H5OH, C6H12O6, CH3CHO là các chất điện li yếu.
(d) Những chất khi tan trong nước cho dung dịch dẫn điện được gọi là những chất điện li.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 13: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Câu 14: Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là
A. là chất xúc tác cho phản ứng.
B. tạo môi trường trung tính cho phản ứng.
C. làm tăng tốc độ phản ứng.
D. xác định thời điểm khi phản ứng đạt đến hoặc vượt qua điểm tương đương.
Câu 15: Cho 100 ml dung dịch A chứa HCl 0,05M, H2SO4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH)2 0,02M thu được dung dịch có pH = x. Giá trị x là
A. 1,4. B. 11,8. C. 2,2. D. 12,6.
Câu 16: Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
A. 0,224 lít. B. 0,15 lít. C. 0,336 lít. D. 0,448 lít.
Câu 17: Hiện tượng mưa acid chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là
A. CO2 và O2. B. NH3 và HCl. C. SO2 và NO2. D. H2S và N2.
Câu 18: Phương trình phản ứng nhiệt phân nào sau đây sai?
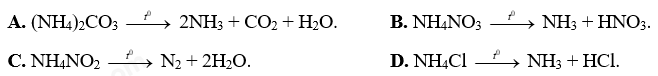
Câu 19: Cho hỗn hợp khí A gồm 0,2 mol N2; 0,9 mol H2 phản ứng trong điều kiện thích hợp thu được hỗn hợp B biết dA/B = 51/55. Hiệu suất phản ứng là
A. 10%. B. 20%. C. 30%. D. 40%.
Câu 20: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam. B. 33,6 gam. C. 44,4 gam. D. 59,2 gam.
Đáp án
|
1.B |
2.C |
3.C |
4.A |
5.B |
6.C |
7.C |
8.D |
9.B |
10.D |
|
11.D |
12.A |
13.C |
14.D |
15.D |
16.B |
17.C |
18.B |
19.B |
20.B |
Câu 1: Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M); [NH3] = 0,62 (M). Giá trị hằng số cân bằng KC của phản ứng trên gần nhất với
A. 10. B. 311. C. 502. D. 6.
Phương pháp giải
Công thức tính hằng số cân bằng KC của phản ứng.
Lời giải chi tiết
\({K_C} = \frac{{0,{{62}^2}}}{{0,45.0,{{14}^3}}} = 311,3\)
Chọn B.
Câu 2: Cho phản ứng hóa học: H2(g) + I2(g) ⇌ 2HI(g)
Ở 430oC, hằng số KC = 51,52. Biết nồng độ ban đầu của H2 và I2 lần lượt là 1,0 (M) và 3,0 (M). Nồng độ của hydrogen tại thời điểm cân bằng là
A. 2,06 M. B. 0,96 M. C. 2,04 M. D. 0,94 M.
Phương pháp giải
Công thức tính hằng số KC của phản ứng.
Lời giải chi tiết
H2(g) + I2(g) ⇌ 2HI(g)
Ban đầu: 1 3
Phản ứng: x ⟶ x ⟶ 2x
Sau: (1 – x) (3 – x) 2x
\({K_C} = \frac{{{{[2x]}^2}}}{{[3 - x].[1 - x]}} = 51,52\)
⟹ x = 0,96 (mol)
[H2] = 2,04 (M)
Chọn C.
Câu 3: Nhận xét nào sau đây sai?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn diễn ra theo nhiều hướng và xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch, tại thời điểm tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì phản ứng đạt trạng thái cân bằng.
Phương pháp giải
Lý thuyết về phản ứng một chiều, phản ứng thuận nghịch, trạng thái cân bằng.
Lời giải chi tiết
C sai, vì phản ứng một chiều là phản ứng hóa học xảy ra theo một chiều hướng nhất định.
Chọn C.
Câu 4: Cho cân bằng hóa học: CaO(s) + CO2(g) ⇌ CaCO3(s) ∆rH < 0
Khi áp suất tăng thì
A. cân bằng chuyển dịch theo chiều thuận. B. cân bằng chuyển dịch theo chiều nghịch.
C. cân bằng không chuyển dịch. D. cân bằng chuyển dịch theo cả hai chiều.
Phương pháp giải
Chuyển dịch cân bằng theo nguyên lí Le Chaterlier.
Lời giải chi tiết
nkhí trước > nkhí sau ⟹ Phản ứng thuận giảm áp suất ⟹ Khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận.
Chọn A.
Câu 5: Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
A. 2SO2(g) + O2(g) ⇌ 2SO3 (g). B. CH4(g) + Cl2(g) ⇌ CH3Cl (g) + HCl(g).
C. PCl5(g) ⇌ PCl3(g) + Cl2(g). D. 2CO(g) + O2(g) ⇌ 2CO2(g)
Phương pháp giải
Chuyển dịch cân bằng theo nguyên lí Le Chaterlier.
Lời giải chi tiết
Áp suất chỉnh ảnh hưởng đến những phản ứng có sự chệnh lệch số mol khí trước và sau phản ứng.
Chọn B.
Câu 6: Cho các chất sau: nitric acid, hydrofluoric acid, hydrochloric acid, sodium hydroxide, potassium chloride, copper hydroxide, acetic acid. Số chất điện li mạnh là:
A. 2. B. 3. C. 4. D. 1.
Phương pháp giải
Lý thuyết về sự điện li.
Lời giải chi tiết
Số chất điện li mạnh là: nitric acid, hydrochloric acid, sodium hydroxide, potassium chloride.
⟹ Có 4 chất.
Chọn C.
Câu 7: Phương trình điện li nào dưới đây sai?
A. NaCl ⟶ Na+ + Cl-. B. HF ⇌ H+ + F-.
C. CH3COOH ⟶ CH3COO- + H+. D. KNO3 ⟶ K+ + NO3-.
Phương pháp giải
Cách viết phương trình điện li.
Lời giải chi tiết
C sai, vì CH3COOH ⇌ CH3COO- + H+.
Chọn C.
Câu 8: Dung dịch X chứa các ion sau: 0,10 mol Cl-; 0,15 mol SO42-; 0,10 mol Na+ và a mol Cu2+. Giá trị của a là
A. 0,10. B. 0,05. C. 0.20. D. 0,15.
Phương pháp giải
Định luật bảo toàn điện tích:
Lời giải chi tiết
BTĐT: 0,1 + 0,15.2 = 0,1 + 2.nCu2+
⟹ nCu2+ = 0,15 (mol)
Chọn D.
Câu 9: Cho những mô tả dưới đây nói về ứng dụng của chất nào?
(a) Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
(b) Dạng lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
(c) Sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc,…
A. Sulfur. B. Sulfur dioxide. C. Sulfuric acid. D. Sulfur trioxide.
Phương pháp giải
Lý thuyết về ứng dụng của sulfur dioxide.
Lời giải chi tiết
Các ứng dụng trên là của SO2
Chọn B.
Câu 10: Khi nhỏ sulfuric acid đặc vào cốc đựng đường mía thì xuất hiện hiện tượng
A. đường bị chuyển thành màu đen.
B. đường bị than hóa và có khí mùi hắc thoát ra khỏi cốc.
C. đường bị than hóa và bị đẩy ra khỏi cốc.
D. đường thị than hóa, bị đẩy ra khỏi cốc và có không màu, không mùi thoát ra.
Phương pháp giải
Lý thuyết về tính chất hóa học của sulfuric acid đặc, nóng.
Lời giải chi tiết
Khi nhỏ sulfuric acid đặc vào cốc đựng đường mía thì xuất hiện hiện tượng đường thị than hóa, bị đẩy ra khỏi cốc và có không màu, không mùi thoát ra.
Chọn D.
Câu 11: Khẳng định nào dưới đây là sai khi nói về cân bằng của H2SO4 trong nước (Hình 2.6).

Hình 4.11. Cân bằng của H2SO4 trong nước
A. Trong phản ứng thuận, H2SO4 đóng vai trò là acid.
B. Trong phản ứng thuận, H2O đóng vai trò là base.
C. Trong phản ứng nghịch, H3O+ đóng vai trò là acid.
D. Trong phản ứng thuận, H2O là chất cho H+.
Phương pháp giải
Dựa vào thuyết Bronsted – Lowry về acid, base.
Lời giải chi tiết
D sai, vì trong phản ứng thuận, H2SO4 là chất cho H+.
Chọn D.
Câu 12: Cho các phát biểu:
(a) HCl khi tan trong nước cho dung dịch có pH < 7.
(b) Dãy các chất: HF, NaF, NaOH đều là chất điện li mạnh.
(c) Dãy các chất: C2H5OH, C6H12O6, CH3CHO là các chất điện li yếu.
(d) Những chất khi tan trong nước cho dung dịch dẫn điện được gọi là những chất điện li.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Phương pháp giải
Dựa vào lý thuyết về sự điện li.
Lời giải chi tiết
(a), (d) đúng.
(b) sai, vì HF là chất điện li yếu.
(c) sai, vì dãy các chất: C2H5OH, C6H12O6, CH3CHO không phải là chất điện li.
Chọn A.
Câu 13: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Phương pháp giải
Dựa vào lý thuyết về pH.
Lời giải chi tiết
[H+] = 10-pH = 3,98.10-3 M
Chọn C.
Câu 14: Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là
A. là chất xúc tác cho phản ứng.
B. tạo môi trường trung tính cho phản ứng.
C. làm tăng tốc độ phản ứng.
D. xác định thời điểm khi phản ứng đạt đến hoặc vượt qua điểm tương đương.
Phương pháp giải
Dựa vào lý thuyết về phương pháp chuẩn độ.
Lời giải chi tiết
Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là xác định thời điểm khi phản ứng đạt đến hoặc vượt qua điểm tương đương.
Chọn D.
Câu 15: Cho 100 ml dung dịch A chứa HCl 0,05M, H2SO4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH)2 0,02M thu được dung dịch có pH = x. Giá trị x là
A. 1,4. B. 11,8. C. 2,2. D. 12,6.
Phương pháp giải
Tính số mol H+, OH-
Tính theo PT ion suy ra số mol OH- dư sau phản ứng
Tính [OH-] dư ⟹ pOH ⟹ pH
Lời giải chi tiết
Dung dịch A có: nHCl = 0,1.0,05 = 0,005 mol; nH2SO4 = 0,1.0,025 = 0,0025 mol
⟹ nH+ = nHCl + 2nH2SO4 = 0,005 + 0,0025.2 = 0,01 mol
Dung dịch A có: nNaOH = 0,4.0,035 = 0,014 mol; nBa(OH)2 = 0,4.0,02 = 0,008 mol
⟹ nOH- = nNaOH + 2nBa(OH)2 = 0,014 + 0,008.2 = 0,03 mol
H+ + OH- → H2O
Dựa vào tỉ lệ phản ứng H+ hết, OH- dư
H+ + OH- → H2O
Bđ: 0,01 0,03 (mol)
Pư: 0,01 → 0,01 (mol)
Sau: 0 0,02 (mol)
⟹ nOH-dư = 0,02 mol
⟹ [OH-]dư = 0,02/0,5 = 0,04 M
⟹ pOH = -log[OH-] = -log(0,04) ≈ 1,4
⟹ pH = 14 - pOH = 12,6.
Chọn D.
Câu 16: Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
A. 0,224 lít. B. 0,15 lít. C. 0,336 lít. D. 0,448 lít.
Phương pháp giải
pH sau = 2 → môi trường axit ⟹ axit dư. Mọi tính toán theo OH-
Ta có: \(\frac{{n{H^ + } - nO{H^ - }}}{V} = \left[ {{H^ + }} \right]sau \Rightarrow {\mkern 1mu} a = {\mkern 1mu} ?\)
Lời giải chi tiết
pH = 1 ⟹ [H+] = 10-1 ⟹ nH+ = 0,01 mol
pH sau = 2 < 7 → môi trường axit ⟹ H+ dư
Ta có:
\(\begin{array}{*{20}{l}}{\frac{{n{H^ + } - nO{H^ - }}}{V} = \left[ {{H^ + }} \right]sau}\\{ \Rightarrow \frac{{0,01 - 2.0,025.V}}{{0,1 + V}} = 0,01}\\{ \Rightarrow 0,01 - 0,05V = 0,001 + 0,01V}\\{ \Rightarrow 0,06V = 0,009}\\{ \Rightarrow V = 0,15{\mkern 1mu} (lit)}\end{array}\)
Chọn B.
Câu 17: Hiện tượng mưa acid chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là
A. CO2 và O2. B. NH3 và HCl. C. SO2 và NO2. D. H2S và N2.
Phương pháp giải
Dựa vào kiến thức hiểu biết thực tế với môi trường.
Lời giải chi tiết
SO2 và NO2 là hai khí chính gây ra hiện tượng mưa acid do
SO2 + H2O ⟶ H2SO3
NO2 + O2 + H2O ⟶ HNO3
Các khí này tạo ra các acid, có tính oxi hóa gây ra nhiều hư hại tổn thất cho cuộc sống.
Chọn C.
Câu 18: Phương trình phản ứng nhiệt phân nào sau đây sai?
A. (NH4)2CO3 --> 2NH3 + CO2 + H2O. B. NH4NO3 --> NH3 + HNO3.
C. NH4NO2 --> N2 + 2H2O. D. NH4Cl --> NH3 + HCl.
Phương pháp giải
Dựa vào kiến thức về phản ứng nhiệt phân của muối ammonium.
Lời giải chi tiết
Sai sửa lại: NH4NO3 --> N2O + 2H2O
Chọn B.
Câu 19: Cho hỗn hợp khí A gồm 0,2 mol N2; 0,9 mol H2 phản ứng trong điều kiện thích hợp thu được hỗn hợp B biết dA/B = 51/55. Hiệu suất phản ứng là
A. 10%. B. 20%. C. 30%. D. 40%.
Phương pháp giải
Dựa vào số mol N2 và H2 xác định hiệu suất phản ứng tính theo chất nào.
Áp dụng định luật bảo toàn khối lượng: mA = mB suy ra tỉ lệ \(\frac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \frac{{{n_B}}}{{{n_A}}}\), từ đó tính được số mol hỗn hợp B.
Đặt số mol N2 phản ứng là x, từ đó thiết lập mối quan hệ giữa mol B và x, tìm x.
Tính hiệu suất theo công thức.
Lời giải chi tiết
Dựa vào tỉ lệ số mol: \(\frac{{{n_{{N_2}}}}}{1} = \frac{{0,2}}{1} < \frac{{{n_{{H_2}}}}}{3} = \frac{{0,9}}{3}\)⟹ Tính hiệu suất phản ứng theo N2.
BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} {\rm{\;}} = {n_B}.\overline {{M_B}} \) ⟹ \(\frac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \frac{{{n_B}}}{{{n_A}}} \Rightarrow \frac{{51}}{{55}} = \frac{{{n_B}}}{{0,2 + 0,9}} \Rightarrow {n_B} = 1,02(mol)\)
PTHH: N2 + 3H2 ⇄ 2NH3.
Ta có nA – nB = 2.nN2 phản ứng ⟹ 1,1 – 1,02 = 2.nN2 pư ⟹ nN2 pư = 0,04 mol.
H% = (0,04/0,2).100% = 20%.
Chọn B.
Câu 20: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam. B. 33,6 gam. C. 44,4 gam. D. 59,2 gam.
Phương pháp giải
Dựa vào lý thuyết về nitric acid.
Lời giải chi tiết
Mg2+ - 2e → Mg2+ N+5 + 8e → N-3
0,2 → 0,4 (mol) 0,4 → 0,05 (mol)
mmuối = 148.nMg(NO3)2 + 80.nNH4NO3 = 148.0,2 + 80.0,05 = 33,6 (g).
Chọn B.












Danh sách bình luận