 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 10
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 10
Đề số 5 - Đề kiểm tra học kì II - Hóa học lớp 10
Đề kiểm tra hết học kì II hóa 10 có giải chi tiết
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1 : Kim loại nào sau đây không tác dụng với dung dịch HCl?
A. Cu B. Al
C. Mg D. Na
Câu 2 : Kim loại M phản ứng được với dung dịch HCl, dung dịch H2SO4 đặc nguội. Kim loại M là:
A. Al B. Fe
C. Zn D. Cu
Câu 3 : Để trung hòa 30 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là:
A. 0,3 B. 0,4
C. 0,1 D. 0,2
Câu 4 : Trong các chất sau, chất nào dễ tan trong nước?
A. AgI B. AgBr
C. AgF D. AgCl
Câu 5 : Trường hợp nào sau đây xảy ra phản ứng hóa học?
A. Cho Cu vào dung dịch H2SO4 loãng
B. Sục khí H2S vào dung dịch Pb(NO3)2
C. Sục khí H2S vào dung dịch FeCl2
D. Cho Al vào dung dịch H2SO4 đặc nguội
Câu 6 : Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C → 2SO2 + CO2 + 2H2O
(b) 4H2SO4 + 2FeO → Fe2(SO4)3 + SO2 + 4H2O
(c) 6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
(d) H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
Trong các phản ứng trên, phản ứng xảy ra tương ứng với tính chất của dung dịch H2SO4 loãng là:
A. (d) B. (a)
C. (c) D. (b)
Câu 7 : Cho dãy các kim loại: Zn, Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là:
A. 5 B. 2
C. 4 D. 3
Câu 8 : Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc, thể tích khí H2 (đktc) thoát ra là:
A. 2,24 lít B. 4,48 lít
C. 3,36 lít D. 6,72 lít
Câu 9 : Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là:
A. 75,68% B. 24,32%
C. 51,35% D. 48,65%
Câu 10 : Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
A. 2 : 1 B. 1 : 1
C. 3 : 1 D. 3 : 2
II. PHẦN TỰ LUẬN
Câu 1 : Hoàn thành phương trình hóa học của các phản ứng sau:
a) S + O2 \(\xrightarrow{{{t}^{0}}}\)
b) Fe(OH)2 + H2SO4 (loãng) →
c) KMnO4 + HCl (đặc) →
d) FeCO3 + H2SO4 (đặc) \(\xrightarrow{{{t}^{0}}}\)
Câu 2 : Viết phương trình hóa học của các phản ứng xảy ra trong các thí nghiệm sau (nếu có):
a) Nhúng thanh sắt vào dung dịch HCl.
b) Cho FeO vào dung dịch H2SO4 loãng.
c) Cho Ba dư vào dung dịch H2SO4 loãng.
d) Sục khí SO2 vào dung dịch KMnO4.
e) Cho Al2O3 vào dung dịch H2SO4 đặc nóng.
Câu 3
1. Hòa tan hoàn toàn 13,8 gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4 loãng (dư), thu được 10,08 lít khí (đktc). Tính phần trăm về khối lượng của mỗi kim loại trong hỗn hợp X.
2. Hấp thụ hoàn toàn 4,48 lít khí SO2 (đktc) vào dung dịch chứa 16 gam NaOH, thu được dung dịch X. Tính khối lượng muối thu được trong dung dịch X.
3. Đốt cháy hoàn toàn 21,3 gam hỗn hợp B1 gồm bột các kim loại Mg, Cu và Al ngoài không khí, thu được 33,3 gam hỗn hợp B2 gồm 3 oxit. Cho toàn bộ hỗn hợp B2 tác dụng vừa đủ với V lít dung dịch HCl 2M.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính V.
Lời giải chi tiết
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. PHẦN TRẮC NGHIỆM
Câu 1:
Phương pháp:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch HCl.
Hướng dẫn giải:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch HCl.
Do đó kim loại Cu không tác dụng với dung dịch HCl.
Đáp án A
Câu 2:
Phương pháp:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch HCl.
Dung dịch H2SO4 đặc nguội không phản ứng với Fe, Al và Cr.
Hướng dẫn giải:
- Al phản ứng với HCl, không phản ứng với H2SO4 đặc nguội ⟹ A sai
- Fe phản ứng với HCl, không phản ứng với H2SO4 đặc nguội ⟹ B sai
- Zn vừa phản ứng với HCl, H2SO4 đặc nguội ⟹ C đúng
- Cu không phản ứng với HCl, phản ứng với H2SO4 đặc nguội ⟹ D sai
Đáp án C
Câu 3:
Phương pháp:
Viết phương trình hóa học và tính theo phương trình hóa học, lưu ý CM = n/Vdd
Hướng dẫn giải:
HCl + NaOH → NaCl + H2O
Ta có: nNaOH = nHCl → 0,01x = 0,03.0,1 → x = 0,3M
Đáp án A
Câu 4:
Phương pháp:
Dựa vào tính chất vật lí của các muối halogenua.
Hướng dẫn giải:
Trong các muối bạc halogenua thì chỉ có muối AgF dễ tan trong nước.
Đáp án C
Câu 5:
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Hướng dẫn giải:
Phản ứng A không xảy ra vì Cu đứng sau H trong dãy hoạt động hóa học của kim loại.
Phản ứng B xảy ra vì
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Phản ứng C không xảy ra vì tính axit của H2S yếu hơn axit HCl.
Phản ứng D không xảy ra vì Al bị thụ động hóa trong dung dịch H2SO4 đặc nguội.
Đáp án D
Câu 6:
Phương pháp:
Dựa vào tính chất hóa học của H2SO4 loãng và đặc.
Hướng dẫn giải:
Phản ứng (a), (b) và (c) tương ứng với tính chất của dung dịch H2SO4 đặc.
Phản ứng (d) tương ứng với tính chất của dung dịch H2SO4 loãng.
Đáp án A
Câu 7:
Phương pháp:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch H2SO4 loãng.
Hướng dẫn giải:
Các kim loại: Zn, Al, Fe phản ứng được với dung dịch H2SO4 loãng (có 3 kim loại).
Đáp án D
Câu 8:
Phương pháp:
Viết phương trình hóa học xảy ra và tính toán theo phương trình hóa học.
Hướng dẫn giải:
PTHH: 2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
Ta có: nH2 = 1,5.nAl = 1,5.0,1 = 0,15 mol
→ VH2 = 0,15.22,4 = 3,36 lít
Đáp án C
Câu 9:
Phương pháp:
Dùng định luật bảo toàn electron và bảo toàn khối lượng để tìm số mol Al trong Y, từ đó tìm được %mAl.
Hướng dẫn giải:
Theo bảo toàn khối lượng ta có mX = mZ - mY = 60,2 - 22,2 = 37,8 (gam)
Đặt số mol Cl2 là x mol; số mol O2 là y mol.
Ta có: x + y = nX = 0,7 mol và mX = 71x + 32y = 38 gam
Giải hệ trên ta có x = 0,4 và y = 0,3
Gọi số mol Mg là a mol; số mol Al là b mol → 24a + 27b = 22,2 (1)
Các quá trình cho e:
Mg0 → Mg+2 + 2e
Al0 → Al+3 + 3e
Các quá trình nhận e:
Cl2 + 2e → 2Cl-
O2 + 4e → 2O-2
Theo bảo toàn electron ta có
2.nMg + 3.nAl = 2.nCl2 + 4.nO2
→ 2a + 3b = 2. 0,4 + 4.0,3 = 2 (mol) (2)
Giải hệ (1) và (2) ta có a = 0,7 và b = 0,2
Phần trăm khối lượng của Al trong Y là:
%mAl = \(\frac{0,2.27}{22,2}.100%\) = 24,32%
Đáp án B
Câu 10:
Phương pháp:
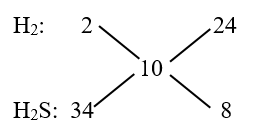
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z tính được nH2 : nH2S = 3 : 1
Ta luôn có nFe = nH2S + nH2; nH2S = nS pứ = nFe pứ
Biện luận để xác định hiệu suất phản ứng tính theo S hay theo Fe.
Từ đó tính được số mol S ban đầu và tỉ lệ a : b.
Hướng dẫn giải:
- Nung nóng hỗn hợp bột X gồm Fe và S (phản ứng có hiệu suất) thu được hỗn hợp Y:
Fe + S → FeS (1)
⟹ Hỗn hợp Y chứa FeS, Fe dư, S dư
- Cho hỗn hợp Y tác dụng với HCl dư thu được hỗn hợp khí Z:
FeS + 2HCl → FeCl2 + H2S ↑ (2)
Fe + 2HCl → FeCl2 + H2 ↑ (3)
⟹ Hỗn hợp khí Z chứa H2 và H2S
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z (MZ = 5.2 = 10)
⟹ nH2 : nH2S = 24 : 8 = 3 : 1
Giả sử H2S là 1 mol thì số mol H2 là 3 mol
Theo (1) (2) ⟹ nFe pư = nFeS = nH2S = 1 mol
Theo (3) ⟹ nFe dư = nH2 = 3 mol
⟹ nFe ban đầu = nFe pư + nFe dư = 3 + 1 = 4 mol
Vì H = 50% > nFe pu/nFe = 0,25 nên hiệu suất phản ứng tính theo nguyên tố S.
Ta có: nS pư = nFeS = 1 mol
⟹ nS ban đầu = 1.(100%:H%) = 2 mol.
Vậy a : b = 4 : 2 = 2 : 1.
Đáp án A
II. PHẦN TỰ LUẬN
Câu 1:
Phương pháp:
Dựa vào tính chất hóa học của các chất để viết phương trình hóa học xảy ra.
Hướng dẫn giải:
a) S + O2 \(\xrightarrow{{{t}^{0}}}\) SO2
b) Fe(OH)2 + H2SO4 (loãng) → FeSO4 + 2H2O
c) 2KMnO4 + 16 HCl (đặc) → 2KCl + MnCl2 + 5Cl2 + 8H2O
d) 2FeCO3 + 4H2SO4 (đặc) \(\xrightarrow{{{t}^{0}}}\) Fe2(SO4)3 + SO2 + 2CO2 + 4H2O
Câu 2:
Phương pháp:
Dựa vào tính chất hóa học của các chất để viết phương trình hóa học xảy ra.
Hướng dẫn giải:
a) Fe + 2HCl → FeCl2 + H2 ↑
b) FeO + H2SO4 loãng → FeSO4 + H2O
c) Ba + H2SO4 → BaSO4 ↓ + H2 ↑
Ba dư + 2H2O → Ba(OH)2 + H2
d) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
e) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Câu 3:
b) Tính V.
Phương pháp:
1.
Fe + H2SO4 loãng → FeSO4 + H2
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Lập hệ phương trình về khối lượng hỗn hợp và số mol H2 để tính số mol Fe và số mol Al.
Từ đó tính được % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
2. Từ tỉ lệ k = nNaOH/nSO2 để xác định sản phẩm tạo thành.
3.
a) Viết phương trình hóa học của các phản ứng xảy ra.
2Mg + O2 \(\xrightarrow{{{t}^{0}}}\) 2MgO (1)
2Cu + O2 \(\xrightarrow{{{t}^{0}}}\) 2CuO (2)
4Al + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2Al2O3 (3)
MgO + 2HCl → MgCl2 + H2O (4)
CuO + 2HCl → CuCl2 + H2O (5)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (6)
b) Tính V.
Bảo toàn khối lượng ta tính được số mol O2 phản ứng
Theo các phương trình (5), (4), (6) ta có:
nHCl = 2.nO, từ đó tính được giá trị V.
Hướng dẫn giải:
1.
Đặt số mol Fe, Al trong hỗn hợp X lần lượt là x, y mol
Suy ra 56x + 27y = 13,8 (g) (1)
Fe + H2SO4 loãng → FeSO4 + H2
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Ta có: nH2 = nFe + 1,5.nAl = x + 1,5y = 0,45 mol (2)
Giải hệ (1) và (2) ta được x = 0,15 và y = 0,2
Từ đó tính được
%mFe = (0,15.56/13,8).100% = 60,87% và %mAl = 39,13%
2. nSO2 = 0,2 mol và nNaOH = 0,4 mol
Ta có tỉ lệ k = nNaOH/nSO2 = 2.
Do đó SO2 tác dụng với NaOH theo phương trình sau:
SO2 + 2NaOH → Na2SO3 + H2O
Ta có: nNa2SO3 = nSO2 = 0,2 mol
Do đó: mNa2SO3 = 0,2.126 = 25,2 (gam)
3.
a) Viết phương trình hóa học của các phản ứng xảy ra.
2Mg + O2 \(\xrightarrow{{{t}^{0}}}\) 2MgO (1)
2Cu + O2 \(\xrightarrow{{{t}^{0}}}\) 2CuO (2)
4Al + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2Al2O3 (3)
MgO + 2HCl → MgCl2 + H2O (4)
CuO + 2HCl → CuCl2 + H2O (5)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (6)
b) Tính V.
Bảo toàn khối lượng ta có
mO2 = mB2 - mB1 = 33,3 - 21,3 = 12 (g) → nO2 = 0,375 (mol)
Suy ra nO = 2nO2 = 0,75 mol
Theo các phương trình (5), (4), (6) ta có:
nHCl = 2.nO = 2.0,75 = 1,5 (mol)
Vậy V = Vdd HCl = n/CM = 1,5/2 = 0,75 (lít)
Các bài khác cùng chuyên mục












Danh sách bình luận