 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 10
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 10
Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 10
Đáp án và lời giải chi tiết Đề số 2 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 10
Đề bài
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1 : Công thức của oleum là:
A. SO3
B. H2SO4
C. H2SO4.nSO3
D. H2SO4.nSO2
Câu 2 : Tác nhân chủ yếu gây mưa axit là
A. CO và CO2.
B. CH4 và NH3.
C. CO và CH4.
D. SO2 và NO2.
Câu 3 : Hòa tan kim loại R trong m gam dung dịch H2SO4 đặc, nóng. Sau khi SO2 (sản phẩm khí duy nhất) bay ra hết thì dung dịch còn lại có khối lượng m gam. Kim loại R là
A. Cu B. Mg
C. Fe D. Ag
Câu 4 : Khi cho O3 tác dụng lên giấy tẩm dung dịch hồ tinh bột và KI, thấy xuất hiện màu xanh. Hiện tượng này xảy ra là do
A. sự oxi hóa kali.
B. sự oxi hóa iotua.
C. sự oxi hóa tinh bột.
D. sự oxi hóa ozon.
Câu 5 : Hoà tan hoàn toàn 2,81g hỗn hợp gồm Fe2O3, MgO, ZnO trong 500ml dd H2SO4 0,1M (vừa đủ). Sau phản ứng, cô cạn dung dịch thu được muối khan có khối lượng là:
A. 3,81 gam. B. 5,81 gam.
C. 4,81 gam. D. 6.81 gam.
Câu 6 : Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl khí có tỉ khối so với hiđro là 9. Thành phần % theo khối lượng Fe trong hỗn hợp ban đầu là
A. 40%. B. 50%.
C. 38,89%. D. 61,11%.
Câu 7 : Cho 13,92 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3 (trong số đó số mol FeO bằng số mol Fe2O3) tác dụng vừa đủ dung dịch H2SO4 loãng được dung dịch X. Sục khí clo vào dung dịch X đến khi phản ứng xong được dung dịch Y. Cô cạn dd Y được m gam muối khan. Giá trị của m là
A. 32,15. B. 33,33.
C. 35,25. D. 38,66.
Câu 8 : Cho sơ đồ phản ứng:
S + H2SO4 (đặc, nóng) → X + H2O. X là
A. H2SO3. B. SO3.
C. H2S. D. SO2.
Câu 9 : Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này gồm bao nhiêu công đoạn chính?
A. 3 B. 2
C. 5 D. 4
Câu 10 : Nguyên tắc pha loãng axit sunfuric đặc là
A. rót từ từ axit vào nước và đun nhẹ.
B. rót từ từ nước vào axit và đun nhẹ.
C. rót từ từ nước vào axit và khuấy nhẹ.
D. rót từ từ axit vào nước và khuấy nhẹ.
Câu 11 : Chất dùng để làm khô khí Cl2 ẩm là
A. Na2SO3 khan.
B. dung dịch NaOH đặc.
C. CaO.
D. dung dịch H2SO4 đậm đặc.
Câu 12 : Hợp chất nào sau đây vừa thể hiện tính oxi hóa, vừa thể hiện tính khử?
A. O3 B. SO2
C. SO3 D. H2SO4
Câu 13 : Trong nhóm oxi, theo chiều tăng dần của điện tích hạt nhân:
A. Tính phi kim tăng, độ âm điện giảm, bán kính nguyên tử tăng.
B. Tính phi kim giảm, độ âm điện giảm, bán kính nguyên tử tăng.
C. Tính phi kim tăng, độ âm điện tăng, bán kính nguyên tử giảm.
D. Tính phi kim giảm, độ âm điện tăng, bán kính nguyên tử giảm.
Câu 14 : Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
A. tầng ozon có khả năng phản xạ ánh sáng tím.
B. tầng ozon rất dày, ngăn không cho tia cực tím đi qua.
C. tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi.
D. tầng ozon chứa khí CFC có tác dụng hấp thụ tia cực tím.
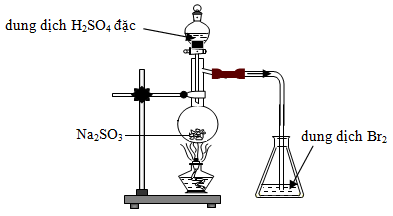
Câu 15 : Cho biết phản ứng nào xảy ra trong bình cầu?
A. SO2 + Br2 + 2H2O → 2HBr + H2SO4
B. Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
C. 2SO2 + O2 → 2SO3
D. Na2SO3 + Br2 + H2O → Na2SO4 + 2HBr
Câu 16 : Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
A. Fe B. Cr
C. Al D. Zn
Câu 17 : Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe này vào dung dịch H2SO4 đặc nóng thì lượng khí (đktc) sinh ra là
A. 10,08 lít. B. 5,04 lít.
C. 3,36 lít. D. 22,4 lít.
Câu 18 : Hiđro peoxit tham gia các phản ứng hóa học:
H2O2 + 2KI → I2 + 2KOH (1)
H2O2 + Ag2O → 2Ag + H2O + O2 (2).
Nhận xét nào đúng?
A. Hiđro peoxit vừa có tính oxi hóa, vừa có tính khử.
B. Hiđro peoxit không có tính oxi hóa, không có tính khử.
C. Hiđro peoxit chỉ có tính khử.
D. Hiđro peoxit chỉ có tính oxi hóa.
Câu 19 : Cấu hình lớp electron ngoài cùng của các nguyên tố nhóm oxi là:
A. ns2np6. B. ns2np5.
C. ns2np4. D. ns2np3.
Câu 20 : Khi sục SO2 vào dung dịch H2S thì
A. Dung dịch bị vẩn đục màu vàng.
B. Tạo thành chất rắn màu đỏ.
C. Không có hiện tượng gì.
D. Dung dịch chuyển thành màu nâu đen.
Câu 21 : Để phân biệt được 3 chất khí: CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt, người ta dùng thuốc thử lần lượt là:
A. nước vôi trong (dd Ca(OH)2) và dung dịch KMnO4.
B. dung dịch nước Br2 và dung dịch nước vôi trong (dd Ca(OH)2).
C. dung dịch KMnO4 và dung dịch nước Br2.
D. nước vôi trong (dd Ca(OH)2) và dung dịch HCl.
II. TỰ LUẬN (3 ĐIỂM)
Câu 22 : Hoàn thành chuỗi phản ứng sau (ghi rõ điều kiện nếu có):
FeS2 .\(\xrightarrow{(1)}\). SO2 \(\xrightarrow{(2)}\) SO3 \(\xrightarrow{(3)}\) H2SO4 \(\xrightarrow{(4)}\) SO2
Câu 23 : Hấp thụ hoàn toàn V lít SO2 (đktc) vào dung dịch NaOH, thu được 6,3 gam Na2SO3 và 5,2 gam NaHSO3. Tính giá trị của V?
Câu 24 : Cho 11,3 gam hỗn hợp X gồm Mg và Zn tác dụng với dung dịch H2SO4 2M dư thì thu được 6,72 lít khí (đktc). Tính % khối lượng mỗi kim loại trong hỗn hợp?
Lời giải chi tiết
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
Câu 1:
Phương pháp:
Dựa vào lí thuyết về oleum.
Hướng dẫn giải:
Công thức của oleum là H2SO4.nSO3
Đáp án C
Câu 2:
Hướng dẫn giải:
Tác nhân chủ yếu gây mưa axit là SO2 và NO2.
Đáp án D
Câu 3:
Phương pháp:
- Ta thấy dung dịch trước và sau phản ứng có khối lượng bằng nhau
→ Khối lượng chất thêm vào bằng khối lượng chất thoát ra
→ mR =mSO2
- Gọi kim loại R có hóa trị cao nhất là n. Giả sử số mol kim loại R là a mol.
- Viết PTHH:
2R + 2nH2SO4 đặc → R2(SO4)n + nSO2 + 2nH2O
- Từ dữ kiện mR = mSO2 lập phương trình mối liên hệ giữa MR và n.
- Biện luận với n = 1, 2, 3.
Chọn giá trị phù hợp của n và MR.
Hướng dẫn giải:
Ta thấy dung dịch trước và sau phản ứng có khối lượng bằng nhau
→ Khối lượng chất thêm vào bằng khối lượng chất thoát ra
→ mR =mSO2
Gọi kim loại R có hóa trị cao nhất là n. Giả sử số mol kim loại R là a mol.
2R + 2nH2SO4 đặc → R2(SO4)n + nSO2 + 2nH2O
a → 0,5an (mol)
Ta có: mR =mSO2 → MR.a = 0,5an.64 ⇔ MR = 32n
Do R là kim loại nên n = 1, 2, 3. Lập bảng biện luận:
|
n |
1 |
2 |
3 |
|
MR |
32 (Loại) |
64 (Cu) |
96 (Loại) |
Vậy kim loại R là Cu.
Đáp án A
Câu 4:
Phương pháp:
Dựa vào phương trình hóa học xảy ra để giải thích.
Hướng dẫn giải:
Ta thấy giấy tẩm hồ tinh bột chuyển xanh → Sản phẩm có chứa I2
PTHH: O3 + 2KI + H2O → 2KOH + O2 + I2
Số oxi hóa của iot tăng từ -1 lên 0 nên I- là chất khử.
Do đó ở phản ứng này xảy ra sự oxi hóa iotua (I-) và sự khử ozon (O3).
Đáp án B
Câu 5:
Phương pháp:
Ta có: Oxit bazo + H2SO4 → Muối + H2O
- Bảo toàn nguyên tố H ta có: nH2O =nH2SO4
- Áp dụng định luật bảo toàn khối lượng:
mmuối =mOxit + mH2SO4 - mH2O
Hướng dẫn giải:
Ta có: Oxit bazo + H2SO4 → Muối + H2O
Bảo toàn nguyên tố H ta có: nH2O =nH2SO4 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng:
moxit + mH2SO4 = mmuối + mH2O
→ mmuối =mOxit + mH2SO4 - mH2O
= 2,81 + 0,05.98 - 0,05.18 = 6,81 (gam)
Đáp án D
Câu 6:
Phương pháp:
Giả sử hỗn hợp ban đầu có x mol Fe và y mol FeS
Fe + 2HCl → FeCl2 + H2↑
FeS + 2HCl → FeCl2 + H2S↑
Từ tỷ khối của hỗn hợp khí với H2 tìm được mối quan hệ giữa x và y. Từ đó tìm được % theo khối lượng Fe trong hỗn hợp ban đầu.
Hướng dẫn giải:
Giả sử hỗn hợp ban đầu có x mol Fe và y mol FeS
Fe + 2HCl → FeCl2 + H2↑
FeS + 2HCl→ FeCl2 + H2S↑
Theo PTHH: nH2 = nFe = x mol; nH2S = nFeS = y mol
Ta có: \({{M}_{khi}}=\frac{{{m}_{khi}}}{{{n}_{khi}}}=\frac{2x+34y}{x+y}=9.2=18\)
→ 16y = 16x → x = y
Phần trăm theo khối lượng Fe trong hỗn hợp ban đầu là:
\(%{{m}_{Fe}}=\frac{{{m}_{F\text{e}}}}{{{m}_{F\text{e}}}+{{m}_{F\text{eS}}}}.100%=\frac{56x}{56x+88x}.100%=38,89%\)
Đáp án C
Câu 7:
Phương pháp:
Khi mol FeO bằng số mol Fe2O3 ta có thể quy thành Fe3O4.
Vậy hỗn hợp đầu coi như chỉ có Fe3O4.
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
3Cl2 + 6FeSO4 → 2FeCl3 + 2Fe2(SO4)3
Dung dịch Y chứa Fe2(SO4)3 và FeCl3
Từ đó tính được giá trị của m.
Hướng dẫn giải:
Vì số mol FeO bằng số mol Fe2O3 nên có thể coi hỗn hợp X chỉ gồm Fe3O4.
Suy ra nFe3O4 = 13,92 : 232 = 0,06 mol
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,06 → 0,06 0,06 (mol)
3Cl2 + 6FeSO4 → 2FeCl3 + 2Fe2(SO4)3
0,06 → 0,02 0,02 (mol)
Dung dịch Y chứa 0,08 mol Fe2(SO4)3 và 0,02 mol FeCl3
Vậy m = mFe2(SO4)3 + mFeCl3
= 0,08.400 + 0,02.162,5 = 35,25 (gam).
Đáp án C
Câu 8:
Phương pháp:
Dựa vào tính chất hóa học của H2SO4 đặc nóng.
Hướng dẫn giải:
S + 2H2SO4(đặc,nóng → 3SO2 + 2H2O
Vậy X là khí SO2.
Đáp án D
Câu 9:
Phương pháp:
Dựa vào phương pháp sản xuất axit sunfuric.
Hướng dẫn giải:
Sơ đồ sản xuất axit H2SO4:
a. Sản xuất lưu huỳnh đioxit (SO2):
+ Đốt cháy lưu huỳnh:
S + O2 \(\xrightarrow{{{t}^{o}}}\) SO2
+ Đốt quặng pirit sắt:
4FeS2 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3 + 8SO2
b. Sản xuất SO3:
2SO2 + O2 \(\xrightarrow{{{V}_{2}}{{O}_{5}},{{t}^{0}}}\) 2SO3
c. Hấp thụ SO3 bằng H2SO4
98% theo phương pháp ngược dòng tạo oleum:
H2SO4 + nSO3 → H2SO4.nSO3
- Dùng lượng nước thích hợp pha loãng oleum được dung dịch H2SO4.
Vậy phương pháp này gồm 3 công đoạn chính là:
+ Sản xuất SO2
+ Sản xuất SO3
+ Hấp thụ SO3 bằng H2SO4
Đáp án A
Câu 10:
Phương pháp:
Dựa vào tính chất vật lí của axit sunfuric đặc.
Hướng dẫn giải:
H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào axit, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại.
Đáp án D
Câu 11:
Phương pháp:
Nguyên tắc lựa chọn chất dùng để làm khô một chất X là:
- Chất này có khả năng hút nước.
- Chất này không phản ứng với chất X.
Hướng dẫn giải:
Chất dùng để làm khô khí Cl2 ẩm là chất hút nước mạnh và không tác dụng với Cl2.
Cả 4 chất trên đều hút nước nhưng Na2SO3, NaOH đặc, CaO đều tác dụng với Cl2:
Na2SO3 + Cl2 + H2O → 2HCl + Na2SO4
2NaOH + Cl2 → NaCl + NaClO + H2O
CaO + H2O → Ca(OH)2;
Ca(OH)2 + Cl2 → CaOCl2 + H2O
Vậy chỉ có thể dùng dung dịch H2SO4 đậm đặc để làm khô khí Cl2 ẩm.
Đáp án D
Câu 12:
Phương pháp:
Chất vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là chất chứa nguyên tố có số oxi hóa trung gian.
Hướng dẫn giải:
Trong hợp chất SO2 nguyên tố S có số oxi hóa +4 là số oxi hóa trung gian
→ SO2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử.
Đáp án B
Câu 13:
Phương pháp:
Dựa vào quy luật biến đổi tính phi kim, độ âm điện và bán kính nguyên tử trong một nhóm A.
Hướng dẫn giải:
Trong nhóm cùng nhóm A, theo chiều tăng dần của điện tích hạt nhân: tính phi kim giảm, độ âm điện giảm, bán kính nguyên tử tăng.
Đáp án B
Câu 14:
Phương pháp:
Dựa vào đặc điểm của tầng ozon.
Hướng dẫn giải:
Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi: \(2{{\text{O}}_{3}}\overset{UV}{leftrightarrows}3{{O}_{2}}\)
Đáp án C
Câu 15:
Phương pháp:
Dựa vào tính chất hóa học của các chất.
Hướng dẫn giải:
Phản ứng xảy ra trong bình cầu là:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O.
Đáp án B
Câu 16:
Phương pháp:
Dựa vào tính chất của axit H2SO4 đặc, nguội.
Hướng dẫn giải:
Các kim loại Al, Fe, Cr bị thụ động hóa trong axit H2SO4 đặc nguội. Vậy nên chỉ có kim loại Zn có phản ứng với axit H2SO4 đặc, nguội.
Đáp án D
Câu 17:
Phương pháp:
Fe + H2SO4 loãng → FeSO4 + H2 (1)
2Fe + 6H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O (2)
Từ phương trình hóa học (1) suy ra số mol Fe.
Từ số mol Fe tính được số mol khí SO2 dựa vào phương trình (2).
Hướng dẫn giải:
Fe + H2SO4 loãng → FeSO4 + H2 (1)
2Fe + 6H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O (2)
Theo PTHH (1) ta có: nFe = nH2 = 0,15 mol
Theo PTHH (2) ta có: nSO2 = 1,5.nFe = 1,5.0,15 = 0,225 mol
→ VSO2 = 5,04 (lít)
Đáp án B
Câu 18:
Phương pháp:
Dựa vào số oxi hóa của các nguyên tố để xác định tính khử, tính oxi hóa của các chất.
Hướng dẫn giải:
Xác định số oxi hóa của các nguyên tố trong 2 phản ứng sau:
\(\begin{array}{*{20}{l}}{{H_2}{{\mathop O\limits^{ - 1} }_2}\; + \;2K\mathop I\limits^{ - 1} \; \to {\rm{ }}{{\mathop I\limits^0 }_2}\; + \;2K\mathop O\limits^{ - 2} H\;\;\;\left( 1 \right)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;}\\{{H_2}{{\mathop O\limits^{ - 1} }_2}\; + \;{{\mathop {Ag}\limits^{ + 1} }_2}O\; \to {\rm{ }}2\mathop {Ag}\limits^0 \; + \;{H_2}O\; + \;{{\mathop O\limits^0 }_2}\;\;\;\left( 2 \right).\;\;\;}\end{array}\).
Ở phản ứng (1), số oxi hóa của O trong H2O2 giảm từ -1 xuống -2 nên H2O2 là chất oxi hóa, có tính oxi hóa.
Ở phản ứng (2), số oxi hóa của O trong H2O2 tăng từ -1 lên 0 nên H2O2 là chất khử, có tính khử.
Vậy hiđro peoxit vừa có tính oxi hóa, vừa có tính khử.
Đáp án A
Câu 19:
Phương pháp:
Dựa vào vị trí của các nguyên tố nhóm oxi.
Hướng dẫn giải:
Cấu hình lớp electron ngoài cùng của các nguyên tố nhóm oxi là ns2np4.
Đáp án C
Câu 20:
Phương pháp:
Viết phương trình hóa học và dựa vào tính chất vật lí của các chất để nêu hiện tượng xảy ra.
Hướng dẫn giải:
Khi sục SO2 vào dung dịch H2S thì xảy ra phản ứng:
SO2 + 2H2S → 3S↓ + 2H2O
Vậy hiện tượng là dung dịch bị vẩn đục màu vàng (S).
Đáp án A
Câu 21:
Phương pháp:
Dựa vào tính chất hóa học của các chất để lựa chọn thuốc thử.
Hướng dẫn giải:
Dẫn 3 khí lần lượt qua dung dịch brom, chất làm mất màu dung dịch brom là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Còn lại không có hiện tượng gì là CO2 và O2.
Dẫn 2 khí còn lại qua dung dịch nước vôi trong, chất làm đục nước vôi trong là CO2.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Khí còn lại là O2
Đáp án B
II. Tự luận (3 câu; 3 diểm)
Câu 1:
Phương pháp:
Dựa vào tính chất hóa học của các chất để viết phương trình hóa học xảy ra.
Hướng dẫn giải:
(1) 4FeS2 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3 + 8SO2
(2) 2SO2 + O2 \(\xrightarrow{{{V}_{2}}{{O}_{5}},{{t}^{0}}}\) 2SO3
(3) SO3 + H2O → H2SO4
(4) Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Câu 2:
Phương pháp:
Dùng bảo toàn nguyên tố S để tìm số mol SO2, từ đó tính được thể tích khí SO2.
Hướng dẫn giải:
Ta có: nNa2SO3 = 6,3 : 126 = 0,05 mol;
nNaHSO3 = 5,2 : 104 = 0,05 mol
Bảo toàn nguyên tố S ta có:
nSO2 = nNa2SO3 + nNaHSO3 = 0,05 + 0,05 = 0,1 mol.
Vậy V = VSO2 = 0,1.22,4 = 2,24 (lít)
Câu 3:
Phương pháp:
Mg + H2SO4 → MgSO4 + H2
Zn + H2SO4 → ZnSO4 + H2
Lập hệ phương trình về khối lượng hỗn hợp X và số mol H2 để tìm số mol mỗi kim loại trong hỗn hợp X.
Từ đó tính % khối lượng mỗi kim loại trong hỗn hợp.
Hướng dẫn giải:
Gọi số mol Mg và số mol Zn trong hỗn hợp X lần lượt là x, y mol
Mg + H2SO4 → MgSO4 + H2
x → x (mol)
Zn + H2SO4 → ZnSO4 + H2
y → y (mol)
Ta có: mX = 24x + 65y = 11,3 (g) và nH2 = x + y = 0,3 mol
Giải hệ trên ta được x = 0,2 mol và y = 0,1 mol
Do đó mMg = 4,8 (g); mZn = 6,5 (g)
Vậy %mMg = 4,8.100%/11,3 = 42,48%; %mZn = 57,52%
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục




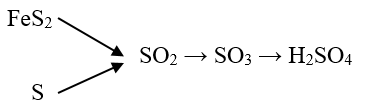








Danh sách bình luận